CCF20091206�006

1.6. Energia wewnętrzna
Materia, tworząca układ termodynamiczny, stanowi zbiór cząsteczek i atomów. Każda cząsteczka znajduje się w ruchu, ma więc określoną energię kinetyczną. Cząsteczki oddziałują wzajemnie na siebie, a więc istnieje energia ich wzajemnego oddziaływania.
Na energię E układu termodynamicznego składają się energia kinetyczna Ek i potencjalna Ep układu rozpatrywanego jako całość oraz energia o pozostałych możliwych postaciach zawarta w układzie — zsumowana w jedną wielkość, zwaną energią wewnętrzną U. Można to zapisać następująco
E=U + Ek + Ep (U)
Energia wewnętrzna układu jest sumą energii o różnej postaci, a więc energii związanej z ruchem i położeniem cząsteczek, energii związanej ze strukturą atomów, energii wiązań chemicznych i in.
Energia wewnętrzna stanowi parametr stanu, gdyż zależy jedynie od stanu układu. Jest ona także parametrem ekstensywnym*’, gdyż jej wartość zależy od masy czynnika termodynamicznego.
Energię wewnętrzną danej masy czynnika oznaczamy symbolem U, natomiast energię wewnętrzną odniesioną do jednostki masy substancji symbolem u, a więc
U
u = — m
przy czym u jest oczywiście parametrem intensywnym i nazywa się go energią wewnętrzną właściwą.
1.7. Praca i ciepło
Najczęściej występującym oddziaływaniem między dwoma układami termodynamicznymi (z których jednym może być otoczenie) jest oddziaływanie energetyczne. Polega ono na wymianie energii. Układy otwarte, niezależnie od oddziaływania energetycznego, mogą wymieniać
*’ Ekstensywny (z jęz. łac. extensivus — rozszerzający) — rozciągły, obszerny, jako przeciwieństwo do intensywny nie oznacza zmiany jakościowej, lecz jedynie ilościowe zwiększanie (p. str. 15).
między sobą czynnik termodynamiczny (masę). Natomiast między układami zamkniętymi może zachodzić tylko oddziaływanie ener-|i<'lyczne. Istnieją dwie formy tego oddziaływania — praca i ciepło.
Praca jest zwykle przedstawiana w postaci działania siły F na pewnej ilrodze x między punktami 1 i 2.
/nająć rachunek całkowy, można udowodnić, że praca ma prostą min pretację graficzną (rys. 1.11). Jest ona równa polu zakreskowanemu |hhI krzywą zmiany siły F w funkcji drogi x.
|
1 |
2 | ||
|
k“i l l p l l LJ_I | |||
Rys. 1.12. Układ złożony z cylindra z tłokiem wykonującym pracę L = p{V2-Vi)
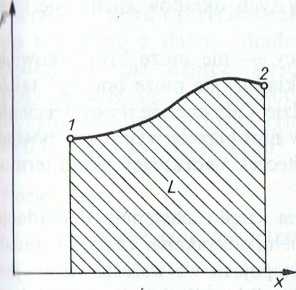
IIVN. 1.11. Interpretacja graficzna pracy
Typowym w termodynamice przykładem wykonywania pracy jest oddziaływanie tłoka na czynnik termodynamiczny zamknięty w cylind-i ze (rys. 1.12). W tym przypadku siła działająca na tłok jest wywoływana ciśnieniem czynnika zawartego w cylindrze, a wykonanie pracy wiąże się /,0 zmianą objętości układu. Po przesunięciu tłoka od położenia 1 do położenia 2 wykonana praca wyniesie
L = p(Vr2-Vt) (1.2)
Obliczona praca jest pracą mechaniczną i nazywa się ją pracą zewnętrzną lub pracą absolutną. Przyjęto umowną zasadę, że praca wykonana przez układ ma znak dodatni, praca zaś związana z oddziaływaniem otoczenia na układ — znak ujemny.
Na podkreślenie zasługuje fakt, że praca nie jest parametrem stanu, ponieważ zależy nie tylko od stanu początkowego i końcowego
27
Wyszukiwarka
Podobne podstrony:
67021 Slajd58 Układ termodynamiczny Stanowi część przestrzeni materialnej, będącą przedmiotem rozważ
2 (2204) Energia wewnętrza i ciepło. Pierwsza zasada termodynamiki.... 47 Transport energii wewnętrz
DSCN4687 Zbiornik energii wewnętrznej Zd o stałej temperaturze Td stanowi źródło ciepła doprowadzane
CCF20090205�010 lwi. o 5 o C ^ Dwie ciecze X i Y tworzą układ
CCF20090205�014 ^ ) Tl) Dwie ciecze A i B tworzą układ dwóch cieczy z ograniczoną rozpuszczalnością.
PB260113 Pierwsza zasada termodynamiki Ciepło pobrane przez układ musi być równe wzrostowi energii w
fizyczna egzamin001 Chemia fizyczna I (termodynamika) 1. Zmiana energii wewnętrznej układu AU w ogól
Slajd64 Pierwsza zasada termodynamikiQ = AU + p AV dla p = const. Kosztem ciepła Q zwiększa się ener
skan0046 (2) 3. Termodynamika chemiczna I zasada termodynamiki stwierdza, że energia wewnętrzna U uk
fizyczna egzamin003 11. Ogólne sformułowanie obu zasad termodynamiki ma postać (S - entropia, U - en
Zmienne stanu W termodynamice, oprócz energii wewnętrznej, do opisu zmian zachodzących w układach
1779433?4854199873438?5466969 n c) układ zmieni objętość i energię wewnętrzną tak,
IMG$18 Kawnwua le noszą nazwę pierwszego równaniu termodynamiki. Zakładając, że energia wewnętrzna c
154 Ograniczenia ekonomiczne tworzą układ wewnętrznie powiązany, nawzajem negatywnie sie wspomagając
więcej podobnych podstron