CCF20110121�154

d>Beata Ostrowska |> Twoja matura - chemia
S ogólny wzór wodorku: XH,„ (dla grup: 1, 2, 13, 14) lub Hg.„X (dla grup: 15, 16, 17); gdzie n to liczba jedności w numerze grupy układu okresowego, a X to symbol pierwiastka.
Poziom rozszerzony
1. a) Elektroujemność rośnie w miarę wzrostu stopnia utlenienia pierwiastka.
b) Tlenki pierwiastków na wyższych stopniach utlenienia mają właściwości coraz bardziej kwasowe.
2. a) Wielkość promienia jonowego w trzecim okresie maleje wraz ze wzrostem liczby atomowej pierwiastka, b) Objętość drobiny w szeregu anion - atom - kation maleje. Wiąże się to ze zmniejszającą się ilością elektronów.
3. a)
|
F |
Cl |
Br |
I | |
|
temperatura 0°C |
gazowy |
gazowy |
ciekły |
stały |
|
temperatura 70°C |
gazowy |
gazowy |
gazowy |
stały |
b) Najłatwiej przeprowadzić w jon atom fluoru. Atomy grupy 17 przechodzą w aniony typu X”, przyjmując jeden elektron na powłokę walencyjną. Elektron ten jest najsilniej przyciągany, gdy pierwiastek ma mało powłok elektronowych. Wtedy oddziaływanie elektrostatyczne jest najsilniejsze.
c) Im wyższy ładunek jądra atomu, tym większa objętość anionu pierwiastka grupy 17.
III. Wiązania chemiczne Poziom podstawowy
i.
|
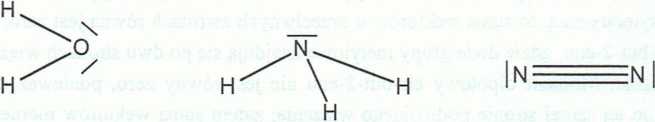
woda |
chlor |
dwutlenek węgla |
tlenek osmu (VIII) |
chlorek sodu |
amoniak |
|
kowalencyjne spolaryzowane |
kowalencyjne |
kowalencyjne spolaryzowane |
kowalencyjne spolaryzowane |
jonowe |
kowalencyjne spolaryzowane |
2. fluorek cezu
3. A-grafit B - diament C — fulleren
|
Struktura |
Właściwości fizyczne | |
|
A |
przewodzi prąd |
metaliczny połysk |
|
B |
wysoka twardość |
nie przewodzi prądu |
|
C |
rozpuszcza się w rozpuszczalnikach organicznych |
nierozpuszczalny w wodzie |
|
Substancja |
Wiązanie |
|
diament |
kowalencyjne |
|
chlorek potasu |
jonowe |
|
srebro |
metaliczne |
Wyszukiwarka
Podobne podstrony:
CCF20110121�176 H>Beata Ostrowska [f> Twoja matura - chemia Wzór
CCF20110121�065 H> Beata Ostrowska [J> Twoja matura - Chemia 8. Ile gramów wody należy dodać d
CCF20110121�071 0> Beata Ostrowska [[> Twoja matura - Chemia Wyprowadź zależność pomiędzy Ostw
CCF20110121�073 d> Beata Ostrowska [J> Twoja matura - Chemia 10 .W tabeli podano wartości stał
CCF20110121�091 [J> Beata Ostrowska [[> Twoja matura - Chemia b) I2 + OH" -» r + I03"
CCF20110121�117 K> Beata Ostrowska [J^> Twoja matura - ChemiaWęglowodory i ich jednofunkcyjne
CCF20110121�172 U>Beata Ostrowska [[> Twoja matura - chemia tan(V) baru dobrze rozpuszcza się
CCF20110121�196 U>Beata Ostrowska [[> Twoja matura - chemiaXVIII. Chemia doświadczalna Poziom
CCF20110121�198 2>Beata Ostrowska [J> Twoja matura - chemiaPoziom rozszerzony 1. &
CCF20110121�200 22. [£>Beata Ostrowska [[> Twoja matura - chemia wzór I CHr(CH2)4-cf H wzór
CCF20110121�017 [£> Beata Ostrowska [J> Twoja matura - ChemiaIII.Wiązania chemiczne Poziom pod
CCF20110121�045 [£> Beata Ostrowska [f> Twoja matura - Chemia Określać wpływ stężenia reagentó
CCF20110121�079 tO Beata Ostrowska [O Twoja matura - Chemia 22. Wykres przedstawia krzywą miareczkow
CCF20110121�101 XIV. [£> Beata Ostrowska
CCF20110121�127 [£> Beata Ostrowska (J> Twoja matura - Chemia Projektować doświadczenia p
CCF20110121�146 [£> Beata Ostrowska (J> Twoja matura - Chemia oznacza dodatnio naładowany atom
CCF20110121�152 19.[J>Beata Ostrowska [J> Twoja matura - chemia Okres Grupa Konfiguracja ele
165 odp [£>Beata Ostrowska [[> Twoja matura - chemiaOdpowiedzi do zadań We wszystkich zadaniac
CCF20110121�164 [J>Beata Ostrowska [J> Twoja matura - chemić e) Wykres zależności wydzielające
więcej podobnych podstron