img032 3

Część pierwsza
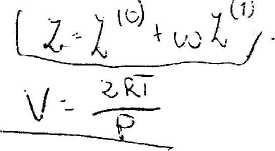

'Stosując równanie Lee-Kessiera dla pewnego gazu otrzymano następujące wartości 'współczynników ściśliwości:
2 (°> = 0,91: Zfl) = Ó.i dla ciśnienia P = 400 kPa i temperarury 300 K. Obliczyć objętość 1 mola tego gazu.
Dane dodatkowe: R = 8.j14 J/(mol.K); współczynnik acentryczoy u? - 0,2.
l\± Eter etylów otrzymuje się w reakcji odwodnienia etanolu. r ZRj
2 C.H5OH '=> (C2H5); O + H20 p
Stopień przereagowania etanolu przy jednorazowym przejściu przez reaktor wynosi 0.9, a nieprzereagowany etanol po rozdzieleniu produktów reakcji zawraca się ponownie do reaktora. Obliczyć, w jakiej ilości dostrczać trzeba świeży etanol, aby produkować 148 kg eteru na (y ■ godzinę. Przyjąć, że do reaktora doprowadzany jest 1 OOYo-owy etanol.
h z. 1
piecu o specjalnym przeznaczeniu jako paliwo spala się etan w czystym tlenie. Ilość , doprowadzanego etanu - 1 mol/min. Reakcję spalania przedstawia równanie: ś 'r
y 0 = - CH6 - 3p O, +2CO; +3H-.0y
i dla ułatwienia przyjmujemy, że spalanie następuje w sposób stechiometryczny.
( Obliczyć jaka ilość ciepła-dostarcza ten piec w ciągu minuty, jeżeli temperatura spalania (i gazów odlotowych) wynosi 1298 K.
Dane pomocnicze w temperaturze standardowej 29S K: ciepło tworzenia j pojemność cieplna.
|
" ' " Substancja |
AH°f kJ/mol |
/ Cp = a + bT j J/(mol K) | |
|
a |
b | ||
|
CĄ |
-85 |
5-4 |
0,18 |
|
k COyf |
-394 |
20 |
0,07 |
|
3 f |
-242 |
32 |
0,002 |
|
ri O |
- |
28 |
- . |

Wyszukiwarka
Podobne podstrony:
Równania ruchu Ostatecznie dla dwóch współrzędnych otrzymujemy dwa równania parametryczne. W ten spo
B4 2 4. Dla 8 wylosowanych gmin otrzymano następujące informacje o liczbie ludności w tys. (x) i lic
Antonkiewicz4 kg 1 s.m. [Falkowski i in. 2000]. Dla poszczególnych mikroelementów przyjęto następują
IMG324 Stosując równanie komfortu cieplnego można obliczyć dla dowolnego rodzaju czynności
W kolejnych przęsłach kratownicy stosujemy przekroje pionowe ot,-a, dla i=l,...,9 oraz trzy równania
1 (111) 3 _ . Wybór autorów polskich Część pierwsza WST£P* Raz powiedziałem: ja dl
i ■)■ ,VA idnJ0 Część pierwsza L/ ))-v, yV "T^<D> Stosując
egz anal MS 1 Przykładowy egzamin z analizy matematycznej dla studentów I roku WFAIS UJ (I semestr)
CZĘŚĆ PIERWSZA ■ wpisz numery rachunków bankowych urzędu skarbowego dla podatku VAT i dochodowego w
Biznes Plan Dr Sosnowski WSEI część 2 a N.___ •Bkncspiao stosuje się dla; ficnnsniwcBia inwestycji b
skanuj0012 (156) stronica 9 EN ISO 14683:1999 UWAGA 1: Przytaczane wartości orientacyjne dotrzymano,
więcej podobnych podstron