skanuj0078 2

152 5- iwmagljonowc w rozcieńczonych roztworach wodnych
Podstawiając równania (7.8), (7.15) i (7.16) do (7.4) otrzymuje się:
«2
fiu;
(7.17)
(7.18)
(7.19)
Drugi pierwiastek równania (7.18) nie ma sensu fizycznego (cOH_ < 0). Znaj#
stężenie jonów wodorotlenkowych z równania (7.5) wylicza się stężenie jonów oksoniowych, a następnie zgodnie z równaniem definicyjnym (12) wykładnik pH:
- -Kw- 2Kw (7.20)
i dalej:
oraz:
C0H-"
K,
|
" K. |
c— |
|
K. °» | |
|
-*SjlA |
Kw |
|
K, f |
K. |
oir
•c=0
H\0*
on*
2*K,
K,
K,
(7.21)
+4-
Kv
K„
HjO*-
-14
^6,3.10
1,0-lO"14 6,3-lO"10
•0,150
= 6.514-10'
pH = - Iogc
Hj04
- log6,514 HTlł =11,19
WERYFIKACJA ZAŁOŻENIA UPRASZCZAJĄCEGO
W tym celu należy obliczyć stężenie pozostałych składników roztworu, a następnie zweryfikować nierówność (7.13) oraz równanie bilansu ładunków (7.11).
Z równania (7.5) oblicza się stężenie jonów wodorotlenkowych:
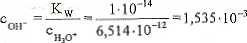
dm'
i podstawia do (7.13).
^2£- = 2,410*»20
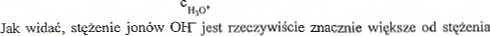
jonów HjO*.
Stężenie cyjanków oblicza się z równań (7.4) i (7.10) otrzymując:
Po podstawieniu wartości stężeń jonów# oksoniowych, wodorotlenkowych, cyjanków i potasu do bilansu ładunków (7.11) stwierdzono, że przykład rozwiązany jest prawidłowo:
lewa strona bilansu L=c(C. +c|li0. =0,150+6^14-10"12 *0,150, prawa strona bilansu P=cCN_ +cQH_ -0,149 +1,535-10"3 *0,150.
Odpowiedź
Wartość pH roztworu soli cyjanku potasu o stężeniu c — 0,150 mol/dm3 wynosi pH-11,19.
UPROSZCZONY MODEL MATEMATYCZNY II
Stopień protolizy jonu CN~ jest mały (a < 5%). Można przyjąć analogicznie do przykładu 3, że stężenie cyjanków jest znacznie większe od stężenia kwasu cyjanowodorowego:
(7.22)
(7-23)
Cctr >>c«Qi
i stężenie jonów CN“ jest równe stężeniu formalnemu soli c:
®or-c
Wtedy stałą protolizy K* można zapisać równaniem:

c
(7.24)
Wyszukiwarka
Podobne podstrony:
skanuj0064 (16) 5. Równowagi jonowe w rozcieńczonych roztworach wodnych prawa strona bilansu P = cHj
skanuj0058 2 114 S. Równowagi joiwre w rozcieńczonych roztworach wodnych znanych jest kilka innych,
skanuj0060 2 118 5. Równowagi .tonowe w rozcieńczonych roztworach wodnychK, SOL Iloczyn
skanuj0061 2 na 5. Równowiigl jonowe w rozcieńczonych roztworach wodnych Ml* <V Bocływ
skanuj0083 162 5. Równowag jonowe w rozcieńczonych roztwoiii^ wodnych 162 5. Równowag jonowe w rozci
skanuj0091 178 5. Równowagi jonowy w rozcieńczonych roztworach wodnych Bilans materiałowy W rozpatry
skanuj0093 - 182 5. Równowagi jonowe w rozcieńczonych roztworach wodnych - 182 5. Równowagi jonowe w
skanuj0095 186 S. Równowagi jonowe w rozcieńczonych roztworach wodnych Ks = cscs(cs+c)
skanuj0101 2 198 5. Równowagi jonowe vr rozcieńczonych roztworach wodnych pH - 8. Stężenie formalne
skanuj0102 2 200 5. Równowag jonowe w rozcieńczonych roztworach wodnych 22. Oblicz
50054 skanuj0082 (12) 160 5. Równowagi Jonowo yy rozcieńczonych roztworach wodnych Odpowiedź . Skład
skanuj0086 2 S. Rówmm«
10670189x5432704831476U05956075151962700 n VII. Reakcje w roztworach wodnych Rozwiązanie: Należy pam
152 Rozdział 12 Numeryczne rozwiązanie układu równań różniczkowych wykorzystano do symulacji rozruch
10670189x5432704831476U05956075151962700 n VII. Reakcje w roztworach wodnych Rozwiązanie Należy pami
więcej podobnych podstron