skanuj0086 2

S. Rówmm«|l Jonowe w m/cłtńoonych roztworach wodnych
(10.17)
S. Rówmm«|l Jonowe w m/cłtńoonych roztworach wodnych
które po uporządkowaniu ma postać:
(10.18)
Pierwiastek tego równania wynosi:
c
(K. -c,)+J((K. -c,)ł+4 (K. (c, +C,)
2
(10.19)
Drugi pierwiastek równania (10.18) nie ma sensu fizycznego (cH^0, < 0).
Podstawiając (10.19) do równania definicyjnego (12), otrzymuje się zależność pozwalającą obliczyć szukaną wartość pH:
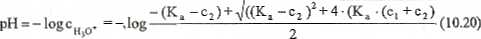
Obliczenia
Po podstawieniu danych liczbowych otrzymuje się:
= 1,00
-(10-M3 -0,1) + V( -0,1)* +4-10'*”;(1,0■ 10-J + 0,1) prl = - log---
WERYFIKACJA MODELU MATEMATYCZNEGO
W przykładzie 2 sprawdzono, że w równaniu bilansu ładunków można pominąć stężenie jonów wodorotlenkowych. Założenie upraszczające (10.13) musi więc być również prawidłowe dla mieszaniny kwasu mrówkowego i solnego.
CZĘŚĆ Ć
W przykładzie 9 obliczono, że pH roztworu bufoni octanowego o składzie c, “ 0,175 mol/dm3 i Cj “ 0,225 mol/clm3 wynosi 4,65. Po dodaniu kwasu HCI skład formalny buforu wynosi: stężenie octanu sodu cs = 0,175 mol/dm3, stężenie kwasu octowego 'c, = 0,225 mol/dm3, stężenie kwasu solnego 2c* = 0,1 mol/dm3.
MODEL STECHIOMETRYCZNY
5*3. Roztwory buforowe
CHjCOOH + HaO « CHjCOO’ + H30+ {\Q22)
HCl + H20-*Cr + HjOł • (10.23)
2H20 ~ HjO+ + OH- i\02A)
Składniki roztworu; jony Na*. H30‘. CH,COO‘, Cr, OH", cząsteczki niezdy-socjowanego kwasu CH3COOH i HjO.
MODEL MATEMATYCZNY
Opis równowagi
K^WV (10.25)
c CHjCOOH
kw“cHio-co»- (l0-2<5)
Bilans materiałowy ,
cNa* -°s 0°-27>
C» + ‘C» =0CHjCOO- CHjCOOH (10.28)
ca.-2ca (10.29)
Zakłada się, że stężenie wody jest stałe i wynosi cllj0 ■ 55,34 mol/dm3. Bilans ładunków
CN.* +‘CH30->CCHJC00' +<r0H- + ccr (l0:30>
W porównaniu z przykładem 9 w modelu występuje dodatkowa niewiadoma cc|_ opisana równaniem (10.29). Wartość stężenia formalnego kwasu solnego *c, podano w treści zadania. Model jest kompletny.
UPROSZCZONY MODEL MATEMATYCZNY 1 Uproszczenie modelu * ' * ”*
Do kwaśnego roztworu buforu octanowego dodano kwasu HC1. Wartość pH roztworu będzie więc mniejsza od pH ** 4,65 (dla samego buforu). Można więc przyjąć założenie, że:
V- »«o„- ~L>1°
OHm
i w bilansie ładunków pominąć stężenie jonów wodorotlenkowych
(1031)
Wyszukiwarka
Podobne podstrony:
skanuj0102 (3) cU,sj^ Oj CA‘ T2011-10-17 NMR w WPROWADZENIE Większość cząsteczek organicznych
skanuj0078 2 152 5- iwmagljonowc w rozcieńczonych roztworach wodnych Podstawiając równania (7.8), (7
skanuj0084 2 164 5. Równowagi Jonowe w ruzckrtc/onych roztworach wodnych -(0,175 +1,74 • 10“5) + ^(0
skanuj0062 (16) 120 5. Równowagi Jonowe w rozclortesonych roztworach wodnych5.1. Roztwory mocnych kw
skanuj0065 (15) MO 1 ^ł<c 126 _- S. Równowag jonowe w rozckricropydi roztworach
skanuj0072 (15) 140 5. Równowagi Jonowe ro/ctcrtczonych roztworach wodnych Bilans ładunków. Zgodni
skanuj0064 (16) 5. Równowagi jonowe w rozcieńczonych roztworach wodnych prawa strona bilansu P = cHj
skanuj0061 2 na 5. Równowiigl jonowe w rozcieńczonych roztworach wodnych Ml* <V Bocływ
skanuj0081 158 • S. Równowagi Jonowe w roy,doliczonych roztworach wodnych Stężenie jonów wodorotlenk
skanuj0083 162 5. Równowag jonowe w rozcieńczonych roztwoiii^ wodnych 162 5. Równowag jonowe w rozci
skanuj0089 174 5. Równowri Jonowe w roickśczonych roztworach wodnych Przykład 11 W jakim stosunku ob
skanuj0093 - 182 5. Równowagi jonowe w rozcieńczonych roztworach wodnych - 182 5. Równowagi jonowe w
skanuj0095 186 S. Równowagi jonowe w rozcieńczonych roztworach wodnych Ks = cscs(cs+c)
skanuj0097 190 5. Równowagi jonowe w nudcńcłonych roztworach wodnych stężenie jonów OH- c --^--l0(’p
więcej podobnych podstron