P1120602 [1024x768]
149
oporu kalibracyjnego. pojemności kalibracyjnej (kondensator o zmiennej pojemności), umożliwiającej zrównoważenie impedancji naczyńka elektrolitycznego do pomiaru . przewodnictwa, jak również zastosowanie w miejsce galwanometru prądu stałego tfcOję^ulego wskaźnika zera. W przyrządach do pomiaru przewodnictwa roztworów (ionduktometrach) stosuje się mostki pomiarowe automatyczne, w których doprowadzenie mostka do stanu równowagi następuje samoczynnie za pośrednictwem tnv. układu śledzącego, przy równoczesnym przesuwie wskazówki na skali miernika w nówe położenie, odpowiadające mierzonej wartości przewodnictwa.
Naczyńka do pomiaru przewodnictwa mogą mieć różny kształt, ale muszą zapewniać możliwie najmniejszą pojemność elektryczną układu i zachowywać ściśle określone warunki geometryczne (równoległości powierzchni elektrod, określony ijednolity przekrój poprzeczny słupka elektrolitu). Praktycznie niemożliwa jest konstrukcja dwóch identycznych naczyniek i dlatego pomiary przewodnictwa mają charakter porównawczy. Każde naczyńko charakteryzuje się ściśle określoną wartością stosunku J/S = k, nazywaną stałą naczyńka^ lub jego! pojemnością oporową) którą wyznacza się z równania
(4)
mierząc opór naczyńka napełnionego elektrolitem wzorcowym o dokładnie znanym przewodnictwie właściwym, wyznaczonym drogą pomiarów bezpośrednich (są to zwykle roztwory KCI lub H2S04). Znając stałą naczyńka i mierząc przewodnictwo roztworu badanego, można obliczyć jego przewodnictwo właściwe ze wzoru
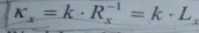
(5)
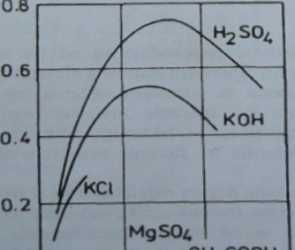
W większości przypadków krzywe zależności przewodnictwa od stężenia wykazują charakterystyczny przebieg przedstawiony na rysunku 1.
c
Rys. I. Zależność przewodnictwa właściwego elektrolitów od ich stężenia w roztworze
Wyszukiwarka
Podobne podstrony:
P1120629 [1024x768] REFRAKCJA I WYZNACZANIE MOMENTU DIPOLOWEGO Dielektryk umieszczony w kondensatorz
P1120600 [1024x768] 231 2. Obliczyć gęstości prądu anodowego, średni potencja! ele
P1120603 [1024x768] W zakresie niskich stężeń elektrolitu wzrost przewodnictwa właściwego ze stężeni
P1120605 [1024x768] uniwersalnych co> R. AU- Dla elektrolitu 1-1 wartościowego flf+MiJ-l iq«o.S)
P1120606 [1024x768] 193 A = a Aof A«-(-<+£Ao)^a>cJ(»•) Z równania tego wynika, źe stopień dyso
P1120607 [1024x768] Wykonanie ćwiczenia I. Napełnić naczyńko pomiarowe roztworem 0.01 M KCI, którego
P1120608 [1024x768] 155j® - a&h + /Kt - 25)1 Wartości A®, oraz fi podano w tabeli 2. Tabela 2
P1120609 [1024x768] 156 10. Przedyskutować uzyskane wyniki, a przeprowadzone ohUn w tabelach: &
P1120611 [1024x768] 166 Stężenia poszczególnych jonów w roztworze miareczkowanym, o objętości wktm w
P1120612 [1024x768] Podczas miareczkowania słabego kwasu mocną zasadą przewodnictwo roztworu rośnie
P1120613 [1024x768] 16$ z każdej strony punktu końcowego. Możliwość ekstrapolacji prostych do punktu
P1120615 [1024x768] ELEKTRODY JONOSELEKTYWNE. WYZNACZANIE STĘŻENIA JONÓW METODAMI DODATKU WZORC
P1120616 [1024x768] a) elektrody czule na gazy, w których wykorzystuje się przepus
P1120617 [1024x768] 21 I £° — SEA-f pomiarowego ogniwa elektrodowego w roztworze jonów mierzonych o
P1120622 [1024x768] WYZNACZANIE STAŁEJ DYSOCJACJI WSKAŹNIKA KWASOWO-ZASADOWEGO METODĄ ABSORPCJO
P1120623 [1024x768] widma absorpcyjne czerwieni fenolowej zarejestrowane dla różnych wartości pH ośr
P1120624 [1024x768] W reakcji dysocjacji słabego kwasu, będącego wskaźnikiem jednozasadowym (np błęk
P1120625 [1024x768] ■ 123 Odczynniki HCI. I M NaOH. Wykonanie ćwiczenia (JW- ^^ C ^ &nbs
P1120626 [1024x768] 124 Opracowanie wyników m m 1. Obliczyć pH roztworów, przyjmuj
więcej podobnych podstron