skanuj0002
Do powierzchni warstwy enzymatycznej dyfunduje tlen rozpuszczony w wodzie oraz substrat. W nieobecności substratu ustala się pewien początkowy stan stacjonarny, któremu odpowiada początkowy, ustalony sygnał elektrody tlenowej. Po dodaniu do roztworu pewnej ilości substratu, w warstwie unieruchomionego enzymu część tlenu jest zużywana w reakcjach (1) i (2) w zależności od tego, jaki jest substrat, a strumień tlenu dyfundującego do powierzchni elektrody ulega zmniejszeniu. W efekcie zmniejsza się natężenie prądu będącego wynikiem redukcji tlenu na katodzie i sygnał elektrody maleje, aż ustali się nowy stan stacjonarny (Rysunek 2).
dodanie porcji substratu
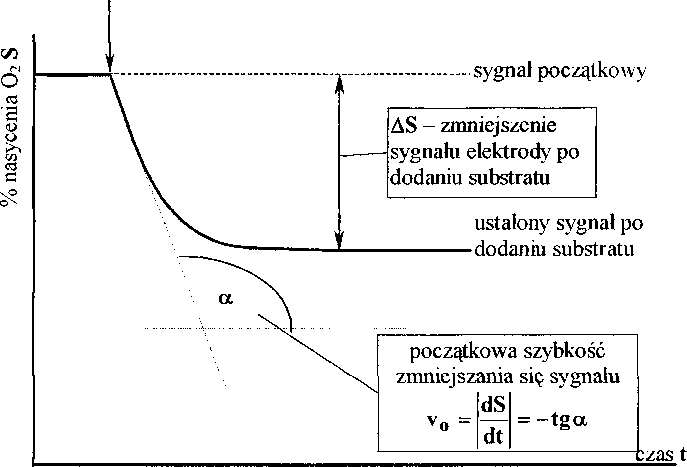
Rysunek 2. Zmiany sygnału elektrody enzymatycznej po dodaniu substratu i sposób analizy tych zmian
W metodzie stacjonarnej mierzy się zmniejszenie sygnału AS powstałe w wyniku dodania substratu czyli różnicę sygnału w stanie stacjonarnym w nieobecności substratu i po jego dodaniu. W metodzie kinetycznej można mierzyć początkową szybkość zmniejszania się sygnału v0 (Rysunek2). W obu wypadkach mierzona wielkość (AS lub v0) jest wprost proporcjonalna do stężenia substratu w badanym roztworze. W efekcie, dokonując pomiarów dla kilku różnych stężeń substratu, możemy otrzymać krzywą kalibracyjną elektrody enzymatycznej czyli zależność AS = f(cSUbstratu) lub v0 = f(CsUbstratu), która powinna być linią prostą. Jednak istnieje wiele czynników powodujących, że rzeczywiste krzywe kalibracyjne są nieliniowe, szczególnie dla wyższych stężeń substratu. Pierwszym z nich jest wyczerpywanie się tlenu w pobliżu powierzchni elektrody w obecności wysokiego stężenia substratu. Drugim - mała aktywność unieruchomionego enzymu, co powoduje, że odpowiedź elektrody jest kontrolowana przez kinetykę reakcji enzymatycznej, a nie przez dyfuzję reagentów do powierzchni elektrody. Można temu zapobiec stosując dużą ilość unieruchomionego enzymu. Trzecim - istotnym tylko w przypadku niektórych enzymów - autoinhibicja enzymu przez wysokie stężenie substratu. Czynnik ten jest szczególnie ważny w przypadku oksydazy polifenoli, gdyż należy ona do grupy enzymów podlegających „samobójczej” inaktywacji przez substrat.
Ponieważ czyste enzymy są często bardzo drogie i trudno dostępne, toteż często wygodnie jest posłużyć się enzymem w postaci surowego wyciągu z odpowiednich tkanek czy mikroorganizmów. W przypadku tyrozynazy bogatym źródłem tego enzymu są różne tkanki
2
Wyszukiwarka
Podobne podstrony:
skanuj0002 Do powierzchni warstwy enzymatycznej dyfunduje tlen rozpuszczony w wodzie oraz substrat.
28 (405) I f. do różnych grup. b). GRUPA IJ. • •’ Związki rozpuszczalne ; / w w?), wodzie . : &
Stosowane są do rozdzielania substancji nierozpuszczalnych lub słabo rozpuszczalnych w wodzie. Należ
WŁAŚCIWOŚCI ORGANOLEPTYCZNE: SMAK - Sole i gazy rozpuszczone w wodzie oraz zawarte w niej zawiesiny
90 Paulina Pająk, Teresa Fortuna Największą zawartością pektyn rozpuszczalnych w wodzie oraz pektyn
skanuj0006 (205) 4 1 .Przygotowanie do kardiowersji -leki rozrzedzające krew; tlen; przed zabiegiem
P2201321 Teoretyczne podstawy uprawy roli Oleba * to powierzchniowa warstwa skorupy ziemskiej (do 15
skanuj0004 (331) 86 Rwńrial IX jako definicję składowej naprężenia normalnej do powierzchni AS, oraz
skanuj0094 (Kopiowanie) Dodatkową rolę osłaniającą, w stosunku do związków chemiczn; rozpuszczalnych
skanuj0307 Projektowanie i nakładanie tekstur Teksturowanie jest sztuką dodawania do powierzchni 3D
slowniczek 2 W malarstwie gruntowanie to powlekanie powierzchni przeznaczonej do malowania warstwą m
45030 SNC03567 nywana niekiedy do biologicznej pompy węglowej. W powierzchniowej warstwie oceanu gru
skanuj0002 13. z wyjątkiem Lipaz min. aw konieczne do przebiegu reakcji enzymatycznej to:aw> 0,85
pharm 1 b © Przenikanie przez powierzchowne warstwy skóry © Wchłanianie się do krwi i rozprowadzanie
DSC00508 Z powierzchni rośliny woda przemieszcza się do przyległej warstwy powietrza
więcej podobnych podstron