420
A HibUl. IM1U.1 .Vvu .«»•»».--u, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«}
U KINETYKA I MECHANIZM REAKCJI CHEMICZNYCH
skutecznych. Możemy więc napisać
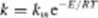
114.23)
oraz po zlogarytmowaniu
In k = lnjt*
Podstawiając Ink,. = B oraz E/R = A. otrzymujemy równanie Arrheniusa (14.22).
Stalą B można obliczyć z częstości zderzeń następujących w gazie (liczby zderzeń w ciągu sekundy) i z tego powodu nazywa się ją czynnikiem częstości W wielu przypadkach wartość B obliczona na podstawie teorii kinctyczno-molckularncj zgadza się dobrze z wartością wyznaczoną doświadczalnie, z czego wyciąga się wniosek, że każde zderzenie cząsteczek aktywnych jest skuteczne. W innych przypadkach wartość doświadczalna B jest mniejsza od wartości obliczonej, a różnice dochodzą do kilku rzędów wielkości. Widocznie nic każde zderzenie cząsteczek aktywnych jest wówczas skuteczne. W takich przypadkach sądzi się. ze oprócz aktywacji zderzających się cząsteczek. konieczne jest jeszcze, aby zderzenie nastąpiło w jakiś określony sposób, np. aby zderzały stę z sobą określone części cząsteczek. Równanie (14.23) należy wówczas uzupełnić przez wprowadzenie do iloczynu po jego prawej stronie liczby ułamkowej P, zwanej czynnikiem steryeznym:
k = Pk,.c-E'Kr
114.25)
Liczba ta. zależnie od reakcji, zmienia się w szerokim zakresie od 1 do liczb rzędu I0_,J.
Przedstawiona tutaj w zarysie teoria zderzeń zakłada, jak widzieliśmy, że cząsteczka
o przeciętnej energii przed wejściem w reakc ję musi uzyskać, na skutek zderzeń z. innymi cząsteczkami, pewien nadmiar energii, energię aktywacji Przejście cząsteczki ze stanu o energii zbliżonej do przeciętnej do stanu aktywnego przedstawiono schematycznie na rys. 14.4. Uzyskany nadmiar energii jest następnie oddawany przez produkty w dalszych zderzeniach.
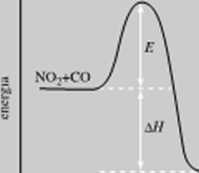
NOtCO.
współrzędna reakcji
Rys. 14.4. Zmiana energii reagujących cząsteczek w czasie reakcji NO; + CO -• NO f CO.-. ..Współrzędna reakcji" charakteryzuje zmiany wzajemnego położenia jąder alomowych przy przejściu od cząsteczki NO; i cząsteczki CO do cząsteczek NO I CO;
Wyszukiwarka
Podobne podstrony:
S10 A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II S-7. © l>. WN TOS
S2 A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II S-7. © l>. WN TOS
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«} 33
000IX A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >
000VIII A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II S-7. © l>. WN TOS »*} VI
000VII A HibUl. IM1U.1 .Vvu .«»•»».--u, r ), buui :uO ISBN D4H1II S-7. © l>. WN TOS >*} SPIS T
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«} II
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >*} 72
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II t-7. © l>. WN TOS >*} 3.1
A HibUl. IM1U.1 .Vvu .•»•»»«. :u, r ), buui :uO ISBN D4H1II t-7. © l>. WN TOS »*} 4 3 HOMOJĄDftOW
A HibUl. IM1U.1 .Vvu r.,, r ), buui :uO ISBN D4H1II t-7. © l>. WN TOS >«} 5
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II S-7. © l>. WN TOS >*} 162 5 S
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«} 7 12 TE
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II t-7. © l>. WN TOS >«} 8 1
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«} 10
A HibUl. IM1U.1 .Vvu .•»•»».--u, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«} 430
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >*} U
więcej podobnych podstron