Image47 (15)

181 Rozwiązania zadań ze zbioru "MENDLA "
Wi = P5_^b.(Ta_Tb)
Pb * Vb
Wartość c-=-wyznaczymy z równania Clapeyrona dla stanu B.
Tb
PB • Vb Tb
= n ■ R
Tb = 200K
i Ta = 300K
(300K-200K)
Wi = 1 mol• 8,31
Po podstawieniu do Wi mamy: Wi = n • R • (Ta-Tb) J
K ■ mol
Wi = 831 J
Podczas przemiany B-C objętość gazu jest stała, więc praca W2=0.
W czasie trzeciej przemiany C-D gaz wykonuje pracę rozprężając się izobary-cznie, skąd mamy:
W3 = - p • AV , ale AV = Vd - Vc, więc W3 = - po • (Vd - Vc)
Z równania przemiany izobarycznej wyznaczymy Vc Vc VD . _
Tc = Td /TC
V0 =
Vp • Tc Td _
Po podstawieniu Vc do pracy W3 możemy obliczyć jej wartość. W3 = - po • I Vd - ^"C
W3 = po
W3 = pd
Td
Vd - Tc .. ^ 7 Vd-Tc Vd-Td^
Td
Td
W3 = • (Tc - TD)
= n • R
Z równania Clapeyrona dla stanu D otrzymamy PD • Vp Td
skąd W3 = n • R • (Tc - Td)
W3= 1 mol• 8,31
(100AC— 300K)
J
K ■ mol
W3 = - 1662 J
Całkowita praca wykonana przez gaz podczas całego cyklu wynosi:
W = W1 + W2 + W3 W = 831 J+ 0- 1622 J W = - 831 J
Zgodnie z I zasadą termodynamiki zmiana energii wewnętrznej jest równa:
AU = W + Q , ale AU = 0 skąd Q = -W
Q = - (-831 J)
Q = 831 J
Odp.: Podczas cyklu A-B-C gaz otrzymał 831 J ciepła, wykonując 831 J pracy, ale jego energia wewnętrzna nie uległa zmianie.
Zadanie 686 str.137
Dane:
Odczytujemy z wykresu.
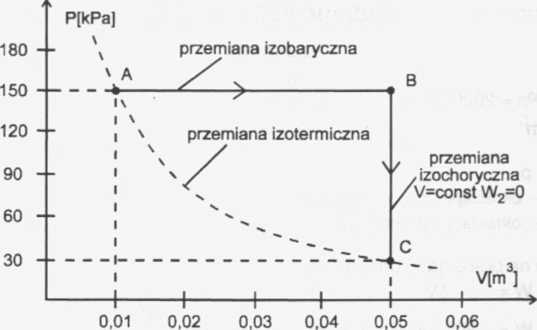
Ze stanu A do C można przejść bezpośrednio w wyniku przemiany izotermicz-
nej bo:
PaA/a = 150 kPa • 0,1 rrł3 = 15 kPa ■ m3 pc • Vc = 30 kPa ■ O.źrrP = 15 kPa ■ m3, więc pa • Va = pc • Vc , Ta = Tc Podczas przemiany izobarycznej A-B gaz wykonuje pracę Wi.
Wi = - pA • AV , ale aV = Vb~Va skąd Wi = - pA • (Vb - Va)
Wi =- 150 kPa ■ (0,05m3- 0,01/t?3)
Wi =- 150000 Pa- 0,0ĄrrP , Pa = ~
rrr
W1=-600OĄ-rrP , N-m=J
Wi = - 6kJ
Wyszukiwarka
Podobne podstrony:
18469 Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru &q
18469 Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru &q
Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru "ME
Image48 (15) 183____Rozwiązania zadań ze zbioru "MENDLA"_ W przemianie B-C praca W2 = O, w
Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru "ME
69485 Image43 (19) 173 Rozwiązania zadań ze zbioru "MENDLA " k = n • R • T n- R T-W Odp.:
Image42 (19) 171 Rozwiązania zadań ze zbioru "MENDLA” Za pi • Vi do pracy W podstawimy n R • Ti
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
Image49 (16) 185 Rozwiązania zadań ze zbioru "MENDLA" Q - K P • AV K - 1 1,4 • 200000 Pa •
Image4 (61) 88 Rozwiązania zadań ze zbioru "MENDLA" V1 • T2 = Ti • (Vi + Ah • S) Vi -T2 =
Image4 (62) 62 Rozwiązania zadań ze zbioru "MENDLA"_ Z równania gazu doskonałego dla stanó
Image4 (63) 12 Rozwiązania zadań ze zbioru "MENDLA" 0,0001 0,003 = 3-10~
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
więcej podobnych podstron