skan0029 (3)
32 Stany skupienia materii
b =
RT,
8,314 • 33,3
8pc 8 • 12,8 ■ 1,013 • 105
= 26,7 10
-6
m
mol
0,0267
dm3
mol
Stąd
400 - 1,013 - 105
ln tc = -x
v 8,314-300
26,7 • 10"6-
0,0249 (26,7 • H)-6) • 400 • 1,013 • 105
8,314-300
+
2 • 8,314 • 300
= 0,3657.
Tak więc współczynnik lotności (p = 1,442, a sama lotność/= 584,4. Wyrażenie (2.29) można przekształcić do postaci
ln (p =
RT
J (^n - -y-)
gdzie zależność między/? i Vm wynika, w tym przypadku, wprost z izotermy Van der Waalsa.
Drugi sposób sprowadza się więc do wykreślenia wartości różnicy (Vm-RT/p) w funkcji ciśnienia (rys. 2.2), a następnie całkowania graficznego. Pole pod krzywą wynosi 199,16 J • mol-1, obliczony stąd współczynnik lotności (p = 1,378, natomiast lotność/ = 558,5.
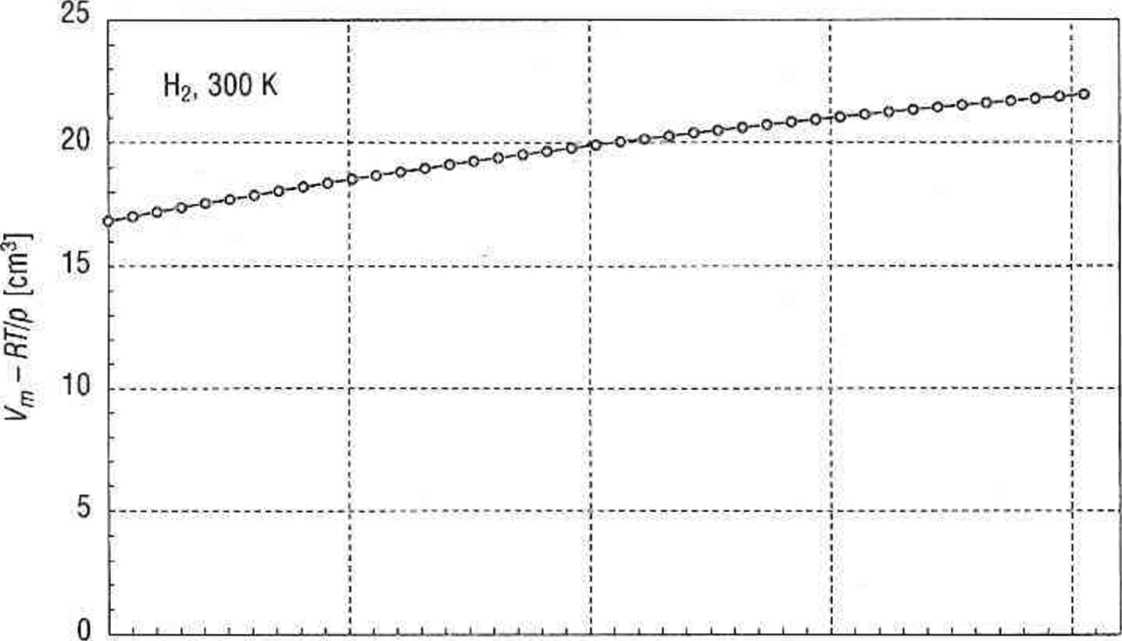
0 10 20 30 40
p [MPa]
Rys. 2.2. Wyznaczanie współczynnika lotności gazu metodą całkowania
graficznego
Wartości lotności wyznaczonej za pomocą równania wirialnego (ze współczynnikami obliczonymi z równania Van der Waalsa), a także otrzymanej metodą całkowania graficznego, przy wykorzystaniu tego równania, znacznie odbiegają od wartości doświadczalnych. Widać, że równanie Van der Waalsa źle odtwarza zachowanie się gazu rzeczywistego w wyższych ciśnieniach. ■
Wyszukiwarka
Podobne podstrony:
77535 skan0027 (3) 30 Stany skupienia materii / d
skan0021 (5) 24 Stany skupienia materii Przykład 2.3. Dla jednoatomowego gazu idealnego=
skan0043 (4) 46 Stany skupienia materii 2c:6. Ułamek cząsteczek gazu dNIN, o prędkościach pomiędzy u
skan0025 (3) 28 Stany skupienia materii(2.22) Analogicznie można wyprowadzić zredukowane równanie
skan0033 (3) 36 Stany skupienia materii średnia droga swobodna równa sięhi ~ gdzie Ar12 oznacza całk
43763 skan0037 (4) 40 Stany skupienia materii b) dla ciekłego CH3OH Par = (M,64 + 3 • 2,74 + 1 • 3,5
skan0025 (3) 28 Stany skupienia materii(2.22) Analogicznie można wyprowadzić zredukowane równanie
więcej podobnych podstron