skan0154

Roztwory i równowagi fazowe 157
wyrażenie końcowe na l2 będzie miało postać
i
d -\hn
U - AHml +
W ten sposób entalpię mieszania n2 moli HNO3 z /?] molami H20 możemy zapisać jako sumę udziału składników (4.27):
= n2AHinl = nyli + n2l2.
Potrzebną do obliczenia /t i /2 wartość pochodnej
dj
3 'Jni
znajdujemy analitycznie, na podstawie znajomości równania AHmt= f (yim), albo graficznie (rys. 4.12), prowadząc styczną do krzywej AHini(^m), w żądanym punkcie (tu dla nxln2 = 4).
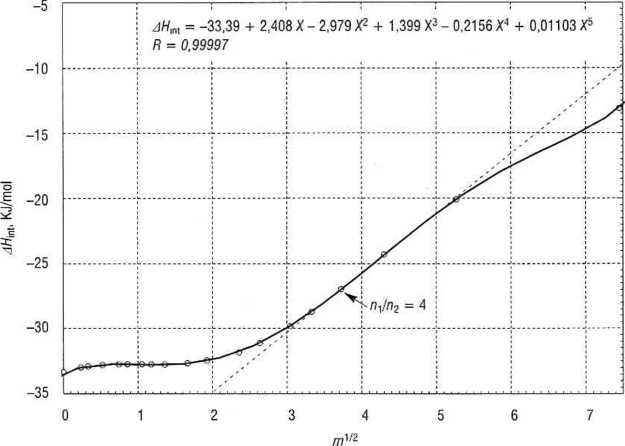
Rys. 4.12. Całkowite ciepło rozpuszczania HNO ( w wodzie w 25°C
Przy stosunkowo niewielkiej krzywiźnie można poprowadzić prostą przez 2 punkty, bezpośrednio sąsiadujące na krzywej z żądanym (w tym wypadku przez punkty odpowiadające 11 \ = 3 oraz nx = 5 moli wody na 1 mol kwasu).
Współczynnik kierunkowy tej prostej (łatwo go obliczyć, gdyż znamy współrzędne obu punktów) przyjmujemy jako wartość szukanej pochodnej. Dla roztworu zawierającego 4 mole wody na 1 mol kwasu współczynnik ten wynosi 1 r)graf — 4,569.
Wyszukiwarka
Podobne podstrony:
skan0144 (2) Roztwory i równowagi fazowe 147 Zależność przedstawiona na rys. 4.9,
skan0170 (2) Roztwory i równowagi fazowe 173 mamy MC* AH° = AH°opni + (T- 7t więc otrzymane wyrażeni
skan0158 (2) Roztwory i równowagi fazowe 161 Przy wyznaczaniu entalpii cząstkowych metodą graficzną
65435 skan0153 (2) 156 Roztwory i równowagi fazowe gdzie wyrażenie w pierwszym nawiasie jest entalpi
23919 skan0152 Roztwory i równowagi fazowe 155 a molową entalpię mieszania, w [kJ na 1 mol roztworu]
skan0130 (2) Roztwory i równowagi fazowe 133 Dla roztworu o jc2 = 0,6 Gf1 = -3272,5 J • mol-1, G™ =
skan0164 (2) Roztwory i równowagi fazowe 167 wykreślić diagram destylacyjny mieszaniny benzenu i tol
skan0166 Roztwory i równowagi fazowe 169 x2 - dx2 = x2n —y2dn n - dn Zaniedbując iloczyn dx2dn ~ 0,
skan0178 Roztwory i równowagi fazowe 181 v - 0 x-0 8-0 10-0=*y = 0,8 • *. Linia Sb przechodzi przez
skan0123 4. Roztwory i równowagi fazowe Roztworem nazywamy homogeniczną mieszaninę dwu lub więcej su
więcej podobnych podstron