skan0160
Roztwory i równowagi fazowe 163
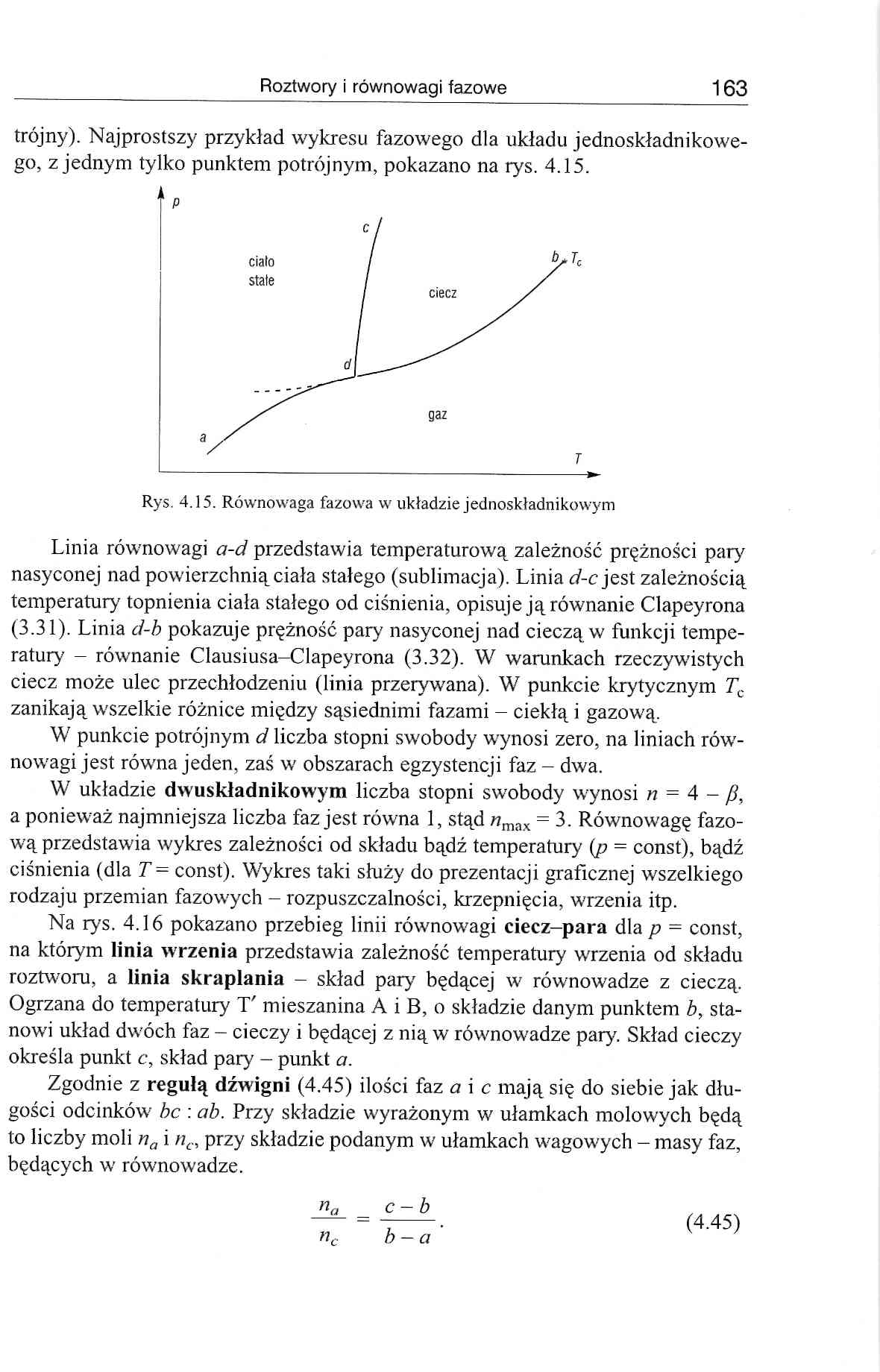
trójny). Najprostszy przykład wykresu fazowego dla układu jednoskładnikowego, z jednym tylko punktem potrójnym, pokazano na rys. 4.15.
Roztwory i równowagi fazowe 163

Linia równowagi a-d przedstawia temperaturową zależność prężności pary nasyconej nad powierzchnią ciała stałego (sublimacja). Linia d-c jest zależnością temperatury' topnienia ciała stałego od ciśnienia, opisuje ją równanie Clapeyrona (3.31). Linia d-b pokazuje prężność pary nasyconej nad cieczą w funkcji temperatur}' - równanie Clausiusa-Clapeyrona (3.32). W warunkach rzeczywistych ciecz może ulec przechłodzeniu (linia przerywana). W punkcie krytycznym Tc zanikają wszelkie różnice między sąsiednimi fazami - ciekłą i gazową.
W punkcie potrójnym d liczba stopni swobody wynosi zero, na liniach równowagi jest równa jeden, zaś w obszarach egzystencji faz - dwa.
W układzie dwuskładnikowym liczba stopni swobody wynosi n - 4-/3, a ponieważ najmniejsza liczba faz jest równa 1, stąd «max = 3. Równowagę fazową przedstawia wykres zależności od składu bądź temperatury (p = const), bądź ciśnienia (dla T = const). Wykres taki służy do prezentacji graficznej wszelkiego rodzaju przemian fazowych - rozpuszczalności, krzepnięcia, wrzenia itp.
Na rys. 4.16 pokazano przebieg linii równowagi ciecz-para dla p = const, na którym linia wrzenia przedstawia zależność temperatury wrzenia od składu roztworu, a linia skraplania - skład pary będącej w równowadze z cieczą. Ogrzana do temperatury T' mieszanina A i B, o składzie danym punktem b, stanowi układ dwóch faz - cieczy i będącej z nią w równowadze pary'. Skład cieczy określa punkt c, skład pary - punkt a.
Zgodnie z regułą dźwigni (4.45) ilości faz a i c mają się do siebie jak długości odcinków bc : ab. Przy składzie wyrażonym w ułamkach molowych będą to liczby moli na i nc, przy składzie podanym w ułamkach wagowych - masy faz, będących w równowadze.
(4.45)
b-a
na c-b fh
Wyszukiwarka
Podobne podstrony:
skan0126 Roztwory i równowagi fazowe 129 Przykład 4.2. Wartości stałych Henrykego dla azotu i tlenu
skan0130 (2) Roztwory i równowagi fazowe 133 Dla roztworu o jc2 = 0,6 Gf1 = -3272,5 J • mol-1, G™ =
skan0144 (2) Roztwory i równowagi fazowe 147 Zależność przedstawiona na rys. 4.9,
skan0164 (2) Roztwory i równowagi fazowe 167 wykreślić diagram destylacyjny mieszaniny benzenu i tol
skan0166 Roztwory i równowagi fazowe 169 x2 - dx2 = x2n —y2dn n - dn Zaniedbując iloczyn dx2dn ~ 0,
skan0170 (2) Roztwory i równowagi fazowe 173 mamy MC* AH° = AH°opni + (T- 7t więc otrzymane wyrażeni
skan0178 Roztwory i równowagi fazowe 181 v - 0 x-0 8-0 10-0=*y = 0,8 • *. Linia Sb przechodzi przez
skan0123 4. Roztwory i równowagi fazowe Roztworem nazywamy homogeniczną mieszaninę dwu lub więcej su
skan0134 Roztwory i równowagi fazowe 137 Rozwiązanie. Entalpia topnienia w zadaniu dotyczy 1 grama b
skan0136 Roztwory i równowagi fazowe 139 Rys. 4.5. Wyznaczanie współczynnika aktywności metodą krios
więcej podobnych podstron