skan0126

Roztwory i równowagi fazowe 129
Przykład 4.2. Wartości stałych Henrykego dla azotu i tlenu w wodzie wynoszą odpowiednio 6,51 • 107 min Hg oraz 3,30-107 mm Hg. Przyjmując, że powietrze zawiera 77,5% wagowych azotu i 22,5% wagowych tlenu, porównać rozpuszczalności tych gazów w powierzchniowych warstwach wód przy ciśnieniu zewnętrznym 750 mm Hg.
Rozwiązanie. W 100 g powietrza zawartych jest 22,5 g tlenu i 77,5 gazo-tu, zatem
_ 22,5/32
A°2 ” 22,5/32 + 77,5/28
oraz xN2 = 1 - .v0, = 0,798.
Zgodnie z prawem Daltona (równanie (2.10)), ciśnienia parcjalne tlenu i azotu wynoszą
p= Xq1 p = 0,202 • 750 = 151,5 mm Hg,
pN, = P-Po2 = 750 - 151,5 = 598,5 mm Hg.
Według prawa Henry’ego (równanie 4.10), rozpuszczalności tych gazów' w wodzie (w ułamkach molowych) wynoszą
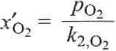
151,5 3,30 - 107
= 4,6 • 10~6
oraz
*n2
P N2
^2,N2
598,5 6,51 -107
= 9,19 nr6.
Mimo że stężenie tlenu w powietrzu jest czterokrotnie mniejsze od stężenia azotu, jego ilość w wodzie jest tylko dwukrotnie mniejsza od ilości azotu. Ma to duże znaczenie biologiczne. ■
W spółczynnik podziału Nernsta KPN
/
Km = -,7 (4-11)
c
określa, że w stanie równowagi stosunek stężeń substancji, rozpuszczonej w dwróch, nie mieszających się ze sobą fazach, jest wielkością stałą.
Przykład 4.3. Kwas benzoesowy rozpuszcza się zanrwno w wodzie (gdzie ulega dysocjacji), jak i w ksylenie (gdzie ulega częściowej dimeryzacji). W temperaturze 25°C stała dysocjacji wynosi Kc = 6,46 • 10-5, zaś stała dimeryzacji jest rówma Kd = 500. W pewnym eksperymencie całkowite stężenia kwasu benzoeso-
Wyszukiwarka
Podobne podstrony:
skan0160 Roztwory i równowagi fazowe 163 trójny). Najprostszy przykład wykresu fazowego dla układu
28708 skan0156 Roztwory i równowagi fazowe 159 Podobnie jak poprzednio, wartość poehodnej możemy wyz
skan0130 (2) Roztwory i równowagi fazowe 133 Dla roztworu o jc2 = 0,6 Gf1 = -3272,5 J • mol-1, G™ =
skan0144 (2) Roztwory i równowagi fazowe 147 Zależność przedstawiona na rys. 4.9,
skan0164 (2) Roztwory i równowagi fazowe 167 wykreślić diagram destylacyjny mieszaniny benzenu i tol
skan0166 Roztwory i równowagi fazowe 169 x2 - dx2 = x2n —y2dn n - dn Zaniedbując iloczyn dx2dn ~ 0,
skan0170 (2) Roztwory i równowagi fazowe 173 mamy MC* AH° = AH°opni + (T- 7t więc otrzymane wyrażeni
skan0178 Roztwory i równowagi fazowe 181 v - 0 x-0 8-0 10-0=*y = 0,8 • *. Linia Sb przechodzi przez
skan0195 198 Roztwory i równowagi fazowe Temperatury wrzenia benzenu i toluenu pod ciśnieniem 400 mm
skan0123 4. Roztwory i równowagi fazowe Roztworem nazywamy homogeniczną mieszaninę dwu lub więcej su
skan0134 Roztwory i równowagi fazowe 137 Rozwiązanie. Entalpia topnienia w zadaniu dotyczy 1 grama b
skan0136 Roztwory i równowagi fazowe 139 Rys. 4.5. Wyznaczanie współczynnika aktywności metodą krios
więcej podobnych podstron