skan0210
Kinetyka chemiczna 213
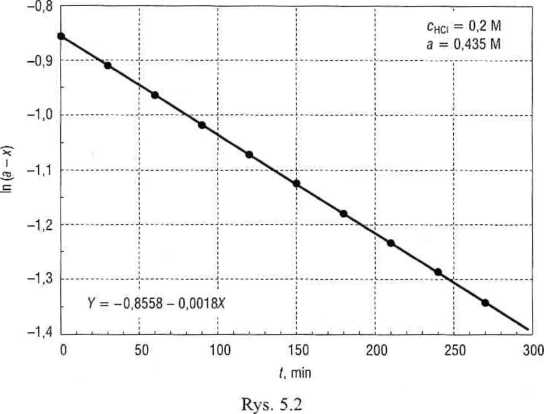
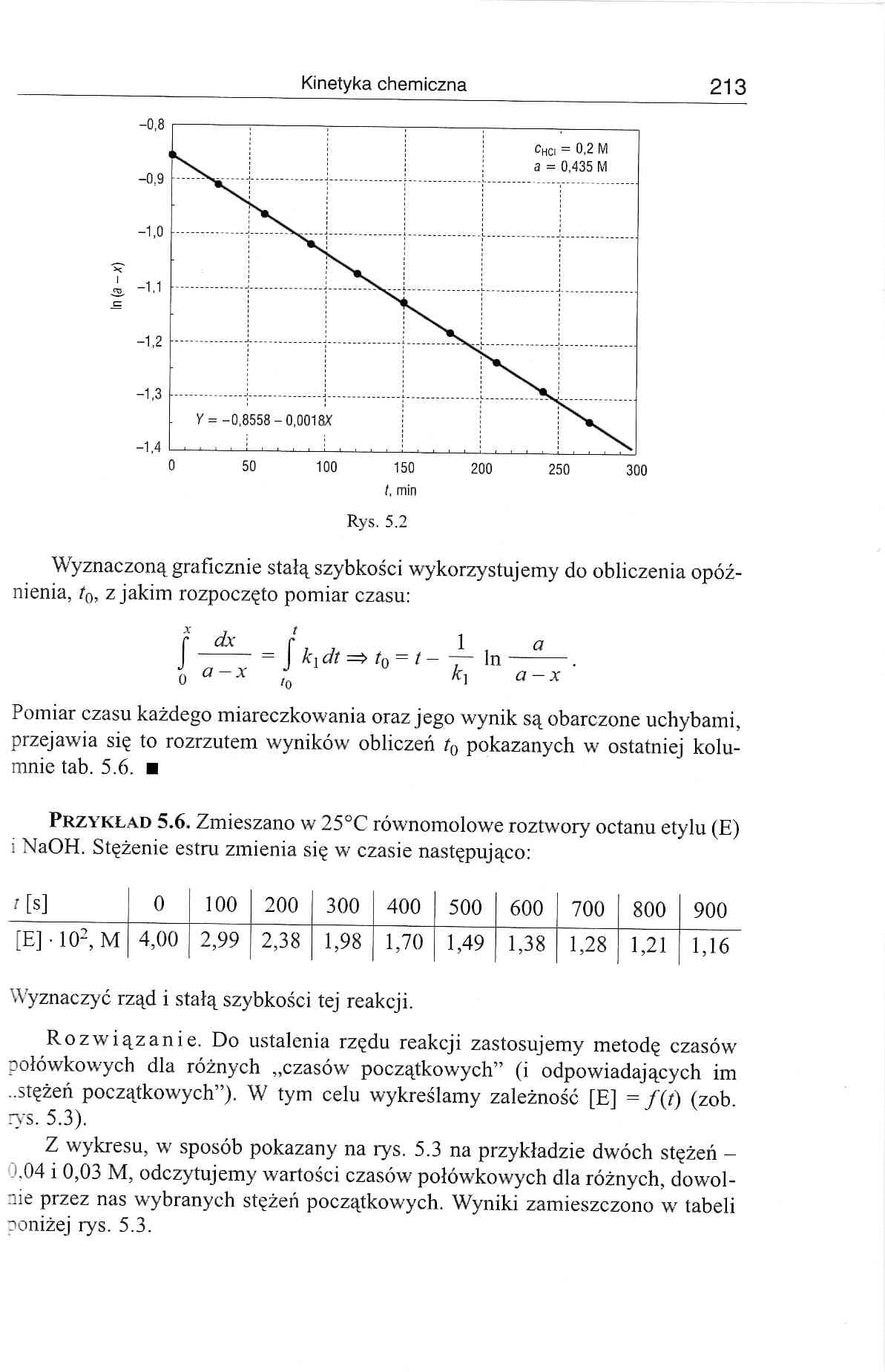
Wyznaczoną graficznie stałą szybkości wykorzystujemy do obliczenia opóźnienia, t0, z jakim rozpoczęto pomiar czasu:
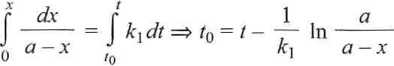
Pomiar czasu każdego miareczkowania oraz jego wynik są obarczone uchybami, przejawia się to rozrzutem wyników obliczeń t0 pokazanych w ostatniej kolumnie tab. 5.6. ■
Przykład 5.6. Zmieszano w 25°C równomolowe roztwory octanu etylu (E) i NaOH. Stężenie estru zmienia się w czasie następująco:
|
'[s] |
0 |
100 |
200 |
300 |
400 |
500 |
600 |
700 |
800 |
900 |
|
[E] • 102, M |
4,00 |
2,99 |
2,38 |
1,98 |
1,70 |
1,49 |
1,38 |
1,28 |
1,21 |
1,16 |
Wyznaczyć rząd i stałą szybkości tej reakcji.
Rozwiązanie. Do ustalenia rzędu reakcji zastosujemy metodę czasów połówkowych dla różnych „czasów początkowych” (i odpowiadających im ..stężeń początkowych”). W tym celu wykreślamy zależność [E] = f(t) (zob. rys. 5.3).
Z wykresu, w sposób pokazany na rys. 5.3 na przykładzie dwóch stężeń -.04 i 0,03 M, odczytujemy wartości czasów połówkowych dla różnych, dowolnie przez nas wybranych stężeń początkowych. Wyniki zamieszczono w tabeli poniżej rys. 5.3.
Wyszukiwarka
Podobne podstrony:
skan0218 Kinetyka chemiczna 221 w którym po etapie (1), z szybko ustalającą się równowagą, następuje
skan0222 Kinetyka chemiczna 225 oraz, analogicznie, gdyż szybkość powstawania produktu C, dcę/dt = k
skan0206 (2) Kinetyka chemiczna 209 Eliminując z nich liczbę moli azotu, ;?N, możemy obliczyć w każd
12447 skan0208 Kinetyka chemiczna 211 Rys. 5.1. Wyznaczanie rzędu i stałej szybkości reakcji metodą
skan0200 (2) Kinetyka chemiczna 203 Szybkość reakcji A B zgodnie z równaniem (5.1) wyraża się
51801 skan0211 214 Kinetyka chemiczna [E], M Rys. 5.3. Wyznaczanie czasów połówkowych reakcji dla ró
więcej podobnych podstron