skan0213

216 Kinetyka chemiczna
W 250°C mierzono ciśnienie całkowite w reaktorze wypełnionym pierwotnie czystym N02:
|
/[S] |
0 |
20 |
40 |
60 |
80 |
100 |
120 |
|
PŚ) [hPa] |
1001 |
1024 |
1045 |
1064 |
1083 |
1099 |
1113 |
Wyznaczyć stałą szybkości reakcji rozkładu N02.
Rozwiązanie. Szybkość tej reakcji, zgodnie z (5.1), przedstawia równa-
= A'[N02]2.
W przybliżeniu gazu idealnego
cNO->
P~NO->
RT• 1()3
[M]
równanie to będzie miało postać
1_ ^Rno2 2 dl
k
RT-103
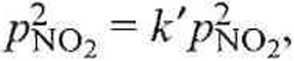
gdzie stała szybkości k' jest wyrażona w [Pa-1 • s-1]. Liczba lO-^dm3 • m-3] wynika z konieczności przeliczenia stężenia z mol ■ m-3, przy ciśnieniu w Pa, na mol • dm-3 (M).
Całkowanie tego równanie prowradzi do wyrażenia
-= 2 k't + const,
PNO2
gdzie, tak jak w' przykładzie 5.4, w stałej całkowania zawarte są, trudne do precyzyjnego wyznaczenia, ciśnienie początkowa N02 oraz czas rozpoczęcia reakcji rozkładu.
Do obliczenia/;(N02) wykorzystamy stechiometrię reakcji. Tym razem, zamiast liczby moli, pod schematem reakcji zapiszemy od razu ciśnienia parcjalne reagentów
|
2N02 |
—> |
2NO |
+ o2 pc(t) = lLPi(t) |
|
Po |
0 |
0 O |
t = 0
t Puo2(t) = Po~ 2/>o2(0 2/?no(0 = 2pQl(t) p02(t) p0 +po2(t)
Wyszukiwarka
Podobne podstrony:
skan0233 236 Kinetyka chemiczna Tak więc, po drobnych przekształceniach mamy 236 Kinetyka chemiczna
skan0237 240 Kinetyka chemiczna Przykład 5.17. Stałe szybkości reakcji w fazie gazowej 1. &nbs
skan0251 254 Kinetyka chemiczna a — «<*, w którym a0 jest kątem skręcenia płaszczyzny polaryzacji
68830 skan0219 222 Kinetyka chemiczna Stąd po scałkowaniu mamy 222 Kinetyka chemiczna CB k„ a a h -
skan0207 210 Kinetyka chemiczna można go uniknąć, obliczając stałe szybkości za pomocą wyrażeń otrzy
skan0223 226 Kinetyka chemiczna wynosi 37 fis. W tej temperaturze gęstość wody wynosi 0,9970 g ■ cm
47714 skan0253 256 Kinetyka chemiczna szybkość powstawania produktu w funkcji [A] i stałych szybkośc
więcej podobnych podstron