skan0232

Kinetyka chemiczna 235
Z różnicy obliczonych w ten sposób wartości energii aktywacji EA(i) dla reakcji w obu kierunkach można obliczyć standardową zmianę energii wewnętrznej reakcji AU® = -20,9 kJ • mol-1. Wynik ilustruje diagram energetyczny reakcji (rys. 5.10). ■
Zgodnie z teorią zderzeniową szybkość reakcji A + B —> produkty jest funkcją liczby zderzeń (ZAB) i ułamka cząsteczek mających energię £a, wystarczającą do przereagowania. Szybkość reakcji zależy od liczby zderzeń, w których wyniku powstaje produkt, w 1 m3 mieszaniny gazowej w ciągu 1 sekundy
v' = PZABexp(- Jjr] [nr3 ■ s-1], (5.46)
gdzie P jest czynnikiem sferycznym wyrażającym prawdopodobieństwo właściwej orientacji w momencie zderzenia,
Zab =Ar(A).V(B)7C^B* (5.47)
jest liczbą zderzeń w ciągu 1 sekundy między cząsteczkami A i B zawartymi w 1 m3. N(A) i Ar(B) oznaczają, odpowiednio, liczby cząsteczek A i B w 1 m3, natomiast
^ab -
+
2
(5-48)
jest średnicą zderzeniową obu cząsteczek. Można przyjąć w uproszczeniu, że w ciągu 1 s z cząsteczką A zderzą się cząsteczki B zawarte w walcu o promieniu crAB i długości równej względnej prędkości średniej w - zob. (2.31):
w
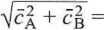
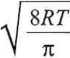
( + Mb \
\ MaMb I
[m • s-1].
(5.49)
Chcąc porównać v\ dane relacją (5.46), z szybkością reakcji v = £2[A][B], wyrażaną zazwyczaj w M • s_1, należy przeliczyć zarówno l?', jak i stężenia N(A) oraz N(B)
/
v
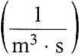
= 103
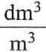
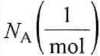
/ mol \ Idm3 • s /
podobnie N(A) = [A] • 103 • NA oraz jV(B) = [B] • 103 • NA.
Uwzględniając powyższe, możemy zapisać szybkość reakcji i/jako
v' = 103 • Nav=P[A] • 103 • jVa[B] ■ 103 • NAn<rlBwexp (- -Jjr] (5.50)
Wyszukiwarka
Podobne podstrony:
Warto zauważyć, że obliczana w ten sposób wartość c jest dodatnia. Interpretujemy to jako falę rozch
58556 skan0238 Kinetyka chemiczna 241 ASoU możemy obliczyć za pomocą wyrażenia (5.62) lub (5.64). To
skan0206 (2) Kinetyka chemiczna 209 Eliminując z nich liczbę moli azotu, ;?N, możemy obliczyć w każd
skan0210 Kinetyka chemiczna 213 Wyznaczoną graficznie stałą szybkości wykorzystujemy do obliczenia o
skan0218 Kinetyka chemiczna 221 w którym po etapie (1), z szybko ustalającą się równowagą, następuje
skan0228 Kinetyka chemiczna 231 W przybliżeniu stanu stacjonarnego mamy = ki[A]" - *2[L][A] + a
oraz wyjaśnienia i rozliczenia ewentualnych różnic. Dokonana w ten sposób inwentaryzacja jest podsta
skan0200 (2) Kinetyka chemiczna 203 Szybkość reakcji A B zgodnie z równaniem (5.1) wyraża się
skan0242 Kinetyka chemiczna 245 Rozwiązanie. Stopień pokrycia węgla aktywnego etenem, <9, definiu
więcej podobnych podstron