skan0296

Elektrochemia 299
pH = pKa + lg
soli
Dc
(9)
Obliczona stąd przybliżona wartość pH wynosi 4,756.
c) Stałą dysocjacji amoniaku NH4OH NH4 + OH- wyraża równanie
(10)
^oh- _ coh- }'± "nh4oh (cz - cOH-) c® ’
gdzie c.Ł jest stężeniem początkowym NH4OH, a współczynnik aktywności nie-zdysocjowanej zasady przyjęto za równy 1. Amoniak jest słabo zdysocjowany i, podobnie jak w punkcie a), nietrudno wyprowadzić przybliżone wyrażenie
aon~ =
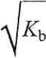
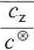
skąd można obliczyć przybliżoną wartość pH:
pH= p£w-— p/ćb-lg
= 13,997— • (4,75 - lg 0,1) = 11,123.
Dokładną wartość pH otrzymamy, przekształcając równanie (10):
^y± + Kbc®x- K^czc® = 0, (11)
gdzie * oznacza stężenie jonów' OH-. Identycznie jak w punkcie a) znajdujemy x i y± - zob. tab. 6.13.
Tabela 6.13
|
i |
/[M] |
logy± |
y± |
A |
*; [M] |
pH | ||
|
0 |
i |
7,113 • |
10-6 |
1,325 |
10-3 |
11,119 | ||
|
1 |
1,325 • 10-3 |
-0,01853 |
0,958 |
6,532 • |
10-6 |
1,382 |
10-3 |
11,119 |
|
2 |
1,382- 10-3 |
-0,01893 |
0,957 |
6520 • |
10"6 |
1,383 |
10-3 |
11,119 |
|
3 |
1,383 • 10-3 |
-0,01893 |
0,957 |
6,519 • |
10-6 |
1,383 |
10-3 |
11,119 |
Dokładna wartość pH 0,1-molowego roztworu amoniaku w 25°C nieznacznie odbiega od wartości przybliżonej
pH = pATw + lg -#= 13,997 + lg
1,383 -10-3- 0,957
,119,
toteż dla słabych zasad metoda przybliżona jest w' zupełności wystarczająca.
d) Analogicznie jak w punkcie b), można z równania (10) wyprowadzić wyrażenie
Wyszukiwarka
Podobne podstrony:
45178 skan0298 Elektrochemia 301 pH = pAw - pAb + lg ~~L~ • (15) ^soli Obliczona
skan0278 Elektrochemia 281 lg y± = -A z+zJj^I 1 +Bayfr ’ (6.39) gdzie stała A jest określona wzorem
skan0266 Elektrochemia 269 >dzie e jest ładunkiem protonu, f;() - przenikalnością elektryczną pró
skan0270 Elektrochemia 273 W jej wyniku, przy przepływie przez naczynko Hittorfa ładunku 1 farada-ja
Dysocjacja, Odczyn roztworu DYSOCJACJA rozpad elektrolitów na jony kwasów zasad soli jony H+ i jo
76152 skan0280 Elektrochemia 283 a ich suma daje reakcję ogniwa +H2 + AgBr = H+ + Ag + Br-. Zgodnie
80057 skan0290 Elektrochemia 293 Rys. 6.4 Zgodnie z nim SEM ogniwa wynosi E = —t —In aA^>*N°^ >
skan0282 Elektrochemia 285 Wykres zależności E = /(ln a±) powinien przedstawiać, zgodnie z równaniem
skan0288 Elektrochemia 291 Elektrochemia 291 Ks = [Pb2+][F-]2(2) gdzie [F ] = 2c + cs. Zatem c, rozp
więcej podobnych podstron