29139 skan0023 (6)

26 Stany skupienia materii
Rozwiązanie.
1) Obliczanie ciśnienia a) Według równania (2.9)
nRT
p= —
— 17,68 atm (1791 kPa).
b) Według równania (2.18)
nRT n2 3,5 • 0,08206 • 320,15 p~ V-nb ~a v2~ 5,2 -3,5-0,0371
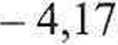
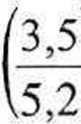
= 16,25 atm (1646 kPa).
Zmierzone ciśnienie w tych warunkach wynosi 16,0 atm. 2) Obliczanie objętości
Wyrażenie (2.18) można przekształcić do postaci
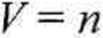
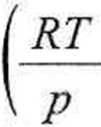
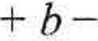
cm abn2 pV pV2
Ostatni wyraz sumy w nawiasach jest bardzo mały w porównaniu z innymi i można go pominąć. Równie mały błąd popełnia się przy niewielkich ciśnieniach, przyjmującpV ~ nRT.
W ten sposób otrzymujemy wyrażenie, z którego możemy obliczyć przybliżoną objętość gazu Van der Waalsa
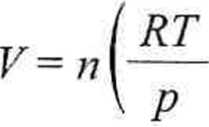
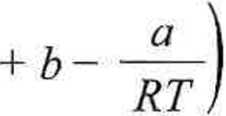
_ ,0,08206-320,15 = 3,5-1-—-+ 0,0371 -
4,17
0,08206-320,15
= 5,233 dm3.
Chcąc obliczyć objętość dokładną, należy zastosować metodę kolejnych przybliżeń (iteracji)
P/+1 = n\b +
RT
p + a(n/Vj)2 /'
W pierwszym przybliżeniu, jako wartość początkową, bierzemy objętość gazu
idealnego
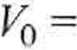
nRT
P
3,5 - 0,08206 • 320,15 16,25
= 5,658 dm3
irzymujemy Vh które, w drugim kroku, wstawiamy zamiast V0 itd. Pro-przenwamy, gdy kolejne wielkości zaczynają się powtarzać (na przyję-i-i rrrie dokładności). Wyniki pokazano w tab. 2.1.
X.
Wyszukiwarka
Podobne podstrony:
36124 skan0035 (3) 38 Stany skupienia materii Rozwiązanie. Zgodnie z równaniem (2.41) 38 Stany skupi
skan0029 (3) 32 Stany skupienia materii b = RT, 8,314 • 33,3 8pc 8 • 12,8 ■ 1,013
skan0021 (5) 24 Stany skupienia materii Przykład 2.3. Dla jednoatomowego gazu idealnego=
skan0043 (4) 46 Stany skupienia materii 2c:6. Ułamek cząsteczek gazu dNIN, o prędkościach pomiędzy u
skan0025 (3) 28 Stany skupienia materii(2.22) Analogicznie można wyprowadzić zredukowane równanie
skan0033 (3) 36 Stany skupienia materii średnia droga swobodna równa sięhi ~ gdzie Ar12 oznacza całk
43763 skan0037 (4) 40 Stany skupienia materii b) dla ciekłego CH3OH Par = (M,64 + 3 • 2,74 + 1 • 3,5
skan0025 (3) 28 Stany skupienia materii(2.22) Analogicznie można wyprowadzić zredukowane równanie
więcej podobnych podstron