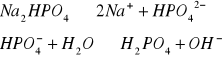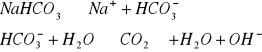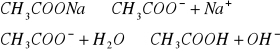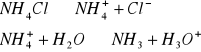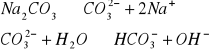Data wykonania: 30.03.2010r. |
|
Dr inż. Magdalena Frańska |
Data oddania: 13.04.2010r. |
Ćw. Nr 3; Odczyn roztworów wodnych soli |
Ocena: |
Teoria Bronsteda
Według tej teorii kwas to związek chemiczny lub jon zdolny do oddawania protonów czyli jonów H+, natomiast zasada to związek chemiczny lub jon zdolny do przyjmowania protonów.
Amfolity- to substancje amfiprotyczne, związki chemiczne zawierające w cząstce zarówno grupy kwasowe, jak i zasadowe (np. aminokwasy), zależnie od warunków mogą dysocjować jak kwasy lub zasady.
Wyznaczanie stałej kwasowej za pomocą wzorów na pH słabej zasady i pH słabego kwasu:
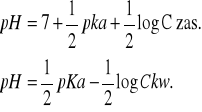
Opracowanie wyników:
1.
L.p. |
sól |
pH zmierzone pH-metrem |
Równanie kationu jako kwasu lub anionu jako zasady |
pH obliczane ze wzorów |
1. |
|
7,77 |
KCl → K+ + Cl- |
pH = 7
|
2. |
|
9,3 |
|
pKa2 = 7,2 , pKa3 = 12,3 pH = (7,2 + 12,3) / 2 pH = 9,75 |
3. |
Na2SO4
|
7,3 |
Na2SO4 → 2Na+ + SO42- |
pH = 7
|
4. |
|
8,6 |
|
pKa1 = 6,4 , pKa2 = 10,3 pH = 8,35 |
5. |
|
8,6 |
|
pKa = 4,75 pH = 7 + 0,5*4,75 + 0,5log0,1 pH = 8,87 |
6. |
|
6,5 |
|
pKa = 9,2 pH = 0,5 * 9,2 - 0,5log0,1 pH = 5,1 |
7. |
|
10,6 |
|
pKa2 = 7,2 pH = 7 + 0,5*7,2 + 0,5 log0,1 pH = 10,1 |
2.Wyznaczanie stałej kwasowej 0,2 M r-ru ZnCl2:
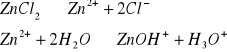
C- ZnCl2- 0,2mol/dm3
pH=7,4
Korzystamy ze wzoru na pH słabego kwasu: ![]()
Następnie przekształcamy wzór tak aby wyznaczyć pKa:
pKa=2 pH+logC ZnCl2
pKa=14,8-log0,2
pKa=14,101
3. Sprawdzenie wpływu stężenia soli na pH roztworu:
a) 0,1 M i 0,01 M r-ru NH4Cl
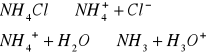
C= 0,1mol/dm3 C= 0,01mol/dm3
pH=6,0 pH=7,4
pH=0,5pKa-0,5logkwasu pH=0,5pKa-0,5logkwasu
6=0,5pKa-0,5log0,1 7,4=0,5pKa-0,5log0,01
6=0,5pKa+0,5 7,4=0,5pKa+1
6-0,5=0,5pKa 7,4-1=0,5pKa
pKa=5,5/0,5 pKa=6,4/0,5
pKa=11 pKa=12,8
b) 0,2 M i 0,02 M r-ru Na2CO3
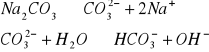
C=0,2mol/dm3 C=0,02mol/dm3
do obliczania korzystam ze wzoru podanego powyżej
pH=11,5 pH= 11,2
pH=7+0,5pKazas+0,5logCzas pKa=9,1
11,5=7+0,5pKazas+0,5log0,2
11,5=7+0,5pKazas-0,35
11,5-6,65=0,5pKazas
4,85=0,5pKazas
pKa=4,85/0,5
pKa=9,7
Wnioski:
Dane w tabelce przedstawiają nam, że na pH roztworów soli wpływają jony pochodzące ze słabego kwasu lub słabej zasady, nie wpływają natomiast jony pochodzące z mocnego kwasu i mocnej zasady.
W punkcie 2 wyznaczaliśmy stałą kwasową. Obliczony wynik różni się od wartości podanej w tabelach, która wynosi: pka=9. Nie dokładność wyników może być spowodowana błędnym działaniem ph-metru.
Z obliczeń przedstawionych w punkcie 3 widać, że stężenie roztworów ma wpływ na pH roztworu, oraz na wartość pKa .
Wyszukiwarka
Podobne podstrony:
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
cw3 odczyn roztworow wodnych soli, Rok I, fizyka-laborki, laborki-nieorgana
odczyn roztworów wodnych soli, laborki chemia nieorganiczna
Cw3 Odczyn roztworow wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia o
02 5 Odczyn roztworów wodnych pH zadania do lekcji nr 2
02 4 Folia Odczyn roztworów wodnych pH zadania do lekcji nr 1
01 3 FOLIA Zachowanie metali w roztworach wodnych elektrolitów zadania do lekcji nr 1
stezenie molowe roztworow wodnych 2
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
SPEKTROFOTOMETRYCZNE?DANIE RÓWNOWAG KWASOWO ZASADOWYCH W ROZTWORACH WODNYCH sprawozdanie równowag
1 5 1 Reakcje w roztworach wodnych
reakcje w roztworach wodnych, Studia, I rok, I rok, I semestr, Chemia I
spraw nr 6
SPRAW~10, S P R A W O Z D A N I E nr 1
reakcje chemicznew roztworach wodnych zadania
reakcje w roztworach wodnych, Nauka, CHEMIA, Szkoła, Chemia ogólna
57. Pomiar widm absorpcji i oznaczanie stężenia ryboflawiny w roztworach wodnych za pomocą spektrofo
57. Pomiar widm absorpcji i oznaczanie stężenia ryboflawiny w roztworach wodnych za pomocą spektrofo
więcej podobnych podstron