40. Wyznaczanie przewodności właściwej elektrolitów.
Celem mojego ćwiczenia jest wyznaczenie przewodności właściwej elektrolitów: 5% NaCl i 15% CuSO4.
Elektrolit to roztwór, który zawiera oprócz cząstek obojętnych również jony, których źródłem mogą być cząsteczki kwasów zasad i soli. Ulegają one dysocjacji w rozpuszczalniku o dużej przenikalności dielektrycznej np.: woda.
Dysocjacja elektrolityczna, to rozpad drobin na jony dodatnie-są to kationy oraz na jony ujemne- aniony. Dodatnimi jonami są metale i wodór, a ujemnymi reszta kwasowa lub grupa wodorotlenowa. Jony te mogą przewodzić prąd elektryczny. Prąd przepływający w elektrolitach różni się od prądu przepływającego w metalach, ponieważ nie jest to przepływ elektronów, lecz dużych jonów. Dlatego opór właściwy (współczynnik proporcjonalności ρ charakteryzujący rodzaj materiału. Jednostką oporu właściwego jest [Ω*m])
Współczynnik proporcjonalności σ nazywana jest przewodnością właściwą elektrolitu. Jego jednostką jest ![]()
(S- simens)
Przewodność właściwa i opór właściwy spełniają zależność
ρ=![]()
Natężenie płynącego przez elektrolit prądu elektrycznego jest wprost proporcjonalne do natężenia pola elektrycznego E oraz powierzchni przekroju S strumienia nośników prądu.
I=σ∙E∙S
Zdolność do przewodzenia prądu przez elektrolity jest dużo mniejsza niż w przypadku przewodnictwa elektronowego w metalach.
σ-przewodność właściwa zależy od rodzaju rozpuszczonej substancji, jej stężenia, temperatury oraz rodzaju rozpuszczalnika. Zależność σ od temperatury przedstawia wzór
σ =σ0+γ(t-18)
σ i σ0-przewodności właściwe elektrolitu odpowiednio w temperaturze t i t0=18˚C
γ- współczynnik temperaturowy przewodności właściwej.
Wiemy, że E pola elektrycznego pomiędzy elektrodami spełnia zależność:
E=![]()
(U- napięcie na elektrodach , l-odległość elektrod).
Podstawiając tą zależność do wzoru I=σ∙E∙S
Otrzymujemy:
I=![]()
Uwzględniając, że I=![]()
, gdzie R oznacza opór elektryczny przewodnika otrzymamy:
R=![]()
,gdzie
![]()
- dla danego układu elektrod w naczyniu elektrolitycznym jest stały i nazywany jest pojemnością oporową naczynia C:
C=![]()
Jednostką C jest m-1.
Podstawiając ten wzór do R=![]()
dostaniemy:
σ =![]()
Ten wzór możemy wykorzystać do wyznaczenia przewodności właściwej, gdy mierzymy opór R elektrolitu w naczyniu o znanej pojemności oporowej C.
Aby obliczyć pojemność oporową naczynia wykorzystujemy elektrolit o znanym przewodnictwie właściwym.
Opór elektrolitu R możemy wyznaczyć za pomącą mostka Wheatstone'a.Układ ten składa się z 4 oporów. Elektrolit znajduje się w naczyniu NE, Ra i Rb- są to opory pomocnicze o stałej wartości, RD opór regulowany- opornica dekadowa, służąca do zrównoważenia mostka.
Pomiar oporu R polega na dobraniu takiego RD, aby prąd płynący przez galwanometr G miał wartość minimalną. Wtedy potencjały punktów O i S są takie same i mostek jest zrównoważony.
W warunkach zrównoważenia mostka opór Elektrolitu jest taki sam jak opór opornicy dekadowej.
Wyznaczając opór R1 elektrolitu o znanej przewodności właściwej σ1, zmierzony w temperaturze t1, można na podstawie wzoru σ =![]()
obliczyć pojemność oporową naczynia:
C=R1∙σ1
Pojemność oporową naczynia obliczyć możemy również ze wzoru C=R1∙[σ01+γ1(t1-18)].
Gdy wyznaczymy C to do tego samego naczynia elektrolitycznego wlewamy taką samą ilość roztworu o nieznanym σ2 i mierzymy jego opór R2.
Wartość σ2 obliczamy ze wzoru:
σ2 =![]()
Wartość przewodnictwa właściwego σ02 w temperaturze pokojowej t=18˚C możemy policzyć ze wzoru:
σ02=σ2-γ2(t2-18)
t2- temperatura, w której mierzono σ2,
γ2- współczynnik temperaturowy przewodności właściwej elektrolitu.
WYKONANIE POMIARÓW I OBLICZEŃ:
Wyznaczanie pojemności oporowej naczynia elektrolitycznego C dla 5% NaCl.
Do naczynia wlewam 5% roztwór NaCl oraz łączę obwód według schematu (mostek Wheaststone'a).
Mierzę temperaturę początkową elektrolitu- tp.
Ustawiam na opornicy dekadowej wartość 10Ω i włączam zasilacz do sieci.
Wyszukuję taką wartość oporu RD na opornicy dekadowej, przy której natężenie prądu w gałęzi SO jest najmniejsza.
Zmieniam wartość oporu na opornicy w zakresie ± kilku omów licząc od oporu, przy którym natężenie prądu jest minimalne i odczytuję kolejne wskazania miliamperomierza; (wszystkie pomiary zapisuję w tabelach I).
Po wyłączeniu zasilacza mierzę temperaturę końcową elektrolitu tk i obliczam wartość średnią.
Sporządzam wykres I=f(R)
Ze wzoru C=R1[σ01+γ1(t1-18)] obliczam pojemność oporową naczynia elektrolitycznego C.
Tabele I
opór RD [Ω] |
10 |
9 |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
I [mA] |
62 |
57 |
50 |
45 |
38 |
33 |
29 |
34 |
50 |
85 |
Opór roztworu |
Temperatura roztworu [˚C] |
Pojemność oporowa |
||
R1 [Ω] |
tp |
tk |
t1 |
C [m-1] |
4 |
21 |
22,6 |
21,8 |
29,08 |
t1=![]()
![]()
C=R1[σ01+γ1(t1-18)] γ1=0,15![]()
C=4[6,7+0,15(21,8-18)] ![]()
C=4(6,7+0,57)
C=4∙7,27
C=29,08m-1
![]()
Wyznaczam przewodność właściwą elektrolitu σ02.
Do naczynia wlewam taką samą objętość 15% CuSO4 co 5% NaCl.
Wyznaczam opór R2 badanego elektrolitu postępując tak samo jak w punktach 1÷7 w punkcie I.
Pomiary zapisuję w tabelach II.
Obliczam σ2 i σ02, przewodność właściwą badanego elektrolitu w temperaturze odpowiednio t1 i 18˚C.
Sporządzam wykres I=f(R).
Tabele II.
Opór RD [Ω] |
17 |
16 |
15 |
13 |
12 |
11 |
10 |
9 |
8 |
7 |
6 |
I [mA] |
25 |
22,5 |
20,5 |
16 |
13 |
12 |
13,05 |
14,5 |
19,5 |
26,5 |
35 |
Opór roztworu |
Temperatura roztworu [˚C] |
Przewodność właściwa |
|||
R2 [Ω] |
tp |
tk |
t2 |
W temp.t2,σ2 |
W 18˚C,σ02 |
11 |
21 |
23 |
22 |
2,64 |
2,24 |
t2=![]()
γ2=0,10![]()
σ2=![]()
![]()
σ02=σ2-γ2(t2-18)
σ02=2,64-0,1(22-18)=2,64-0,4
σ02=2,24![]()
![]()
RACHUNEK BŁĘDÓW
Do obliczeń przyjmujemy:
ΔR1=ΔR2=0,5Ω
Δt1=Δt2=0,5˚C
dla 5% NaCl
![]()
ΔC=![]()
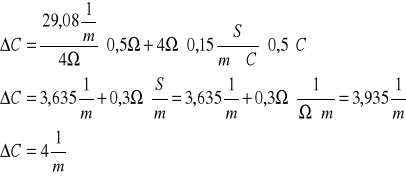
C±ΔC=(30±4) ![]()
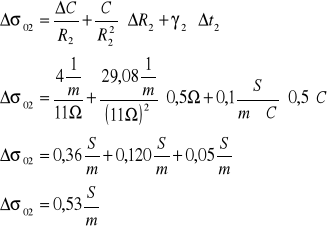
σ02±Δσ02=(2,24±0,53) ![]()
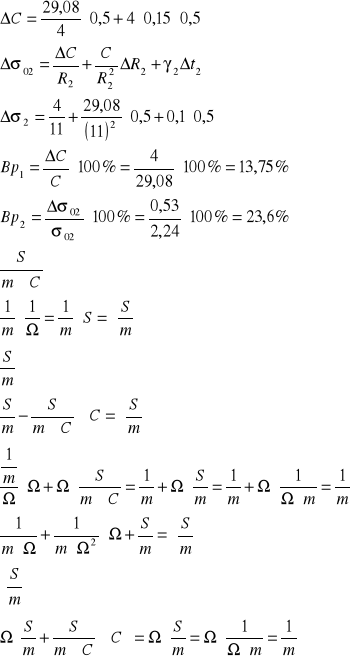
OBLICZAM BŁĘDY WZGLĘDNE PROCENTOWE:
![]()
![]()
WNIOSEK:
Zmiany oporu na opornicy dekadowej powodują zmiany natężenia prądu na galwanometrze. Dla pewnych wartości RD natężenie osiąga wartość minimalną. Przepływ prądu przez elektrolity powoduje wzrost temperatury elektrolitu. Natężenie prądu w czasie zmian oporu maleje do pewnego momentu, osiągając wartość minimalną, po czym znów rośnie.
Wyszukiwarka
Podobne podstrony:
Wyznaczanie przewodnoėci wlasciwej elektrolitow opis
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Wyznaczanie przewodnictwa granicznego elektrolitów, STUDIA
Wyznaczanie ładunku właściwego, Wyznaczanie ładunku właściwego e do m metodą magnetronową 7, Doświad
052 Wyznaczanie ładunku właściwego elektronu sprawozdanie
Ćwiczenie$ Wyznaczanie ładunku właściwego elektronu
Wyznaczanie ładunku właściwego elektronów, studia, studia, sprawozdania, Ćw 24, ćw24 zaliczone
WYZNACZANIE PRZEWODNICTWA, sprawozdanie wyznaczanie przewodnictwa granicznego elektrolitów , POLITEC
Wyznaczanie ładunku właściwego elektronu metodą magnetronową, LAB52, LABORATORIUM FIZYCZNE
Ćwiczenie 24 Wyznaczanie ładunku właściwego elektronu
Wyznaczanie oporu elektrycznego metodą mostka Wheatstone’a 5, AGATA ŻABICKA
ćw$ Wyznaczanie ładunku właściwego em elektronu
pomiar oporu elektrycznego i wyznaczanie oporu wlasciewgo metali, Inżynieria Środowiska PK, Semestr
18, Wyznaczanie ciepła właściwego cieczy w stałym ciśnieniu metodą elektryczną, Artur Grudziński
Pomiar oporu elektrycznego i wyznaczanie oporu właściwego metali, Wydział Mechaniczny
WYZNACZANIE OPORU WŁAŚCIWEGO PRZEWODNIKA, FIZYKA(1)
Wyznaczanie ładunku właściwego em elektronów, Prz inf 2013, I Semestr Informatyka, Fizyka, SPRAWOZDA
więcej podobnych podstron