14631 skan0173
340 H. BUCHOWSKI
wiście zmierzone bezpośrednio ciepło mieszania, przedstawione linią ciągłą na rys. 12, różni się ogromnie od hE obliczonego przy założeniu, że mamy do czynienia z mieszaniną zasocjowaną doskonałą. Oszacowanie wielkości udziałów oddziaływań innych niż wiązanie wodorowe w cieple mieszania acetonu z HC7F15 przedstawia górna krzywa przerywana otrzymana jako różnica dwóch poprzednich krzywych. Widzimy na tym przykładzie jak nieuzasadnione jest traktowanie wszystkich roztworów jako roztworów zasocjowanych doskonałych. W układzie aceton-HC7F15 udział w cieple mieszania oddziaływań innych niż wiązanie wodorowe jest tego samego rzędu wielkości co udział związany z tworzeniem wiązania wodorowego.
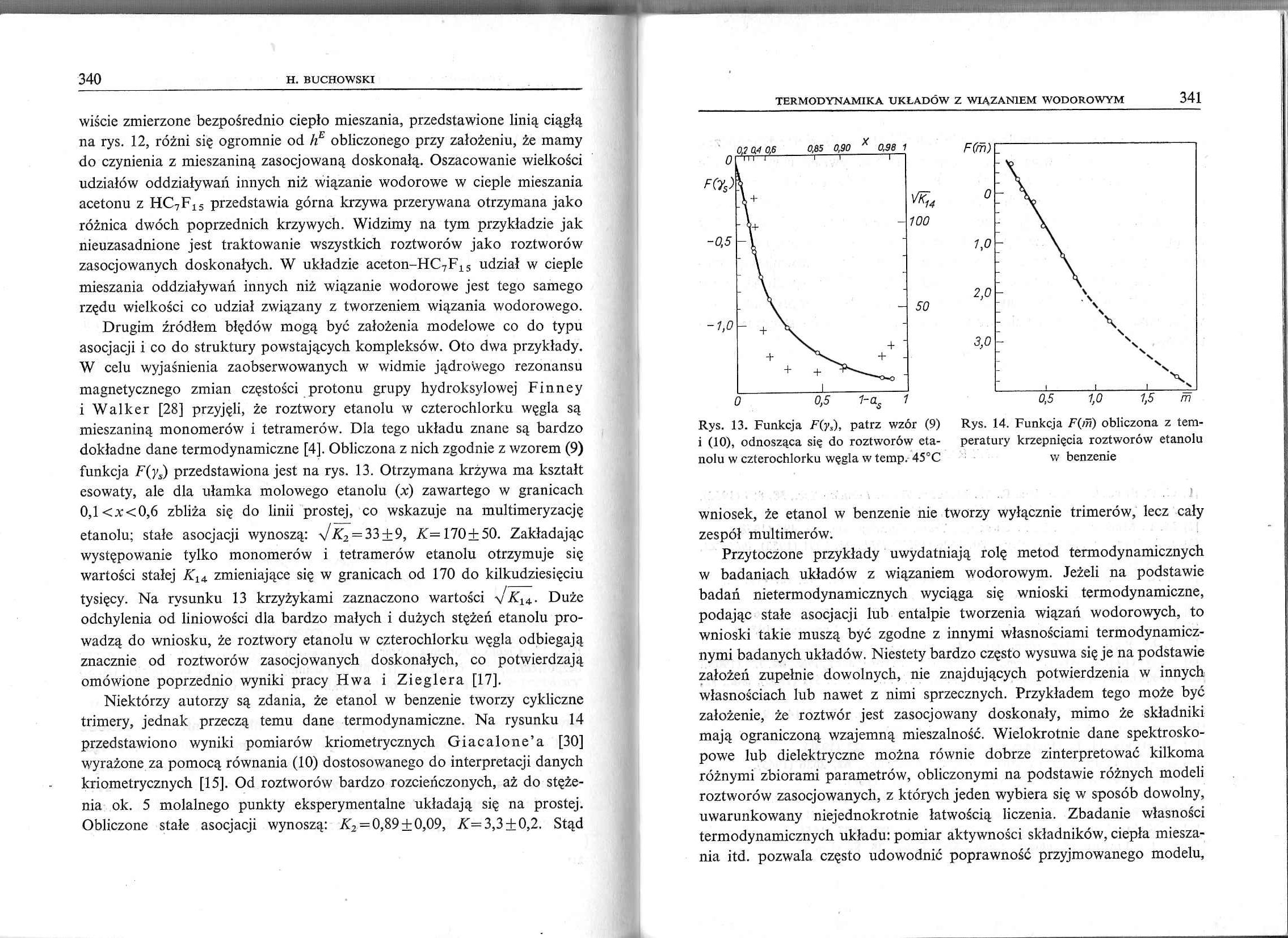
Drugim źródłem błędów mogą być założenia modelowe co do typu asocjacji i co do struktury powstających kompleksów. Oto dwa przykłady. W celu wyjaśnienia zaobserwowanych w widmie jądrowego rezonansu magnetycznego zmian częstości protonu grupy hydroksylowej Finney i Walker [28] przyjęli, że roztwory etanolu w czterochlorku węgla są mieszaniną monomerów i tetramerów. Dla tego układu znane są bardzo dokładne dane termodynamiczne [4]. Obliczona z nich zgodnie z wzorem (9) funkcja F(ys) przedstawiona jest na rys. 13. Otrzymana krzywa ma kształt esowaty, ale dla ułamka molowego etanolu (x) zawartego w granicach 0,l<x<0,6 zbliża się do linii prostej, co wskazuje na multimeryzację etanolu; stałe asocjacji wynoszą: \J K2 = 33 ±9, A=170±50. Zakładając występowanie tylko monomerów i tetramerów etanolu otrzymuje się wartości stałej A'14 zmieniające się w granicach od 170 do kilkudziesięciu tysięcy. Na rysunku 13 krzyżykami zaznaczono wartości \/a14. Duże odchylenia od liniowości dla bardzo małych i dużych stężeń etanolu prowadzą do wniosku, że roztwory etanolu w czterochlorku węgla odbiegają znacznie od roztworów zasocjowanych doskonałych, co potwierdzają omówione poprzednio wyniki pracy Hwa i Zieglera [17].
Niektórzy autorzy są zdania, że etanol w benzenie tworzy cykliczne trimery, jednak przeczą temu dane termodynamiczne. Na rysunku 14 przedstawiono wyniki pomiarów kriometrycznych Giacalone’a [30] wyrażone za pomocą równania (10) dostosowanego do interpretacji danych kriometrycznych [15]. Od roztworów bardzo rozcieńczonych, aż do stężenia ok. 5 molalnego punkty eksperymentalne układają się na prostej. Obliczone stałe asocjacji wynoszą: A2 = 0,89 ±0,09, AT=3,3±0,2. Stąd

i (10), odnosząca się do roztworów eta- peratury krzepnięcia roztworów etanolu nolu w czterochlorku węgla w temp. 45°C w benzenie
. 1
wniosek, że etanol w benzenie nie tworzy wyłącznie trimerów, lecz cały zespół multimerów.
Przytoczone przykłady uwydatniają rolę metod termodynamicznych w badaniach układów z wiązaniem wodorowym. Jeżeli na podstawie badań nietermodynamicznych wyciąga się wnioski termodynamiczne, podając stałe asocjacji lub entalpie tworzenia wiązań wodorowych, to wnioski takie muszą być zgodne z innymi własnościami termodynamicznymi badanych układów. Niestety bardzo często wysuwa się je na podstawie założeń zupełnie dowolnych, nie znajdujących potwierdzenia w innych własnościach lub nawet z nimi sprzecznych. Przykładem tego może być założenie, że roztwór jest zasocjowany doskonały, mimo że składniki mają ograniczoną wzajemną mieszalność. Wielokrotnie dane spektroskopowe lub dielektryczne można równie dobrze zinterpretować kilkoma różnymi zbiorami parametrów, obliczonymi na podstawie różnych modeli roztworów zasocjowanych, z których jeden wybiera się w sposób dowolny, uwarunkowany niejednokrotnie łatwością liczenia. Zbadanie własności termodynamicznych układu: pomiar aktywności składników, ciepła mieszania itd. pozwala często udowodnić poprawność przyjmowanego modelu,
Wyszukiwarka
Podobne podstrony:
42779 skan0169 332 H. BUCHOWSKI Rysunek 8 przedstawia wykres zależności (10) dla trzech układów: ż-b
13644 skan0170 334 H. BUCHOWSKI 6. Stosowalność modelu roztworu zasocjowanego doskonałego Model rozt
skan0171 336 H. BUCHOWSKI kolwiek energia oddziaływań międzycząsteczkowych fenol-toluen jest większa
skan0172 338 H. BUCHOWSKI Rys. 11. Wpływ rozpuszczalnika na entalpię tworzenia wiązań wodorowych lin
Creat0016 78 I Moc czynną odbiornika można zmierzyć bezpośrednio przy wykorzystaniu watomierza. Znaj
Zadanie 9.3. (0-1) W opisanym doświadczeniu zmierzono bezpośrednio czas. po jakim kula dotrze od naj
Postępy Nauki i Techniki nr 8, 2011 Na rys. 8 przedstawiono zmierzone powierzchnie. Wyznaczono nastę
skanuj0241 (4) łożysk przedstawiono na rys. 10.23. Niedopuszczalne jest zdejmowanie łożysk przez bez
skanuj0241 (4) łożysk przedstawiono na rys. 10.23. Niedopuszczalne jest zdejmowanie łożysk przez bez
Filozofia Kanta w swych bezpośrednich interpretacjach 51 myślenia. Ponadto natrafiamy na jeszcze jed
skan0144 (2) Roztwory i równowagi fazowe 147 Zależność przedstawiona na rys. 4.9,
więcej podobnych podstron