26029 IMGW91 (3)

3 nymi. Część molekuł acetonitrylu wiąże się silnymi wiązaniami międżymolcfajk | nymi z kationami rozpuszczonej soli. Pojawia się więc w widmie podczerwieni no*. || pasmo drgania =N—kation o częstości zależnej od kationu, 200-300 cnr> 1 Częstości wewnątrzmolekularnych drgań C=N i C—C ulegają dużym zmianom. I W roztworze mamy dwa rodzaje molekuł acetonitrylu - molekuły związani z kationami i molekuły nie zaburzone w głębi roztworu. W widmie roztworem pojawiają się nowe pasma związanego acetonitrylu obok pierwotnych pasm acetonitrylu nie zaburzonego. W miarę wzrostu stężenia soli rośnie intensywność nowych pasm kosztem intensywności pasm pierwotnych. Takie przejawy w widmach wskazują wyraźnie, że utworzony kompleks żyje dostatecznie długo, aby w promie, niowaniu podczerwonym wydać się tworem trwałym. W dodatku, ponieważ pasma pierwotne acetonitrylu pozostają na swoim miejscu, można wnioskować, że molekuły acetonitrylu nie związane w kompleksie nie są zaburzone.
W jądrowym rezonansie magnetycznym te same kompleksy nie dają oddzielnych jl sygnałów. Dla tej metody obserwacji kompleksy acetonitrylu z kationami ąi nietrwałe. Molekuły acetonitrylu wciąż odrywają się od kationów i na ich miejsce | wchodzą inne molekuły acetonitrylu z częstością większą od częstości promieniowa. nia radiowego oddziałującego w tym przypadku z molekułami. Zróżnicowanie | molekuł zaburzonych i nie zaburzonych zostaje uśrednione. W widmie otrzymujemy I jeden wspólny uśredniony sygnał, który w miarę wzrostu stężenia soli przesuwa się j; w sposób ciągły ze swego pierwotnego położenia w kierunku położenia, które by | osiągnął, gdyby w układzie był tylko acetonitryl związany z kationami.
W większości przypadków oddziaływania międzymolekułarne przejawiają się; w widmach oscylacyjnych w postaci zmian ciągłych. Oprócz bowiem krótkiego czasu i życia i statystycznego uśredniania stanów, przyczyną ciągłości zmian widmowych i często bywa efekt dalekiego zasięgu. Polega on na tym, że centrum zaburzające f zaburza nie tylko molekuły bezpośrednio z nim związane, ale również molekuły ' oddalone od tego centrum. Oczywiście w miarę wzrostu odległości zaburzenia sąg coraz słabsze i zmiany widmowe coraz mniejsze.
Rozpuszczanie substancji stałej lub ciekłej polega na rozrywaniu międzymoleb; lamej struktury substancji i tworzeniu na jej miejsce nowej struktury w postaci= kompleksów molekuł rozpuszczalnika i substancji rozpuszczanej. Wszelkie zmiany struktury międzymolckulamej powodują zmiany częstości, molowej intensywnoia kształtu konturu, stopnia depolaryzacji itp. Zdarza się czasem, że nowo utwoizon struktura jest z punktu widzenia oddziaływań równoważna strukturze pierwotną i wtedy w widmie nie obserwujemy zmian lub zmiany są trudno zauważalne. Mato miejsce np. w mieszaninach węglowodorów alifatycznych. Ale nie oznacza to wcak, że rozpuszczalnik nie oddziałuje z substancją rozpuszczaną i dlatego pojęce: „obojętnego" rozpuszczalnika jest nieporozumieniem.
Szczególnym i bardzo charakterystycznym rodzajem oddziaływań międzynwk-kula mych jest wiązanie wodorowe. Powstaje ono między molekułami, z których joli na jest donorem elektronów, a druga akceptorem elektronów. Atom wodoru zwią zany wiązaniem chemicznym z elektroujemnym atomem lub grupą atomów X wiąś się z elektroujemnym atomem lub grupą atomów Y, tworząc mostek wodoro*]
X— H Y
W klasycznym ujęciu atomami X i Y są atomy fluoru, tlenu lub azotu. Mogą to być 3.6 także elektroujemne grupy funkcyjne, np. C130— w chloroformie (jako akceptor elektronów), pierścień aromatyczny (jako donor elektronów) itp. Cechą charaktery' styczną grupy Y jest dysponowanie przynajmniej jedną wolną parą elektronów, do których przyłącza się proton grupy X—H. Na rysunku 3.43 pokazano przykłady międzymolekularnych wiązań wodorowych. Energia tych wiązań wynosi
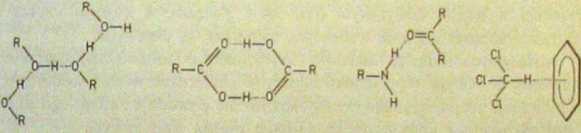
Rys. 3.43. Przykłady międzymolekularnych wiązań wodorowych
8-40 kJ-moI-1, są więc one dostatecznie słabe, aby ich nie uznać za wiązania chemiczne i aby w temperaturze pokojowej następowało ich ciągłe rozrywanie i ponowne odtwarzanie. W rezultacie ustala się stan równowagi dynamicznej między monomerami, dimerami, trimerami i wyższymi multimerami. Czas życia multimerów jest wystarczająco długi, aby były one zauważalne jako indywidua w spektroskopii oscylacyjnej, ale mnogość kombinacji strukturalnych nadaje zmianom parametrów pasm charakter skomplikowany i urozmaicony.
Pewne zmiany parametrów pasm oscylacyjnych uważane są za kryterium istnienia wiązań wodorowych. Są to:
a) znaczne obniżenie częstości rozciągającego drgania X—H, rzędu paruset cm'1,
b) wzrost molowej intensywności integralnej pasma X—H w podczerwieni o rząd lub dwa rzędy wielkości,
c) wzrost szerokości połówkowej pasma X—H od kilkunastu cm'1 (monomer) do kilkuset cm"1 dla związanej wiązaniem wodorowym grupy X—H.
Wystarczy, by wystąpiła w widmie jedna z powyższych zmian, aby wnioskować o istnieniu wiązania wodorowego. Zmiany parametrów pasm oscylacyjnych obserwuje się w czasie podwyższania temperatury lub rozcieńczania rozpuszczalnikiem niepolarnym (n-heksan, cykloheksan, n-heptan, CC14), takie zabiegi bowiem powodują rozrywanie wiązań wodorowych i przesuwanie równowagi w kierunku monomerów.
Zmiany parametrów pasma drgania X—H są bardzo duże, niejednokrotnie większe niż w przypadku oddziaływań wewnątrzmolekularnycb. Pasma drgań innych grup atomów w molekułach partnerów zmieniają się nieznacznie. Na przykład w acetonie związanym wiązaniem wodorowym z wodą częstość drgania rozciągającego 0=0 maleje o 5 cm " \ molowa intensywność integralna lego pasma rośnie nieco w obu widmach oscylacyjnych IR oraz R. Zmienia się także częstość rozciągającego drgania O—C—*C wzrastając o 3 cm'ł.
Wiązanie wodorowe może powstać również wewnątrz molekuły, jeśli grupy X—H i Y znajdą się w dogodnej konfiguracji względem siebie. Taki układ występuje
Wyszukiwarka
Podobne podstrony:
zadan i —^ vw«. mIŁ >htądoiw<im«qe____ i 1 Część A tobi błoniczej wiąże się
stul1 73 PIOTR DANEK przejmują część chwały, jaka wiąże się z potęgą sportową klubu w przeszło ści i
HPIM5352 1 uunj .in/poprawną odpowiedź W * I. Który z wymienionych procesów wiąże się z hydrolizą wi
Dynamiczny rozwój gospodarczy wiąże się z ekspansją wymiany międzynarodowej, która powoduje wzrost
img063 (12) inne amidy kwasowe ma charakter polarny, co jest przyczyną tworzenia się podwójnego wiąz
SKMBT?5007122709250�05 CZĘŚĆ I! • DZIAŁANIE Arystotelesa koncepcja duszy wiąże się z kontekstem kult
SKMBT?5007122709250�05 CZĘSC II • DZIAŁANIE Arystotelesa koncepcja duszy wiąże się z kontekstem kult
SKMBT?5007122709470�79 CZĘSC III • WYTWARZANIE Przeciw technice Rzadkość środków i dóbr wiąże się z
s3(4) część II ZASTOSOWANIA Jak praca nas kształtuj? Nawet gdy praca nic wiąże się z naruszaniem pod
ZT050 (2) 98 CZĘŚĆ I. ZARZĄDZANIE SYSTEMEM TURYSTYKI nych dystrybutorów wiąże się z pewnymi problema
DSC02041 Utlenowana hemoglobina nosi nazwę Nieznaczna część jedynie, bo około 10% przenoszonego CO,,
więcej podobnych podstron