IMGX04 (3)
5 odróżniać elektron od pozostałych elektronów. Wynika z tego, że na każdym I orbitalu a mogą się znaleźć najwyżej dwa elektrony. Natomiast na każdym orbitali I n, S.... czyli na orbitalach X # 0 może się znaleźć do czterech elektronów, ponieważ I termy te są dwukrotnie zdegenerowane (patrz rys. 5.7 i 5.9).
W wypełnionych elektronami orbitalach wektory ż i wektory s są parami [I antyrównolegle, co daje wypadkowy wektor A = 0 i 5 = 0. Term molekularny jest [I więc termem '£* w liniowej molekule lub termem lAt w wieloatomowej molekule j| nieliniowej. Inne termy występują wtedy, gdy orbitale nie są wypełnione. Jeżeli w molekule jest jeden elektron a, to A = 0, 5 = i i mamy term . Jeden elektron II n o wartościach A = 1 i 5 = ł daje term 2J7. Dwa nierównoważne elektrony a (np. [I 2pa i <rls na rys. 5.8), których A, = 0 i X2 = 0, czyli A — 0, mogą mieć spiny [I równoległe, 5 = 1, lub antyrównolegle, 5 = 0, dają więc termy 3L* lub lZ*. Dwa 1 równoważne elektrony a (np. lstr i ols na rys. 5.8) wypełniają orbital i dają term [I lE*. Elektrony n i ó o liczbach Xt = 1 i A2 = 2 dają A = 3, przy zgodnej orientacji j wektorów X, lub A = 1, przy przeciwnej orientacji wektorów X, przy czym ich spiny [I mogą być równoległe, 5=1, lub antyrównolegle, 5 = 0. Odpowiadające temu termy I to 3<P, 1(p, 3n i ln. Każdy z tych termów ma inną energię.
Jeżeli dwa elektrony znajdą się na orbitalu dwukrotnie zdegenerowanym, to fj w kolejności energetycznej ich termów obowiązuje reguła Hunda, w myśl której [I najniższej energii odpowiada term o najwyższej multipletowości. Tak więc w przypa- i dku dwóch równoważnych elektronów n lub 5 występują termy i3Z*,z których | niższą energię ma term trypletowy 3Z*. Taką sytuację mamy np. w molekule tlenu i o konfiguracji elektronowej (<rg ls)2{oM ls)2 (at2s)2(au2s)2(al2p)3(nu2p)*(nl2p)\ | gdzie ostatnie dwa elektrony n mają spiny niesparowane na najniższym poziomie | energetycznym, tzn. w stanie podstawowym, dlatego też molekuła tlenu jest I paramagnetyczna (por. punkt 8.1).
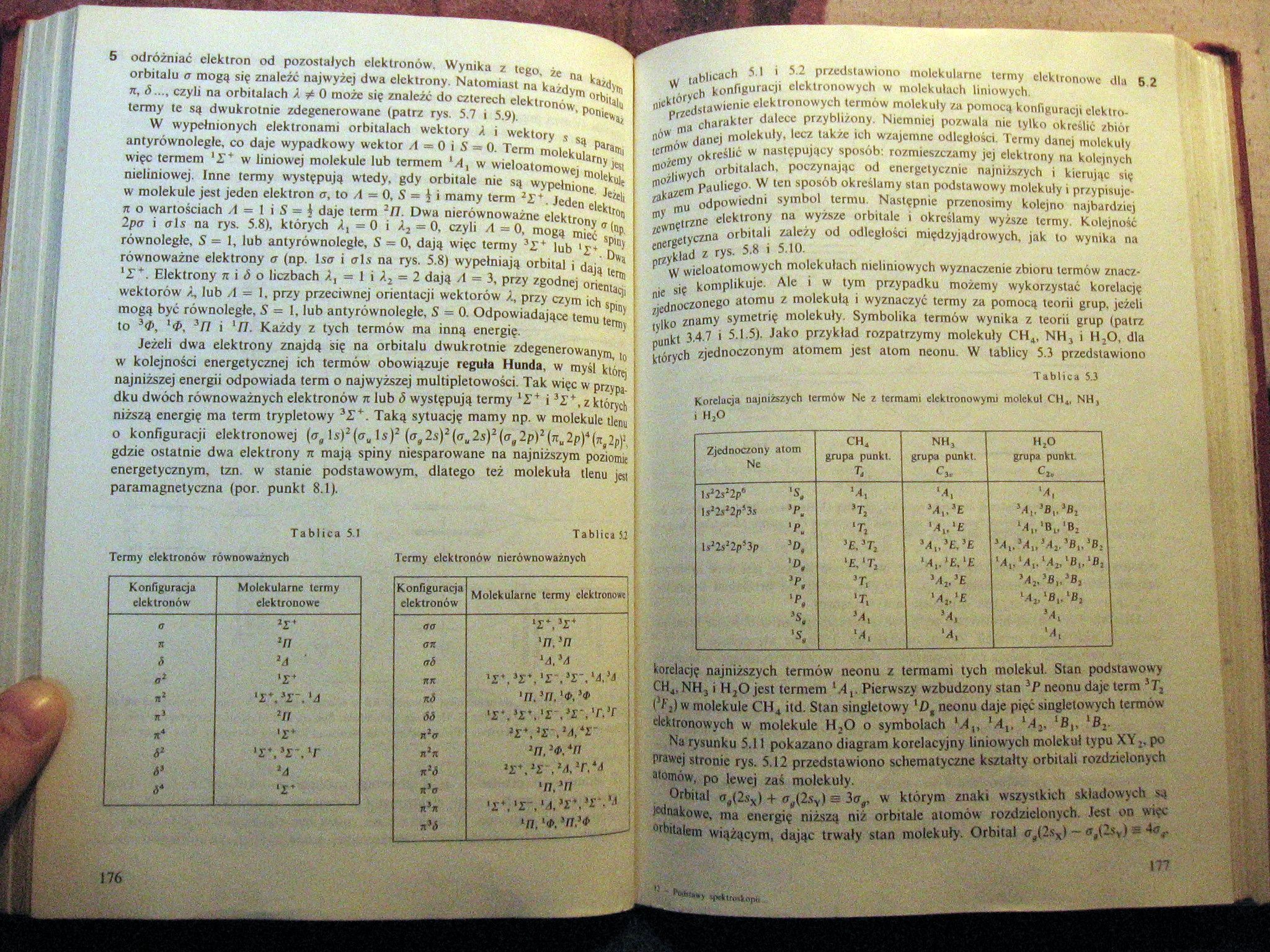
Tablica 5.1
Termy elektronów równoważnych
|
Konfiguracja ejektronów |
Molekularne termy elektronowe |
|
a | |
|
n |
*n |
|
5 |
2 A ' | |
|
m |
M, |
|
‘z*. sz~. U | |
|
*» |
li |
|
a4 |
•r* |
|
V |
lz\s£’,*r |
|
6* |
V. |
|
5* |
' Spl |
Tablica 52 i
Termy elektronów nierównoważnych
|
Konfiguracja elektronów |
Molekularne termy elektronowi |
|
aa |
iZ*,iZ* |
|
on |
*/7. s/7 |
|
ci |
lA,lA |
|
nn |
'Z*,Z'.1*.** 1 |
|
ni |
*/J. >n, *<*►, |
|
53 |
xz\*z*>lz~,*z‘j |
|
*z+,*z-,1aSz- | |
|
*** |
WM$m. |
|
tt*d |
**Vf\‘*4 lr,Ąi |
|
it’0 |
ln,%n |
|
ź** • |
iZ*,lZ~,lA,iZ*,lZ‘*A |
|
n96 |
ln, *♦. |
W tablicach 5.1 i 5.2 przedstawiono molekularne termy elektronowe dla 6.2 niektórych konfiguracji elektronowych w molekułach liniowych.
Przedstawienie elektronowych termów molekuły za pomocą konfiguracji elektro-nów ma charakter dalece przybliżony. Niemniej pozwala nie tylko określić zbiór termów danej molekuły, lecz także ich wzajemne odległości. Termy danej molekuły możemy określić w następujący sposób: rozmieszczamy jej elektrony na kolejnych możliwych orbitalach, poczynając od energetycznie najniższych i kierując się zakazem Paulicgo. W ten sposób określamy stan podstawowy molekuły i przypisujemy mu odpowiedni symbol termu. Następnie przenosimy kolejno najbardziej zewnętrzne elektrony na wyższe orbitale i określamy wyższe termy. Kolejność energetyczna orbitali zależy od odległości międzyjądrowych, jak to wynika na przykład z rys. 5.8 i 5.10.
W wieloatomowych molekułach nieliniowych wyznaczenie zbioru termów znacznie się komplikuje. Ale i w tym przypadku możemy wykorzystać korelację zjednoczonego atomu z molekułą i wyznaczyć termy za pomocą teorii grup. jeżeli tylko znamy symetrię molekuły. Symbolika termów wynika z teorii grup (patrz punkt 3.4.7 i 5.1.5). Jako przykład rozpatrzymy molekuły CH4, NH3 i H20, dla których zjednoczonym atomem jest atom neonu. W tablicy 5.3 przedstawiono
Tablica U
Korelacja najniższych termów Ne z termami elektronowymi molekuł.CH*. NHj i HjO
|
Zjednoczony atom Ne |
ch4 grupa punkt. V |
NHj grupa punkt. Cu |
HjO grupa punkt Cu |
|
1®lip! >s. |
ł4, |
'Ax | |
|
ls*2»*2^3s iP, |
M || |
M„*E |
3At ,}Bv3B2 |
|
lP„ |
‘T? |
lipi |
l4„ ‘By 'Bj |
|
li12sJ2p53p 3Dt |
3E, 3Tj | ||
|
%: |
'£, ‘Tj |
lA„lE, '£ |
Mz, pili |
|
3P, |
3T, |
M*.3£ |
.Mi |
|
mś |
s | ||
|
% |
% |
3 At | |
|
g |
M, |
*4,. |
'Ay | |
korelację najniższych termów neonu z termami tycb molekuł. Stan podstawowy Ctt4, NH3 i HjO jest termem M,. Pierwszy wzbudzony stan 3P neonu daje term sTł rajL) w molekule CH4 itd. Stan singletowy neonu daje pięć singletowych termów elektronowych w molekule H20 o symbolach Młt lAv lĄ2, lBt, iBx.
Na rysunku 5.1 i pokaźno diagram korelacyjny liniowych molekuł typu XY po prawej stronie rys. 5,12 przedstawiono schematyczne kształty orbitali roztbdelpnych atomów, po lewej zaś molekuły.
Orbita! otf(2%) + afl(2%) s 3ot, w którym znaki wszystkich składowych są jednakowe, ma energię niższą niż orbitale atomów rozdzielonych. Jest on więc orbitalem wiążącymi dając trwały stan molekuły. Orbita! <r,(2sx) ~ <r,(2sv) « 4$^.
m
W - spiklroikopfi ..
Wyszukiwarka
Podobne podstrony:
Ziemia obraca się z zachodu na wschód. Wynika z tego że na wschodzie jest zawsze później niż na zach
FunkcjonowanieRynku R1144 345 Bariery strukturalne wynikają również ze struktury podmiotowej rynku.
Zadanie 9.2. (0-1) Podaj jedną cechę budowy zewnętrznej głowonogów, która odróżnia je od pozostałych
ScannedImage 5 MYŚLEĆ JAK ANTROPOLOG rakter probabilistyczny i mamy tu do czynienia z wyjątkiem od r
gdzie: y - przewodnictwo właściwe elektrolitu. USgf
IMG091 91 b) - 10 Ic + 100 » O A ■ 100 - 400 ■ - 300 brak pierwiastków rzeczywistych równania. Wynik
PROJEKT POWOŁANIA REPOZYTORIUM 465 zytorium. Wynika z tego, że zarządzanie nim należy powierzyć osob
P1170385 70 UTOPIA IRZYKOWSKIEGO biciem obecnej rzeczywistości, w takim razie nie wynika z tego, że
IMGP14 (3) średników. Wynika z tego, że klienci są niedoinformowani i nie wiedzą, te &nb
IMG?74 i ,pełnienia przestępstwa zarzucanego Markowi Falcncie wynika z tego, że nie możemy udziału w
page0236 236 zbierał". Wynika z tego, że robotnik dobry musi mieć zawsze prawo do włożenia swoj
więcej podobnych podstron