3 (367)
OTRZYMYWANIE HALOGENKÓW ALKILOWYCH HALOGENKI 1. Reakcja addycji elektrofilowej HX (X = Cl, Br, I) i X2 (X = Cl, Br) do alkenów.
ch3ch2ch2ch=ch2
1-pen ten
CH2=CHCH2Br + Br2 bromek allilu
-- CH3CH2CH2CHBrCH3
2-bromopentan
CCI4 98%
1,2,3-tribromopropan
2. Reakcja addycji rodnikowej bromowodoru.
ROOR
CH3CH2CH=CH2 + HBr * CH3CH2CH2-CH2Br 1-buten A 1-bromobutan
3. Reakcja podstawienia rodnikowego X2 (X = Cl, Br) w alkanach i alkenach.
NBS, hv
CCI4 *
cykloheksen 3-bromocykloheksen
4. Reakcje alkoholi z kwasami. Najefektywniejsza dla trzeciorzędowych alkoholi.
H®
R3C-OH + HX ^ » R3C-X + h2o
x ‘ Cl'Br'' CHEMIA ORGANICZNA
r^YCH2°H PCU
-► [ K + HCI + POCI3
cykloheksylometanol (chlorometylojcykloheksan
CH3CH2CH2OH Br? * Pc;”v'» CH3CH2CH2Br 1-propanol 1-bromopropan
REAKCJE
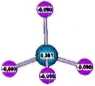
HALOGENOWĘGLOWODORÓW Cząstkowy ładunek dodatni na atomie C - reakcje podstawienia nukleofilowego
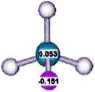
1. Reakcje z magnezem i litem -związki Grignarda i Gilmana.
2. Reakcja substytucji nukleofilowej SN2
RX + iNue
THF/HMPA
RNu + X®
O
X = F, CI, Br, I
THF * tetrahydrofuran
0=P[N|CH3)2]3 HMPA = heksametylotriamid
fosforytu CHEMIA ORGANICZNA
HCI stęż. AT *
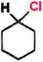
chlorek
cykloheksylu
cykloheksanol
ch3 hci stęż. ch3 HALOGENKI
CHj-i-OH-» CHj-C-CI
6h3 *emP- P°k- 6h3
alkohol chlorek
ferf-butylowy ferf-butylu
HBr stęż.
CH3CH2CH2CH2OH h s0 at» CH3CH2CH2CH2Br 1-butanol 2 4 1-bromobutan 95%
OH
CH3CH2&HCH3 2-butanol
HI stęż. AT
I
CH3CH2^HCH3 2-jod o butan
5. Reakcja alkoholi z chlorowcowymi pochodnymi siarki i fosforu (SOCI2 i PBr3). Efektywna dla alkoholi pierwszo- i drugorzędowych.
ch3ch2oh
SOCI2
pirydyna
CH3CH2CI + S02| +
3
CH3CH2OH.
PBr3 eter 0°C
3 CH3CH2Br + P(OH)3
RX ''Nu
h£5:
7
'h2ch2ch3
H 7
CH
Br©
|
Wpływ struktury substratu | ||||
|
CH3CH2Br |
W CH3 CHj-icH2Br iH3 |
i© CH3CI reaktywność . w acetonie |
% CH3CH2CI : 1 |
i© s CH3CHCI ćh3 : 0.008 |
|
bromek etylu |
bromek neopentyłu | |||
|
reaktywność 4104 |
: 1 |
CHEMIA |
ORGANICZNA | |
Wyszukiwarka
Podobne podstrony:
substytucja SnI otrzymywanie halogenków alkilowych z alkoholi (kat. kwasowa, alk. 2°
Reakcja alkilowania IV-rzędowych soli amoniowych Otrzymywanie bromku alkilopirydyniowegoW stęp
005 2 1. Halogenowanic - reakcja podstawienia odbywająca się poza grupą karbo
319 [1024x768] 328 ELEKTROCHEMIA Liczba elektronów otrzymanych na anodzie w wyniku reakcji utleniani
S0022 (2) I Solcrkływno Iwoi/imiki wigzuii wyijibl w»,m
10852 Obraz (1033) 502 Do otrzymywania alifatycznych izocyjanianów służy reakcja liaiogcnoalka-nów z
76152 skan0280 Elektrochemia 283 a ich suma daje reakcję ogniwa +H2 + AgBr = H+ + Ag + Br-. Zgodnie
Scan0008 (44) .3+ «//»/ s jonowy reakcji: liiktns elektronowy: Rilttłis jonowy: Reakcja w zapisie
Marcin Kowalski. Uniwersytet Łódzki Chemoselektywne reakcje addycji odczynnika Rupperta-Prakasha do
Chemia Organiczna. Ćwiczenia - Lista VII W jaki sposób otrzymać następujące związki, stosując reakcj
2 (2479) c)przyłączenie 0. , (q Z 2. Reakcjami addycji 1,4 są: a)cykloaddycja Diesla -Aidera ^przegr
Krzysztof Kuciński Promotor prot UAMdrhab Grzegorz Hrecz; ..Reaktywność Holi w reakcjach addycjl I s
Podsumowanie Reakcja Volmera jest reakcją przeniesienia elektronu od elektrody do hydratyzowane
więcej podobnych podstron