CCF20110121�153

Twoja matura - chemia <CH Beata Ostrowska<H
25.
Mg
II. Zmiany właściwości pierwiastków na tle układu okresowego Poziom podstawowy
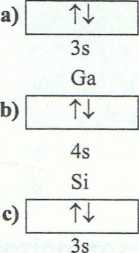
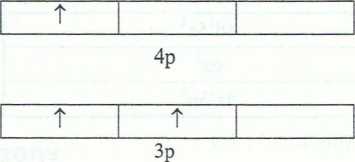
1. a) Na: KLM i K: K L M N ; oba pierwiastki mają po jednym elektronie na ostatniej powłoce, zatem leżą
w tej samej grupie - pierwszej.
b) Al: K L M i Cl: K L M ; oba pierwiastki mają po i trzy powłoki elektronowe, zatem leżą w trzecim okresie.
c) Mg: ls22s22p63s2 i Li: ls22sI; oba pierwiastki posiadają elektrony walencyjne na takim samym typie podpo-włoki elektronowej - s zatem leżą w bloku energetycznym s.
2. a) Aktywność metali w grupie 1 układu okresowego rośnie w miarą wzrostu liczby atomowej pierwiastka.
Świadczy o tym wielkość energii jonizacji. Im wyższa wartość energii jonizacji, tym trudniej przeprowadzić atom w kation, tym trudniej oderwać od niego elektron walencyjny. Pierwiastek o dużej energii jonizacji jest mniej aktywny od tego o małej wartości £jon. Na aktywność metalu wpływa oddziaływanie pomiędzy elektronami a jądrem atomowym. Im wiącej pierwiastek posiada powłok elektronowych, tym łatwiej oderwać elektron walencyjny, bo oddziaływanie elektrostatyczne pomiędzy nim a jądrem atomu jest słabsze.
b) Aktywność metali w grupie 2 układu okresowego rośnie wraz ze wzrostem liczby atomowej pierwiastka z takich samych powodów jak w grupie 1 (patrz: odpowiedź a).
c) Łatwiej w jony przeprowadzić metale jedno wartościowe niż dwuwartościowe. Odpowiednie wartości energii jonizacji dla pierwiastków jedno wartościowych są mniejsze niż dla pierwiastków dwuwartościowych. Oderwanie od atomu jednego elektronu wymaga mniejszej energii niż oderwanie dwóch elektronów.
3. Elektroujemność pierwiastków grup głównych rośnie w okresach i maleje w grupach wraz ze wzrostem liczby atomowej.
4. Tlenki pierwiastków leżących na początku okresu mają charakter zasadowy (tlenki litowców i berylowców), następnie występują tlenki amfoteryczne, a na końcu okresu tlenki kwasowe.
5.
|
Symbol |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
|
tlenek |
Na20 zasadowy |
MgO zasadowy |
AEO3 amfoteryczny |
Si02 kwasowy |
P2O5 kwasowy |
so3 kwasowy |
C1207 kwasowy |
- |
|
wodorek |
NaH zasadowy |
MgH2 zasadowy |
A1H3 zasadowy |
SiH4 lekko kwasowy, właściwie obojętny |
ph3 słabo zasadowy |
H2S kwasowy |
HC1 kwasowy |
Każdy okres w układzie okresowym pierwiastków rozpoczynają zasadowe tlenki oraz wodorki litowców i berylowców, później występują tlenki i wodorotlenki amfoteryczne bądź obojętne, zaś na końcu znajdują się związki chemiczne o charakterze kwasowym.
S ogólny wzór tlenku na najwyższym stopniu utlenienia: X2Om
Wyszukiwarka
Podobne podstrony:
CCF20110121�169 Twoja matura - chemia <CH Beata Ostrowska<CI3X. Dysocjacja jonowa. Reakcje w r
CCF20110121�187 Twoja matura - chemia <33 Beata Ostrowska<H2. b) A CHrCH2CI B ch=ch2 C CH—
CCF20110121�012 Twoja matura - Chemia Beata Ostrowska <3] II.Zmiany właściwości pierwiastków na t
CCF20110121�024 Twoja matura - Chemia <33 Beata Ostrowska <3 Pisać równana reakcji chemicznych
CCF20110121�046 Twoja matura - Chemia <33 Beata Ostrowska <3] VII.Rozpuszczalność. Rodzaje roz
CCF20110121�090 Twoja matura - Chemia <33 Beata Ostrowska <]] Dobierać współczynniki w re
CCF20110121�120 Twoja matura - Chemia <33 Beata Ostrowska <3]XVI.Wielofunkcyjne pochodne węglo
CCF20110121�124 Twoja matura - Chemia <3j Beata Ostrowska <J]Wielofunkcyjne pochodne węglowodo
CCF20110121�145 Twoja matura - Chemia <fj Beata Ostrowska <UXX.Zadania z fragmentem tekstu pop
CCF20110121�163 Twoja matura - chemia <33 Beata Ostrowska<33 przewidywane obserwacje: W miarę
CCF20110121�181 Twoja matura - chemia <33 Beata Ostrowska<339. 10. Na[Al(OH)
CCF20110121�183 Twoja matura - chemia <CD Beata Ostrowska<3] 4,5-dichloropent-2-en CH—CH=CH—
CCF20110121�185 Twoja matura - chemia “CD Beata Ostrowska<33 e) C H —C—O—CH017 35
CCF20110121�191 Twoja matura - chemia <33 Beata Ostrowska<33 d) początek tak jak w informacji
CCF20110121�193 Twoja matura - chemia <31 Beata Ostrowska<33 7. koagulacja:
CCF20110121�197 Twoja matura - chemia <33 Beata Ostrowska<33 3. a) Do przeprowadzenia doświadc
CCF20110121�014 Twoja matura - Chemia <3 Beata Ostrowska <3Zmiany właściwości pierwiastków na
CCF20110121�157 Twoja matura - chemia <H Beata Ostrowska<Cl] A: etanolan sodu CH-CH-ONa o Z
CCF20110121�002 Twoja matura - Chemia Beata Ostrowska <]] XI. Tlenki, kwasy, za
więcej podobnych podstron