Wydział
|
Kierunek
|
Grupa |
|
Imię i nazwisko
|
Nr pary |
Nr ewidencyjny |
Prowadzący |
14. Entalpia zobojętniania
Cel ćwiczenia
Zapoznanie się ze sposobem wyznaczania pojemności cieplnej kalorymetru oraz pomiaru entalpii rozpuszczania i zobojętniania.
Zasada pomiaru
Procesowi rozpuszczania krystalicznego NH4Cl lub KCl w wodzie towarzyszy pewien efekt cieplny (ΔH), którego miarą może być zmiana temperatury układu (ΔT) zachodząca w czasie tej przemiany. Znając wartość molowej entalpii rozpuszczania tych związków oraz przyjmując zamiast rzeczywistej pojemności cieplnej (C) średnią pojemność cieplną w granicach temperatur T1, T2, można z następującej zależności wyznaczyć średnią pojemność cieplną kalorymetru:
![]()
ponieważ
![]()
więc
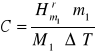
gdzie C - średnia pojemność cieplna kalorymetru, ![]()
- molowa entalpia rozpuszczania NH4Cl lub KCl (kJ ∙ mol-1), ml - liczba gramów substancji rozpuszczonej, m1 - masa molowa substancji rozpuszczonej (g), ΔT1 zmiana temperatury zachodząca w procesie rozpuszczania.
Przekształcając równanie do postaci:
![]()
można z niego obliczyć entalpię rozpuszczania dowolnej substancji (o masie molowej M2), mierząc zmianę temperatury ![]()
podczas rozpuszczania m2 gramów badanego związku w rozpuszczalniku (wodzie) o objętości takiej samej, jaka była stosowana. do wyznaczania średniej pojemności cieplnej kalorymetru (C).
Zmiana entalpii towarzysząca reakcji zobojętniania wodorotlenku sodu stężonym kwasem siarkowym (ΔHc- entalpia całkowita) jest sumą entalpii rozpuszczania kwasu siarkowego (ΔHr) i entalpii powstawania cząsteczek wody, czyli entalpii zobojętniania (ΔHz):
![]()
stąd
![]()
Ponieważ w reakcji tej tworzą się dwie cząsteczki wody, więc
![]()
Ostatecznie otrzymujemy:
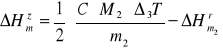
)
gdzie m2 - liczba gramów kwasu siarkowego użytego do reakcji zobojętniania, M2 - masa molowa kwasu siarkowego (g), C - średnia pojemność cieplna kalorymetru ![]()
- molowa entalpia rozpuszczania kwasu siarkowego (kJ ∙ mol-1) wyznaczona przez rozpuszczenie takiej samej ilości kwasu, jakiej użyto do reakcji zobojętniania, tj. m2.
Wykonanie ćwiczenia
1. Wyznaczenie pojemności cieplnej kalorymetru (kalibrowanie kalorymetru)
a. Odważyć w naczyńku wagowym około 5 g NH4Cl lub KCl z dokładnością do 0,0001 g.
b. Do kalorymetru wlać 100 cm3 wody i mierzyć jej temperaturę w odstępach co 1 min w ciągu około 10 min (do czasu osiągnięcia niewielkich stałych zmian temperatury w kolejnych odczytach - okres wstępny).
c. Wsypać do kalorymetru odważoną ilość NH4Cl lub KCl i ciągle mieszając mierzyć temperaturę przez pierwsze 5 min co 0,5 min, a następnie co 1 min przez około 30 min (do momentu, gdy zmiany temperatury będą niewielkie i stałe - okres główny i końcowy).
d. Otrzymane wyniki zestawić w tabeli I.
CZAS (MIN.) |
OKRES POCZATKOWY |
|||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||||||||||
TEMP. (ºC) |
|
|
|
|
|
|
|
|
|
|
||||||||||
CZAS (MIN.) |
OKRES GŁÓWNY |
|||||||||||||||||||
|
10,5 |
11 |
11,5 |
12 |
12,5 |
13 |
13,5 |
14 |
14,5 |
15 |
||||||||||
TEMP. (ºC) |
|
|
|
|
|
|
|
|
|
|
||||||||||
CZAS (MIN.) |
OKRES KOŃCOWY |
|||||||||||||||||||
|
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|||||
TEMP. (ºC) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
2. Wyznaczenie molowej entalpii rozpuszczania kwasu siarkowego
a. Jak w punkcie l b.
b. Wprowadzić do kalorymetru 2 cm3 stężonego mierzyć zmiany temperatury jak w punkcie l c.
c. Wyniki wpisać do tabeli II.
CZAS (MIN.) |
OKRES POCZATKOWY |
|||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||||||||||
TEMP. (ºC) |
|
|
|
|
|
|
|
|
|
|
||||||||||
CZAS (MIN.) |
OKRES GŁÓWNY |
|||||||||||||||||||
|
10,5 |
11 |
11,5 |
12 |
12,5 |
13 |
13,5 |
14 |
14,5 |
15 |
||||||||||
TEMP. (ºC) |
|
|
|
|
|
|
|
|
|
|
||||||||||
CZAS (MIN.) |
OKRES KOŃCOWY |
|||||||||||||||||||
|
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|||||
TEMP. (ºC) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
3. Wyznaczenie molowej entalpii zobojętniania w reakcji wodorotlenku sodu z kwasem siarkowym
a.. W zlewce zawierającej 100 cm3 wody rozpuścić NaOH w ilości potrzebnej do zobojętnienia 2 cm3 stężonego H2S04. Roztwór ten oziębić do temperatury wody stosowanej w poprzednich pomiarach, tj. w punkcie lb i 2b.
b. Oziębiony roztwór NaOH przelać do kalorymetru i notować zmiany temperatury jak w punkcie lb.
c. Wprowadzić do kalorymetru 2 cm3 stężonego kwasu siarkowego i ciągle mieszając mierzyć temperaturę jak w punkcie lc.
d. Rezultaty pomiarów zebrać w tabeli III.
CZAS (MIN.) |
OKRES POCZATKOWY |
|||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||||||||||
TEMP. (ºC) |
|
|
|
|
|
|
|
|
|
|
||||||||||
CZAS (MIN.) |
OKRES GŁÓWNY |
|||||||||||||||||||
|
10,5 |
11 |
11,5 |
12 |
12,5 |
13 |
13,5 |
14 |
14,5 |
15 |
||||||||||
TEMP. (ºC) |
|
|
|
|
|
|
|
|
|
|
||||||||||
CZAS (MIN.) |
OKRES KOŃCOWY |
|||||||||||||||||||
|
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|||||
TEMP. (ºC) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Sposób przedstawienia wyników
Pojemność cieplna kalorymetru
Substancja - NH4Cl (KCl)
molowa entalpia rozpuszczania![]()
- 15,99 (18,33) kJ ∙ mol-1
masa substancji - m1 =………………g
objętość wody - V= 100 cm3
zmiana temperatury - ![]()
= …………….°C
Sporządzić wykres zależności zmian temperatury układu od czasu. Wyznaczyć metodą graficzną wartość ![]()
(patrz punkt 4.) i obliczyć pojemność cieplną kalorymetru (C.)
2. Wyznaczanie molowej entalpii rozpuszczania kwasu siarkowego w wodzie
Sporządzić tabelę II na wzór tabeli I.
pojemność cieplna kalorymetru - C = ………………… kJ ∙ K-1
masa H2S04 (objętość 2 cm3) - m2 =………………...g
objętość wody - V = 100 cm3
zmiana temperatury - ![]()
=…………………..°C
Wykreślić wykres zmian zależności temperatury od czasu i odczytać z niego ![]()
jak w punkcie 1. oraz obliczyć molową entalpię rozpuszczania H2S04 (![]()
).
3. Wyznaczanie molowej entalpii zobojętniania
Sporządzić tabelę III na wzór tabeli I i wykres zależności temperatury od czasu - T = ƒ(t).
pojemność cieplna kalorymetru - C =………… kJ ∙ K-1
molowa entalpia rozpuszczania H2S04 - ![]()
=………… kJ ∙ mol-1
masa H2S04 (o objętości 2 cm3) - m2 = …………g
masa NaOH - mNaOH =………….g
zmiana temperatury - ![]()
=………….°C
Na podstawie zależności obliczyć molową entalpię zobojętniania mocnego kwasu (H2S04) mocną zasadą (NaOH). Wartość molowej entalpii rozpuszczania H2S04 w tym równaniu bierzemy z pomiarów wykonanych w punkcie 2.
4. Wyznaczanie ΔT
Pomiar kalorymetryczny składa się, niezależnie od rodzaju kalorymetru, z trzech okresów: początkowego AB, głównego BC i końcowego CD (ryc.).
Okres początkowy trwa od rozpoczęcia obserwacji temperatury układu kalorymetrycznego do zainicjowania badanej przemiany. Od tego momentu do uzyskania maksymalnej temperatury trwa okres główny. Po nim zaczyna się okres końcowy, który trwa przez cały czas odczytywania pomiarów po okresie głównym. Jeśli nie byłoby wymiany ciepła z otoczeniem i innych dodatkowych efektów powodujących straty ciepła (układ idealnie izolowany), to temperatura w okresie początkowym i końcowym miałaby wartość stałą, a zmiana temperatury ΔT byłaby równa różnicy między nimi. Jednak z uwagi na to, że układ traci część ciepła na tzw. promieniowanie, zmierzona. w kalorymetrze różnica ΔT jest mniejsza od tej, jaką układ osiągnąłby, gdyby wyrównanie temperatur nastąpiło w bardzo krótkim czasie.
Aby wyeliminować błąd powstały na skutek wymiany ciepła z otoczeniem kreśli się tzw. krzywą idealnego wyrównania temperatur (ryc. 108), z której w drodze ekstrapolacji otrzymuje się ΔT przy nieskończenie szybkim wyrównaniu temperatur. W tym celu nanosi się na wykres zmiany temperatury
względem czasu - otrzymując krzywą ABCD. Następnie kreśli się prostą przechodzącą przez punkty pomiarowe odpowiadające okresowi początkowemu i przedłuża się ją w stronę wzrastających wartości czasu (na prawo od punktu B - krzywa I). Analogicznie kreśli się prostą przechodzącą przez punkty odpowiadające okresowi końcowemu i ekstrapoluje się ją w stronę przeciwną (na lewo od punktu C - krzywa II). Otrzymuje się w ten sposób dwie proste pomocnicze (I i II), lekko nachylone względem osi poziomej. Przedłużenia te łączymy prostą EF prostopadłą do osi czasu w ten sposób, aby odcinki EG i FG były równe. Odcinek EF wyznaczony przez oba otrzymane w ten sposób punkty E i F odpowiada wartości ΔT = T1 - T0, otrzymanej przy nieskończenie szybkim wyrównaniu temperatury. Wykres należy sporządzić bardzo starannie, ponieważ tylko wówczas wyznaczona wartość ΔT będzie w przybliżeniu równa wartości żądanej.
Ryc. Krzywa zmian temperatury układu w zależności od czasu: AB - okres wstępny, BC - okres
główny, CD - okres końcowy [6]
Wyszukiwarka
Podobne podstrony:
14 Entalpia zobojętniania, 14. Entalpia zobojętniania NOWY, Wydział
8 Entalpia zobojętniania
9 KALORYMETRIA CIEPŁO ZOBOJĘTNIANIA (Entalpia zobojętniania)
Entalpia zobojętniania Wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria,
14 Entalpia zobojêtniania NOWY
entalpia zobojętnienia Guzika, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria,
Entalpia zobojetniania wzor, Politechnika Poznańska, chemia
sprawozdanie - Entalpia zobojętniania, STUDIA POLIBUDA, INŻYNIERIA MATERIAŁOWA, SEMESTR I, Chemia, L
WYDZIAŁ V, RIII , sem VI 14
Laboratorium 14 - Wyznaczanie stosunku E do M (4), Wydzia˙: AEI
Rozdzial 14 - oprac, ►► UMK TORUŃ - wydziały w Toruniu, ► Wydział politologii i studiów międzynarodo
TVN 14, Politechnika Lubelska, Studia, Studia, sem VI, z ksero na wydziale elektrycznym
TWN 14(1), Politechnika Lubelska, Studia, Studia, sem VI, z ksero na wydziale elektrycznym
Plan oblicze- wa-ka 12E3 r ak 2013 14, Energetyka Politechnika Krakowska Wydział Mechaniczny I stopi
Strona Tytu-owa 12E3 r ak 2013 14, Energetyka Politechnika Krakowska Wydział Mechaniczny I stopień,
Laboratorium 14 - Wyznaczanie stosunku E do M (3), Wydzia˙: AEI
więcej podobnych podstron