POLITECHNIKA KOSZALIŃSKA
Wydział Mechaniczny
Zakład Elektrochemii Powierzchni
L A B O R A T O R I U M
Z TECHNOLOGII POWIERZCHNI I POWŁOK
ĆWICZENIE NR 4
Temat ćwiczenia:
Polerowanie chemiczne i elektrochemiczne ( ECP).
Grupa/Rok studiów IZK III Grupa K - 02
Semestr VI
Sprawozdanie wykonał
Paweł Urban
Magdalena Krudos
Grzegorz Skrzypkowski
Data wykonania ćwiczenia
18 marzec 1997
Data zaliczenia
Sprawdził/Ocena
KOSZALIN 1997
Wstęp teoretyczny.
Metale lub ich stopy zanurzone w odpowiedniej kąpieli, w dobranych warunkach elektrycznych i temperaturze, mogą rozpuszczać się na anodzie w ten sposób, że powierzchnia ich zostanie wygładzona i wybłyszczona. Proces ten nosi nazwę polerowania elektrolitycznego. Podobny efekt można osiągnąć, gdy zamiast umieszczenia metali (lub stopów ) na biegunie dodatnim dodamy do kąpieli odpowiednich środków utleniających. W takim przypadku zachodzić będzie polerowanie chemiczne.
Oba te procesy mają charakter elektrochemiczny, który nie jest jeszcze ostatecznie wyjaśniony. Proces polerowania elektrolitycznego polega na selektywnym rozpuszczaniu nierówności powierzchni anody. Elektrochemiczny opis zjawiska podał Jacquet w latach 1935 - 1936. Dotyczył on polerowania miedzi w roztworach kwasu ortofosforowego, przy czym zauważył on charakterystyczną zależność między potencjałem a gęstością prądu na anodzie.
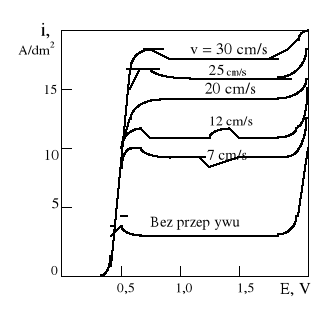
Jak widać na powyższym rysunku, wszystkie krzywe polaryzacji mają wyraźny odcinek poziomy w obszarze potencjałów anodowych 0,4 - 1,5 V, przy czym gęstość prądu odpowiadająca temu potencjałowi waha się w bardzo wąskich granicach i dla roztworów bardziej rozcieńczonych jest coraz większa. Ten charakterystyczny odcinek poziomy odpowiada procesowi elektrolitycznego polerowania anody i zachodzi, jak widać na rysunku, w ściśle określonych warunkach.
Praca Jacquea wyjaśniła mechanizm procesu polerowania elektrolitycznego, można przyjąć, że zachodzi on wtedy gdy powierzchnia anody pokryje się cienką lepką warstwą o większym oporze elektrycznym niż opór elektryczny kąpieli. Odległości między „szczytami nierówności” powierzchni (b)i końcem warstewki są mniejsze niż między wgłębieniami i końcem warstewki (a), więc opór elektryczny na drodze do szczytów jest mniejszy niż na drodze do wgłębień (rysunek na następnej stronie). Z tego powodu natężenie prądu płynącego do szczytu jest większe niż natężenie prądu płynącego do wgłębień, a więc przede wszystkim zachodzi rozpuszczanie się szczytu.
Polerowanie chemiczne zachodzi gdy, rozpuszczanie następuje poprzez warstwę przypowierzchniową. Wytworzona warstwa umożliwia zróżnicowanie szybkości rozpuszczania się zagłębień i wzniesień powierzchni, przy czym - jak widać na rysunku poniżej szybkość ta rośnie przy zawartości wody ok. 15-20% obj. w zakresie powierzchni błyszczących do około 25% obj. w zakresie trawienia, po czym spada . Na podstawie tego wykresu należałoby przyjąć, że w zagłębieniach warstwa dyfuzyjna jest uboższa w wodę (wolniej się rozpuszcza) niż na mikrowzniesieniach. Zjawisko takie w stężonych kąpielach rzeczywiście występuje, ponieważ na skutek słabej konwekcji w mikrowgłębieniach panuje większe stężenie rozpuszczonych jonów metalu i aktywność wody jest mniejsza.
Teoria ta stosuje się do kąpieli o dużym stężeniu, jednak nie tłumaczy działania kąpieli rozcieńczonych, które są stosowane wielu technologiach.
Na podstawie powyższego można stwierdzić, że brak jest jednolitej teorii wyjaśniającej całokształt zjawiska polerowania elektrolitycznego, chociaż niektóre technologie polerowania dają się stosunkowo dość dobrze interpretować teoretycznie.
Rozkład warstwy dyfuzyjnej przy polerowaniu anodowym.
a - odległość od szczytu nierówności do końca warstewki;
b - odległość od wgłębienia nierówności do końca warstewki;
Cel ćwiczenia
Celem ćwiczenia jest poznanie chemicznego i elektrochemicznego polerowania metali, parametrów procesu, oraz wyznaczenie wydajności prądowej elektropolerowania.
Wykonanie ćwiczenia
Podczas wykonywania ćwiczenia przeprowadzaliśmy polerowanie chemiczne i elektrochemiczne, chemiczne - próbki z miedzi i mosiądzu, elektrochemiczne - stal 55.
Próbki z miedzi i mosiądzu.
• kąpiel alkaliczna Na2CO3 + K2CO3 (1 min.)
• płukanie w wodzie
• kwas H2SO4 o stężeniu 15-20%
• płukanie w wodzie
• kąpiel do polerowania ( w celu zwiększenia szybkości stosowaliśmy podgrzewanie)
skład kąpieli:
H3PO4 γ = 1,65 500 cm3
CH3COOH lodowaty 300 cm3
HNO3 γ = 1,42 200 cm3
• płukanie w wodzie
• wybłyszczanie
skład kąpieli:
H3PO4 300 cm3
CH3COOH lodowaty 650 cm3
HNO3 γ = 1,42 50 cm3
• płukanie w wodzie
Próbkę ze stali 55 polerowaliśmy elektrochemicznie po wcześniejszym oczyszczeniu mechanicznym w roztworze o składzie:
H3PO4 γ = 1,65 235 cm3
H2SO4 γ = 1,84 217 cm3
CrO3 30 g
Woda destylowana 170 cm3
Obliczenia
Równoważnik ten wykorzystujemy do obliczenia masy teoretycznej mt metalu straconego podczas polerowania co będzie potrzebne do obliczenia wydajności prądowej procesu elektropolerowania stali.
![]()
gdzie:
m1 = masa początkowa;
m2 - masa końcowa;
mt = k I t, k - równoważnik elektrochemiczny;
Równoważnikiem elektrochemicznym nazywamy ilość substancji wydzielonej na katodzie (biegunie ujemnym) lub też przeprowadzonej do roztworu na anodzie (biegunie dodatnim) pod wpływem elektryczności równej 1Ah.
Dane:
m1 = 15,00039g
m2 = 14,8317g
I = 1,8A
t = 7min
[]
A - masa atomowa,
n - liczba utlenienia.
W przypadku stopów, takich jak np. stal kwasoodporna, równoważnik elektro-chemiczny oblicza się ze wzoru:
[]
gdzie:
P1, P2 ... - zawartość poszczególnych składników w stopie,
k1, k2,... - równoważnik elektrochemiczny każdego ze składników stopu.
W ćwiczeniu badaliśmy stal wyższej jakości 55 o następującym składzie pierwiastkowym:
Pierwiastek |
P |
A |
n |
k |
C |
0,55 % |
12 |
2 |
0,224 |
Mn |
0,65 % |
54,9 |
2 |
0.024 |
Si |
0,25 % |
28 |
4 |
0,261 |
Fe |
98,55% |
56 |
2 |
1,045 |
Obliczanie gęstości prądu
Wymiary próbki:
Uwagi wniosk
Wydajność prądowa procesu elektropolerowania wyniosła 40,65% z czego wynika, że masa zdjętej warstwy podczas procesu okazała się mniejsza od tej, której można by się spodziewać na podstawie wyliczeń teoretycznych. Nasuwa się pytanie, od czego zależy wydajność prądowa? Nie jest to na pewno czas, jak można by się początkowo zasugerować na podstawie wzoru na masę teoretyczną. Nie jest to również prąd, gdyż obie te wielkości wpływają zarówno na masę teoretyczną jak i faktyczną. Co zatem wpływa na skuteczność? Moim zdaniem jest to temperatura, w której przeprowadzany był proces, gdyż temperatura nie wpływa na masę teoretyczną a na faktyczna niewątpliwie tak. Jeszcze jednym czynnikiem może być stopień zanieczyszczenia powierzchni. W początkowej fazie polerowania ubytek masy będzie inny niż później gdyż najpierw usuwane będą tlenki, które maję inny skład niż sam materiał.
Kolejne pytanie to taki: dlaczego wydajność prądowa jest tak mała? Wielkości wymienione wcześniej mają znikome znaczenie. Odpowiedź może być taka. Przy liczeniu masy teoretycznej cały prąd zużywany jest na wydzielenie/ubytek tejże masy, natomiast w praktyce duża część energii zamienia się na ciepło gdyż reakcje zachodzące podczas procesu mają charakter egzotermiczny.
Gęstość płynącego przez próbkę prądu wyniosła 29,14
Podczas polerowania chemicznego zaobserwowaliśmy, że miedź została wypolerowana lepiej niż mosiądz, który był poddany identycznej obróbce jak miedź.
Technologia Powierzchni i Powłok - Laboratorium
Str. 6
Peweł Urban & Magda Krudos & Grzegorz Skrzypkowski
obszar
połysku
Wyszukiwarka
Podobne podstrony:
2LAB, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, Fizyka, sprawka od Mateusza, Fizyka -
WYKRES73, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
C7, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, Fizyka, sprawka od Mateusza, Fizyka - la
b, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, pam - egz, 1 koło
Fizzad2, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
STOS-EM, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
Fizyka21, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
FizWyks2, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
ROZS, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, Labolatorium Fizyki
065S~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
Laboratorium 4, Politechnika Koszalińska, III semestr, Laboratorium techniki cyfrowej
FizPrad, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
051C~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
Politechnika KoszalińskaKoszalin
Analiza i Algebra liniowa semestr 2 Politechnika koszalińska kierunek informmatyka
więcej podobnych podstron