72177

1. Cel ćwiczenia:
Zapoznanie studentów z zagadnieniami dotyczącymi po^rfok ochronnych, sposobami ich wytwarzania oraz ich zastosowaniami.
2. Wstęp teoretyczny:
Potencjał elektrochemiczny metali.
Każdy metal zanurzony w elektrolicie posiada pewien potencjał. Potencjał ten jest związany z reakcją utlenienial ub redukcji metalu, bądź też onentacją cząsteczek z roztworu i jest równy różnicy potencjału na granicy faz metaUroztwór. Praca przejścia przez granicę faz jonu lub elektronu posiada naturę chemiczną i elektryczną. W związku z tym potencjał ten definiujemy jako potencjał elektrochemiczny. Wymiana ładunków jest związana z reakcją utlenienia (oddawania elektronów) i redukcji (pobierania elektronów). Jeśli nie ma odpływu elektronów z elektrody, między obu przeciwnie skierowanymi reakcjami ustali się równowaga:
Me « Me-r+ ne
Prowadzi to do powstania różnicy potencjałów między metalem a roztworem. Jeśli rozpatrujemy układ metal - sól jonów Jasnych, to na podstawie rozważań termodynamicznych można podać równanie określające zależność potencjału metalu od aktywności jego jonów w roztworze. Jest to potencjał odwracalny metalu i opisuje go równanie Nemsta:
Ogólna postać równania:
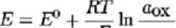
zF “red
dla temperatury 298 K i roztworów na tyle rozcieńczonych, że współczynnik aktywności jonów w nich zawartych jest z dobrym przybliżeniem równy 1 upraszcza się do:
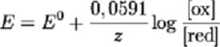
gdzie:
• R - stała gazowa równa 8,314 J K'1 mol’1
• T - temperatura wyrażona w kelwinach
• z - liczba elektronów wymienianych w reakcji połówkowej
• a - aktywność molowa indywiduów chemicznych biorących udział w reakcji elektrodowej
• F-stała Faradaya równa 96485 C mol'1
• [red] - stężenie molowe formy zredukowanej
• [ox] - stężenie molowe formy utlenionej
W przypadku innych układów tzn. metali zawierających obce kationy, wartość potencjału zmienia się analogicznie ze zmianą aktywności elektrolitu. Jednak ze względu na nieznaną wartość potencjału normalnego metalu w danym roztworze potencjału tego nie można obliczyć z równania Nemsta. Potencjał ten definiujemy jako potencjał nieodwracalny. Bezwzględnej wartości skoku potencjału na granicy faz metal-roztwór nie potrafimy zmierzyć. Można natomiast określić różnicę potencjałów dwóch elektrod.
Wyszukiwarka
Podobne podstrony:
CEL NAUCZANIA Zapoznanie studentów z zagadnieniami epidemiologii chorób zakaźnych i pasożytniczych
img326 Temat: Ubój i obróbka poubojowa drobiu Cel ćwiczenia: Zapoznanie studentów
1. Cel ćwiczenia: Zapoznanie studentów z jedną z możliwości badania pieca przed je
1. Cel ćwiczenia: Zapoznanie studentów z jedną z możliwości badania pieca przed je
1. CEL ĆWICZENIA Celem ćwiczenia jest zapoznanie studentów z zagadnieniami sprzęże
1. CEL ĆWICZENIA Zasadniczym celem ćwiczenia jest zapoznanie studentów z zagadnieniami związanymi z
Cel ćwiczenia Zapoznanie się z obróbkami cieplnymi stopów żelaza oraz strukturami stali po ulepszani
2. RYSUNEK MODELU, SUROWEGO ODLEWU I FORMY ODLEWNICZEJ 2.1. Cel ćwiczenia Zapoznan
. PRZYGOTOWANIE PRODUKCJI ODLEWU 1.1. Cel ćwiczenia Zapoznanie się z metodami
Cel ćwiczenia Zapoznanie z systemami plików używanymi w systemach operacyjnych Windows Zadania 1.
img046 Ćwiczenie 2UŻYTKOWANIE ROZPŁODOWE KRÓW Cel ćwiczeń: zapoznanie się z fizjologicznymi podstawa
img098 Ćwiczenie 10OPAS BYDŁA. OCENA WARTOŚCI RZEŹNEJ Cel ćwiczeń: zapoznanie się z fizjologicznymi
IMG!12 1. Cel ćwiczenia:Zapoznanie się ze sposobem pomiaru przesunięcia fazowego metodą figur Lissaj
EFEKTY KSZTAŁCENIA I SPOSÓB PROWADZENIA ZAJĘĆ Cel przedmiotu Zapoznanie studentów z podstawowymi
1. Cele ćwiczenia • zapoznanie studentów z podstawowymi narzędziami pomiarowymi
więcej podobnych podstron