75522

Wpływ stężenia substratu na aktywność enzymów
Szybkość reakcji enzymatycznej (V) rośnie wraz ze wzrostem stężenia substratu (c). W pewnym przedziale stężeń (w reakcjach jednosubstratowych) szybkość reakcji jest liniowo zależna od stężenia substratu. Zależność tę przedstawia wykres Michaelisa-Menten Krzywa zależności V od c ma przebieg hiperboliczny. Przy wysokim stężeniu substratu prędkość reakcji osiąga wartość maksymalną (Vmax). Dalszy wzrost stężenia substratu nie zwiększa szybkości reakcji. Stężenie substratu, przy którym prędkość reakcji osiąga połowę prędkości maksymalnej, nosi nazwę stałej Michaelisa, oznaczanej symbolem KM. Jest ona miarą powinowactwa enzymu do określonego substratu. Wyraża się ją najczęściej w pmol/dm3. W wielu przypadkach enzym może przekształcać kilka substratów, ale wykazuje różne powinowactwo do każdego z nich (Rys. 1). Poszczególne substraty są łatwiej - a bądź trudniej - b wiązane w miejscu aktywnym enzymu. W przypadku a reakcja osiąga prędkość maksymalną już przy niskim stężeniu substratu. Stała Michaelita jest niska. W przypadku b reakcja osiąga prędkość maksymalną przy wysokim stężeniu substratu. Stała Michaelita jest wysoka. Zależność szybkości reakcji od stężenia substratu można przedstawić w postaci wykresu Lineweavera-Burka. Na osi rzędnych oznacza się odwrotność prędkości reakcji, na osi odciętych odwrotność stężenia substratu.
Zależność ma charakter liniowy. Prosta przecina osie współrzędnych w dwóch charakterystycznych punktach, oś rzędnych w punkcie odpowiadającym odwrotności prędkości maksymalnej, a oś odciętych w punkcie odpowiadającym ujemnej odwrotności stałej Michaelisa.

Wykres Michaelisa-Mentena przedstawiający zaleśność szybkości reakcji (V) od stęśenia substratu (c) dla enzymu o różnym powinowactwie do substratów a i b
i
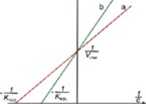
Zaleśność szybkości (V)
reakcji enzymatycznej
od stęśenia substratu (c)
według Lineweavera-
Burka) ,dla enzymu o róśnym powinowactwie do substratów a i b
Wyszukiwarka
Podobne podstrony:
CZYNNIKI WPŁYWAJĄCE NA AKTYWNOŚĆ ENZYMÓW Szybkość reakcji enzymatycznej uzależniona jest od:
ScannedImage 7 t Ryc. 8. zależność aktywności enzymu od pH Szybkość reakcji enzymatycznej rośnie wra
Wpływ temperatury na aktywność enzymów Prędkość reakcji enzymatycznej w pewnym przedziale temperatur
DSC00036 (39) Wpływ stężenia substratu na szybkość reakcji enzymatycznej _
WYKŁAD 2 enzymy cz 1 (30) KINETYKA REAKCJI ENZYMATYCZNEJ 0 Wpływ stężenia substratu na szybkość r
CCI20130725�086 Rys. 6.2. Wpływ stężenia substratu na właściwą szybkość wzrostu bowiem zjawiska inhi
SDC10489 (2) Wpływ odczynu środowiska na aktywność enzymów Do d^rąłar»T3 enzymy wymag^ą odpowiednieg
C. Badanie wpływu stężenia substratu na aktywność katalityczną kwaśnej fosfatazy. Wyznaczanie stałej
PB030081 WPŁYW JONO W METALI NA AKTYWNOŚĆ ENZYMÓW Jony metali mogą pełnić funkcje: katalityczne - bi
Zdjęcie0182 Wpływ temperatury i pH na aktywność enzymów immmi C
C. Badanie wpływu stężenia substratu na aktywność katalityczną kwaśnej fosfatazy. Wyznaczanie stałej
Wpływ stężenia enzymu i czasu na aktywność enzymów Zależność szybkości reakcji od stężenia enzymu
Wpływ stężenia enzymu i substratu na szybkość reakcji enzymatycznej. W stałej temperaturze i pH. prz
SDC10488 (2) © •Wpływ temperatury na aktywność enzymów Wzrost temperatury zwiększa szybkość reakcji
WYKŁAD 2 enzymy cz 1 (25) AKTYWNOŚĆ ENZYMÓW MÓZE BYĆ REGULOWANACzynniki wpływające na szybkość re
więcej podobnych podstron