
Załącznik Nr 5 do ,,Zasad oceny nasion w Lasach Państwowych"
Dyrekcja G e n e r a l n a Lasów Państwowych
Instytut Badawczy Leśnictwa
OZNACZANIE ŻYWOTNOŚCI NASION
D R Z E W I K R Z E W Ó W LEŚNYCH
METODĄ KROJENIA
Warszawa 1997
1

Metodykę opracowali:
dr inż. Andrzej Zaleski
inż. Władysław Kantorowicz
Do opracowania metodyki oznaczania żywotności nasion
drzew i krzewów leśnych metodą krojenia wykorzystano
również materiały zawarte w publikacjach:
1. Antosiewicz Z., 1964. Ocena nasion w gospodarstwie
leśnym. PWRiL, Warszawa.
2. Kocięcki S., 1966. Terminarz nasiennictwa leśnego z
atlasem do oznaczania nasion. PWRiL, Warszawa.

Spis treści
1. Zasada i zakres zastosowania próby krojenia.
2. Wyposażenie laboratorium.
3. Próbka nasion przeznaczonych do krojenia.
4. Oznaczanie czystości i masy 1000 nasion w badaniach terenowych.
. Przygotowanie nasion do krojenia.
6. Budowa anatomiczna nasion.
7. Krojenie i podświetlanie nasion.
8. Ocena żywotności nasion na podstawie wyglądu tkanek.
9. Określenie wartości siewnej nasion i ustalenie normy wysiewu.
Materiały pomocnicze:
tabele
rysunki

1. Z a s a d a i z a k r e s z a s t o s o w a n i a próby krojenia.
1.1. Próba krojenia należy do orientacyjnych metod oceny nasion. Jej zastosowanie nie
wymaga użycia specjalistycznego sprzętu laboratoryjnego i nie musi być wykonana przez
wyspecjalizowany personel laboratoryjny. Od wykonawcy wymagana jest jedynie dobra
znajomość anatomicznej budowy nasion, a więc próba krojenia może być przeprowadzona
przez wszystkich leśników z wykształceniem wyższym i średnim.
1.2. W próbie krojenia dokonuje się oceny żywotności nasion na podstawie makroskopowych
oględzin: rozwoju zarodka i bielma (u niektórych gatunków), stanu tkanki liścieni i
zawiązków korzonka oraz wewnętrznych uszkodzeń spowodowanych przez grzyby i owady.
Ponieważ ocenę dokonuje się tylko na podstawie zewnętrznego wyglądu przekroju przez
tkankę, próba krojenia jest najmniej zawodna w stosunku do nasion świeżo pozyskanych oraz
poprawnie i krótko okresowo przechowywanych. Przy jej pomocy nie da się natomiast
wykryć zmian biochemicznych i fizjologicznych związanych: z niewidocznymi
uszkodzeniami w czasie pozyskania, ze starzeniem się nasion i stanami spoczynku.
1.3. Duża prostota próby krojenia, przy dość ograniczonej jej dokładności, powoduje, że
metodę tę zaleca się stosować tylko w razie potrzeby bardzo szybkiej oceny w terenie, a więc
w przypadkach:
- przedzbiorczego testowania nasion, w celu ustalenia zasadności zbioru szyszek i
owoców,
- oceny żywotności nasion pozyskanych przedwcześnie, przed osiągnięciem pełnej
dojrzałości („na zielono"), w celu ustalenia przybliżonej normy wysiewu,
- oceny żywotności nasion stratyfikowanych w warunkach naturalnych (dołowanych.
przechowywanych pod ściółką), w celu określenia postępów stratyfikacji i
ustalenia
przybliżonej normy wysiewu.
4

Leśniczowie wykonujący ocenę terenową, w nadleśnictwach, zwolnieni są z obowiązku
prowadzenia analizy pełnej, a mianowicie mogą wykonać badania bez określenia
procentowego udziału masy różnych zanieczyszczeń w ogólnej masie próbki średniej i bez
ustalania masy 1000 nasion.
1.4. W ramach oceny uproszczonej prowadzonej przez wyspecjalizowane Stacje Oceny
Nasion (SON), dopuszcza się również zastosowanie próby krojenia dla zbadania żywotności
nasion gatunków drzew domieszkowych i krzewów biocenotycznych (zgodnie z .Zasadami
oceny nasion w Lasach Państwowych"). Stacje Oceny, wydające świadectwo oceny
uproszczonej, zobligowane są jednak do przeprowadzenia analizy pełnej, obejmującej
również określenie procentowego udziału masy różnych zanieczyszczeń w ogólnej masie
próbki średniej oraz ustalenie masy 1000 nasion (zgodnie z odrębną metodyką - załącznik
nr 2 pt. „Oznaczanie czystości i masy 1000 nasion").
2. Wyposażenie laboratorium.
2.1. W próbie krojenia potrzebny jest sprzęt podstawowy do wykonania przekroju przez
zarodek i bielmo, urządzenia powiększające pole widzenia, oraz sprzęt pomocniczy do
wydobycia nasion niektórych gatunków z twardej okrywy i moczenia nasion nadmiernie
wysuszonych.
2.2. Do sprzętu podstawowego należy zaliczyć ostrze krojące i podłoże, na którym układa się
krojone nasiona.
W laboratorium SON, w charakterze ostrza krojącego należy stosować zestaw
skalpeli różnej wielkości, dostosowanej do wielkości i twardości nasion (rys. 1) oraz gilotynę
(rys. 2).
W badaniach terenowych, prowadzonych przez nadleśnictwa, do krojenia nasion
można używać wszelkiego rodzaju dobrze wyostrzonych noży, typu „okulizak" (rys. 3).
5

Krojone nasiona powinny być rozkładane na drewnianym podłożu, za które mogą
posłużyć wszelkiego rodzaju deseczki.
2.3. Laboratoria SON powinny być wyposażone w urządzenia powiększające pole widzenia i
ułatwiające dokładne oględziny przekroju przez zarodek i bielmo nawet najmniejszych
nasion, takie jak: lupa na statywie, binokular lub mikroskop stereoskopowy (rys. 4 i 5).
W badaniach terenowych, prowadzonych przez nadleśnictwa, do dokładnych oględzin
przekroju mogą posłużyć wszelkiego rodzaju oprawione lupy i szkła powiększające (rys. 6).
2.4. Do kruszenia twardej okrywy niektórych nasion, w celu wydobycia ich do próby
krojenia, należy stosować wszelkiego rodzaju małe imadła (rys. 7) i młotki o masie ok. 0.5
kg.
2.5. Laboratoria SON powinny być wyposażone w zestaw szklanych naczyń różnej wielkości,
do moczenia wysuszonych nasion w wodzie destylowanej przed próbą krojenia, a więc
zlewki o pojemności 100, 250 i 500 ml.
W badaniach terenowych, prowadzonych przez nadleśnictwa, dopuszcza się
zastosowanie zwykłej wody, o ile nie jest ona zanieczyszczona ponad normę. i różnej
wielkości szklanych słojów.
3. Próbka nasion przeznaczonych do krojenia.
3.1. Do oceny uproszczonej, wykonywanej w laboratorium SON, przeznacza się próbkę 300
oczyszczonych nasion, składającą się z 3 powtórzeń po 100 sztuk. W wyjątkowych
przypadkach próbę krojenia można przeprowadzić dla 4 powtórzeń po 50 sztuk (dla 200
nasion).
3.2. W badaniach terenowych, prowadzonych przez nadleśnictwa, dopuszcza się
przeprowadzenie próby krojenia dla 4 powtórzeń po 50 sztuk (dla 200 nasion) lub 3
powtórzeń po 50 sztuk (150 nasion).
6

3.3. Nasiona do krojenia powinny być pobrane losowo z frakcji nasion czystych,
wydzielonych w analizie czystości prowadzonej w laboratorium SON, a w badaniach
terenowych (prowadzonych w nadleśnictwach) po oddzieleniu:
- zanieczyszczeń z badanego gatunku,
- zanieczyszczeń obcych,
- nasion niedokształconych,
- nasion uszkodzonych mechanicznie,
- nasion opanowanych przez grzyby,
- nasion uszkodzonych przez owady,
- nasion uszkodzonych przez gryzonie i ptaki,
- zanieczyszczeń mineralnych,
- innych zanieczyszczeń.
3.4. Nasiona czyste wybiera się tylko na podstawie wyglądu zewnętrznego okryw nasiennych,
kształtu nasion i ich wielkości.
3.5. Do zanieczyszczeń z badanego gatunku zalicza się resztki owocni, szypułek, szyszek,
skrzydełek, igliwia, liści oraz grudki żywicy itp.
3.6. Nasiona niedokształcone są to takie, które wyraźnie odbiegają swoją wielkością od
normalnie wyrośniętych. Niedokształcone nasiona wielu gatunków, bardzo często odznaczają
się nie tylko mniejszymi rozmiarami ale innym kształtem, barwą i elastycznością (rys. 8).
U lipy drobnolistnej nasiona niedokształcone są mniej brązowe a bardziej szare, ich okrywy
są mniej kanciaste a bardziej obłe i znacznie łatwiej je zmiażdżyć ściskając w palcach.
Niedokształcone skrzydlaki klonów i jesionów, w miejscu wypełnienia zarodkiem są płaskie
(mniej wypukłe) i dużo łatwiej jest je zgiąć lub nawet złamać.
3.7. Do zanieczyszczeń obcych zalicza się nasiona innych gatunków, a wśród nich wyróżnia
się obce obojętne i obce szkodliwe.
7

Szkodliwym zanieczyszczeniem obcym jest domieszka innych nasion, których nie da
się oddzielić metodą gospodarczą od zapasu nasion właściwego gatunku, a które w istotny
sposób obniżają wartość hodowlaną i genetyczną materiału siewnego. Typowymi
zanieczyszczeniami szkodliwymi są np. nasiona sosny Banksa w zapasie nasion sosny
zwyczajnej lub nasiona olszy szarej w zapasie nasion olszy czarnej. Ponad 10% domieszka
nasion obcych szkodliwych dyskwalifikuje zapas pod względem wartości siewnej.
3.8. Do nasion uszkodzonych mechanicznie zalicza się wszystkie nasiona skaleczone,
pozbawione części łupmy, ułamane i z pęknięciami powstałymi na skutek działania
czynników mechanicznych (rys. 9). Dla uszkodzeń mechanicznych charakterystyczne są
pęknięcia poprzeczne z nieregularnymi, postrzępionymi brzegami. Należą do nich również
nasiona jodły z pogniecionymi pęcherzykami żywicznymi. Do uszkodzeń mechanicznych nie
zalicza się natomiast podłużnych pęknięć łupiny o gładkich brzegach, które powstają przede
wszystkim przy zbyt szybkim wysychaniu nasion takich gatunków, jak dąb, buk, jabłoń.
Nasiona z takimi pęknięciami, o ile nie są nadmiernie wysuszone, nadają się do
natychmiastowego siewu, nie nadają się natomiast do długoterminowego przechowywania.
Obłamanie skrzydełek u nasion uskrzydlonych nie jest uszkodzeniem.
3.9. W próbie czystości, do nasion uszkodzonych przez grzyby zalicza się te, które mają
wyraźne, zewnętrzne oznaki przerośnięcia przez strzępki grzybni, zmurnifikowania,
chorobowego przebarwienia okrywy nasiennej itp.
3.10. Zewnętrznymi oznakami uszkodzeń spowodowanych przez owady są otwory (dziurki)
w okrywach nasiennych (rys. 9), otwory w łuskach szyszek, wydrążone trzpienie szyszek
oraz inne wgryzienia w okrywach nasion, charakteryzujące się gładkością brzegu
uszkodzenia.
3.11. Uszkodzenia nasion spowodowane przez gryzonie i ptaki charakteryzują się tym, że
brzegi uszkodzenia noszą wyraźne ślady ząbków lub są nieregularnie postrzępione. Mogą
8

w którym:
M
p
-
ogólna masa całej próbki materiału siewnego (± 0.01 g),
M
c
-
ogólna masa nasion czystych (± 0.01 g).
4.3. Dla celów oceny terenowej (w nadleśnictwach), masę 1000 nasion (Mt) ustala się na
podstawie pomiaru (zważenia) 3 różnych powtórzeń pobranych z frakcji nasion
oczyszczonych, powstałej po oddzieleniu zanieczyszczeń wymienionych w punktach od 3.5.
występować szczególnie w przypadku nasion stratyfikowanych w warunkach naturalnych
(dołowanych, przechowywanych pod ściółką).
3.12. Do zanieczyszczeń mineralnych zalicza się piasek, kamyki i inne minerały, które
zmieszały się z nasionami w trakcie pozyskania lub przysposabiania przedsiewnego.
3.13. Zanieczyszczeniami innymi są domieszki nie wymienione w punktach od 3.5. do 3.12.
4. Oznaczanie czystości i masy 1000 nasion w badaniach terenowych.
4.1. Nie tylko Stacje Oceny Nasion ale i te nadleśnictwa, które dysponują wagami
analitycznymi o dokładności do 0.01 g, mogą określić czystość nasion i ustalić masę 1000
sztuk. Charakterystyki te są niezbędne do precyzyjnego obliczenia wartości siewnej nasion i
norm wysiewu w szkółce. W przeciwnym razie normę wysiewu nasion można określić tylko
orientacyjnie, z bardzo dużym przybliżeniem, na podstawie tabelarycznych wartości opartych
na średnich z wieloletnich obserwacji.
4.2. Czystość nasion (Cz) określa się na podstawie wyników dwóch pomiarów (ważeń):
ogólnej masy całej próbki materiału siewnego wziętego do analizy (przed oczyszczeniem) i
ogólnej masy frakcji nasion czystych, wydzielonych po oddzieleniu zanieczyszczeń
wymienionych w punktach od 3.5. do 3.13. Oblicza się ją w procentach, według
następującego wzoru:
9

10
w którym:
W1 ,m2, m
3
-
masy kolejnych powtórzeń 100 lub 50* nasion (± 0.01 g)
5. Przygotowanie nasion do krojenia.
5.1. Niektóre nasiona będą wymagały przed krojeniem specjalnego przygotowania. Dotyczy
to głównie zarodków otoczonych twardymi okrywami i nasion nadmiernie wyschniętych.
5.2. Twarde okrywy nasion należy skruszyć za pomocą imadełka lub młotka. Zabieg ten jest
niezbędny w stosunku do takich gatunków jak: czeremchy, czereśnie, derenie, leszczyna,
orzechy, wiśnie i śliwy. Nacisk imadełka lub siła uderzenia młotka muszą być tak dobrane,
aby skruszyły okrywę nasienną a nie zmiażdżyły tkanek zarodka. Dopuszcza się
spowodowanie pęknięć zarodka i rozbicie go na grubsze kawałki.
5.3. Stan tkanki nasion znacznie łatwiej jest ocenić na przekroju wtedy, kiedy jest ona w pełni
uwilgotniona i jędrna. Dlatego przed krojeniem zalecane jest moczenie zarodków przez 24-48
godzin, a jest ono konieczne w przypadku nasion nadmiernie wysuszonych. Nasiona
niektórych gatunków należy wydobyć przed moczeniem z twardej okrywy nasiennej (punkt
5.2.), a osłonięte okrywą mniej twardą, ale nieprzepuszczalną dla wody, skruszyć lub naciąć
przed moczeniem na końcu przeciwległym do zawiązka korzonka. Umieszczone w szklanych
naczyniach nasiona zalewa się wodą destylowaną. W przypadku braku wody destylowanej
można zastosować inną, czystą wodę, możliwie jak najmniej zabrudzoną zanieczyszczeniami
mineralnymi (nie żelazistą) i organicznymi.
do 3.13. Każde powtórzenie może zawierać 100 lub 50 czystych nasion. Oblicza się ją w
gramach jako średnią z 3 powtórzeń, pomnożoną przez 10 - jeśli zważono masę 100 nasion
lub przez 20 - jeśli zważono masę 50 nasion. Obliczenia te wykonuje się według
następującego wzoru i wyraża w gramach:

6. Budowa anatomiczna nasion.
6.1. Prawidłowa ocena rozwoju zarodka wymaga dokładnej znajomości anatomicznej
budowy nasion różnych gatunków. Dla potrzeb gospodarczej oceny wyróżnia się 4 zasadnicze
typy budowy nasion (tabela 1).
6.2. Literą A oznaczono grupę nasion, których całe wnętrze wypełnia prabielmo z kanałem
zarodkowym w centralnej części. W kanale zarodkowym będącym pozostałością woreczka
zalążkowego, znajduje się zarodek. U normalnie wykształconych nasion zarodek jest
wyrośnięty na co najmniej 75% długości kanału zarodkowego.
6.3. Literą B oznaczono grupę nasion, których całe wnętrze wypełnione jest bielmem. W
peryferyjnej części bielma, najczęściej w węższym końcu nasienia, znajduje się bardzo mały
zarodek, kilkakrotnie mniejszy od całego bielma.
6.4. Literą C oznaczono grupę nasion, których całe wnętrze również wypełnione jest
bielmem. Zarodek jednak zajmuje centralne położenie w bielmie, i u nasion całkowicie
wykształconych jest wyrośnięty na co najmniej 75% długości bielma.
6.5. Literą D oznaczono grupę nasion, które nie posiadają bielma, a u nasion całkowicie
wykształconych całe wnętrze wypełniają liścienie dużego zarodka, z niewielkim zawiązkiem
korzonka.
7. Krojenie i podświetlanie nasion.
7.1. Przekroju przez nasiona dokonuje się w osi podłużnej, w dwóch płaszczyznach (dzieląc
na ćwiartki) tak, aby odsłaniał on wierzchołek zarodka, koniec korzonka i cześć kolanka
podliścieniowego. Niezbędna jest do tego znajomość anatomicznej budowy nasion różnych
grup gatunków (podział w punkcie 6.). Nasiona bardzo lekkie, lekkie, średnio ciężkie i
ciężkie kroi się skalpelami lub dobrze wyostrzonymi nożami, natomiast krojenie nasion
bardzo ciężkich, takich jak dęby i kasztanowiec, lepiej jest wykonać za pomocą gilotyny.
11

7.2. Na podstawie przekroju, w próbie krojenia wyróżnia się nasiona:
a) zdrowe,
b) nadpsute,
c) zepsute,
d) uszkodzone przez larwy, u których na przekroju widać jest larwę lub wygryzione przez
nią chodniki,
e) puste, bez zarodka.
7.3. Bardzo drobne nasiona niektórych gatunków trudno jest ocenić w warunkach
terenowych, na podstawie przekroju, ponieważ do oględzin potrzebny jest specjalistyczny
sprzęt o bardzo dużym powiększeniu pola widzenia. W takim przypadku można stosować
metody zastępcze, a mianowicie podświetlanie nasion lub rozgniatanie ich na bibule. Metody
zastępcze pozwalają odróżnić nasiona pełne od pustych, nie dają natomiast możliwości
wydzielenia nasion: zdrowych, nadpsutych i zepsutych.
7.4. Metodę podświetlania można stosować w stosunku do nasion posiadających bardzo
cienkie okrywy nasienne, takich jak np. brzozy. Rozłożone nasiona na matowym szkle lub na
szkle z białą kartką, podświetla się od dołu żarówką, dzięki czemu widać jest, czy ich wnętrze
wypełnione jest orzeszkiem (nasiona ciemne), czy też są one puste (nasiona jasne,
przepuszczające światło).
7.5. Metodę zgniatania można zastosować w odniesieniu do bardzo lekkich nasion, o
nieprzepuszczającej światło okrywie nasiennej, takich jak bzy i topole, jak również do nasion
brzóz, jeśli nie ma warunków do zastosowania metody podświetlania. Nasiona gniecie się na
bibule przy pomocy płasko zakończonego drewienka, np. ołówka. Pełne nasiona pozostawiają
na bibule „tłustą" plamę i przy zgniataniu brak jest odgłosu, natomiast nasiona puste nie
zostawiają plamy a ich zgniatanie powoduje powstawanie charakterystycznego „suchego
trzasku". W nasionach niektórych gatunków, takich jak bzy, na podstawie zgniatania można
12

również wykryć obecność żywych larw. Objawem ich występowania jest galaretowata
zawartość nasion, która nie pozostawia tłustych plam na bibule.
8. Ocena żywotności nasion na podstawie wyglądu tkanek.
8.1 W próbie krojenia, zamieranie tkanek wykrywa się na podstawie zmian w ich naturalnej
barwie i konsystencji. Za martwe uznaje się tkanki przebarwione na kolor brązowy, brunatny
i czarny o konsystencji mazistej. Tkanki żywe są jędrne, na ogół białe, a tylko w
wyjątkowych wypadkach żółte (np. żołędzie), oliwkowe (np. kruszyna) lub zielone (np.
klony). Naturalny kolor żywych tkanek uwypukla moczenie nasion przed krojeniem.
8.2. Na podstawie topografii i obrazu zamierania tkanek wyróżnia się nasiona: zdrowe,
nadpsute i zepsute (tab. 2).
8.3. Nasiona zdrowe nie mają na przekroju żadnych ciemnych plamek będących wynikiem
zmian nekrotycznych - martwej tkanki (rys. 10, 11 i 12). U nasion z grupy A i D dopuszcza
się niewielkie uszkodzenia w czapeczce korzeniowej.
8.4. Do nasion nadpsutych zaliczamy takie, których liścienie zarodka (grupa D) lub bielmo
(grupa A, B i C) mają nekrotyczne zmiany (ciemne plamki) nie sięgające korzonka i
zajmujące nie więcej niż 1/3 powierzchni przekroju (rys. 10).
8.5. Do nasion zepsutych zaliczamy te, które są całkowicie zgniłe (przebarwione), u których
zmiany nekrotyczne (ciemne plamy) są w bezpośrednim sąsiedztwie korzonka lub zajmują
więcej niż 1/3 powierzchni przekroju nasiona (rys. 10 i 12).
8.6. Klasyfikację żywotności nasion, czyli podział na te, które są zdolne do skiełkowania i
niekielkujące, prowadzi się na podstawie stopnia zamierania tkanki, ze szczególnym
uwzględnieniem budowy anatomicznej (punkt 6) i przeznaczenia nasion.
8.7. U nasion z grupy A do żywotnych zalicza się tylko zdrowe, natomiast nadpsute i zepsute
(tab. 2) uznaje się za niezdolne do skiełkowania niezależnie od pory wykonywania oceny.
13

8.8. U nasion z grupy B i D, w ocenie prowadzonej przed siewem jesiennym i przed
przechowywaniem, do żywotnych zalicza się tylko nasiona zdrowe, a w ocenie prowadzonej
po przechowaniu tuż przed siewem wiosennym - nasiona zdrowe i nadpsute (tab. 2).
8.9. U niektórych nasion z grupy C, takich jak: berberys, jesiony, lipy, oliwnik, rokitnik,
sumak i szaklak (kruszyna) w ocenie prowadzonej przed siewem jesiennym i przed
przechowywaniem, do żywotnych zalicza się tylko nasiona zdrowe, a w ocenie prowadzonej
po przechowywaniu tuż przed siewem wiosennym - nasiona zdrowe i nadpsute (tab. 2). U
pozostałych gatunków z tej grupy, takich jak: bzy, derenie, ligustr, lilak, morwa i trzmieliny
do żywotnych zalicza się tylko nasiona zdrowe, niezależnie od póry wykonania oceny.
8.10. Dla każdego powtórzenia osobno określa się procentowy udział liczby nasion
żywotnych (zdolnych do skiełkowania) w ogólnej liczbie 100 lub 50 nasion wziętych do
krojenia. Dla całej próbki badanych nasion oblicza się przeciętną żywotność (Zd), jako
średnią arytmetyczną z 4 lub 3 powtórzeń, wg następującego wzoru:
14
w którym:
z1 z2 z3 z4
- procentowy udział żywotnych nasion w kolejnych powtórzeniach.
8.11. Specyficznym rodzajem oceny żywotności jest badanie przydatności nasion do
wysiewu przed osiągnięciem przez nie pełnej dojrzałości - ,,na zielono". Polega ono na
śledzeniu postępów dojrzewania i uchwycenia właściwego momentu wysiewu. Zewnętrznym
objawem takiej dojrzałości jest osiągnięcie przez nasiona normalnej wielkości, odpowiedniej
dla danego gatunku, oraz początek zanikania chlorofilu w okrywach nasiennych, które są
jeszcze jasnozielone. Przekrój przez nasiono służy natomiast do oceny rozwoju

anatomicznego zarodka oraz konsystencji tkanek. Nasiona powinny mieć całkowicie
wykształcony zarodek (rys. 13), ale tkanki zarodka i bielma powinny znajdować się jeszcze w
fazach dojrzałości „mlecznej", tzn. powinny mieć konsystencję zagęszczonego płynu
(rozmazywać się w palcach). U takich gatunków z grupy C, jak np. jesion, u których zarodek
osiąga pełną wielkość dopiero w trakcie stratyfikacji ciepłej, przed wysiewem ,,na zielono"
zarodek może mieć niepełną długość - ok. 1/2 długości bielma (rys. 14).
8.12. Ocena postępów stratyfikacji u niektórych gatunków z grupy C polega na określeniu
proporcji pomiędzy zarodkiem a bielmem. Po skutecznej stratyfikacji zarodek powinien być
wyrośnięty na co najmniej 7 5 % długości bielma.
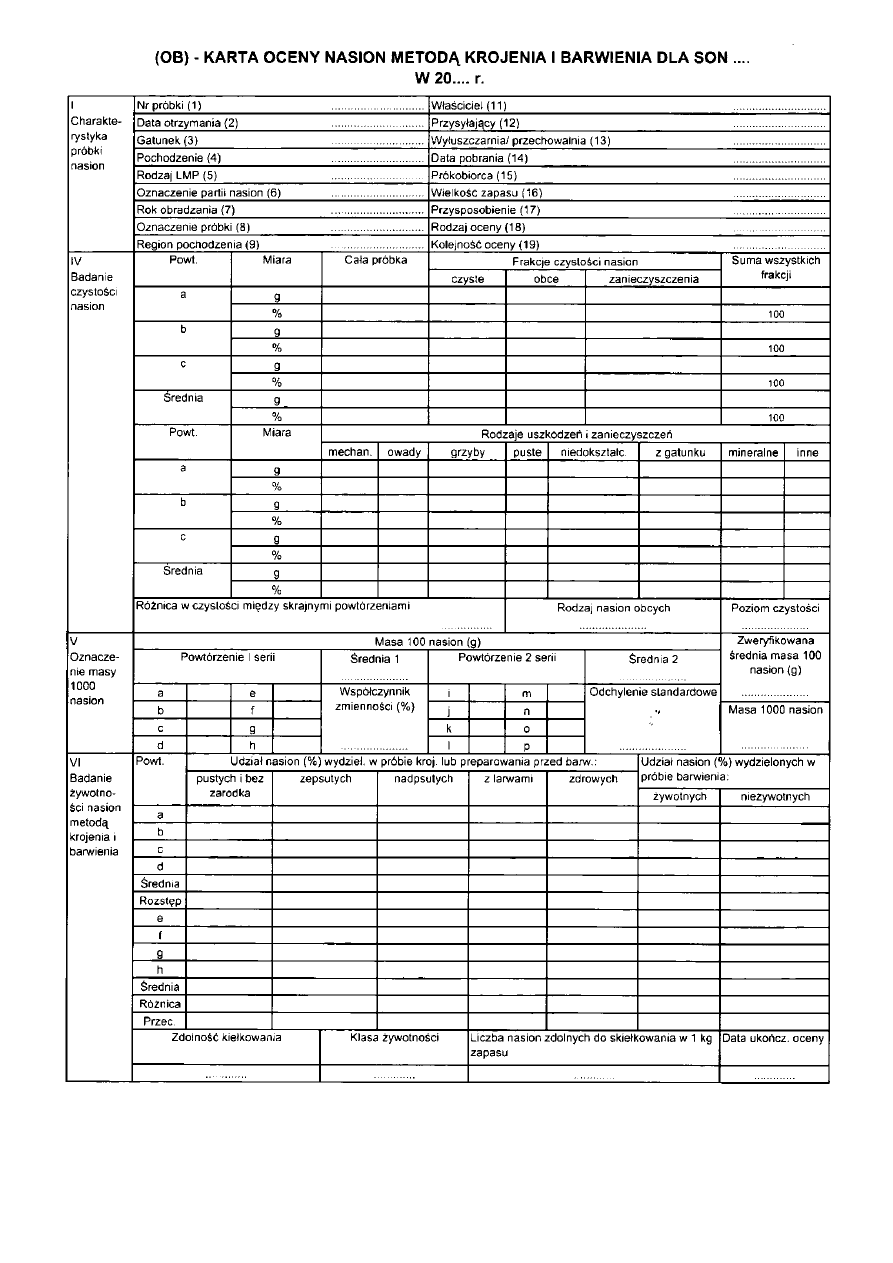
8.13. Wyniki oceny terenowej, prowadzonej przez pracowników nadleśnictw, powinny być
zestawiane i archiwizowane w specjalnych formularzach badania żywotności nasion. Wzór
takiego formularza nazwanego „Kartą terenowej oceny nasion metodą krojenia",
przedstawiono na rysunku 15. W przypadku prowadzenia badań pełnych wypełnia się
wszystkie cztery działy formularza, natomiast w dość częstym przypadku badania samej
żywotności - tylko cześć I i IV.
9. Określenie wartości siewnej nasion i ustalenie normy wysiewu.
9.1. Syntetycznym wskaźnikiem wartości siewnej nasion jest liczba nasion zdolnych do
skiełkowania (Lk
) w 1 kg zapasu materiału siewnego:
15
w którym:
Cz-
czystość plonu (w % ) ,
Zd-
żywotność (w % ) ,
Mt -
masa 1000 nasion (w g).
Wskaźnik ten jest głównym wyznacznikiem normy wysiewu.
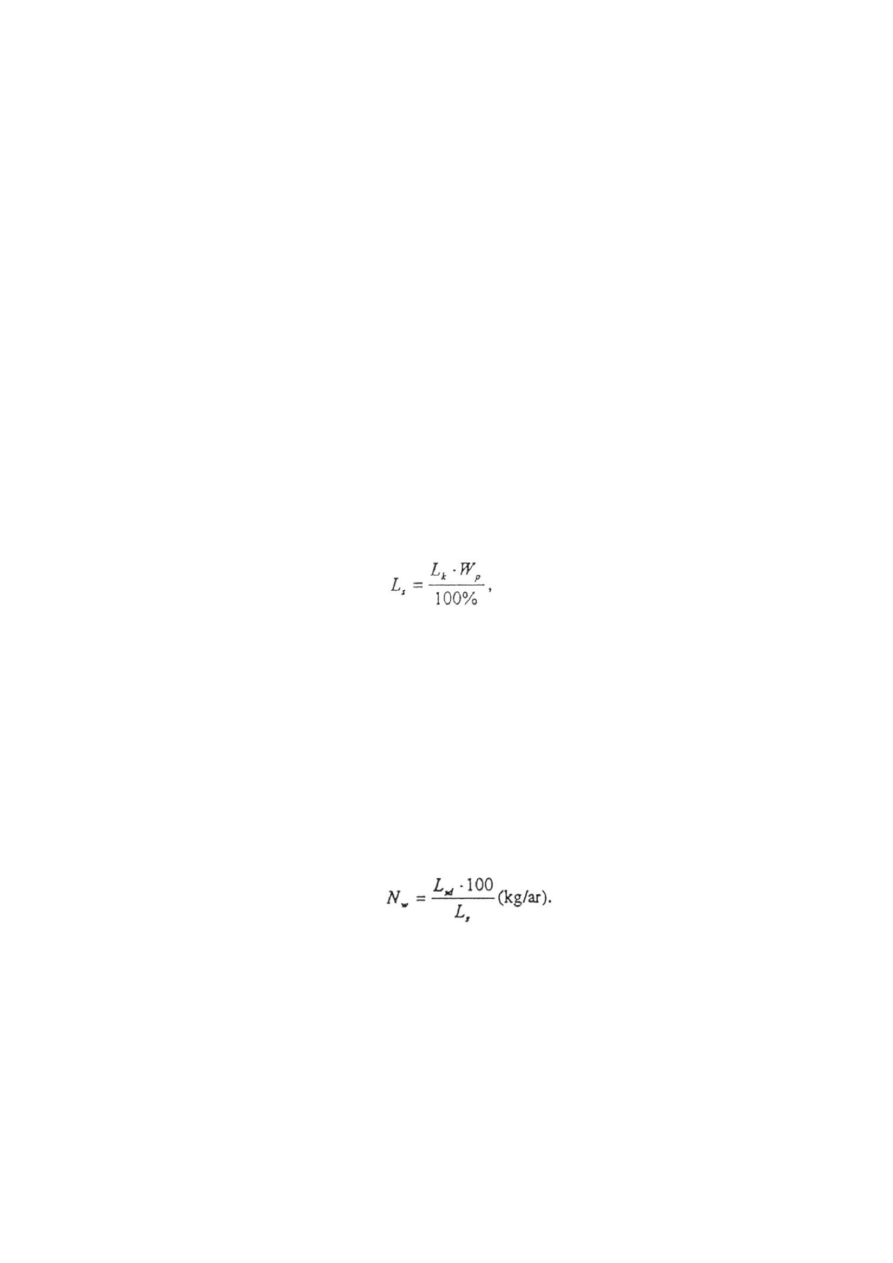
9.2. Wartość siewna nasion może być określona precyzyjnie tylko wtedy, gdy w trakcie oceny
nasion wykonano pełną analizę i oznaczono rzeczywistą czystość plonu (nasion) i masę 1000
nasion. Jeśli w badaniach terenowych lub w ocenie nasion stratyfikowanych prowadzonej
przez SON określono tylko żywotność nasion, a nie można było wyznaczyć pozostałych
dwóch charakterystyk, to do obliczenia wartości siewnej należy przyjąć średnią czystość (Cż)
i masę 1000 nasion (M
t
)
z tabeli 3. W tabeli tej, dla nasion 63 gatunków drzew i krzewów
zestawiono przeciętne wartości, wyliczone na podstawie wyników kilkunastoletnich badań
Stacji Oceny Nasion IBL. Obliczona w ten sposób wartość siewna jest tylko wskaźnikiem
przybliżonym.
9.3. Normę wysiewu w szkółce kalkuluje się na podstawie hipotetycznej liczby siewek (Lg),
które skiełkują w warunkach terenowych po wysiewie 1 kg nasion. Otrzymuje się ją
redukując wartość siewną nasion (Lk) o wydajność polową siewek ( Wp), według wzoru:
w którym:
L
k
-
liczba nasion zdolnych do skiełkowania w 1 kg zapasu (szt),
W
p
-
wydajność siewek osiągana w warunkach gospodarczych (w % ) .
Liczba nasion zdolnych do skiełkowania w 1 kg zapasu (Lk) podawana jest we
wszystkich atestach oceny nasion wydawanych przez SON. Norma wysiewu (Nw) zależeć
będzie od docelowej liczby siewek jaką chcemy otrzymać z 1 m
2
powierzchni siewnej (Lsd)
Tabela 3 podaje polowe wydajności siewek w przedziałach odpowiednich dla nasion
każdego gatunku. Z każdego przedziału należy wybrać wartość odpowiednią do oceny
warunków, w których będzie stosowany siew. Jeśli będzie zastosowany w bardzo dobrych
warunkach szkółki, to należy wybrać wartość maksymalną, a jeśli w złych - to minimalną.
16
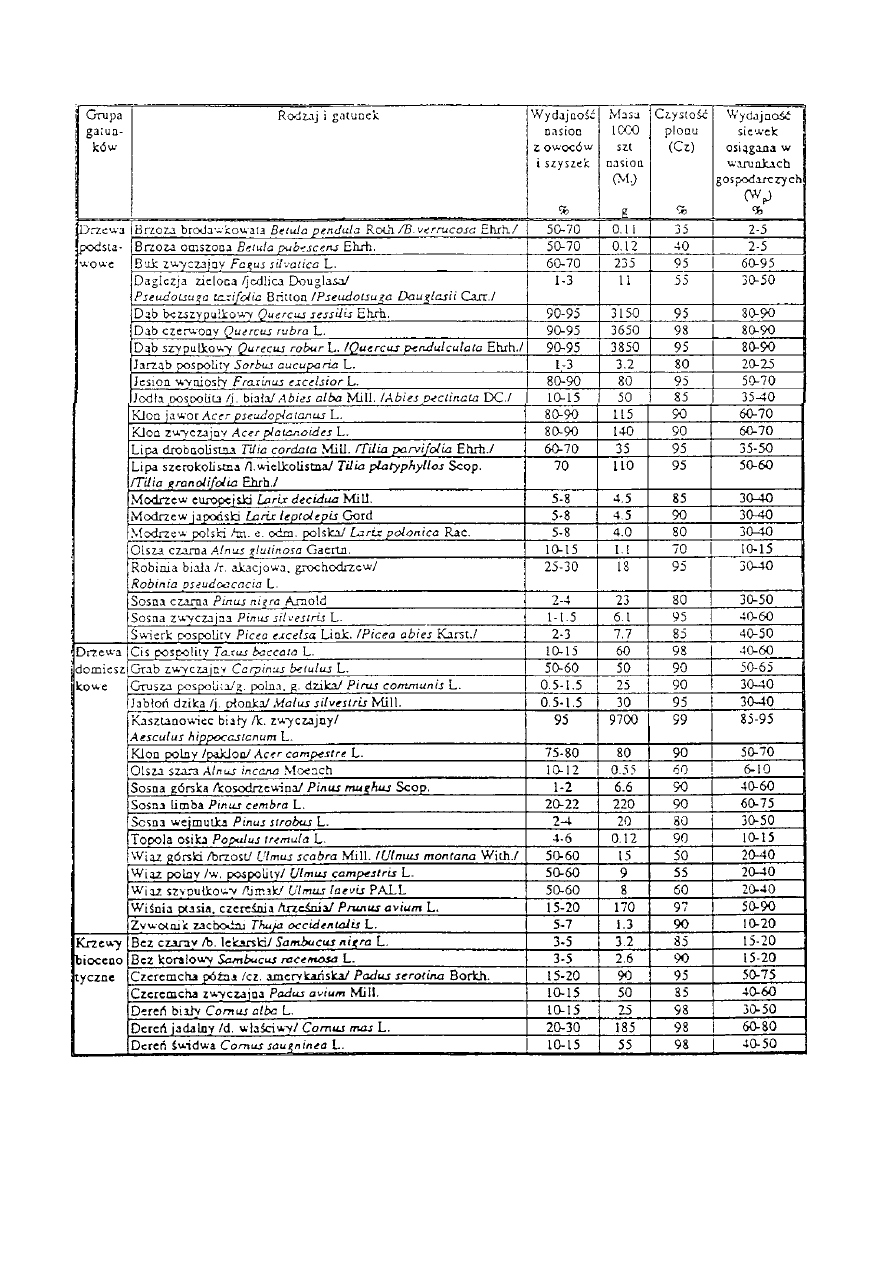
T a b e l a 3. W ł a ś c i w o ś c i siewne nasion d r z e w i k r z e w ó w leśnych (przeciętne z wielu lat obserwacji).
19
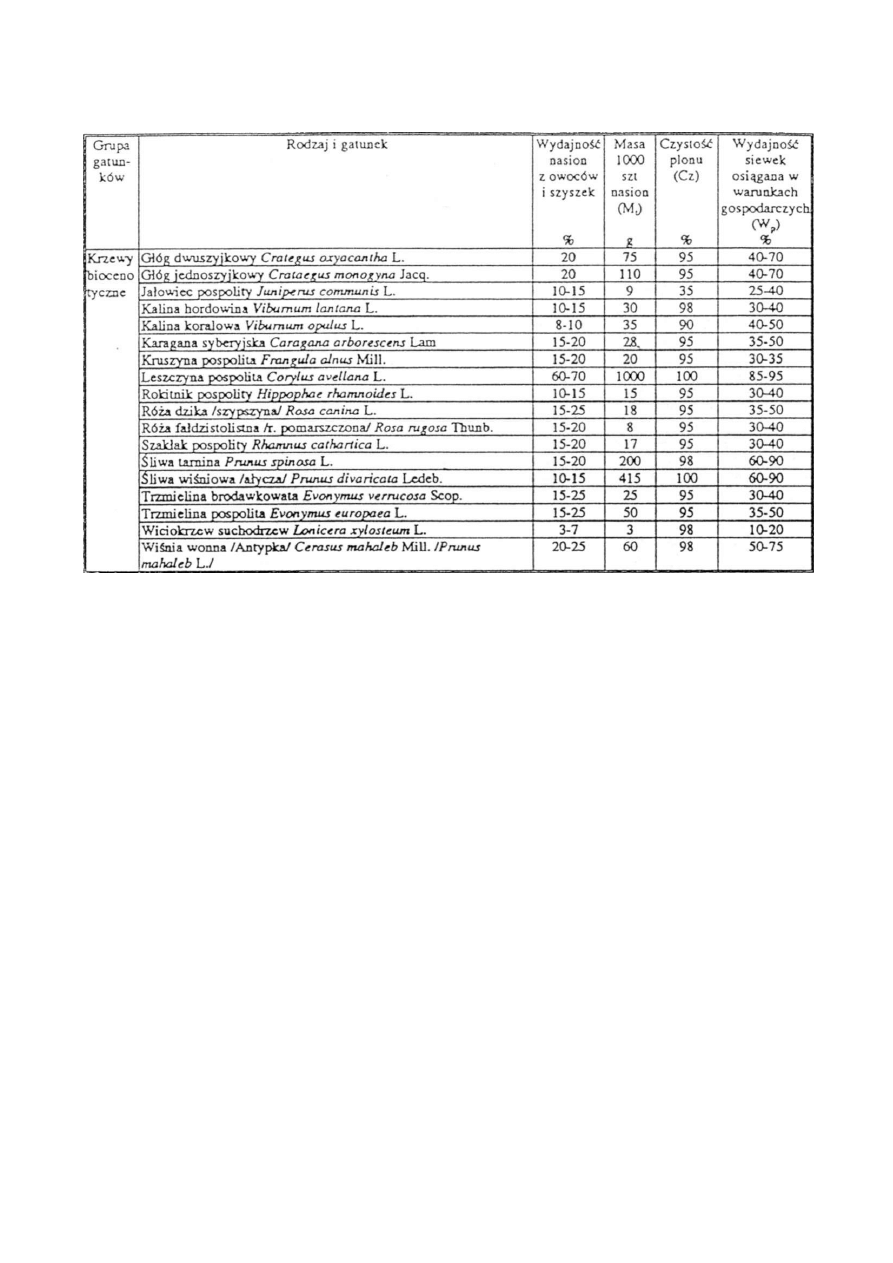
T a b e l a 3 . c d .
20

K A R T A T E R E N O W E J O C E N Y N A S I O N M E T O D Ą K R O J E N I A
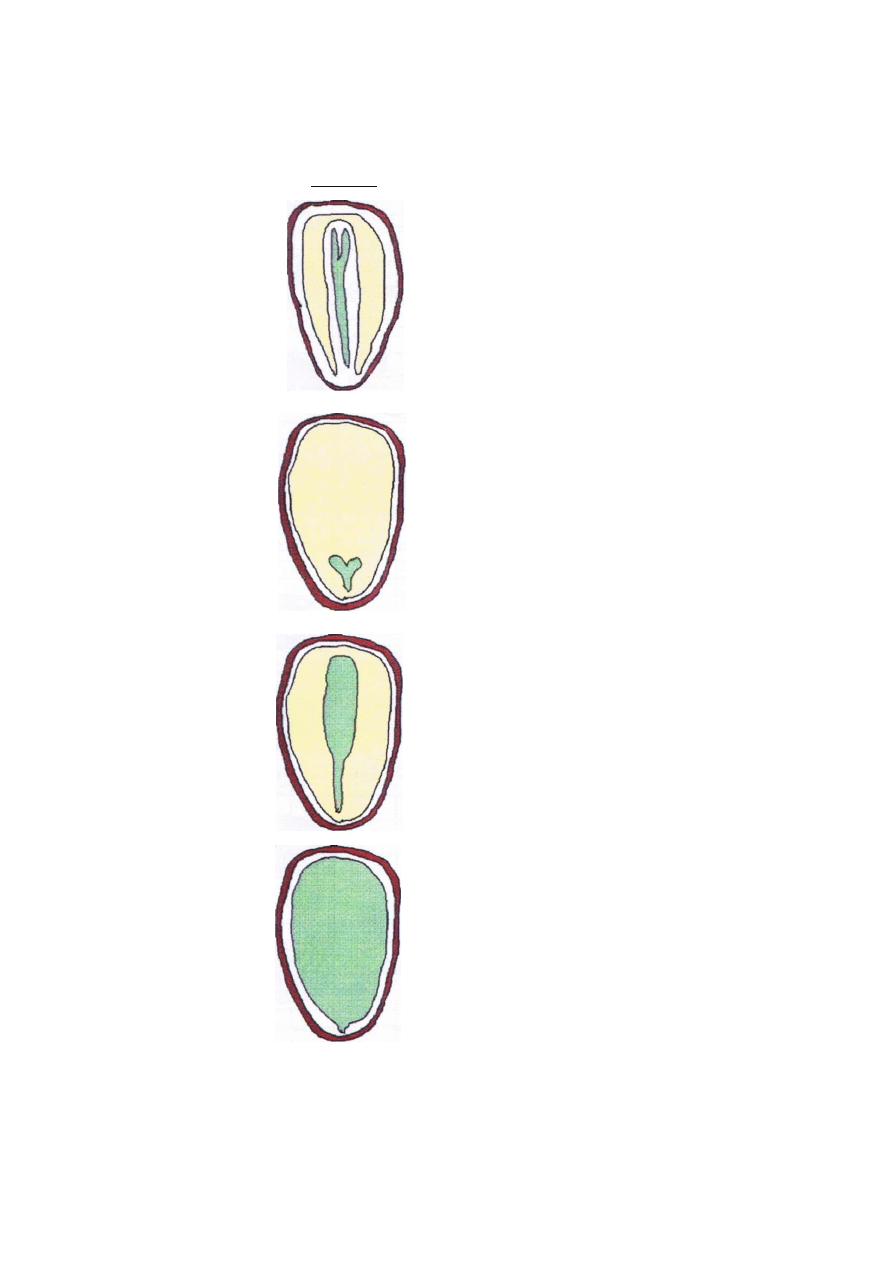
Tabela 1. Cztery typy nasion drzew i krzewów leśnych, wydzielone na podstawie różnic w
budowie anatomicznej.
Typ
Przekrój
podłużny
Gatunki
Iglaste gatunki drzew i krzewów.
(Całe wnętrze nasiona wypełnia prabielmo, w
centralnej części kanał zarodkowy z zarodkiem.
U normalnie wykształconych nasion zarodek jest
wyrośnięty na co najmniej 75% dł. kanału zarod
kowego).
B
Kaliny, ostrokrzew, porzeczki, suchodrzewie
i śnieguliczka.
(Całe wnętrze nasiona wypełnia bielmo. W peryfe
ryjnej części bielma, najczęściej w węższym końcu
nasienia, znajduje się bardzo mały zarodek, kilka
krotnie mniejszy od całego bielma).
Berberysy, bzy, derenie, jesiony, kruszyna, li-
gustr, lilak, lipy, morwa, oliwnik, rokitnik, su
mak, szakłak i trzmieliny.
(Całe wnętrze nasiona wypełnia bielmo. Zarodek
zajmuje centralne położenie w bielmie. U całko
wicie wykształconych nasion zarodek jest wyroś
nięty na co najmniej 75% długości bielma).
D
Pozostałe gatunki drzew i krzewów liściastych
takich jak: buk, brzozy, czeremchy, dęby, głogi,
grab, grusz, jabłoń, jarzęby, karagana, kasztano
wiec, klony, leszczyna, olsze, orzechy, pigwowce,
robinia, róże, śliwy, świdośliwa, topole, wiązy,
wierzby i wiśnie.
(Grupa nasion, które nie posiadają bielma. U cał
kowicie wykształconych nasion całe wnętrze wy
pełniają liścienie dużego zarodka z niewielkim
zawiązkiem korzonka).
- okrywa nasienna
- bielmo lub prabielmo
- zarodek
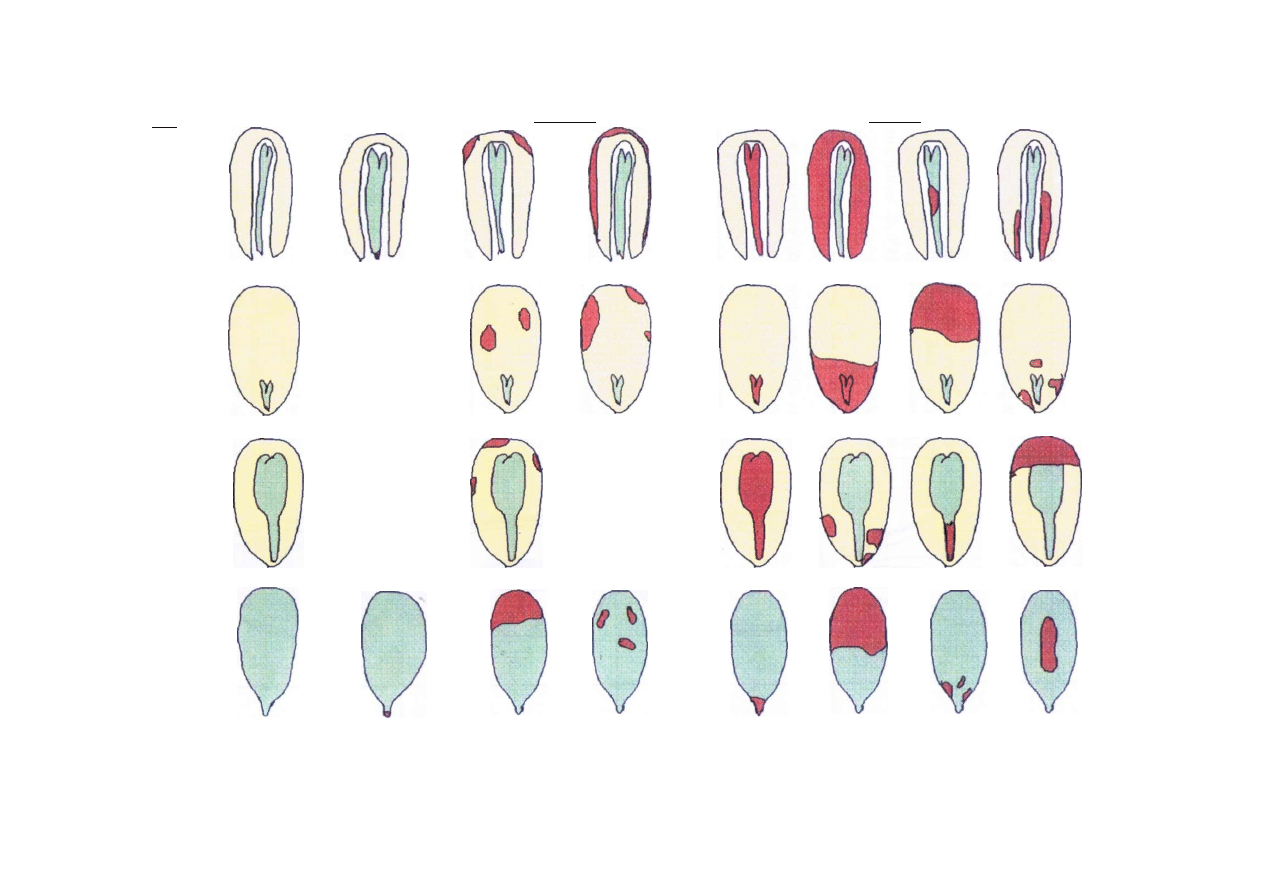
Tabela 2. Nasiona o różnym stopniu zdrowotności, określonym na podstawie topografii i obrazu zamierania tkanek (kolor brązowy) zarodka i
bielma.
Typ
Zdrowe
Nadpsute
Zepsute
B
D
Opis
Na przekroju brak ciemnych plamek
będących wynikiem zmian nekroty
cznych - martwej tkanki. U nasion
grupy A i D dopuszcza się niewiel
kie uszkodzenia w czapeczce korze
niowej
Na liścieniach zarodka (grupa D) lub
bielmie (grupa A. B i C) dopuszczalne
nekrotyczne zmiany (ciemne plamki)
nie sięgające korzonka i zajmujące nie
więcej niż
1
/3 powierzchni przekroju
Całkowicie zgniłe (przebarwione), u których zmiany nekrotyczne
(ciemne plamy) znajdują się w bezpośrednim sąsiedztwie
korzonka lub zajmują więcej niż 1/3 powierzchni przekroju nasiona
Wyszukiwarka
Podobne podstrony:
nasiona oznaczanie zywotnosci metoda ki
Oznaczanie żywotności komórek metodą MTT
Oznaczanie wilgotności metodą suszarkową
Woltamperometryczne oznaczanie jonów?2 metodą wielokrotnego dodatku wzorca
22 Oznaczanie wilgotnościcałkowitej metodą wagową
Oznaczanie fenoli metoda z 4 am Nieznany
oznaczanie tlenu metoda Winklera
OZNACZANIE STĘŻENIA?NOLU METODĄ MIARECZKOWANIA KONDUKTOMETRYCZNEGO
Oznaczanie chlorków metodą miareczkową Mohra
13 met Mohra, Oznaczanie chlorków metodą Mohra
7 - Oznaczanie spoistosci metoda rozmakania, Inżynieria środowiska, inż, Semestr IV, Mechanika grun
Oznaczanie składu metodami chromatografii gazowej 1
0 Oznaczenie bialek metoda Bradforda, biotechnologia inż, sem3, BKiIG, laborki, materiały
Ilościowe oznaczanie miedzi metodą jodometryczną
Oznaczenie gliceryny metodą refraktometryczną, inżynieria ochrony środowiska kalisz
Oznaczanie składu metodami chromatografii gazowej, AKADEMIA GÓRNICZO - HUTNICZA
więcej podobnych podstron