
7
Projekt „Uruchomienie kierunku studiów: Biotechnologia, specjalność: Biotechnologia Medyczna na Uniwersytecie Medycznym w
Łodzi” współfinansowany ze środków Unii Europejskiej, z Europejskiego Funduszu Społecznego, w ramach Programu Operacyjnego
Kapitał Ludzki.
Uniwersytet Medyczny w Łodzi
Wydział Nauk Biomedycznych i Kształcenia Podyplomowego
Materiały dydaktyczne dla studentów kierunku
BIOTECHNOLOGIA
specjalność
BIOTECHNOLOGIA MEDYCZNA
MOLEKULARNE PODSTAWY
ENDOKRYNOLOGII
Kamila Domińska
Tomasz Ochędalski
WSTĘP
Prezentowany skrypt stanowi zarys tematyki wykładów dla przedmiotu
elektywnego Molekularne Podstawy Endokrynologii, prowadzonych na Wydziale
Nauk Biomedycznych i Kształcenia Podyplomowego Uniwersytetu Medycznego
w Łodzi, na kierunku Biotechnologia. Skrypt został podzielony na dwie odrębne
części. W ramach części pierwszej omówiono budowę hormonów oraz podstawowe
mechanizmy ich działania na poziomie biochemicznym. Druga część stanowi
prezentację hormonów jako molekuł kontrolujących zarówno fizyczność jak i umysł
człowieka. Celem wykładów jest ułatwienie zrozumienia i przyswojenia
podstawowych informacji z zakresu endokrynologii a także uświadomienie
złożoności i szerokiego wachlarza funkcji cząsteczek hormonalnych. Niniejszy
skrypt, zawiera szeroką gamę rycin mających na celu przejrzystą prezentację
omawianych zagadnień. Serdecznie zapraszamy do zapoznania się z opracowaniem.
Autorzy

8
LISTA SKRÓTÓW:
5-HT3 – receptor 5-hydroksytryptaminowy typu 3
AAS - steroidy androgenno-anaboliczne
Ach – acetylocholina
AChR – receptor acetylocholinowy typu N
ACTH – adrenokortykotropina
ADAM - zespół niedoboru androgenów
ADH - hormon antydiuretyczny
AF-1 - domena A/B receptora jądrowego
AF-2 – fragment domeny E receptora jądrowego
Akt – kinaza Akt
ARs – receptory androgenowe
ART – techniki rozrodu wspomaganego
cAMP - cykliczny adenozynomonofosforan
CBG - globulina wiążąca kortykosteroidy (transkortyna)
cGMP - cykliczny guanozynomonofosforan
CGRPs - peptydy związane z genem kalcytoniny
CHAM - zespół zmian hormonalnych u starzejących się mężczyzn
CRF - kortkoliberyna
CRLR - receptor podobny do kalcytoniny
DAG - diacyloglicerol
DBD - domena C receptora jądrowego
DBP - białko wiążące witaminę D
DHEA - dehydroepiandrosteron
DHEAS - siarczan dehydroepiandrosteronu
DHT - 5α-dihydrotestosteron
EGF - epidermalny czynnik wzrostu
EPO - erytropoetyna
EPT – systemowa terapia estrogenowo-progestagenową
ET - systemowa terapia estrogenowa
FSH - hormon folikulotropowy (folitropina)
GDP – guanozynodifosforan
GH – hormon wzrostu
GHRH - somatoliberna
GPCR – receptory związane z białkami G
GTP - guanozynotrifosforan
HTZ – hormonalna terapia zastępcza
IGFs - insulinopodobne czynniki wzrostu
IP
3
- trifosforan inozytolu

9
IR – sekwencje powtórzone
KGF - czynnik wzrostowy keratynocytów
LBD - domena E recepora jądrowego
LH - hormon luteinizujący (lutropina)
MAPK - kinazy MAP
MGFs - mechaniczne czynniki wzrostu
MHT - menopauzalna terapia hormonalna
MSH - hormon stymulujący melanocyty (metanotropina)
NLS - sygnał lokalizacji jądrowej
NR - rceptor jądrowy
PADAM - zespół częściowego niedoboru androgenów u starzejących się mężczyzn
PGE2 - prostaglandyna
PKA - kinaza białkowa A
PKC - kinaza białkowa C
PRL – prolaktyna
PTH – parathormon
PTHrP - parathormon
PTKs – kinazy tyrozynowe
RAA - układu renina-angiotensyna-aldosteron
RAMP - białka modyfikujące aktywność receptora
RBP - białko wiążące retinol
REX - receptor retinowy
rhGH - syntetyczny hormon wzrostu
SERMs - selektywne modulatory receptorów estrogenowych
SHBG - globulina wiążąca hormony płciowe
SHGB - hormony płciowe
SSR - powtórzenia proste sekwencji
SST - somatostatyna
STH - somatotropina
T3 - trójjodotyronina
T4 - tetrajodotyronina (tyroksyna)
TBG - globulina wiążąca tyroksynę
TFs – czynniki transkrypcyjne
TSH - tyreotropina
TTR - transtyretyna
WADA - Światowa Komisja Antydopingowa
WHO - Światowa Organizacja Zdrowia

10
SPIS TREŚCI
CZĘŚĆ I
I.
Hormony - molekuły informacyjne..................................................................12
Temat1: Klasyfikacja hormonów.........................................................12
Temat 2: Gruczoły wydzielania wewnętrznego...................................16
Temat 3: Kontrola wydzielania hormonów..........................................17
Temat 4: Transport hormonów.............................................................18
II.
Receptorowe mechanizmy działania hormonów..............................................20
Temat 5: Transdukcja sygnału hormonalnego.....................................20
Temat 6: Receptory związane z kanałami jonowymi...........................21
Temat 7: Receptory związane z białkami G.........................................23
Temat 8: Receptory związane z enzymami..........................................25
Temat 9: Receptory jądrowe................................................................27
Temat 10: Rodzaje interakcji ligand-receptor......................................30
Temat 11: Regulacja siły działania hormonu na poziomie receptora...31
III.
Molekularne mechanizmy działania hormonów steroidowych........................33
Temat 12: Mechanizm genomowy i pozagenomowy...........................33
CZĘŚĆ II
IV.
Hormony - molekuły kontrolujące nasze emocje.............................................36
Temat 13: Hormony szczęścia i miłości...............................................36
Temat 14: Hormony stresu i agresji.....................................................38
V.
Hormony - molekuły odpowiedzialne za „wieczną młodości”........................40
Temat 15: Zmiany hormonalne związane z przekwitaniem i
starzeniem.............................................................................................40
Temat 16: Hormony endogenne - sposób na wieczną młodość?.........43
VI.
Hormony – molekuły wpływające na wydolność fizyczną..............................46
Temat 17: Doping - substancje zabronione w sporcie..........................46
VII.
Hormony – molekuły kontrolujące łaknienie...................................................49
Temat 18: Hormony głodu i sytości.....................................................49
VIII.
Hormony – molekuły regulujące układ sercowo naczyniowy.........................51
Temat 19: Hormony a układ krążenia..................................................51
IX.
Hormony – molekuły odpowiedzialne za stan kości.......................................54.

11
Temat 20: Hormony a proces kości otworzenia...................................54
X.
Hormony – molekuły odpowiedzialne za płodność.........................................56
Temat 21: Niepłodność – istotny problem społeczny..........................56
Temat 22: Kobieca niepłodność z przyczyn hormonalnych.................58
Temat 23: Męska niepłodność z przyczyn hormonalnych...................60
Temat 24: Techniki rozrodu wspomaganego.......................................62
Temat 25: Antykoncepcja hormonalna................................................64
XI.
Hormony – molekuły istotne dla medycyny estetycznej..................................66
Temat 26: Hormony a kondycja skóry.................................................66
Temat 27: Hormony a wzrost i kondycja włosów................................68
Temat 28: Fitohormony w kosmetologii..............................................71
XII.
Hormony – molekuły zaangażowane w proces nowotworzeni........................73
Temat 29: Od hormonozależności do hormonooporności...................73
Temat 30: Hormonoterapia w leczeniu nowotworów.........................76

12
CZĘŚĆ I
Hormony - molekuły informacyjne
Temat 1: Klasyfikacja hormonów
Na przestrzeni lat definicja hormonu uległa istotnej modyfikacji, znacznie
rozszerzając zakres tego pojęcia. Dziś wiemy, że hormony wytwarzane są nie tylko
przez gruczoły dokrewne ale praktycznie przez wszystkie narządy naszego
organizmu. Szacuje się, że obecnie znanych jest około 100 różnych hormonów.
Wśród nich znajdują się hormony działające lokalnie, paracelularnie oraz hormony
oddziaływujące na całe narządy lub tkanki.
HORMON - substancja chemiczna, wytwarzana przez narządy (gruczoły), tkanki
albo wyspecjalizowane komórki, wykazująca działanie systemowe lub miejscowe
obserwowane przy stężeniu 10
-12
– 10
-9
M
W związku z dużą różnorodnością związków zakwalifikowanych do grupy
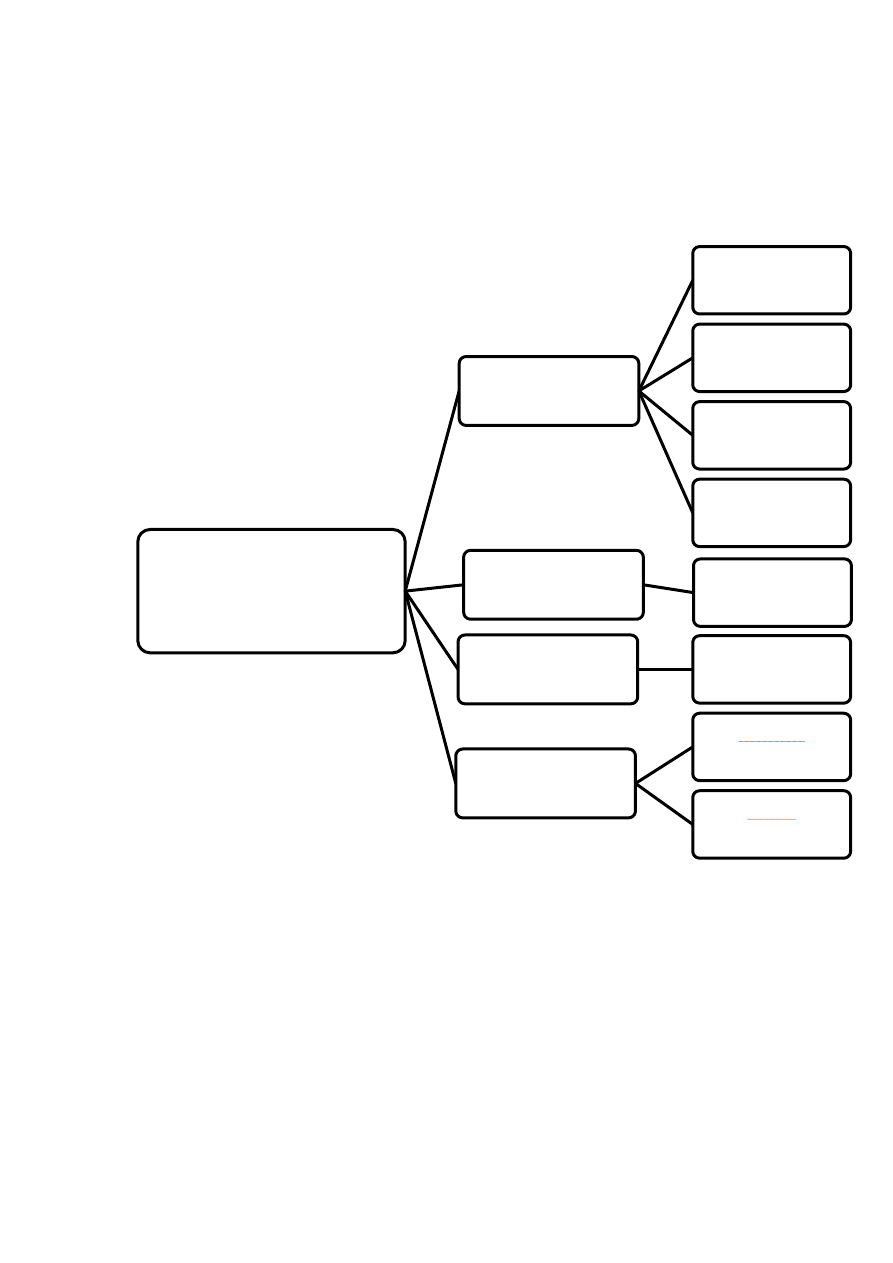
hormonów, można dokonać ich podziału w zależności od następujących kryteriów:
budowy chemicznej (Ryc. 1)
miejsca powstawania (Ryc. 2)
mechanizmu działania (Ryc. 3)
13
Rycina 1.
PODZIAŁ HORMONÓW
- ze względu na budowę chemiczną -
Hormony białkowe
białka
np. hormon wzrostu,
prolaktyna
polipeptydy
np. insulina, parathormon
peptydy
np. wazopresyna,
oksytocyna
pochodne peptydów
np. tyroksyna
Hormony
aminokwasowe
zmodyfikowane
aminokwasy
np. adrenalina
Hormony sterydowe
pochodne cholesterolu
np. testosteron, estradiol,
kortyzol, cholekalcyferol
Pochodne
kwasów tłuszczowych
eikozanoidy
np. prostaglandyny
retinoidy
np. witamina A
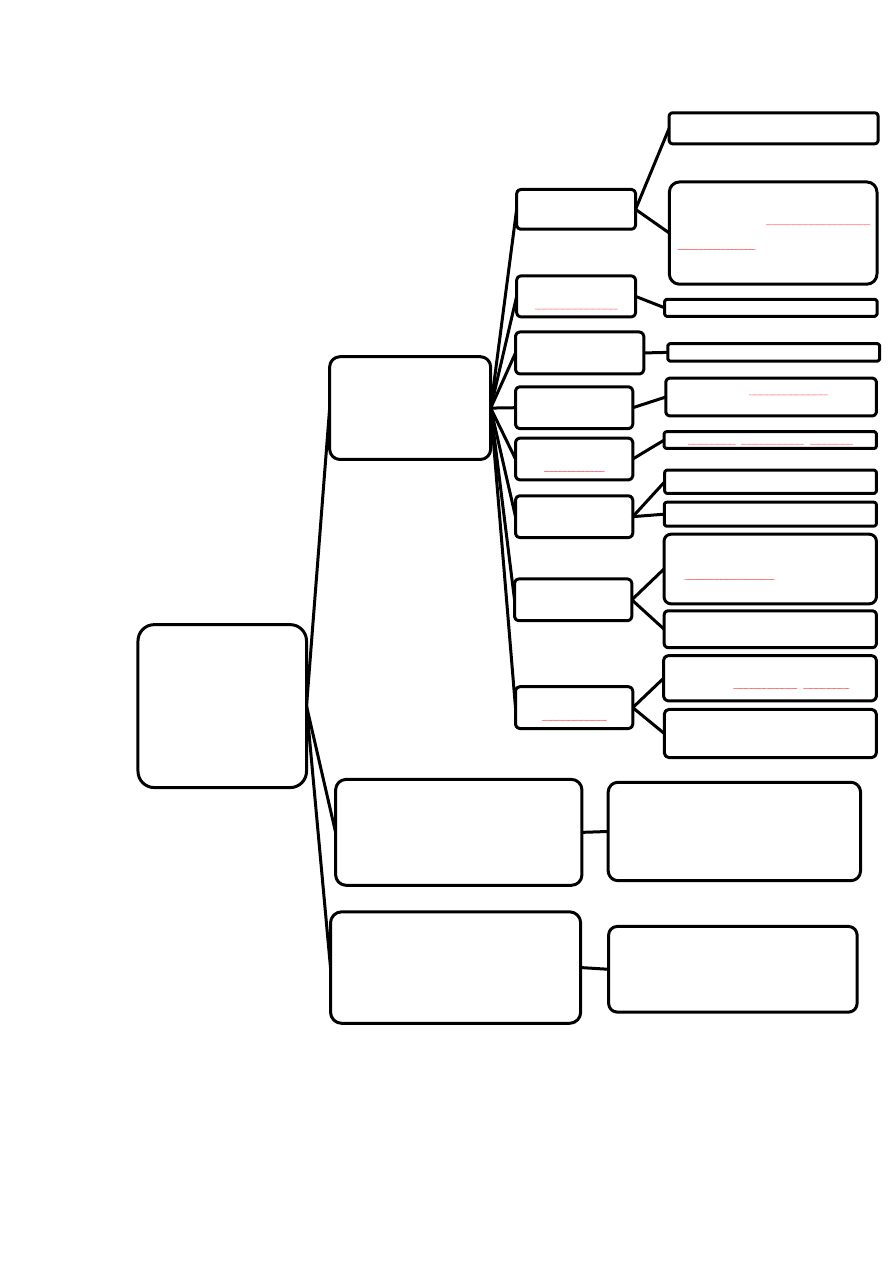
14
Rycina 2.
PODZIAŁ
HORMONÓW
-ze względu na miejsce
powstawania-
Hormony
gruczołowe
wydzielane przez
gruczoły dokrewne
Hormony
przysadkowe
płat tylny: wazopresyna (ADH),
oksytocyna
płat przedni: hormon wzrostu (GH),
prolaktyna (PRL), adrenokortykotropina
(ACTH), tyreotropina (TSH), h.
folikulotropowy (FSH), h. luteinizujący
(LH)
Hormon
szyszynkowy
melatonina (MSH)
Hormony
przytarczycowe
parathormon (PTH)
Hormony
tarczycowe
kalcytonina, trójjodotyronina (T3),
tyroksyna (T4)
Hormony
grasiczne
tymozyna, tymopoetyna, tymulina
Hormony
trzustkowe
komórki ß: insulina
komórki α: glukagon
Hormony
nadnerczowe
kora nadnerczy: glikokortykoidy (np.
kortyzol, kortykosteron, kortyzon),
mineralokortykoid (np. aldosteron),
androgeny
rdzeń nadnerczy: adrenalina, noradrenalina
Hormony
gonadowe
jajniki: estrogeny (np. estradiol, estron,
estriol) , progestageny, relaksyna
jądra: androgeny (np. testosteron,
androsteron)
Hormony tkankowe
wydzielane przez komórki
gruczołowe
gastryna, sekretyna, enterogastron, serotonina,
histamina, prostaglandyny
Neurohormony
wydzielane przez komórki
neurosekrecyjne układu nerwowego
wazopresyna, oksytocyna, acetylocholina,
melanotropina
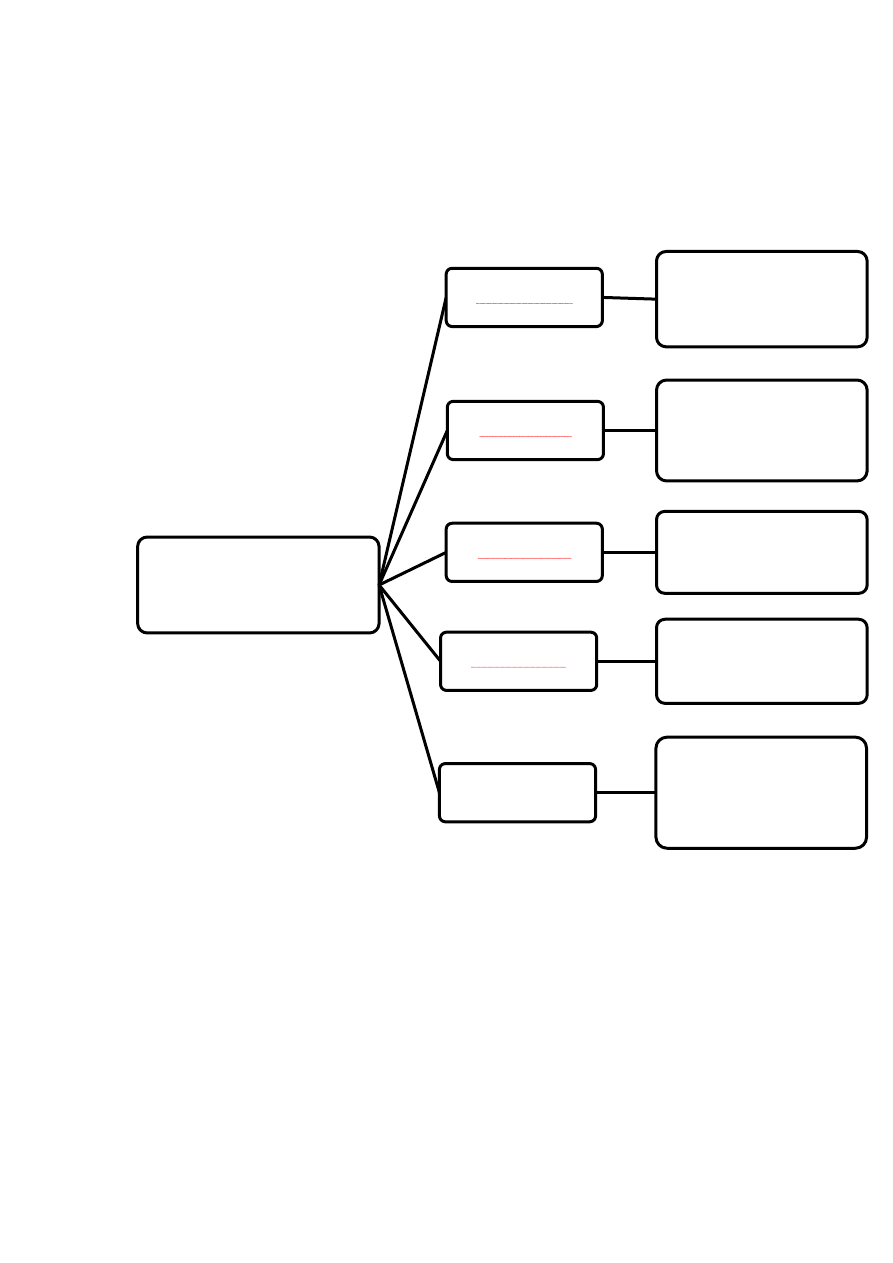
15
Rycina 3.
PODZIAŁ
HORMONÓW
- ze względu na mechanizm
działania-
Endokrynne
wydzielane bezpośrednio do krwi
i działające na odległe narządy
i tkanki
Parakrynne
wydzielane do płynów
międzykomórkowych
i działające na sąsiednie komórki
Autokrynne
wydzielane i działające
bezpośrednio na te same komórki
Intrakrynne
produkowane i działające w tej
samej komórce
Neuroendokrynne
wydzielane przez komórki
nerwowe bezpośrednio do krwi
i działające na odległe narządy
i tkanki

16
Hormony - molekuły informacyjne
Temat 2: Gruczoły wydzielania wewnętrznego
GRUCZOŁY DOKREWNE (inaczej gruczoły wydzielania wewnętrznego lub
gruczoły endokrynne) narządy zbudowane z tkanki nabłonkowo-gruczołowej
i łącznej, które wydzielają substancje - hormony (Ryc. 2) bezpośrednio do krwi,
chłonki lub płynu tankowego:
- przysadka (nadrzędny gruczoł wydzielniczy)
- szyszynka,
- gruczoł tarczowy,
- gruczoły przytarczyczne,
- trzustka,
- nadnercza,
- grasica,
- jądra i jajniki
oraz tzw. nieklasyczne gruczoły wydzielania wewnętrznego:
- podwzgórze
- nerki
- tkankę tłuszczową
- serce
Hormony dokrewne mogą być syntetyzowane w ostatecznej, aktywnej postaci
i natychmiast wydzielane do przestrzeni pozakomórkowych (np. hormony steroidowe)
lub magazynowane w komórkach w których są wytwarzane (np. aminy katecholowe).
Wiele znanych hormonów jest syntetyzowanych w postaci prekursorowej.
Nieaktywne prekursory poddawane są następnie konwersji do postaci aktywnej
hormonu (przez jeden lub kilka enzymów), bezpośrednio przed wydzieleniem (np.
insulina) lub dopiero w tkankach docelowych (np. 5α-dihydrotestosterone - DHT).

17
Hormony - molekuły informacyjne
Temat 3: Kontrola wydzielania hormonów
Wydzielanie hormonów, z powiązanego funkcjonalnie ale rozproszonego
w całym ciele systemu gruczołów dokrewnych, wymaga precyzyjnego sterowania,
które odbywa się na drodze:
NERWOWEJ – regulacja czynności dokrewnych przez ośrodki nerwowe części
współczulnej układu autonomicznego np. uwalnianie insuliny przez nerwy
cholinergiczne, uwalnianie amin katecholowych przez przedzwojowe nerwy
współczulne;
HORMONALNEJ –regulacja czynności dokrewnych polegająca na bezpośrednim
działaniu hormonów na gruczoły wydzielania wewnętrznego np. działanie
hormonów tropowych przysadki na podległe gruczoły dokrewne;
METABOLICZNEJ – regulacja czynności dokrewnych przez bezpośredni wpływ
substratów lub produktów metabolicznych np. wpływ jonów wapnia na
wydzielanie parathormonu, wpływ glukozy na uwalnianie insuliny.
Układ hormonalny funkcjonuje na zasadzie zamkniętych pętli regulacyjnych,
które działają zgodnie z ujemnym lub dodatnim sprzężeniem zwrotnym.
W warunkach fizjologicznych najczęściej mamy do czynienia z ujemnym
sprzężeniem zwrotnym, natomiast sprzężenie dodatnie dotyczy zwykle, stanów
patologicznych.

18
Hormony - molekuły informacyjne
Temat 4: Transport hormonów
Hormony hydrofilowe, rozpuszczalne w osoczu, nie wymagają białek
transportowych (np. hormon wzrostu). Hormony te krążą we krwi w postaci wolnej,
biologicznie aktywnej i charakteryzują się krótkim okresem półtrwania.
W wiązaniu i transporcie hormonów drobnocząsteczkowych (np. hormony
tarczycy, hormony sterydowe), biorą udział specyficzne białka o wysokim
powinowactwie do poszczególnych hormonów (Ryc. 4) oraz białka mniej
specyficzne np. albuminy. Funkcja białek wiążących to przede wszystkim:
przenoszenie hydrofobowych, nierozpuszczalnych w wodzie cząsteczek
hormonu,
zabezpieczenie hormonu przed szybkim metabolizmem (wydłużenie czasu
półtrwania),
utrzymanie we krwi rezerwowej buforującej puli hormonu,
zapewnienie równomiernego wysycenia tkanki docelowej hormonem dzięki
stopniowemu jego uwalnianiu.
FRAKCJA BIODOSTĘPNA - czyli hormony znajdujące się w krążeniu
systemowym (zarówno hormony niezwiązane tzw. FRAKCJA WOLNA jak
i związane z białkami).
FRAKCJA BIOAKTYWNA - czyli pula hormonów wywołująca efekt biologiczny
na poziomie komórkowym.
Efekt biologiczny hormonu zależy nie tylko od stężenia formy biodostępnej lecz
także od ilości i potencjalnej aktywności receptorów dla danego hormon!
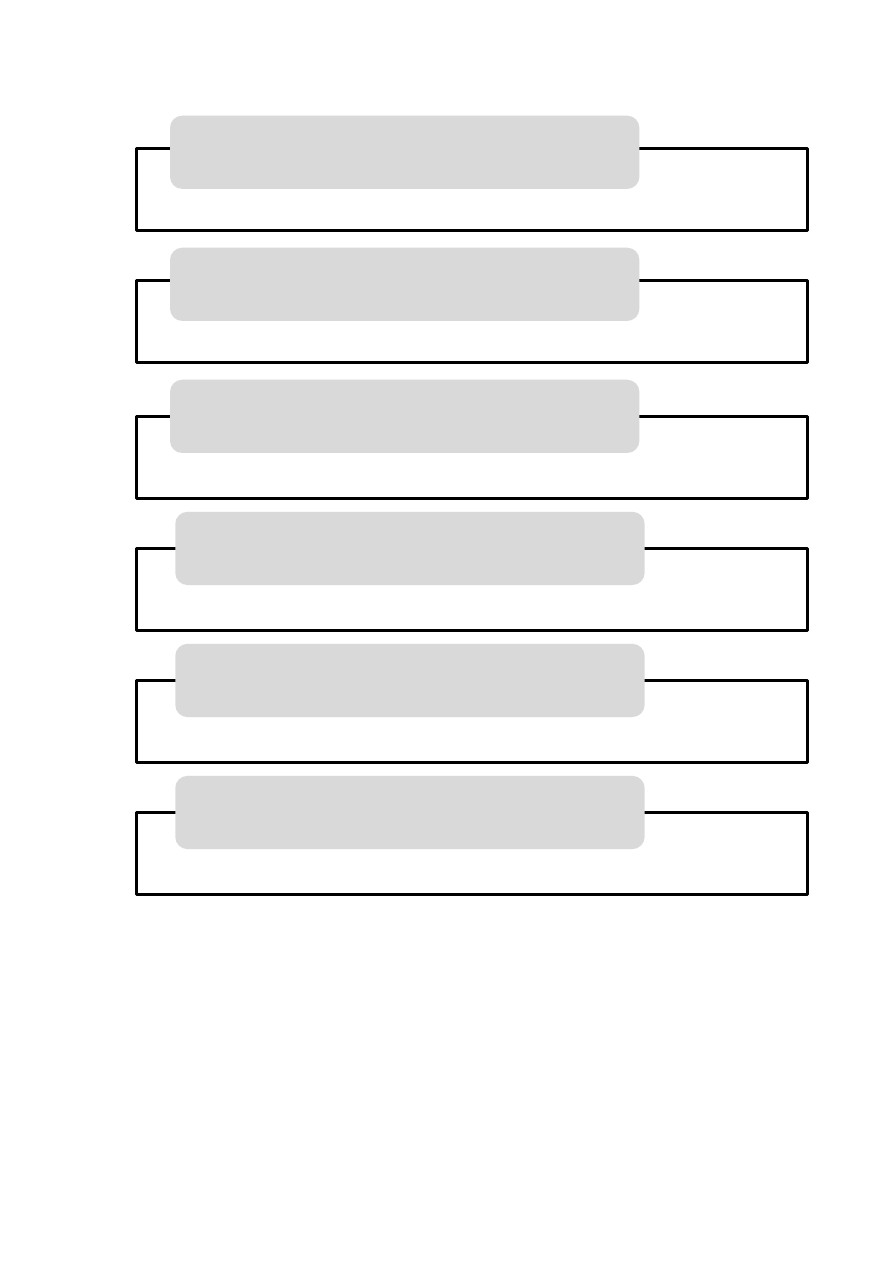
19
Rycina 4. Białka transportowe hormonów
• transportuje 70% T
4
jak i T
3
TBG
ang. thyroxine binding globulin
pol. globulina wiążąca tyroksynę
• jest białkiem transportowym dla hormonów tarczycy oraz retinolu
TTR
ang. transtiretin
pol. transtyretyną
• wiąże z dużym powinowactwem retinol oraz kwas retinowy
RBP
ang. retinol-binding protein
pol. białko wiążące retinol
• jest głównym białkiem wiążącym witaminę D
DBP
ang. vitamin D binding protein
pol. białko wiążące witaminę D
• transportuje hormony kory nadnerczy
CBG
ang. corticosteroid binding globulin
pol. globulina wiążąca kortykosteroidy (transkortyna)
• jest białkiem transportowym dla steroidów płciowych np. testosteronu
SHBG ang. sex hormone binding globuline
pol. globulina wiążąca hormony płciowe
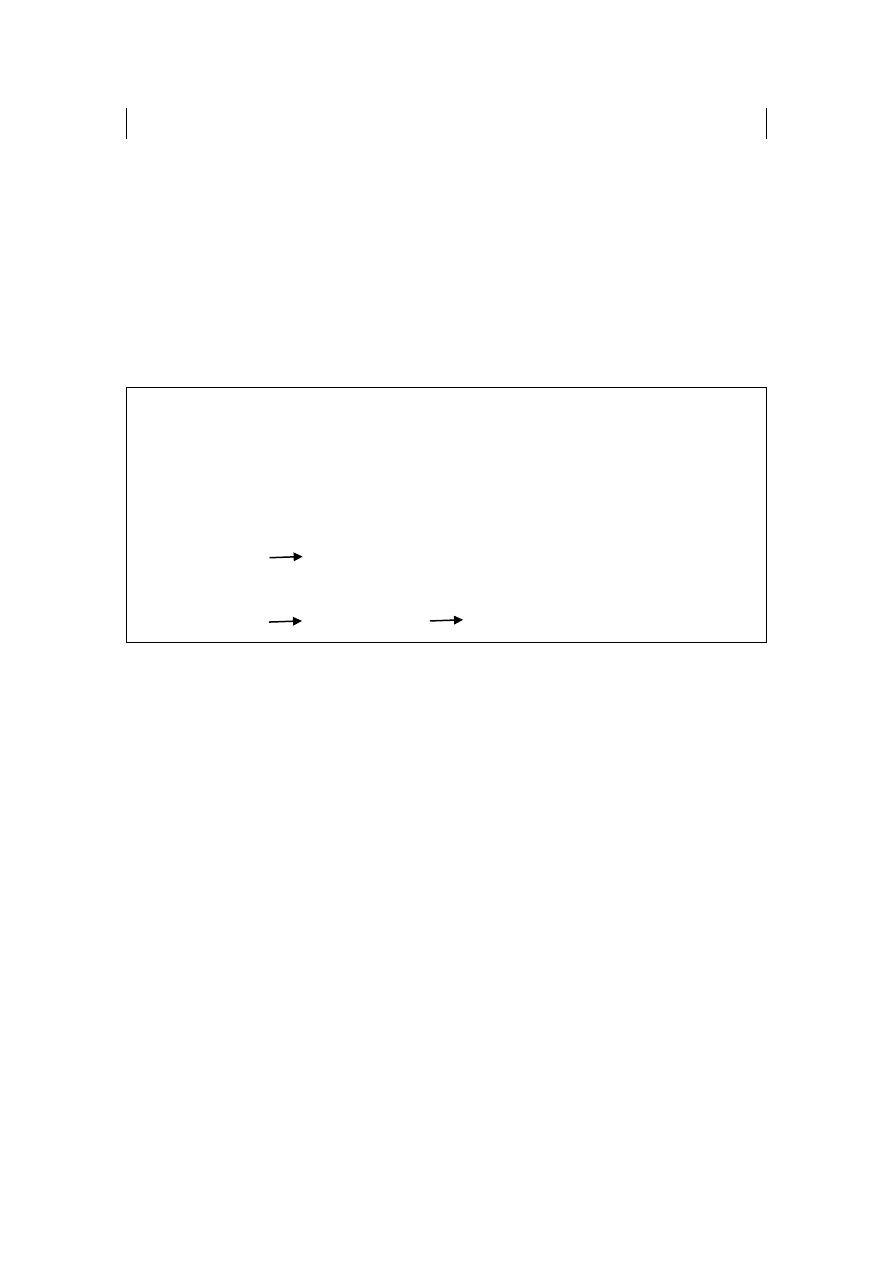
20
Receptorowe mechanizmy działania hormonów
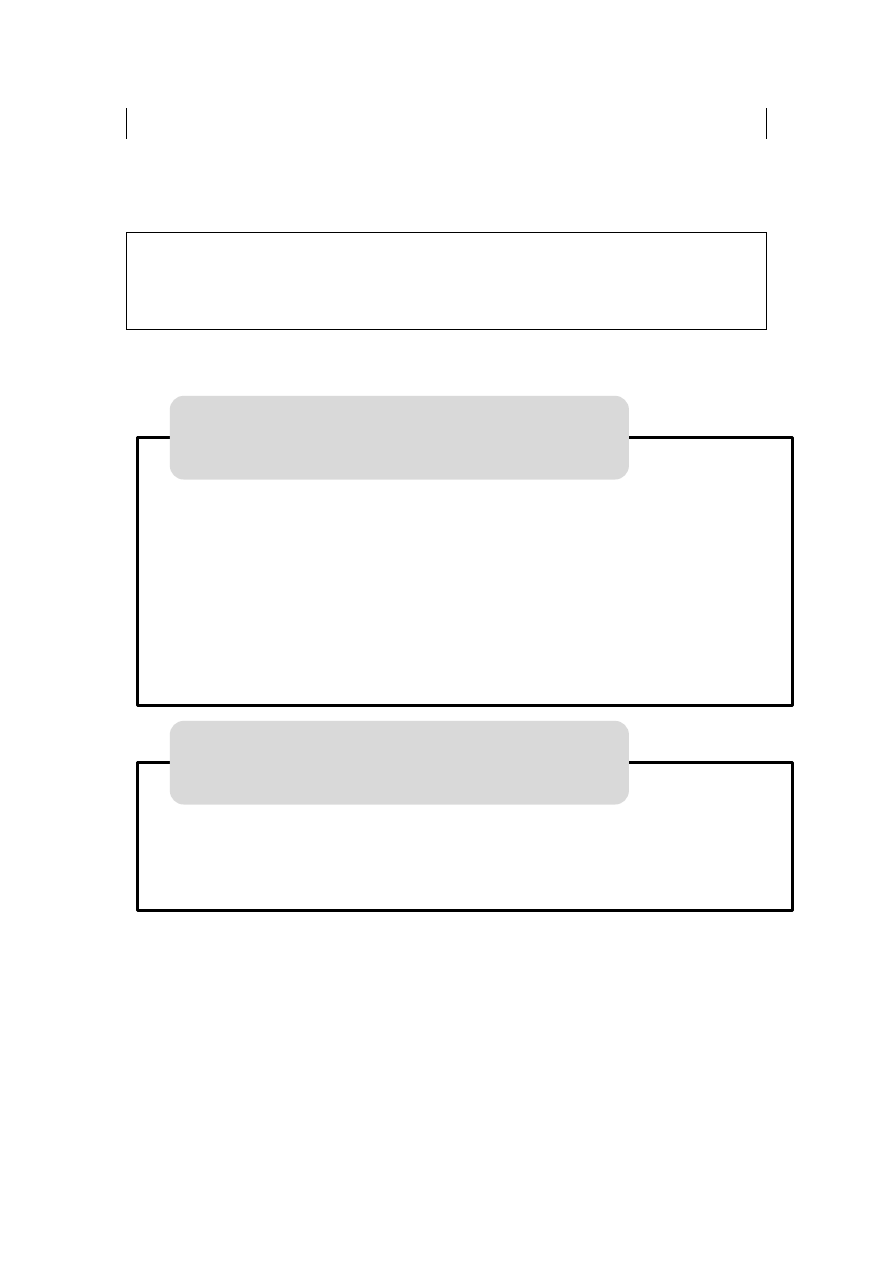
Temat 5: Transdukcja sygnału hormonalnego
Działanie hormonów na komórkę docelową jest ściśle związane z obecnością
lub brakiem receptorów dla danego hormonu (tzw. specyficzność komórkowa).
Ponadto w różnych tkankach ten sam hormon może oddziaływać z różnymi
receptorami (tzw. specyficzność tkankowa).
TRANSDUKCJA SYGNAŁU - proces przenoszenia sygnału z aktywowanego
receptora na efektor komórkowy.
Rodzaje transdukcji sygnału:
jednoskładnikowa
ligand + receptor białka efektorowe / kanały jonowe
wieloskładnikowa
ligand + receptor białka G/enzymy wtórny przekaźnik
Hormony które przenikają przez błonę komórkową oddziaływają specyficznie
ze składnikami cytoplazmy i jądra komórkowego.
Hormony o budowie peptydowej i białkowej nie mają zdolności przenikania
przez błonę komórkową, dlatego oddziaływają z receptorami błonowymi.
W zależności od sposobu transdukcji sygnału wśród receptorów błonowych
wyróżniamy:
receptory jonotropowe (są to receptory związane z kanałami jonowymi),
receptory metabotropowe (należą do nich receptory związane z enzymami
i receptory związane z białkami G).
21
Receptorowe mechanizmy działania hormonów
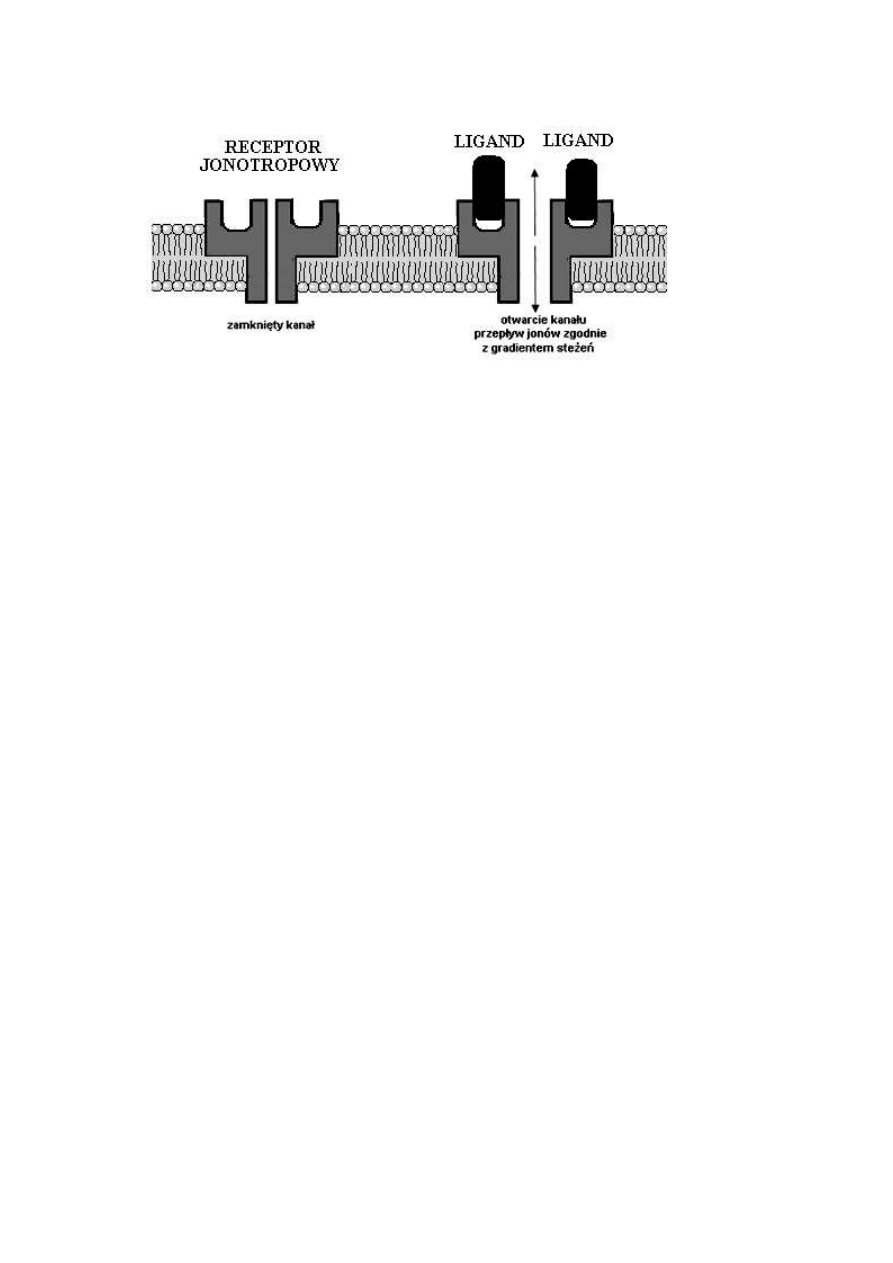
Temat 6: Receptory związane z kanałami jonowymi
RECEPTORY ZWIĄZANE Z KANAŁAMI JONOWYMI – grupa receptorów
błonowych sprzężonych z kanałami jonowymi i działających na zasadzie transdukcji
jednoskładnikowej np. receptor dla acetylocholiny (Ryc. 5)
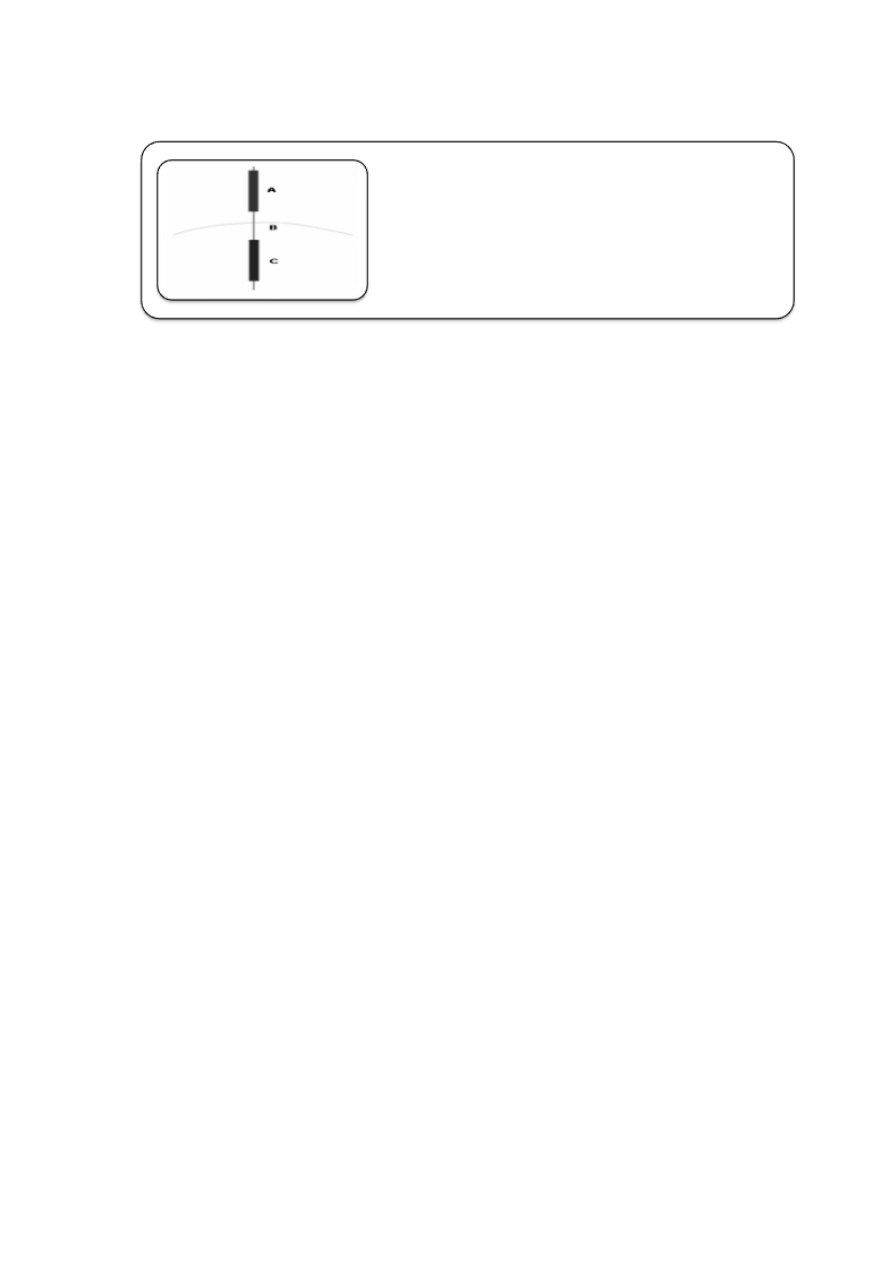
Rycina 5. Receptory związane z kanałami jonowymi aktywowane ligandem
(neurohormonem)
• cholinergiczny receptor nikotynowy jest glikoproteiną złożoną z pięciu
podjednostek: α1, α2, ß, γ, δ;
• przyłączenie dwóch cząsteczek acetylocholiny (Ach) do receptora typu N
(do podjednostek α) powoduje szybkie otwarcie kanału i w efekcie napływ
jonów sodowych i wyciek jonów potasowych z pobudzonego neuronu
• pobudzenie receptora nikotnowego wywołuje np. skurcz mięśni
szkieletowych
• naturalnym, endogenny agonistą tego receptora jest Ach a egzogennym
agonistą - nikotyna; nikotyna początkowo pobudza receptor a w
większych sężeniach blokuje jego działanie
receptor acetylocholinowy typu N (AChR )
• jedyna klasa jonotropowych receptorów serotoninergicznych: 5-HT3A 5-
HT3B 5-HT3C
• receptor 5-HT3 wydaje się odgrywać istotną rolę w procesach leżących u
podstaw uzależnienia od kokainy
receptor 5-hydroksytryptaminy typu 3 (5-HT3)
22
Rycina 6. Aktywacja receptora jonotropowego ligandem
Przyłączenie liganda do części zewnątrzkomórkowej receptora wpływa na zmianę konformacji
łańcucha polipeptydowego tworzącego ściany kanału jonowego, co powoduje natychmiastowe
otwarcie (lub zamknięcie) kanału.

23
Receptorowe mechanizmy działania hormonów
Temat 7: Receptory związane z białkami G
RECEPTORY ZWIĄZANE Z BIAŁKAMI G (GPCR; ang. G protein coupled
receptors) - grupa receptorów należących do wielkiej rodziny homologicznych,
integralnych białek występujących w błonie plazmatycznej, które działają na zasadzie
transdukcji wieloskładnikowej poprzez białka G np. receptory histaminowe, receptory
ß-adrenergiczne wiążące adrenalinę i noradrenalinę
GPCR utworzone są z pojedynczego łańcucha aminokwasowego o strukturze
α-helikalnej (Ryc. 7). Jednorodny schemat budowy receptorów serpentynowych
kompensuje złożony systemem przekazywania sygnału, za pomocą różnych
składowych białek G (Ryc. 8). Pozwala to na precyzyjne dostosowanie szlaków
komórkowych do zróżnicowanych bodźców. Transdukcji towarzyszy zwykle silne
wzmocnienie sygnału, ponieważ pobudzony ligandem receptor może aktywować setki
cząsteczek białek G.
Rycina 7. Budowa receptora należącego do rodziny GPCR
BIAŁKA G - rodzina heterotrimerycznych (złożone z 3 podjednostek: α, ß, γ),
polimorficznych białek wiążących i hydrolizujących GTP, które biorą udział
w transdukcji sygnału wewnątrzkomórkowego
W oparciu o właściwości podjednostki α, zidentyfikowano następujące rodzaje
białek G: Gq, Gs, Gi, Go, G
12
. Białkami docelowymi dla aktywnych składowych
A - domena zewnątkomórkowa
N-końcowy region glikozylowy wiążący ligand
B - domena hyrofobowa
złożona z 7 charakterystycznych pętli przenikających błonę komórkową
(7TM)
C - domena cytoplazmatyczna
C-końcowy region odpowiadający za wiązanie i aktywację białek G
24
białka G mogą być kanały jonowe np. K
+
, Ca
2+
lub enzymy efektorowe np. cyklaza
adenylowa, cyklaza guanylowa, fosfolipaza C. W przeciwieństwie do bardzo szybkiej
odpowiedzi przez kanały jonowe odpowiedź enzymatyczna jest znacznie wolniejsza
i bardziej
złożona. Stanowi bowiem początek skomplikowanej kaskady
sygnalizacyjnej, w której udział biorą wewnątrzkomórkowe cząsteczki sygnałowe
tzw. wtórne przekaźniki (cAMP, cGMP, IP
3
, DAG, Ca
2+
) i kinazy białkowe (MAPK,
PKA, PKC)
Rycina 8. Etapy przekazywania sygnału przez białka G
ETAP V: Powrót do stanu spoczynkowego
- nieaktywna podjednostka α łączy sie ponownie z kompleksem wyjściowym (ßγ)
ETAP IV: Aktywacja efektorowa
- przyłączenie jednostki α i GTP do efektora
- podjednostka α hydrolizuje GTP do GDP i nieorganicznego fosforu (aktywność GTP-azy)
- nastepuje zmiana aktywności białka efektorowego
ETAP III: Aktywacja podjednotki α i ßγ
- odłączenie podjednostki α razem z GTP od podjednostek ßγ
- oba powstałe kompleksy są aktywne i mogą oddziaływać z innymi cząsteczkami białkowymi
ETAP II: Przyłączenie liganda i GTP
- przyłączenie liganda do receptora,
- dysocjacja GDP od biała G,
- przyłączenie GTP do białka G
ETAP I: Stan spoczynkowy
- brak ligandu
- białko G połączone z GDP (nieaktywne)

25
Receptorowe mechanizmy działania hormonów
Temat 8: Receptory związane z enzymami
Obok receptorów związanych z białkami G lub kanałami jonowymi,
receptory
katalityczne
stanowią
kolejną
grupę
receptorów
błonowych
zaangażowanych w transdukcję sygnału hormonalnego.
RECEPTORY ZWIĄZANE Z ENZYMAMI (tzw. receptory katalityczne) –
grupa receptorów błonowych, których domeny cytoplazmatyczne posiadają
aktywność enzymatyczną lub też tworzą kompleksy z innymi białkami posiadającymi
taką aktywność.
W grupie receptorów związanych z enzymami można wyróżnić następujące klasy:
receptory o aktywności kinaz tyrozynowych
Receptory tego typu są pod względem budowy (z wyjątkiem receptora dla insuliny)
pojedynczymi białkami transbłonowymi, które przebijają błonę komórkową tylko
jeden raz (Ryc. 9). Przyłączenie liganda przez domenę zewnętrzną powoduje
dimeryzację receptora, co z kolei umożliwia zajście autofosforylacji (wzajemna
fosforylacja tyrozyn w obrębie domen cytoplazmatycznych dimeru). Fosforylacja
reszt tyrozynowych skutkuje przyłączeniem się do receptora białka efektorowego (np.
fosfolipazy C, kinazy 3-fosfatydyloinozytolu, białka Ras) a następnie kolejnych grup
białek o charakterze kinaz, które ulegają wzajemnej kaskadowej fosforylacji
(uaktywnieniu). Za zakończenie aktywacji receptora katalitycznego odpowiadają
tyrozynowe fosfatazy białkowe, które usuwają związane z receptorem grupy
fosforanowe.
Receptor insulinowy natomiast składa się z 4 podjednostek: 2α (zewnętrzne) i 2ß
(wewnętrzne) i jest dimerem jeszcze przed przyłączeniem liganda. Przyłączenie
liganda do receptora insulinowego skutkuje jego tetrameryzacją i autofosforylacją
domen wewnętrznych.
26
Ryc. 9. Budowa receptora katalitycznego
receptory związane z kinazą tyrozynową
Receptory tego typu same nie posiadają aktywności enzymatycznej dlatego mają
dwuskładnikowy system transdukcji sygnału. Dimeryzując przyłączają związaną
z błoną kinazę tyrozynową (kinazy z rodziny Src lub Jak), która to dopiero dokonuje
fosforylacji receptora w części plazmatycznej.
receptory kinaz serynowo-treoninowych
Receptory tego typu reprezentują jednoskładnikowy system transdukcji sygnału.
Część cytoplazmatyczna receptora wykazuje aktywność enzymatyczną umożliwiającą
fosforylację białek na dwóch aminokwasach: Ser i Thr. Uczestniczą w przekazywaniu
sygnału do jądra za pomocą białka Smad.
receptory o aktywności fosfataz tyrozynowych
Receptory tego typu reprezentują jednoskładnikowy system transdukcji sygnału.
Część cytoplazmatyczna receptora powoduje aktywację odpowiedniej kinazy poprzez
odszczepienie od niej reszty fosforanowej.
A - domena zewnątkomórkowa
B - domena hyrofobowa
C - domena cytoplazmatyczna (efektorowa)
27
Receptorowe mechanizmy działania hormonów
Temat 9: Receptory jądrowe
RECEPTORY
JĄDROWE
(NR;
ang.
nuclear
receptor)
–
grupa
wewnątrzkomórkowych strukturalnie homologicznych białek, które po związaniu
specyficznego liganda przemieszczają się do jądra komórkowego, gdzie regulują
transkrypcję genów odpowiedzialnych za prawidłowe funkcjonowanie komórki, jako
tzw. czynniki transkrypcyjne (TF; ang. transcription factor).
Receptory jądrowe są cząsteczkami wysoce konserwatywnymi. W ich
strukturze można wyróżnić stałe regiony, pełniące analogiczne funkcje (Ryc.1.):
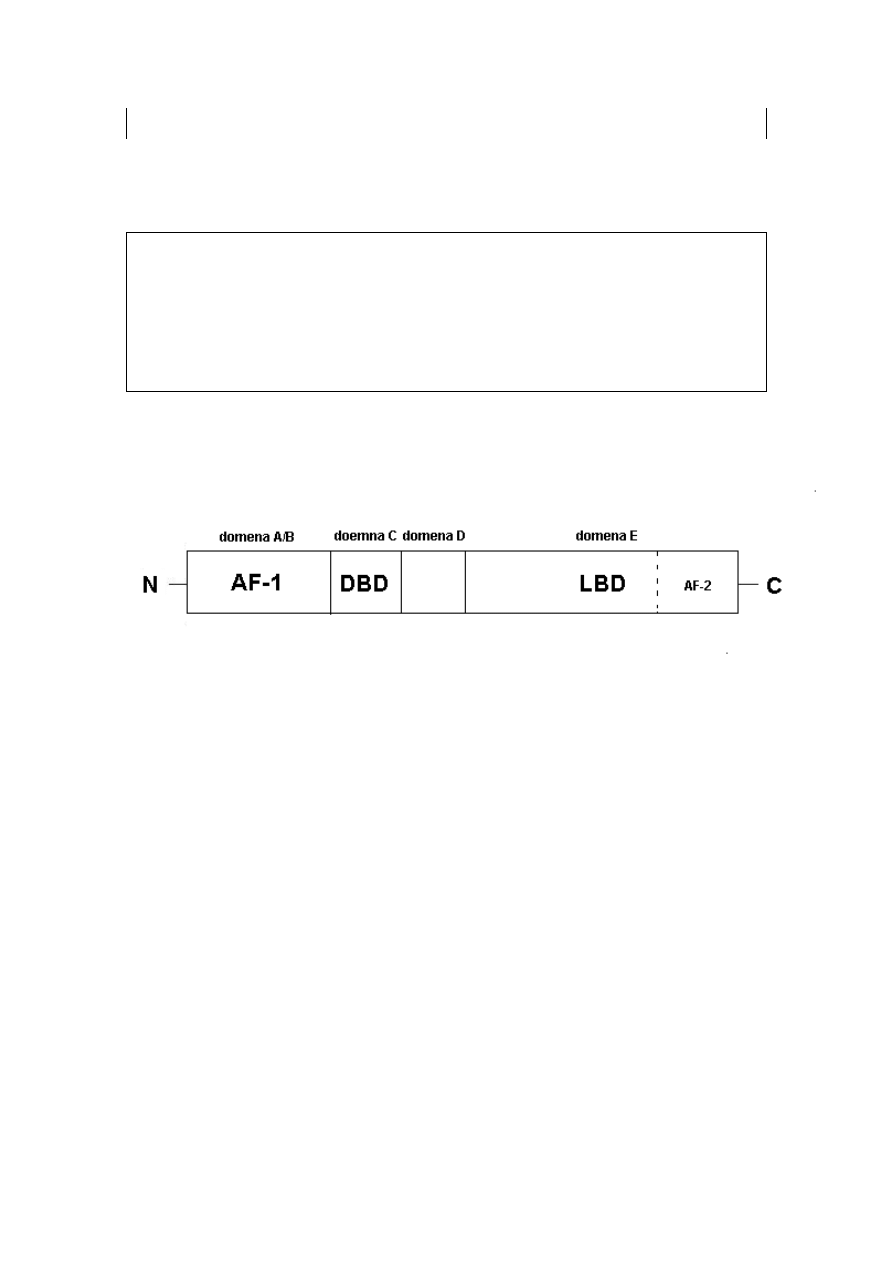
Rycina 10. Schemat budowy receptora jądrowego
N-końcowy region modulatorowy tzw. domena A/B (AF-1; ang. activation
function 1) – region o największej zmienności, odpowiedzialny za aktywację
procesu
transkrypcji
oraz
oddziaływanie
z komórkowo-swoistymi
kofaktorami;
domenę wiążącą DNA tzw. domena C (DBD; ang. DNA-binding domain) -
będącą konserwatywnym fragmentem białka (około 60–70 aminokwasów),
odpowiedzialnym za oddziaływanie z sekwencją nukleotydów DNA.
domenę zawiasową tzw. domena D – zapewniającą czynnościową
elastyczność (rotacja nawet o 180
0
) między domenami DBD i LBD
i zawierającą sygnał lokalizacji jądrowej (NLS; ang. nuclear localization
signal).
28
domenę wiążącą ligand tzw. domena E (LBD; ang. ligand binding domain)–
wielofunkcyjną domenę umożliwiającą m.in.: wiązanie ligandu, dimeryzację,
oddziaływanie z białkami (np. szoku termicznego) czy koregulatorami;
posiada także funkcję trans aktywacyjną, dzięki konserwatywnemu
fragmentowi AF-2 (ang. activation function 2) umiejscowionemu w C-końcu
odcinka LBD.
Białka zaliczane do dużej grupy receptorów jądrowych, pomimo podobieństw
strukturalnych, można podzielić według następujących kryteriów:
rodzaju wiązanego ligandu (Ryc. 11)
rodzaju wiązanej z sekwencji DNA (Ryc. 12)
mechanizmu działania (Ryc. 13)
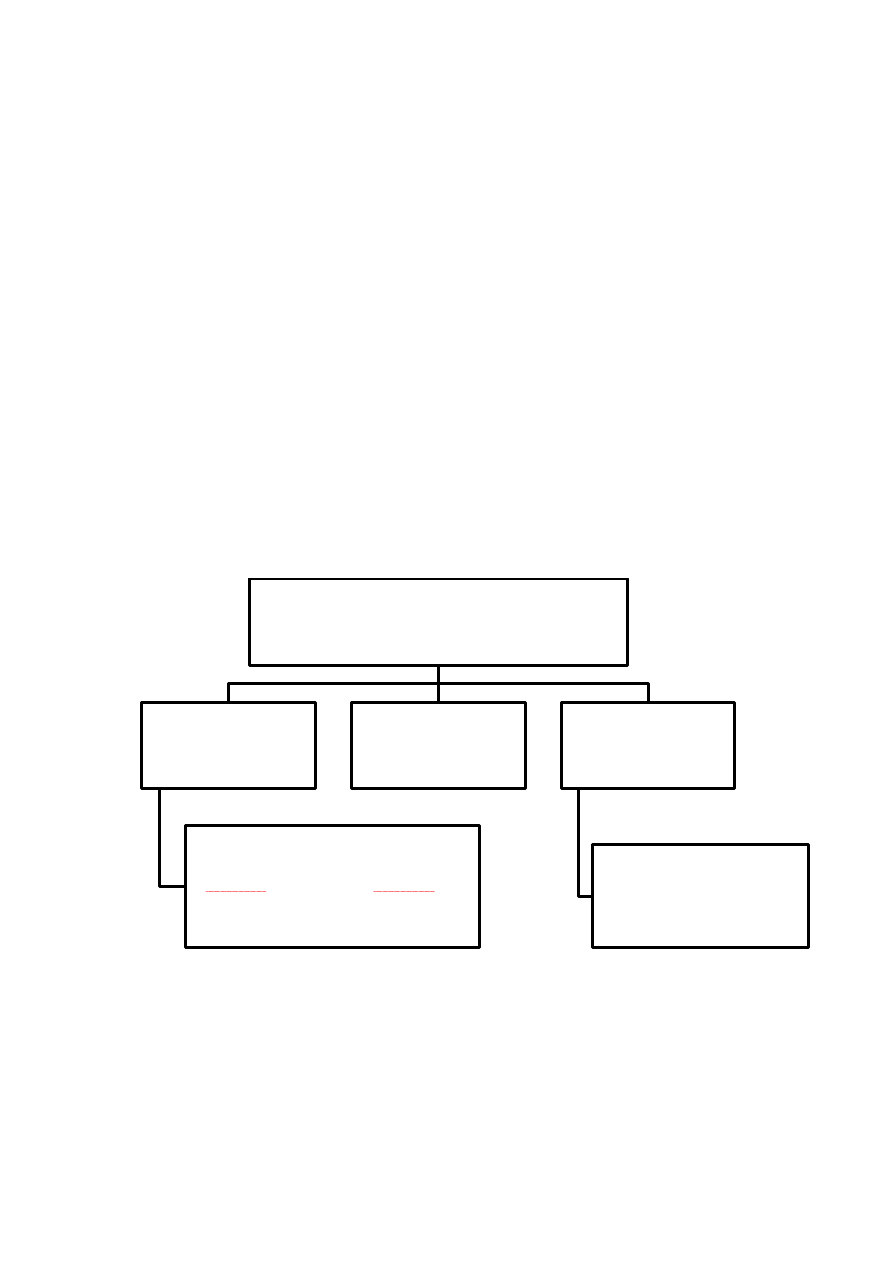
Rycina 11.
PODZIAŁ RECEPTORÓW
JĄDROWYCH
- ze względu na rodzaj wiązanego liganda -
jądrowe receptory
hormonów
białka, których ligandem są hormony
steroidowe (np. kortyzol, estradiol); hormony
tyroidowe (np. tyroksyna); retynoidy (np.
witamina A ); witamina D; niektóre
prostaglandyny
inne receptory
jądrowe
sieroce receptory
jądrowe
białka, których ligandy nie zostały
poznane ale posiadają domeny
typowe dla klasycznych
receptorów jądrowych
29
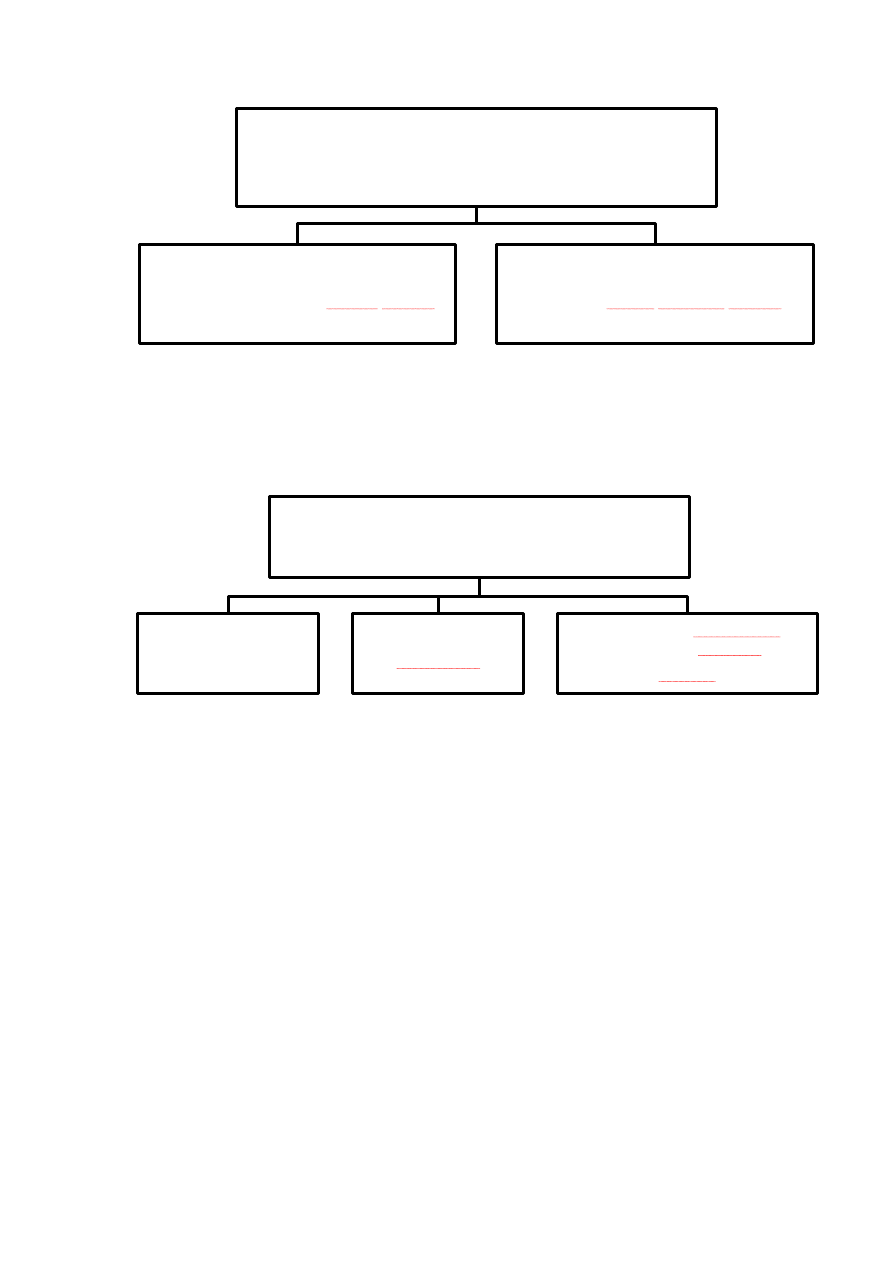
Rycina 12.
Rycina 13.
PODZIAŁ RECEPTORÓW JĄDROWYCH
- ze względu na rodzaj wiązanej sekwencjami DNA -
łączące się z sekwencjami powtórzeń
odwróconych (IR; ang. inverto repeats)
łączące się z powtórzeniami prostymi
(SSR; ang. simple sequence repeats)
PODZIAŁ RECEPTORÓW JĄDROWYCH
- ze względu na mechanizm działania
-
działające jako
monomer
działające jako
homodimer
działające jako heterodimer z
receptorem retinowy
(RXE; ang. retinoid X receptor)

30
Receptorowe mechanizmy działania hormonów
Temat 10: Rodzaje interakcje ligand-receptor
Oddziaływania pomiędzy receptorem a ligandem zależą od ich wzajemnego
powinowactwa jak również od tzw. aktywności wewnętrznej.
POWINOWACTWO – zdolność liganda do wiązania się z receptorem.
SKUTECZNOŚĆ (tzw. aktywność wewnętrzna) - zdolność liganda do pobudzenia
receptora i wyzwolenia reakcji biologicznej; maksymalna skuteczność to α =1.
Opierając się między innymi na dwóch wyżej wymienionych parametrach,
ligand może być w stosunku do receptora:
AGONISTĄ, czyli posiadać wysokie powinowactwo i aktywność wewnętrzną
(α ≥ 1) do danego receptora (agoniści wiążą i pobudzają receptor);
AGONISTĄ CZĘŚCIOWYM, czyli posiadać wysokie powinowactwo
i pośrednią aktywność wewnętrzną (0,2 < α > 0,8) do danego receptora;
ANTAGONISTĄ, czyli posiadać wysokie powinowactwo i zerową
aktywność wewnętrzną (α = 0) (antagoniści blokują wiązanie agonistów
i pobudzenie receptora).
Wyróżniamy antagonizm odwracalny (antagonista łatwo odłącza się od
receptora)
i
nieodwracalny
(antagonista
trwale
blokuje
receptor)
oraz
kompetencyjny (antagonista i agonista wiążą się do tego samego miejsca, stąd
możliwe jest odwrócenie zahamowania receptora przez „nadmiar” agonisty)
i niekompetencyjny (antagonista wiąże się do innego miejsca niż agonista)

31
ODWROTNYM AGONISTĄ, czyli hamować konstytutywną aktywność
receptor (receptor będący w stanie aktywnym bez obecności liganda
aktywującego);
MIESZANYM AGONISTĄ-ANTAGONISTĄ, czyli w zależności od
okoliczności pobudzać lub hamować receptor;
ZWIĄZKIEM NIEAKTYWNYM, czyli nie wiążący się z receptorem (nie
mający charakteru agonisty ani antagonisty).

32
Receptorowe mechanizmy działania hormonów
Temat 11: Regulacja siły działania hormonu na poziomie receptora
Regulacja siły działania poszczególnych hormon na poziomie receptora
obejmuje następując zjawiska:
DESENSYTYZACJĘ RECEPTORA (tzw. „odczulenie” receptora)– zmiana
odpowiedzi receptora na pobudzenie, polegająca na osłabieniu wrażliwości
receptora na kolejne dawki hormonu; odbywa się poprzez fosforylację
receptora (przez kinazy) lub fosforylację połączoną z przyłączeniem
określonego białka (np. arestyny) zapewniającego bardziej długotrwałą
dezaktywację receptora;
REGULACJĘ W DÓŁ RECEPTORÓW (ang. down-regulation) - regulacja
gęstości receptorów w komórce, polegająca na skierowaniu receptorów na szlak
liposomowy, gdzie ulegają strawieniu zamiast normalnej recyrkulacji lub poprzez
zmniejszenie ekspresji genów dla tych receptorów;
REGULACJĘ W GÓRĘ RECEPTORÓW (ang. up-regulation) – zwiększenie
gęstości receptorów w komórce poprzez syntezę białka receptorowego de novo,
nasilenie procesów translacji lub zwolnienie procesów degradacji białek
receptorowych;
SEKWESTRACJĘ RECEPTORÓW - polega na przeniesieniu receptora na
wewnętrzną stronę błony komórkowe (internalizacja podbłonowa); proces
może być całkowicie odwracalny i prowadzić do powrotu receptora na
powierzchnię komórki lub może być pierwszym etapem w procesie
degradacji; ponadto może być także związana z aktywnością tzw. BIAŁKEK
MODYFIKUJĄCYCH AKTYWNOŚĆ RECEPTORA (RAMP; ang.
receptor activity modifying protein), czyli grupy białek modyfikujących
aktywność i specyficzność receptora o budowie podobnej do receptora
kalcytoniny (CRLR; ang. calcitonin receptor like receptor): RAMP 1, RAMP
2, RAMP 3.

33
Molekularne mechanizmy działania hormonów
Temat 12: Mechanizm genomowy i pozagenomowy
Zgodnie z klasyczną teorią działania hormonów steroidowych, należą one do
związków modulujących ekspresję genów na różnych poziomach transkrypcji jak
i translacji (MECHANIZM GENOMOWY). Niemniej jednak obok klasycznego
działania genomowego steroidy mogą także wpływać na funkcjonowanie komórki
poprzez MECHANIZM POZAGENOMOWY.
Pozagenomowe działanie steroidów jest popularnie definiowane jako działanie
„szybkie i krótkotrwałe” w przeciwieństwie do „wolnego i długotrwałego” działania
genomowego. Niemniej jednak czas występowania efektów biologicznych nie do
końca precyzyjnie różnicuje obydwa mechanizmy. Nie można bowiem wykluczyć
niegenomowych działań ujawniających się również po dłuższym okresie czasu.
Ponadto steroidy poprzez wtórne przekaźniki czy wiązanie się z określonymi białkami
G mogą także wpływać na ekspresję genów (tzw. MECHANIZM
NIEGENOMOWO-GENOMOWY). Dlatego też, w uproszczeniu zakłada się, że
efekty pozagenomowe to działanie hormonów poprzez struktury zlokalizowane
w błonie lub cytoplazmie, nie polegające na bezpośrednim łączeniu się receptora
z DNA. Nietranskrypcyjny przekaz sygnału może odbywać się również bez udziału
receptora (Ryc. 14).
Niegenomowe (Ryc. 15) i genomowe (Ryc. 16) mechanizmy działania
hormonów oddziałują na siebie, uzupełniają się, ale także mogą wzajemnie się
potencjalizować. Można mówić zatem o efekcie addycyjnym i synergistycznym obu
mechanizmów.
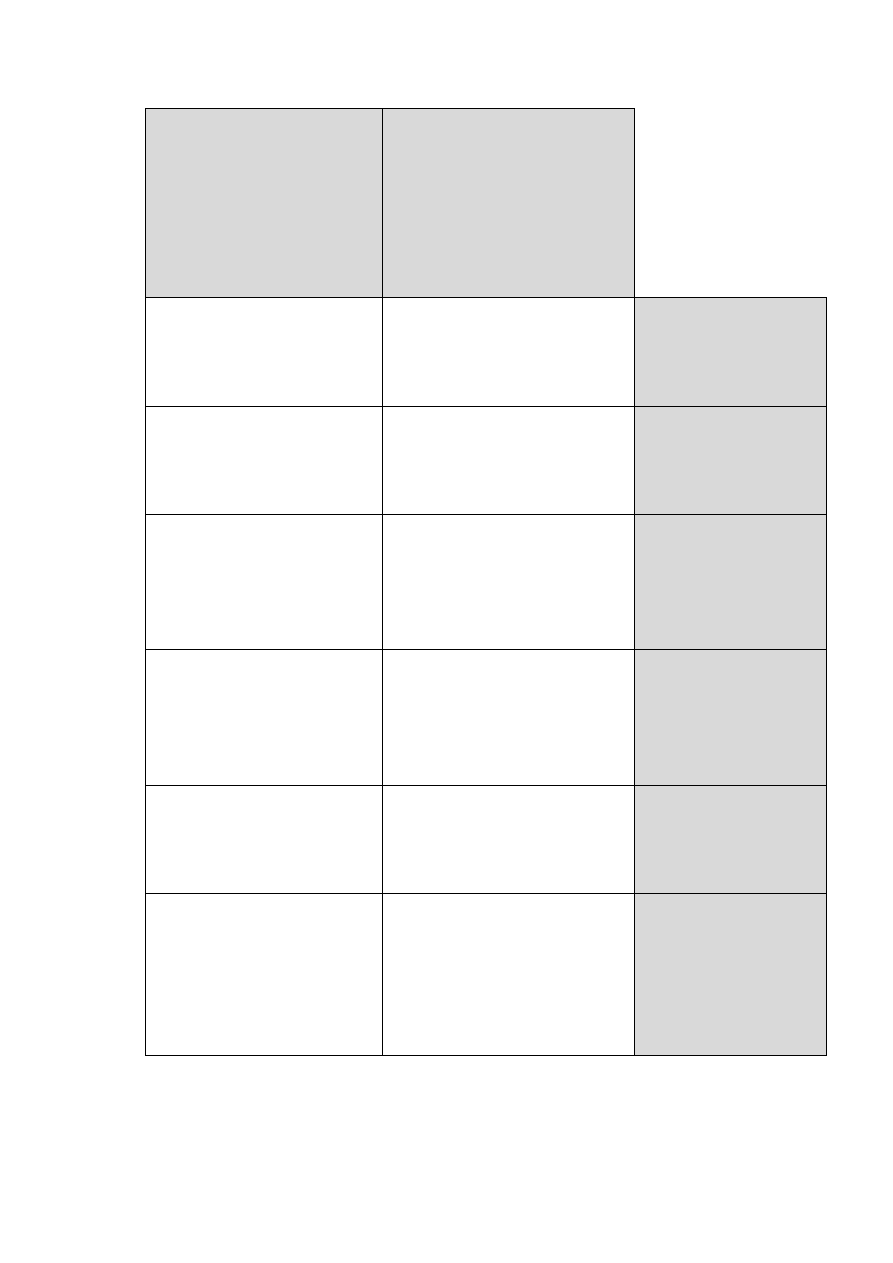
34
M.GENOMOWY
tzw. sygnalizacja inicjowana
z jądra komórkowego
NISS (ang. nuclear-initiated
steroid signalling)
M.POZAGENOMOWY
tzw. sygnalizacja inicjowana
z błony komórkowej
MISS (ang. membrane-initiated
steroid signalling)
receptorowy
receptorowy/niereceptorowy
MECHANIZM
DZIAŁANIA
cytoplazma/jądro
błona komórkowa/cytoplazma
LOKALIZACJA
RECEPTORA
modulowanie ekspresji genów
na poziomie transkrypcji i
translacji
aktywacja szlaków sygnałowych
kinaz, białek G, kanałów
jonowych
MECHANIZM
PRZEKAZYWANIA
SYGNAŁU
po kilku godzinach/dniach
po kilku sekundach/minutach
UJAWNIENIE SIĘ
EFEKTU
BIOLOGICZNEGO
długoterminowe
krótkoterminowe/długotermino
we
WYWOŁYWANE
ZMIANY
zahamowanie
występuje
WPŁYW
INHIBITORÓW
TRANSKRYPCJI I
TRANSLACJI
Rycina 14. Różnice między genomowym i pozagenomowym mechanizmem
działania hormonów
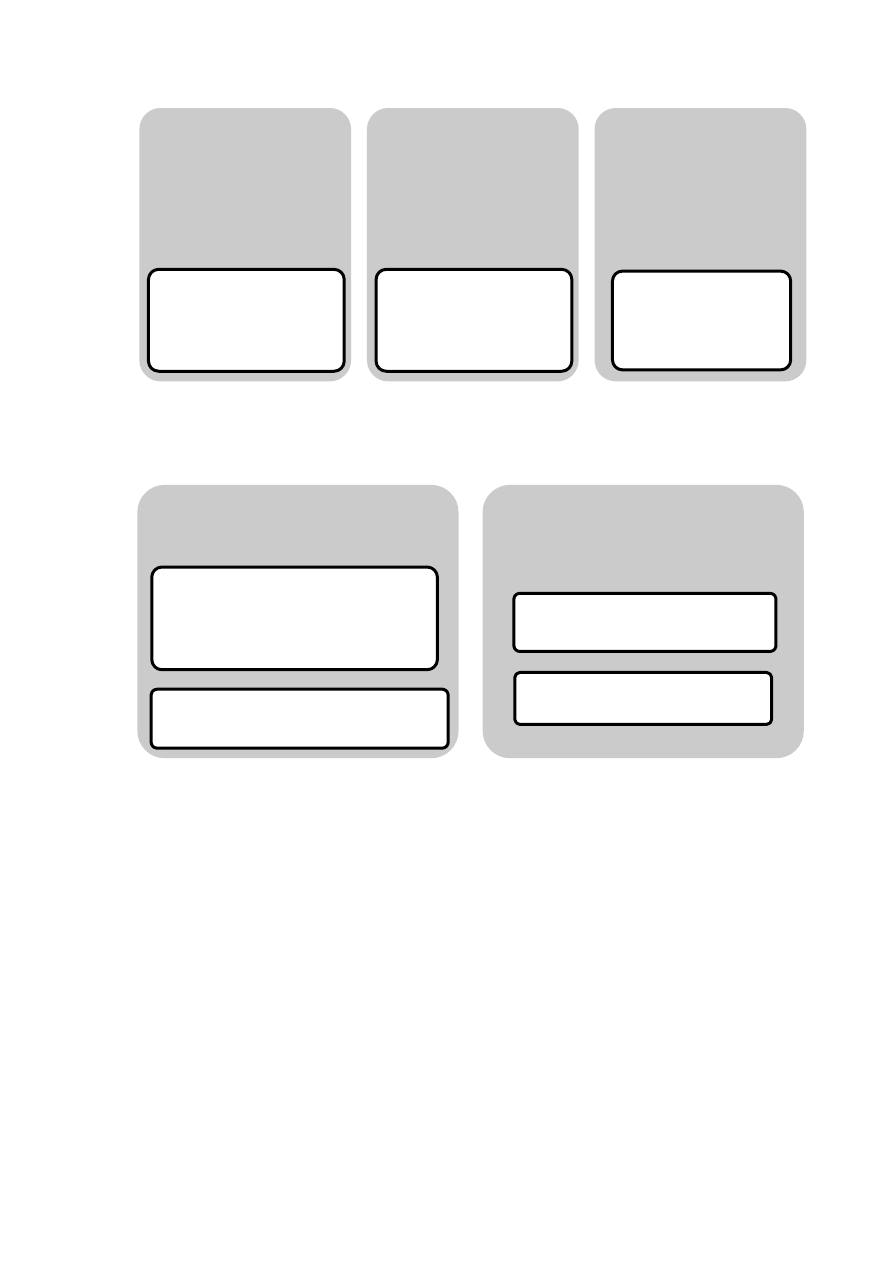
35
Rycina 15. Sposoby pozagenomowego działania hormonów
Rycina 16. Sposoby oddziaływania klasycznych receptorów z DNA
TYP I
działanie na poziomie błony
komórkowej bez łączenia się
z jakimkolwiek receptorem
np. zmiana płynności i
ciagłości błony
komórkowej
TYP II
przez połączenie z
niespecyficznym dla siebie
białkiem receptorowym,
strukturalnym lub
enzymatycznym obecnym w
błonie lub cytoplaźmie
np. interakcje z
receptorami błonowymi
sprzężonymi z białkiem G
TYP III
przez specyficzne, klasyczne
receptory dla hormonów
steroidowych obecne w
błonie komórkowej
np. uruchomienie
wewnątrzkomórkowych
szlaków kinaz
białkowych
TYP I
wiązanie z DNA
bezpośrednie oddzialywanie z DNA,
koaktywatorami i kompleksem
inicjującym polimerazy RNA
inicjacja transkrypcji
TYP II
oddziaływanie z czynnikami
transkrypcyjnymi wiążącymi DNA
stabilizacja kompleksu DNA-TF
przyłaczenie koaktywatora
36
CZĘŚĆ II
Hormony – molekuły kontrolujące nasze emocje
Temat 13: Hormony szczęścia i miłości
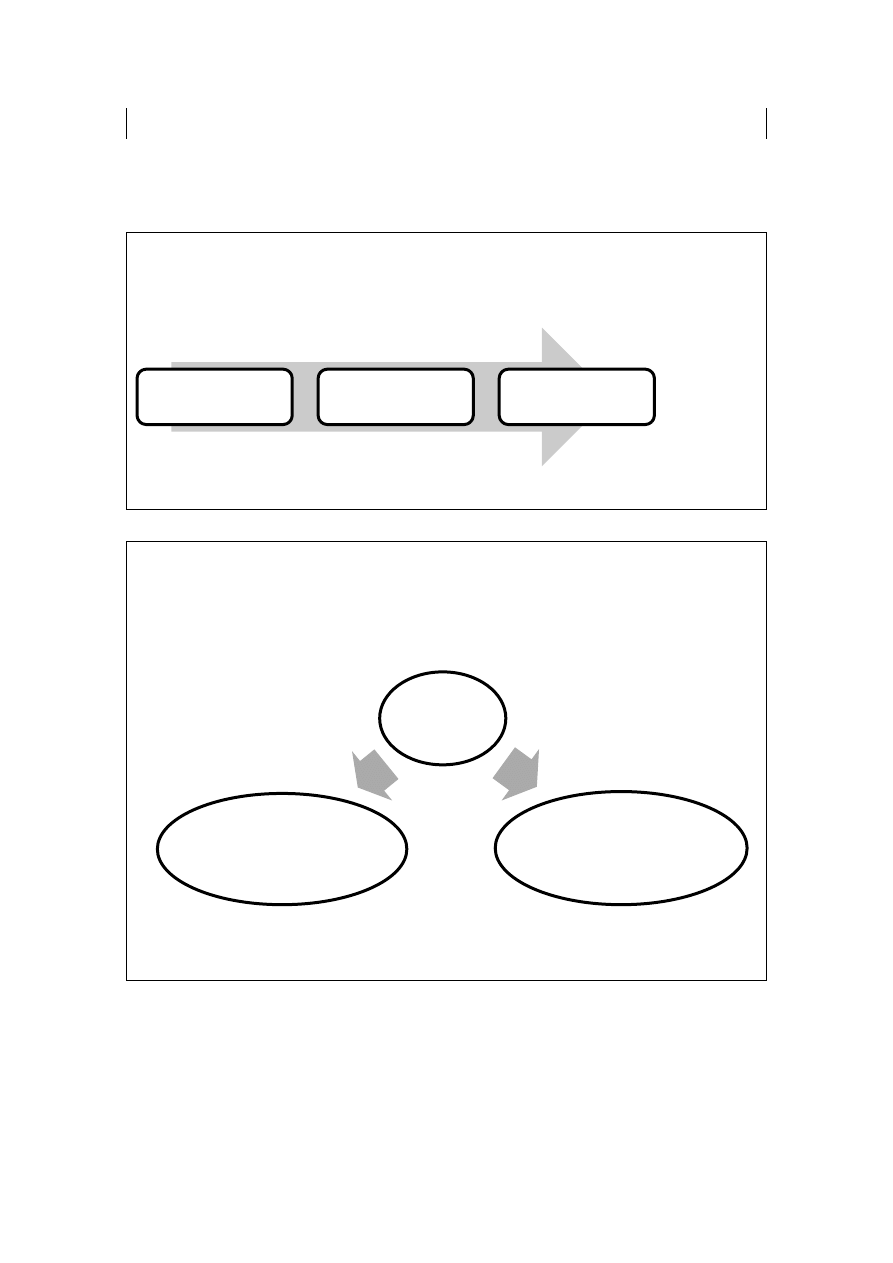
Z naukowego punktu widzenia, MIŁOŚĆ to działanie odpowiednich
neurohormonów. Wzrost lub spadek wydzielania określonych „hormonów miłości”
jest uzależniony od tzw. fazy miłości (Ryc. 17).
Rycina 17. Fazy miłości
W fazie pożądania dochodzi do wzrostu aktywności ESTROGENÓW
i PROGESTERONU
(u
kobiet)
oraz
TESTOSTERONU
(u mężczyzn)
odpowiedzialnych za pobudzenie seksualne.
W stanie zauroczenia stwierdzono zwiększone wydzielanie DOPAMINY
(u ludzi będących w stanie zauroczenia dopamina aktywuje podobne obszary mózgu
jak kokaina wywołując stan zadowolenia, euforii a także wzrost energii
i intensyfikację doznań; jest także tzw. stymulatorem wierności - oddziałuje na
ośrodek
mózgu
odpowiedzialny
za
monogamię),
wzrost
aktywności
NORADRENALINY (powoduje pocenie się i szybsze bicie serca) a także
podwyższenie stężenia FENYLOETYLOAMIN (u ludzi będących w stanie
zauroczenia utrudniają racjonalne myślenie a także powodują zaburzenia emocjonalne
i brak koncentracji) jak również spadek stężenia SEROTONINY (niski poziom
serotoniny powoduje podatność zakochanych na wahania nastrojów oraz zakłóca
odczuwanie potrzeb fizjologicznych takich jak sen czy łaknienie).
POŻĄDANIE
NAMIĘTNOŚĆ
ZAUROCZENIE
INTYMNOŚĆ
PRZYWIĄZANIE
ZAANGAŻOWANIE

37
W okresie przywiązania, który jest kolejnym etapem po zauroczeniu,
wytwarza się tolerancja na działanie monoamin (dopaminy), a następuje wzrost
aktywności OKSYTOCYNY (wpływa na wzajemną czułość między partnerami i jest
także odpowiedzialny za uczucia rodzicielskie) WAZOPRESYNY (wpływa na
instynkt ojcowski i wierność mężczyzn) oraz ENDORFIN (tzw. „hormony szczęścia”
- dają uczucie spokoju wewnętrznego, przywiązania, harmonii i bezpieczeństwa;
neurobiologicznie cementują związek).
38
Hormony – molekuły kontrolujące nasze emocje
Temat 14: Hormony stresu i agresji
STRES – nieswoista reakcja organizmu w odpowiedzi na działanie tzw. stresorów,
czyli wszelkich bodźców (fizycznych i psychicznych) zakłócających równowagę
organizmu
Rycina 18. Stadia stresu
AGRESJA – zachowanie destrukcyjne wynikające z trudności kontrolowania
negatywnych popędów i impulsów; niektóre stresory (np. frustracja) mogą wzmagać
zachowania agresywne
Rycina 19. Rodzaje agresji
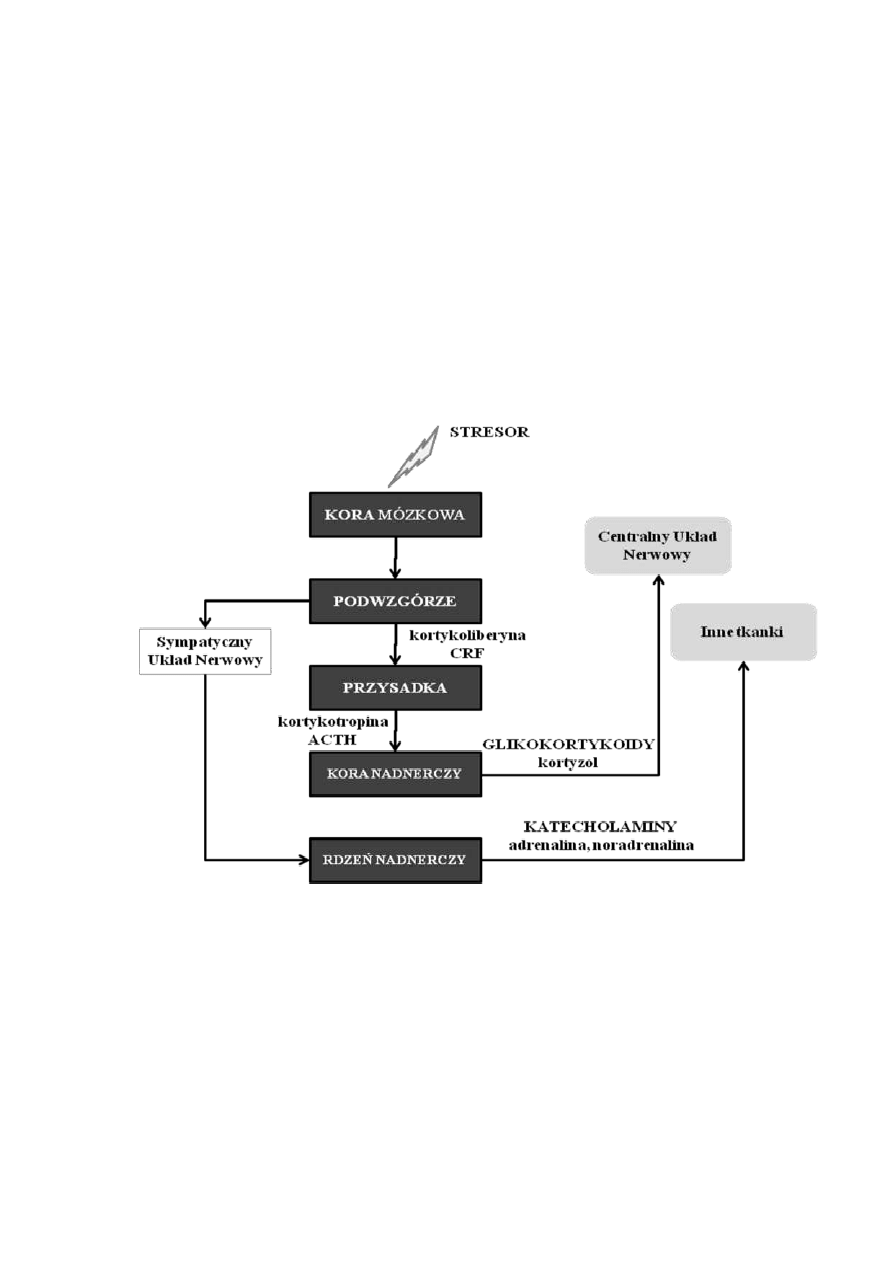
Na poziomie biochemicznym STRES regulują hormony należące do tzw. osi
podwzgórze – przysadka – nadnercza. (Ryc. 20). Podstawowym zadaniem
„hormonów stresu” jest mobilizacja organizmu do radzenia sobie z trudną sytuacją,
czyli stresorem (tzw. gotowość do ucieczki lub ataku). Fizjologiczne skutki działania
STADIUM
ALARMOWE
STADIUM
ADAPTACJI
STADIUM
WYCZERPANIA
AGRESJA
skierowana do wewnątrz
= autoagresja np.
skłonności samobójcze
skierowana na zewnątrz
np. na innego osobnika,
przedmiot
39
„hormonów stresu” obserwujemy w postaci np. wzrostu ciśnienia krwi,
przyspieszenia oddechu, napięcia mięśni, wyostrzenia działania zmysłu, wzmożonej
aktywności gruczołów potowych, obniżenia wydzielania śliny czy enzymów
trawiennych.
W przypadku gdy stresor jest bardzo silny lub gdy jego działanie przedłuża
się, może dochodzić do niekorzystnych zmian w organizmie np. schorzeń układu
krwionośnego, zaburzeń układu trawiennego i przemiany materii, reakcji alergicznych
czy zaburzeń pamięci (Ryc.18). Długotrwałe działanie „hormonów stresu” prowadzi
bowiem do wyczerpania organizmu.
Rycina 20. Regulacja reakcji stresowych przez oś podwzgórze – przysadka –
nadnercza

40
Hormony – molekuły odpowiedzialne za „wieczną młodość”
Temat 15: Zmiany hormonalne związane z przekwitaniem i starzeniem
Starzenie się organizmu człowieka jest procesem stopniowym, rozciągniętym
w czasie i obejmującym wiele układów, w tym układ hormonalny. Zmiany w układzie
hormonalnym nie dotyczą w równym stopniu wszystkich gruczołów dokrewnych
i cechuje je wielokierunkowość. Wraz z wiekiem wydzielanie jednych hormonów
ulega upośledzeniu (np. estradiolu, testosteronu, dehydroepiandrosteronu, hormon
wzrostu czy melatoniny – tzw. „hormony młodości") podczas gdy innych zwiększa
się (np. hormon folikulotropowego czy luteinizującego) lub tez nie ulega istotnym
zmianom (np. kortyzol). Biorąc pod uwagę istotny wzrost długości życia, coraz
więcej dowiadujemy się o pewnych naturalnych, związanych z wiekiem zmianom
hormonalnych.
SOMATOPAUZA: rozpoczyna się około 30-40 roku życia i polega na stopniowym
zmniejszaniu wydzielania hormonu wzrostu (GH) przez przysadkę (obniżeniu ulega
także wydzielanie insulinopodobnego czynnika wzrostu (IGF-I) w tkankach
obwodowych); przyczyn somatopauzy upatruje się w zmniejszonym wydzielaniu
somatoliberny (GHRH) i zwiększonym wydzielaniu somatostatyny (SST); w związku
z faktem, że GH jest hormonem o wielokierunkowym działaniu na niemal wszystkie
narządy naszego organizmu jego niedobór w okresie dorosłym powoduje dolegliwości
zarówno w sferze psychicznej (np. objawy depresyjne, niestabilność emocjonalna,
zaburzenia snu, pogorszenie pamięci i koncentracji, obniżenie libido) jak
i somatycznej (np. wzrost ilości tkanki tłuszczowej i zmniejszenie masy mięśniowej,
spadek wydolności fizycznej, wzrost stężenia lipidów i nasilenie procesów
miażdżycowych, obniżenie odporności).
MELATONINOPAUZA: rozpoczyna się po 40 roku życia i polega na
systematycznym zmniejszaniu wydzielania melatoniny (główny hormon szyszynki
odpowiedzialny za zmiany rytmów biologicznych człowieka) aż do bardzo niskich
wartości w wieku podeszłym; ze zmniejszeniem amplitudy wydzielania tego hormonu
wiąże się przewlekłe zaburzenia snu występujące u 40-70% osób w podeszłym wieku;

41
hormon ten działa również antyoksydacyjnie i przeciwnowotworowo (działa jako tzw.
zmiatacz wolnych rodników) oraz immunomodulacyjnie.
ADRENOPAUZA: pojawia się około 30 roku życia i polega na stopniowym spadku
(średnio 1-2% rocznie) poziomu dehydroepiandrosteronu (DHEA) i jego siarczanu
(DHEA-S). Dehydroepiandrosteron jest prekursorem estrogenów i androgenów
nadnerczowych i zalicza się ponadto do neurosteroidów czyli steroidów
wywierających modulujący wpływ na przewodnictwo nerwowe. Niedobór DHEA
powoduje wiele niekorzystnych objawów, jak: obniżenie odporności, przyspieszenie
miażdżycy, zmniejszenie masy mięśniowej i siły mięśni, obniżenie nastroju,
obniżenie libido.
ANDROPAUZA: charakteryzuje się powolnym przebiegiem i polega na
zmniejszeniu wydzielania androgenów u mężczyzn wraz z wiekiem (dotyczy np. 10%
mężczyzn po 50 roku życia, 20-30% po 60 roku życia i np. 40% po 70 roku życia);
zmiany te są konsekwencją zmniejszenia częstotliwości i amplitudy pulsów
gonadotropin, pogorszenia perfuzji jader i ich włóknienia; równolegle ze spadkiem
testosteronu (np. 1% rocznie) równocześnie wzrasta poziom globuliny wiążącej
hormony płciowe (SHBG), co potęguje niedobór wolnego testosteronu; zespół
andropauzy charakteryzuje się np. zmniejszeniem potrzeb seksualnych i jakości
erekcji, zmianami nastroju, depresją, zaburzeniami snu, uczuciem zmęczenia,
zmniejszeniem beztłuszczowej masy ciała i masy kości; w związku z faktem, że
przedstawione powyżej objawy wywoływane są zmianami nie tylko androgenów ale
także innych hormonów wielu autorów posługując się terminami: zespół niedoboru
androgenów (Androgen Deficiency in the Agincy Male – ADAM), zespół częściowego
niedoboru androgenów u starzejących się mężczyzn (Partial Androgen Deficiency in
the Aging Male – PADAM) lub zespoł zmian hormonalnych u starzejących się
mężczyzn (Changing Hormones in the Aging Male – CHAM).
MENOPAUZA: charakteryzuje się gwałtownym przebiegiem objawów, radykalnym
spadkiem poziomu żeńskich hormonów płciowych – estrogenów, poprzez
samoczynne wygaśniecie czynności jajników; menopauzę rozpoznaje się u kobiet po
40 roku życia gdy brak miesiączki utrzymuje się od ponad roku (całkowity zaniki
zdolności prokreacyjnych); następstwem postępującego zmniejszenia wydzielania

42
estrogenów są zaburzenia neuroendokrynne, zmiany zanikowe w układzie moczowo-
płciowym i w skórze oraz osteoporoza.
Cały proces fizjologicznego wygasania czynności jajników ma charakter
stopniowy i obejmuje takie pojęcia jak:
PREMENOPAUZA-okres kilku lat poprzedzający wystąpienie ostatniej
miesiączki, w którym pojawiają się pierwsze hormonalne objawy
niewydolności jajników);
PERIMENOPAUZA (tzw. okres okołomenopauzalny)-okres podczas którego
następuje stopniowe przejście od prawidłowych cykli owulacyjnych przez
cykle oligoowulacyjne aż do całkowitego zaniku krwawień miesięcznych
włącznie; u 95% kobiet występuje pomiędzy 39 a 51 rokiem życia
i przeciętnie trwa 5 lat);
MENOPAUZA;
POSTMENOPAUZA-okres po roku od ostatniego krwawienia miesięcznego;
KLIMAKTERIUM - zespół objawów neurowegetatywnych i psychoemocjo-
nalnych (np. uderzenia gorąca, zlewne poty, zawroty głowy, podwyższenie
temperatury ciała, obwodowe poszerzenie naczyń, kołatanie serca)
występujących u kobiet w okresie przekwitania

43
Hormony – molekuły odpowiedzialne za „wieczną młodość”
Temat 16: Hormony endogenne – sposób na wieczną młodość?
Obecnie na rynku farmaceutyków dostępnych jest wiele środków
i suplementów zawierających endogenne hormony. Stosowane są one w medycynie
do leczenia niektórych endokrynnych jednostek chorobowych jak również do
łagodzenia procesów starzenia np.:
HORMON WZROSTU
(np. Humatrope, Genotropin, Norditropin, Saizen)
Terapia hormonem wzrostu u osób w podeszłym wieku ma uzasadnienie jedynie
w przypadkach ciężkiego niedoboru i zdecydowanie nie jest rekomendowana jako
terapia antystarzeniowa. Podawanie syntetycznego hormonu wzrostu (rhGH) jest
bowiem kosztowne, pozytywne efekty są niewielkie (badania kliniczne wykazały
pewną poprawę nastroju oraz zdolności poznawczych i pamięci, a także wydolności
fizycznej osób starszych) a ryzyko wystąpienia działań niepożądanych duże (np. bóle
i obrzęki stawów, nadciśnienie, cukrzyca, akromegalia, zwiększone ryzyko chorób
nowotworowych).
Hormon wzrostu wykorzystywany jest także w kulturystyce i sporcie wyczynowym jako środek
dopingowy (działa stymulująco na budowę kości i ścięgien, powoduje przyrost masy i siły mięśniowej
oraz obniża ilość tkanki tłuszczowej, co pozwala na zwiększenie mocy fizycznej organizmu zarówno
w warunkach długotrwałej pracy tlenowej jak podczas wysiłków anaerobowych). Zarejestrowane w
Polsce preparaty hormonu wzrostu podlegają ścisłej kontroli dotyczącej ich dystrybucji i sprzedaży.
MELATONINA
(np. Circadin, Melatonina)
Melatonina okrzyknięto „hormonem młodości” i „lekiem na starość”, chociaż nadal
dowody na udział tego hormonu w procesie starzenia się człowieka są stosunkowo
skąpe. Obecnie skuteczność melatoniny potwierdzono w leczeniu nieprawidłowości
rytmów biologicznych, bezsenności i innych zaburzeniach snu a także łagodzeniu
skutków wynikających z szybkiej zmiany strefy czasowej (jet-lag). Rozpatruje się
również biologiczny potencjał melatoniny w prewencji antynowotworowej. W Polsce
melatonina została zarejestrowana jako lek w 2000 roku. Obecnie jej preparaty
funkcjonują na rynku krajowym także jako suplementy diety (w Stanach

44
Zjednoczonych, Kanadzie czy Holandii melatonina także należy do tzw. food
suplement).
DEHYDROEPIANDROSTERON
(np. Biosteron, Prasteron)
Większość badań nie potwierdza prozdrowotnych efektów podawania DHEA u osób
w podeszłym wieku (nieliczne badania jednak sugerują, że suplementacja DHEA
może korzystnie wpływać na: obniżony nastrój, zdolności poznawcze, zaburzenia
immunologiczne osób starszych). Niemniej jednak ze względu na obawy, że może on
powodować rozwój nowotworów hormonozależnych nie zaleca się jego stosowania
u osób z pozytywnym wywiadem rodzinnym dotyczącym tego typu nowotworów.
Ponadto u kobiet stwierdzono możliwość występowania działania niepożądane
będące wynikiem androgennego wpływu metabolitów DHEA takich jak: hirsutyzm,
trądzik, przetłuszczanie się skóry i włosów, wzrost potliwości. Preparaty zawierające
DHEA są dostępne bez recepty.
ESTROGENY/PROGESTAGENY
(np. Activelle, Angeliq, Estrapatch, Estreva)
Menopauzalna terapia hormonalna (MHT) to forma działania medycznego polegająca
na podawaniu hormonów jajnikowych u kobiet w okresie około- i pomenopauzalnym.
W hormonalnej terapii zastępczej (HTZ) kobiet można wyróżnić: systemową terapię
estrogenową (ET) lub estrogenowo-progestagenową (EPT). Obecnie zastosowanie
terapii hormonalnej uważa się uzasadnione w przypadku: przedwczesnego
wygaśnięcia czynności jajników (POF), silnych lub umiarkowanych objawów
klimakterycznych, atrofii dolnych dróg moczowo-płciowych, profilaktyki i leczenia
osteoporozy i osteopenii. Terapia hormonalna powinna być dobrana indywidualnie,
po rozważeniu wszelkich wskazań i przeciwwskazań (np. choroby towarzyszące) i ze
szczególnym uwzględnieniem potrzeb kobiety w danym przedziale wiekowym (np.
rodzaj preparatu, sposób podawania). Ważnym elementem terapii jest moment
rozpoczęcia leczenia, który warunkuje stopień korzyści zdrowotnych (tzw. okno
możliwości terapeutycznych przypada na 45-60 rok życia kobiety).
KNTROWERSJE: zgodnie z wynikami ostatnich badań EPT skojarzona jest z umiarkowanym
wzrostem ryzyka zachorowania na raka piersi i prawdopodobnie na raka jajnika (ujawniającym się
po kilku latach stosowania terapii), podczas gdy ET silnie wiąże ze znacznym wzrostem ryzyka raka
trzonu macicy.

45
TESTOSTERON
(np. Nebido, Undestor, Tostran)
Hormonalna terapia zastępcza (HTZ) mężczyzn obejmuje podawanie preparatów
testosteronu uwzględniających także jego metabolity. Zastosowanie HTZ u mężczyzn
ma na celu przywrócenie prawidłowego funkcjonowania seksualnego, libido
i dobrego samopoczucia a ponadto może zapobiegać osteoporozie. Utrudnienie
w określeniu wskazań do terapii są problemy diagnostyczne (efekty androgenów nie
zależy jedynie od stężenia tych hormonów we krwi!) oraz brak progowej wartości,
poniżej której należy rozpocząć suplementację testosteronem (brak korelacji między
poziomem hormonu a stopniem nasilenia objawów andropauzy).
KONTROWERSJE: doustne podawanie 17-α alkilopochodnych testosteronu, niepodlegających
aromatyzacji, może prowadzić do uszkodzenia wątroby; innym powikłaniem HTZ testosteronem
może być erytrocytoza

46
Hormony – molekuły wpływające na wydolność fizyczną
Temat 17: Doping – substancje zabronione w sporcie
DOPING – sztuczne podnoszenie wydolności fizycznej i/lub psychicznej organizmu
metodami wykraczającymi poza tzw. „zwykły trening”; doping wydolnościowy
można podzielić na:
-DOPING
FARMAKOLOGICZNY
-
polega
na
podawaniu
środków
farmakologicznych, których użycie nie jest uzasadnione leczeniem zawodnika;
-DOPING FIZJOLOGICZNY - polega na wymianie płynów ustrojowych
(np. autotransfuzja), przeszczepach tkanek (np. mięśni i ścięgien), chirurgicznym
usuwaniu tkanki tłuszczowej a także innych zabiegach mających na celu zwiększenie
osiągnięć sportowych;
-DOPING GENETYCZNY - polega nieterapeutycznej manipulacji genetycznej lub
selektywnej modyfikacji komórek poprzez modulację ekspresji genów, mające na
celu zwiększenie wydolność organizmu.
Międzynarodową organizacją odpowiedzialną za wspieranie, koordynowanie
i nadzorowanie walki z dopingiem w sporcie we wszystkich jego przejawach jest
Światowa Komisja Antydopingowa (ang. The World Anti-Doping Agency;
WADA). Nielegalne preparaty i metody dają możliwość poprawy wyniku
sportowego, a liczba substancji stosowanych w celu wspomagania wydolności
fizycznej i/lub psychicznej ciągle się zwiększa. Dlatego zgodnie ze Światowym
Kodeksem Antydopingowym agencja WADA corocznie publikuje nową listę
środków i metod zabronionych w sporcie (Ryc. 21).
Lista zabroniona obejmuje między innymi środki anaboliczne (np. steroidy
androgenno-anaboliczne - AAS), hormony (np. erytropoetyna - EPO, hormon wzrostu
- hGH, insulina) i związki pokrewne (np. insulinopodobne czynniki wzrostu - IGFs,
mechaniczne czynniki wzrostu - MGFs) oraz substancje antagonistyczne i modulujące
działanie hormonów (np. środki antyestrogenowe takie jak inhibitory aromatazy,
selektywne modulatory receptorów estrogenowych - SERMs).
47
Rycina 21. Podział substancji i metod zabronionych w sporcie
STEROIDY ANDROGENO-ANABOLICZNE
(ang. Anaboilc Androgenie Steroids; AAS)
Steroidy anaboliczne to syntetyczne pochodne męskiego hormonu płciowego,
testosteronu. Modyfikacje cząsteczki testosteronu maja na celu zwiększenie
właściwości anabolicznych (takich jak wzmożona synteza białek, wzrost tempa
przyrostu masy, siły i wytrzymałości mięśni) w porównaniu z niepożądanymi
właściwościami androgennymi (takimi jak łysienie typu męskiego, rozwój gruczołów
łojowych, ginekomastia, maskulinizacja czy zaburzenia emocjonalne). Wśród AAS
można wyróżnić steroidy anaboliczne pochodzenia: egzogennego (np. boldenon,
nandrolon, stanozolol, tetrahydrogestrinon) i endogenne (np. androstendiol,
testosteron, 19-norandrosteron, dihydrotestosteron).
•ŚRODKI ANABOLICZNE
•HORMONY I POKREWNE
SUBSTANCJE
•BETA-2-AGONIŚCI
•ŚRODKI ANTYESTROGENOWE
•DIURETYKI I INNE ŚRODKI
MASKUJĄCE
•METODY POPRAWIAJĄCE
TRANSPORT TLENU
•MANIPULACJE CHEMICZNE I
FIZYCZNE
•DOPING GENETYCZNY
SUBSTANCJE I METODY
ZABRONIONE W KAŻDYM CZASIE
(PODCZAS ZAWODÓW I POZA
ZAWODAMI)
•STYMULANTY
•NARKOTYKI
•KANNABINOIDY
•GLUKOKORTYKOSTEROIDY
SUBSTANCJE I METODY
ZABRONIONE PODCZAS ZAWODÓW
•ALKOHOL
•BETA-BLOKERY
SUBSTANCJE ZABRONIONE W
NIEKTÓRYCH SPORTACH
SUBSTANCJE SZCZEGÓLNE

48
Steroidy anaboliczne należą do substancji najczęściej stosowanych w dopingu
farmakologicznym. Doping AAS dotyczy przede wszystkim sportowców
uprawiających dyscypliny siłowe i siłowo-wytrzymałościowe.
ERYTROPOETYNA (EPO)
Erytropoetyna jest hormonem glikoproteinowym wytwarzanym głównie
w nerkach ale także w wątrobie, mózgu i macicy. Zasadniczym zadaniem EPO jest
stymulacja procesu namnażania i różnicowania erytrocytów z komórek macierzystych
szpiku kostnego (erytropoeza). W medycynie stosowana do leczenia anemii np.
u pacjentów z przewlekłą niewydolnością nerek, nowotworami lub AIDS. W sporcie
erytropoetyna nadużywana jest dla zwiększenia dotlenienia tkanek i poprawy
wydolności fizycznej.
GLUKOKORTYKOSTEROIDY
Glukokortykosteroidy należą do kortykosteroidów i wywołują efekt
farmakologiczny podobny do działania endogennych hormonów takich jak kortyzon
i kortyzol (hydroksykortyzon). Ze względu na działanie przeciwzapalne i obniżające
odporność immunologiczną są szeroko stosowane do celów leczniczych np.
w reumatologii, alergologii. W sporcie często nadużywane w związku ze swoimi
właściwościami przeciwbólowymi, psychostymulującymi i antystresowymi. Stosując
glukokortykosteroidy przewlekle lub w większych dawkach należy liczyć się
z zaburzeniem funkcjonowania osi podwzgórze-przysadka-nadnercza, co może
doprowadzić np. do atrofii tkanek, obniżeniu odporności organizmu, zahamowania
gojenia ran.

49
Hormony – molekuły kontrolujące łaknienie
Temat 18: Hormony głodu i sytości
Przekazywanie i przetwarzanie informacji o stanie odżywiania (koordynacja
ilość spożywanego pokarmu poprzez regulację uczucia głodu i sytości oraz
poszczególnych etapów trawienia i wchłaniania pokarmu) jest ściśle kontrolowana
przez system nerwowy oraz hormonalny. Bodźce regulujące łaknienie docierają do
ośrodkowego układu nerwowego w postaci neuroprzekaźników i hormonów.
OŚRODEK powstawania uczucia GŁODU znajduje się w jądrze pola
podwzgórzowego bocznego (LHA, ang. lateral hypothalamic area) natomiast
OŚRODEK SYTOŚCI zlokalizowany jest w jądrze brzuszno-przyśrodkowym
podwzgórza (VMH, ang. ventromedial hypothalamus). Substancje odpowiedzialne za
regulację łaknienia dzieli się na: SUBSTANCJE OREKSYGENNE, czyli
stymulujące apetyt (Ryc. 22) oraz SUBSTANCJE ANOREKSYGENNE, czyli
hamujące apetyt (Ryc. 23). Czynniki te mają informować zarówno o długofalowych
zasobach energetycznych organizmu jak i o energii dostarczonej na bieżąco, czyli w
czasie ostatniego posiłku.
Prawidłowe funkcjonowanie mechanizmów regulujących łaknienie zapewnia
równowagę między wydatkami energetycznymi organizmu a ilością przyjmowanego
pokarmu. W przypadku, gdy organizm pobiera więcej kalorii niż potrzebuje, nadmiar
składników pokarmowych jest magazynowany w tkance tłuszczowej, co może
prowadzić do OTYŁOŚCI. Natomiast, gdy wydatek energii nie jest w pełni
uzupełniany, organizm w pierwszej kolejności wykorzystuje zgromadzone zapasy
a w sytuacjach krańcowych, inne tkanki (np. w ANOREKSJI = JADŁOWSTRĘT
PSYCHICZNY).
50
Rycina 21. Regulacja łaknienia – substancje oreksygenne
Rycina 23. Regulacja łaknienia – substancje anoreksygenne
SUBSTANCJE
OREKSOGENNE
ghrelina
neuropeptyd Y
(NPY)
białko Agouti
(AgRP)
oreksyny
hormon
wzrostu (GH)
tyroksyna
(T4)
serotonina
dynorfina
galanina
norepinefryna
ß-endorfina
SUBSTANCJE
ANOREKSYGENNE
somatostatyna
insulina
leptyna
peptyd YY
(PYY)
peptyd
glukagonopodobny
(GLP-1)
peptyd
trzustkowy
(PP)
dopamina
oksyntomodul
ina (OXM)
estrogeny
serotonina
hormon
kortykotropowy
(CRH)
Cholecystokinina
(CCK)

51
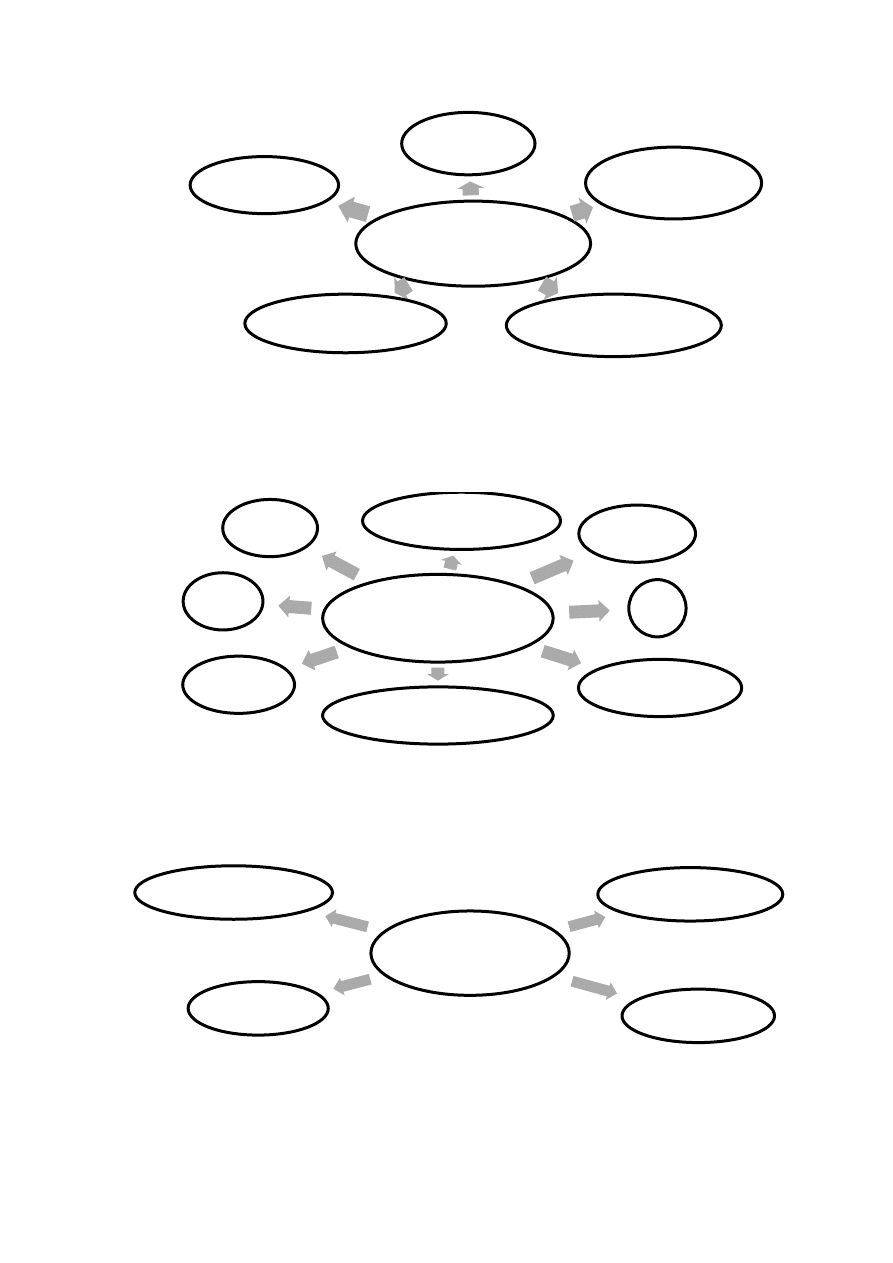
Hormony – molekuły regulujące układ sercowo-naczyniowy
Temat 19: Hormony a układ krążenia
W zależności od sposobu oddziaływania na układ sercowo-naczyniowy,
hormony można podzielić na wykazujące działanie:
PRESYJNE, czyli powodujące wzrost ciśnienia krwi (Ryc. 24)
HIPOTENSYJNE, czyli odpowiedzialne za spadek ciśnienia krwi (Ryc. 25)
CHRONOTROPOWE, czyli odpowiedzialne za zmianę częstości skurczu
mięśnia sercowego (Ryc. 26, 27)
INOTROPOWE, czyli odpowiedzialne za zmianę siły skurczu mięśnia
sercowego (Ryc. 28, 29)
Regulacja układu krążenia na poziomie endokrynnym odbywa się przede
wszystkim za pośrednictwem układu renina-angiotensyna-aldosteron (RAA),
katecholaminy oraz hormonu antydiuretycznego. Niemniej jednak w ścianie
naczyń krwionośnych i komórkach serca zidentyfikowano receptory hormonów
dotychczas niepowiązanych bezpośrednio z krążeniem. Istnieje też grupa substancji
pośrednio wpływających na układ sercowo-naczyniowy poprzez modulowanie układu
neuroendokrynnego.
Hormony zaangażowane w regulację ciśnienia krwi i pracę serca są
wydzielane zarówno przez klasyczne gruczoły dokrewne (np. tarczycę, gonady,
przysadkę) jak i wiele innych narządów (np. serce) i tkanek (np. tłuszczową).
Poznanie wzajemnych skomplikowanych wielopłaszczyznowych relacji
pomiędzy hormonami a układem sercowo-naczyniowym odgrywa ogromne znaczenie
w kontekście patologii tego układu np. nadciśnienia tętniczego, miażdżycy, choroby
niedokrwiennej serca i niewydolności krążenia a także arytmii czy kardiomiopatii.
52
Rycina 24. Hormony odpowiedzialne za wzrost ciśnienia krwi
Rycina 25. Hormony odpowiedzialne za spadek ciśnienia krwi
Rycina 26. Hormony odpowiedzialne za zwiększenie częstości skurczów mięśnia
sercowego
HORMONY
DZIAŁAJĄCE
PRESYJNIE
angiotensyna II
aldosteron
endoteliny
katecholaminy
wazopres
yna
glikokortykosteroidy
hormony
tarczycy
hormon
wzrostu
urotensyna II
leptyna
HORMONY
DZIAŁAJĄCE
HIPOTENSYJNIE
angiotensyna 1–7
peptydy
natriuretyczne
rodzina
CGRP
substancja P,
neurokinina A
grelina
PTHrP
hormony
płciowe
oksytocyna
medullipina
urodylatyna
anandamid
HORMONY
DZIAŁAJĄCE
CHRONOTROPOWO
DODATNIO
katecholaminy
endoteliny
glikokortykosteroidy
hormony tarczycy
leptyna
PTHrP
53
Rycina 27. Hormony odpowiedzialne za zmniejszenie częstości skurczów mięśnia
sercowego
Rycina 28. Hormony odpowiedzialne za zwiększenie siły skurczu mięśnia
sercowego
Rycina 29. Hormony odpowiedzialne za zmniejszenie siły skurczu mięśnia
sercowego
HORMONY
DZIAŁAJĄCE
CHRONOTROPO
WO UJEMNE
oksytocyna
angiotensyna 1–7
peptydy
natriuretyczne
substancja P,
neurokinina A
anandamid
HORMONY
DZIAŁAJĄCE
INOTROPOWO
DODATNIO
angiotensyna II
endoteliny
katecholaminy
ADH
glikokortykosteroidy
hormony
tarczycy
leptyna
PTHrP
HORMONY
DZIAŁAJĄCE
INOTROPOWO
UJEMNIE
aldosteron
rodzina
CGRP
anandamid
substancja P,
neurokinina A

54
Hormony – molekuły odpowiedzialne za stan kości
Temat 20: Hormony a proces kościotworzenia
Kość jest tkanka bardzo aktywną metabolicznie, która podlega ciągłej
przebudowie. Dzięki stale zachodzącym procesom tworzenia i resorpcji kości,
dostosowuje się ona do aktualnych warunków biomechanicznych. Za wspomniane
procesy odpowiedzialne są: osteoblasty (tzw. komórki kościotwórcze), osteocyty
(tzw. właściwe komórki kostne) i osteoklasty (tzw. komórki kościogubne).
Kościotworzenie, wzrost kości długich a także modelowanie kości związane z
wymianą ich składników, podlegają ścisłej regulacji endokrynnej (Ryc. 30).
Mechanizmy niszczenia tkanki kostnej są kontrolowane m.in. przez hormony kory
nadnerczy (kortykosteroidy) i przytarczyc (parathormon). Odbudowa zaś tkanki
kostnej następuje pod wpływem takich hormonów jak: hormony płciowe
(estrogenów i androgenów), hormonu wzrostu i kalcytoniny. Na tempo przebudowy
tkanki kostnej oraz metabolizm minerałów wpływają także hormony tarczycy
(tyroksyna i trijodotyronina).
Obok hormonalnych i prokreacyjnych czynników istnieje wiele innych
wpływających na skład kości i ich odporność na zużycie, w tym:
pierwiastki mineralne
czynniki genetyczne i demograficzne
czynniki żywieniowe i środowiskowe
choroby współistniejące
przewlekłe stosowanie niektórych leków
Masa tkanki kostnej zmienia się zasadniczo wraz z wiekiem. W pierwszych
dwudziestu latach życia jej ilość zwiększa się aby osiągnąć maksimum (tzw.
szczytową masę kostną) około 30-35 roku życia. Po 45 roku procesy kościogubne
zaczynają przeważać nad procesami kościotwórczymi. Proces ubytku tkanki kostnej,
wyraża sie początkowo narastaniem osteopenii (fizjologiczna utrata masy kostnej
wraz z wiekiem) i może przechodzić dalej w postać chorobową - osteoporozę (Ryc.
31).
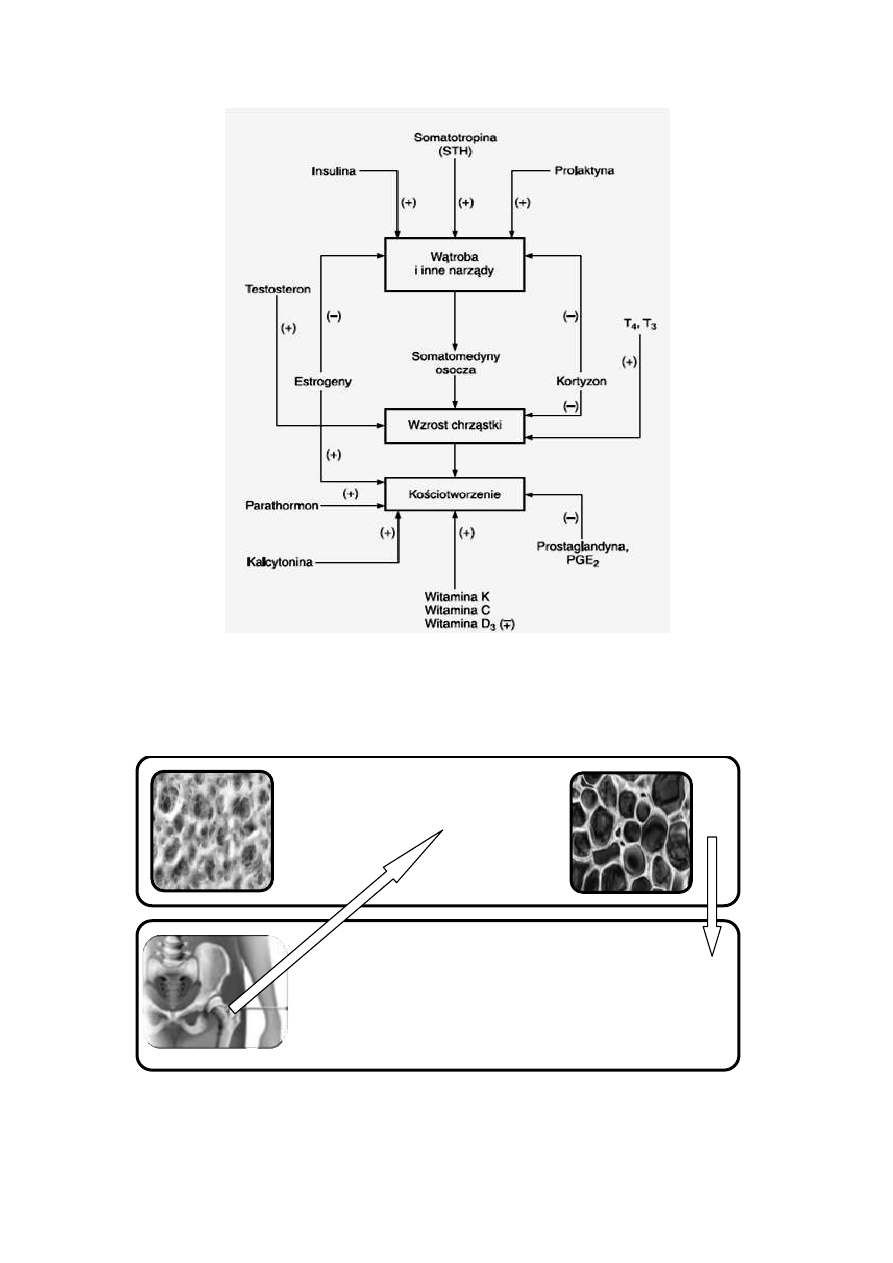
55
Rycina 30. Wpływ witamin i hormonów na procesy kościotwórcze: (+ )działanie
pobudzające, (-) działanie hamujące
[www.pzwl.pl/pdf.php/kid,751,ptitle,fragment-pdf.htm]
Rycina 31. Pojęcie osteoporozy, czyli zrzeszotnienia kości
• właściwa matryca kości
• osteoporoza
OSTEOPOROZA
- układowa choroba szkieletu charakteryzujący się
niskią masą kostną i zaburzoną strukturą przestrzenną
kości, co prowadzi do zwiększonej łamliwości kości
-
najlepszą metodą diagnostyczną jest pomiar gęstości masy kostnej (BMD) za pomocą
podwójnej absorbancji rentgenowskiej lub ilościowej tomografii komputerowej

56
Hormony – molekuły odpowiedzialne za płodność
Temat 21: Niepłodność – istotny problem społeczny
NIEPŁODNOŚĆ – czyli brak zdolności posiadania potomstwa, zdefiniowana jako
niemożność poczęcia dziecka przez parę nie stosującą antykoncepcji po
12- miesięcznym okresie regularnego współżycia płciowego.
Ze względu na duży zasięg problemu niepłodność uznana została przez
Światową Organizację Zdrowia (WHO) za chorobę społeczną. Według światowych
statystyk, problem stałej lub okresowej niepłodności dotyczy 60-80 mln par na
świecie (wg danych WHO). W Polsce częstość niepłodności jest szacowana na 14 -
20% populacji, co stanowi około 1,2 - 1,3 mln par w okresie rozrodczym.
Problem niepłodności może dotyczyć jedynie mężczyzny (tzw. niepłodność
męska) lub tylko kobiety (tzw. niepłodność żeńska), ale także obu partnerów (tzw.
niepłodność małżeńska). W około 10% przypadków nie udaje się ustalić przyczyny
niepłodności
dostępnymi
metodami
diagnostycznymi
(tzw.
niepłodność
idiopatyczna).
Badaniem i leczeniem niepłodności u kobiet zajmuje się ginekolog i
endokrynolog, a u mężczyzn androlog. Zaleca się aby w pierwszej kolejności badaniu
poddawali się mężczyźni ponieważ badania w przypadku kobiet są zdecydowanie
droższe, bardziej skomplikowane i długotrwałe a ponadto często bolesne.
Do najczęstszych powodów niepłodności zalicza są:
wady anatomiczne narządu rodnego np. macicy
problemy hormonalne,
niedrożność jajowodów,
endometrioza,
niepłodność immunologiczna,
niewłaściwa budowa lub niedobór plemników,
przyczyny psychologiczne

57
Na skalę niepłodności duży wpływ mają trendy populacyjne. Na pierwszym
miejscu wymienia się wiek kobiet, które zbyt późno podejmują decyzje o rozrodzie.
Na drugim miejscu klasyfikuje się charakter stylu życia (np. brak aktywności
fizycznej, palenie tytoniu, stres). Niewątpliwie istotne znaczenie odgrywają również
czynniki środowiskowe np. zanieczyszczenie środowiska naturalnego oraz żywności).

58
Hormony – molekuły odpowiedzialne za płodność
Temat 22: Kobieca niepłodność z przyczyn hormonalnych
Rodzaje niepłodności kobiecej:
NIEPŁODNOŚĆ PIERWOTNA (ang. sterilitas prymaria), gdy kobieta
nigdy nie była w ciąży,
NIEPŁODNOŚĆ WTÓRNA (ang. sterilitas secundaria), gdy kobieta była
już w ciąży zakończonej porodem lub poronieniem (naturalnym lub
sztucznym) i nie może ponownie zajść w ciążę,
NIEMOŻNOŚĆ DONOSZENIA CIĄŻY (ang. infertilitas), gdy kobieta nie
ma kłopotów z zajściem w ciążę, natomiast kończą się one poronieniem lub
porodem przedwczesnym
Najczęstszymi przyczynami niepłodności kobiecej są niedrożność jajowodów
(15–35%) oraz zaburzenia hormonalne (25%-40%). Badanie przyczyn kobiecej
niepłodności obejmują szereg metod wśród których można wymienić:
badania oceniające budowę narządów płciowych wraz z oceną drożności
jajowodów
(metody
obrazowe,
diagnostyczno-operacyjne
np.
histerosalpingografia, laparoskopia, histeroskopia)
badania cykli miesiączkowych (np. pomiar temperatury, oznaczenia
hormonalne, USG)
Jeżeli stwierdzi się brak owulacji, można rozpocząć diagnostykę
endokrynologiczną (hormonalną). W celu określenia relacji hormonalnej na osi
podwzgórzowo - przysadkowo - jajnikowej wykonuje się:
ocenę rezerwy jajnikowej – określa potencjał rozrodczy kobiety, gdyż jest
zależna od ilości pozostałych w jajniku pęcherzyków pierwotnych; do badania
rezerwy jajnikowej służy oznaczenie: hormonu folikulotropowego (FSH) a
także test z cytrynianem klomifenu (łączna ocena stężenia FSH i estradiolu);
wraz ze wzrostem poziomu FSH maleje prawdopodobieństwo zajścia w ciążę
nawet jeśli uda się wywołać owulację;

59
ocenę stężenia hormonu luteinizującego (LH) - oznaczenie LH w moczu
może służyć do zdiagnozowania przedowulacyjnego szczytu wydzielania LH
poprzedzającego owulację o 1-2 dni; wspólne oznaczenie stężeń FSH i LH
wykorzystuje się do w różnicowaniu pierwotnej niewydolności jajników
(choroba jajników) od wtórnej niewydolności jajników (zaburzenie czynności
jajników spowodowane chorobą przysadki lub podwzgórza);
ocena stężenia prolaktyny - podwyższone stężenie tego hormonu powoduje
obniżenie poziomu gonadotropin (zwłaszcza LH), co zaburza mechanizm
owulacji i prowadzi do niewydolności fazy lutealnej, ponadto nadmiar
prolaktyny może utrudniać pęknięcie pęcherzyka;
ocena stężenia hormonów tarczycy – niedoczynność tarczycy w istotny
sposób zmniejsza płodność poprzez zwiększenie ryzyka poronień i
przedwczesnych porodów; nadczynność tarczycy może blokować receptory
estrogenowe i prowadzić do komplikacji w ciąży;
ocena stężenia męskich hormonów płciowych - podwyższony poziom
dehydroepiandrosteronu (DHEA) lub siarczanu dehydroepiandrosteronu
(DHEAS) wskazuje na nadnerczowe, a samego testosteronu (zwłaszcza w
połączeniu z wysokim stosunkiem LH : FSH) na jajnikowe źródło nadmiaru
testosteronu;
ocena stężenia insuliny - nadmierna ilość insuliny sprzyja nadprodukcji
testosteronu i obniża poziom białka wiążącego hormony płciowe (SHGB);
ocena stężenia progesteronu - badanie progesteronu wykonuje się w celu
oceny funkcji ciałka żółtego oraz monitorowania wczesnych etapów ciąży.

60
Hormony – molekuły odpowiedzialne za płodność
Temat 23: Męska niepłodność z przyczyn hormonalnych
Przyczyny męskiej niepłodności można podzielić na:
PRZEDJĄDROWE, czyli zaburzenia endokrynne w zakresie gruczołów
podwzgórza i przysadki ale także nieprawidłowości chromosomalne oraz
przyczyny psychologiczne;
JĄDROWE, czyli wrodzone uszkodzenia jąder oraz uszkodzenia
powodowane czynnikami zewnętrznymi, np.: chemio- i radioterapia,
podniesienie temperatury w mosznie, infekcje bakteryjne i wirusowe, choroby
o podłożu autoimmunologicznym;
POZAJADROWE,
czyli zaburzenia w zakresie drożności dróg
wyprowadzających nasienie.
Diagnostyka niepłodności męskiej opiera się na badaniu przedmiotowym
(wywiad) i podmiotowym (obejrzenie i zbadanie narządów płciowych zewnętrznych i
badaniu per rectum) oraz szeregu badań laboratoryjnych (badanie nasienia tzw.
seminogram, badania na przeciwciała przeciwplemnikowe, test penetracyjny in vitro,
badania chromatyny plemnikowej, badania hormonalne).
Trzeba podkreślić, że zaburzenia hormonalne są stosunkowo rzadką przyczyną
męskiej niepłodności. W celu określenia relacji hormonalnej na osi podwzgórzowo -
przysadkowo - jądrowej wykonuje się następujące oznaczenia:
stężenia hormonu folikulotropowego (FSH) – ocena stężenia tego hormonu
ma głównie zastosowanie w diagnostyce różnicowej azoospermii (całkowity
brak plemników w ejakulacie) mechanicznej i spowodowanej nie-
prawidłowościami spermatogenezy;

61
stężenia testosteronu i hormonu luteinizującego (LH) – oceny stężenia
obydwu hormonów dokonuje się zwłaszcza w przypadku podejrzenia
hipoandrogenizmu lub atrofii jąder; w celu uniknięcia wpływ globulin
wiążących hormony płciowe, użyteczne jest oznaczanie stężeń wolnych
androgenów w surowicy;
oznaczanie prolaktyny oraz innych hormonów przedniego płata przysadki –
wzrost stężenia prolaktyny obserwuje się np. w gruczolaku przysadki.

62
Hormony – molekuły odpowiedzialne za płodność
Temat 24: Techniki rozrodu wspomaganego
TECHNIKI ROZRODU WSPOMAGANEGO (ang. assisted reproductive
technology; ART) - grupa różnorodnych metod terapeutycznych mających na celu
uzyskanie ciąży z pominięciem jednego lub kilku etapów naturalnego rozrodu
np. złożenia nasienia w pochwie, zaplemnienia, transportu zarodka do jamy macicy.
Do procedur rozrodu wspomaganego zaliczamy:
unasienienie domaciczne lub dootrzewnowe (inseminacja) nasieniem męża
(ang. artificial insemination by husband - AIH) lub anonimowego dawcy
(ang. artificial insemination by Dono - AIBD),
indukcję dojrzewania licznych pęcherzyków jajnikowych (poliowulacji) z
następowym pobraniem komórek jajowych,
hodowlę komórek jajowych w warunkach laboratoryjnych (ang. in vitro
maturation - IVM),
klasyczne zapłodnienie pozaustrojowe (ang. in vitro fertilisation - IVF),
zapłodnienie pozaustrojowe z docytoplazmatyczną iniekcją plemnika (ang.
intracytoplasmic sperm injection - ICSI),
inseminacja domaciczna (ang. intra-uterine insemination - IUI),
Dojajowodowe przenoszenie gamet (ang. gamet intrafallopian transfer -
GIFT), przezmaciczne dojajowodowe przenoszenie gamet (ang. transuterine
fallopian transfer - TUFT)
przenoszenie połączonych gamet, zygoty lub zarodka do jajowodu
(odpowiednio: ang. postnucleate stage tubal transfer - PROST; ang. zigote
intrafallopian transfer - ZIFT; ang. tubal embryo transfer - TET)
Największe europejskie towarzystwo naukowe zrzeszające różnych
specjalistów zajmujących się medycyną rozrodu (ang. European Society of Human
Reproduction and Embryology; ESHRE), od 1997 roku, zbiera informacje na temat
ilości oraz efektywności wykonanych zabiegów technikami wspomaganego rozrodu

63
w poszczególnych krajach Europy (tzw. program EMI; ang. European IVF
Monitoring). Zgodnie z zebranymi danymi, w 2006 roku, wykonano łącznie ponad
350 tysięcy cykli zapłodnienia pozaustrojowego, ponad 86 tysięcy transferów
rozmrożonych zarodków i zaledwie 247 zabiegów dojrzewania komórek jajowych in
vitro (IVM). Skuteczność metod wspomaganego rozrodu jest różna i zależy od
etiologii niepłodności, doboru pacjentek, doświadczenia ośrodka realizującego
program.
Polska jako jeden z 31 krajów europejskich od kilku lat bierze czynny udział
w programie EIM. Niestety z około 50 zidentyfikowanych ośrodków leczenia
niepłodności w Polsce do programu przystąpiło zaledwie 25. Zgodnie z raportem
"Leczenie niepłodności w Polsce w 2008 roku" dostępnym na stronie Sekcji
Płodności i Niepłodności (SPIN) Polskiego Towarzystwa Ginekologicznego
(http://spin.org.pl/raport-leczenie-nieplodnosci-w-polsce-w-2008-roku/), w Polsce
wykonano tylko 4 126 zabiegów zapłodnienia pozaustrojowego (2008). Tak niska
liczba zabiegów wskazuje na bardzo małą dostępność technik wspomaganego rozrodu
dla par z problemem niepłodności w naszym kraju.

64
Hormony – molekuły odpowiedzialne za płodność
Temat 25: Antykoncepcja hormonalna
ANTYKONCEPCJA HORMONALNA - stosowanie pojedynczych hormonów lub
ich kombinacji w celu zapobiegania ciąży (Ryc. 32).
Ze względu na skład i postać farmaceutyczną, hormonalne preparaty
antykoncepcyjne dla kobiet, można podzielić na:
zawierające estrogeny i gestageny np. dwuskładnikowe tabletki
antykoncepcyjne, plastry antykoncepcyjne, hormonalne wkładki dopochwowe;
zawierające gestageny np. jednoskładnikowe tabletki antykoncepcyjne tzw.
minitabletki, hormonalne wkładki domaciczne.
Metody kobiecej antykoncepcji oparte na preparatach hormonalnych działają
wielokierunkowo, na zasadzie sumowania się następujących mechanizmów:
hamujących owulację, poprzez upośledzenie fazy lutealnej cyklu lub
upośledzenie procesu selekcji i wzrostu pęcherzyka dominującego
utrudniających przesuwanie się komórki jajowej, poprzez zmniejszenie
perystaltyki, kurczliwości i ruchu rzęsek jajowodów
zmniejszających przepuszczalności plemników np. poprzez zwiększenie
gęstości śluzu
utrudniających implantację zarodka, poprzez wywoływanie zmian w
obrębie błony śluzowej macicy
Wciąż podejmowane są próby nad męską antykoncepcją hormonalną. Główne
problemy stworzenia tego typu antykoncepcji to: zdolność mężczyzn do wytwarzania
plemników bez przerwy (od okresu dojrzewania do późnej starości), duża objętość
wydzielanego nasienia, a także trudność zahamowania wytwarzania i dojrzewania
nasienia bez zaburzeń libido. Dotychczas opracowane metody posiadają szereg
słabych stron np. powiększenie się gruczołu prostaty czy spadek libido.
65
Rycina 32. Rodzaje stosowanej antykoncepcji
ANTYKONCEPCJA
naturalna
np. metoda rytmu
płciowego, metoda
objawowo-termiczna
chemiczna
np. substancje
plemnikobójcze
mechaniczna
np. prezerwatywy,
kapturki naszyjkowe
hormonalna
np. tabletki antykoncepcyjne,
antykoncepcyjne wkładki
domaciczne

66
Hormony – molekuły istotne dla medycyny estetycznej
Temat 26: Hormony a kondycja skóry
Budowa, funkcjonowanie i wygląd skóry zależą od wpływu wielu czynników
egzogennych (np. promieniowanie słoneczne, styl życia, uszkodzenia fizyczne i
chemiczne) i endogennych (np. stan hormonalny organizmu wraz z regulacją
nerwową i immunologiczną a także indywidualne predyspozycje genetyczne)
zmieniających się w poszczególnych fazach życia.
Ponieważ skóra jest narządem mającym liczne receptory hormonalne, dlatego
zwykle jako pierwsza reaguje na wahania poziomu hormonów w naszym organizmie.
Jej stan zależy między innymi od hormonów tarczycy, przysadki, a zwłaszcza
hormonów steroidowych. Warto w tym miejscu przypomnieć, że organizm kobiety w
dużo większym stopniu niż organizm mężczyzny podlega cyklicznym zmianom
hormonalnym. Do zmian skórnych o podłożu hormonalnym zaliczamy, między
innymi:
ŁOJOTOK, czyli wzmożone wydzielanie łoju przez gruczoły łojowe na
powierzchnię skóry;
Występowanie łojotoku jest uwarunkowane genetycznie, niemniej jednak w dużej
mierze zależy od gospodarki hormonalnej. Nadmierną stymulację gruczołów
łojowych obserwujemy przy: nadmiarze testosteron lub progesteronu, a także
niedoborze estrogenów. Problem łojotoku występuje w 80% u osób w okresie
pokwitania, a tylko w 20% dotyka osób dorosłych. Łojotok stanowi podłoże do
rozwoju wielu schorzeń w tym: łojotokowe zapalenie skóry, wyprysk łojotokowy,
trądzik pospolity, zapalenie mieszków włosowych.
SUCHA SKÓRY, czyli stan skóry polegający na jej nadmiernym
złuszczaniu i szorstkości powierzchni, zaczerwienieniu i tendencji do
pękania naskórka;
Bezpośrednią przyczynę narastającej suchości, wiotkości skóry, a następnie obniżenia
jej gęstości, zaniku włókien kolagenowych i elastylowych stanowi u kobiet niedobór

67
estrogenów. Natomiast w przypadku niedoczynności tarczycy u osób obserwujemy
bladość skóry a także jej zgrubiałość, szorstkość i słabe ucieplenie. Paznokcie łamią
się oraz tracą naturalny kolor i połysk.
PRZEBARWIENIA SKÓRY, czyli zmiany konstytucjonalnego koloru
skóry;
Zaburzenia hormonalne, stosowanie niektórych leków, ziół lub kosmetyków
zawierających substancje fotouczulające, to główne przyczyny powstawania zmian
barwnikowych. O kolorze naszej skóry decyduje przede wszystkim barwnik skóry–
melanina, ale także hemoglobina oraz barwniki karotenoidowe. Na proces
melanogenezy wpływają takie hormony jak: hormon stymulujący melanocyty (MSH;
ang. melanocyte stimulating hormon), hormony płciowe (szczególnie estrogeny) oraz
hormony tarczycy i kory nadnerczy.
NADPOTLIWOŚĆ, czyli nadmierne wydzielanie potu nieadekwatne do
sytuacji.
Wzmożone pocenie się z reguły świadczy o nadmiarze hormonów tarczycy i jest
jednym z pierwszych objawów jej nadczynności. Skóra jest wówczas stale wilgotna,
zaczerwieniona i ciepła.

68
Hormony – molekuły istotne dla medycyny estetycznej
Temat 27: Hormony a wzrost i kondycja włosów
HIRSUTYZM, czyli nadmierne owłosienie typu męskiego występujące u kobiet
spowodowane zwiększonym działaniem androgenów i/lub zwiększoną wrażliwością
skóry na ich działanie
Głównymi przyczynami kobiecej androgenizacji, prowadzącej między innymi
do hirsutyzmu są:
wzrost produkcji androgenów przez jajniki
wzrost produkcji androgenów przez nadnercza
wzrost produkcji bardziej aktywnych metabolitów androgenów
wzrost wrażliwości tkanek docelowych na androgeny
obniżenie ilości białek wiążących androgeny
spadek klirensu androgenów
hiperandrogenizacja jatrogenna
Rycina 33.
Skala nasilenia owłosienia ciała kobiet
wg Ferriman i Gallway
(ocenianych jest 9 regionów ciała: warga górna, broda, klatka piersiowa, nadbrzusze,
podbrzusze, ramiona, uda, plecy, okolice pośladków; w każdej ocenianej okolicy jest
przyznawane od 0-4 pkt., punktem odcięcia jest 8 pkt i powyżej tej wartości rozpoznaje się
hirsutyzm) [http://www.awog.it/index.php?option=com_content&view=frontpageplus&limitstart=15]
69
ŁYSIENIE ANDROGENOWE, czyli uwarunkowany genetycznie, najczęściej
występujący typ łysienia (95% wszystkich przypadków łysienia), dotykający zarówno
kobiet jak i mężczyzn, choć mężczyzn o wiele częściej.
W patogenezie łysienia androgenowego i hirsutyzmie główną rolę odgrywa
dihydrotestosteron (DHT), który jest metabolitem testosteronu powstającym przy
udziale 5α-reduktazy. Drugim ważnym enzymem jest aromataza cytochromu P-
450 która odpowiada za konwersję testosteronu do estradiolu. Zaburzenie właściwej
proporcji estradiol/testosteron także prowadzi do tego typu zaburzeń owłosienia.
Receptory dla androgenów są zlokalizowane w jądrach komórkowych
mieszków włosowych. Mieszki włosowe w różnych okolicach ciała wykazują
zmienną
wrażliwość
na
działanie
androgenów.
W
tzw.
okolicach
androgenozależnych przemiany androgenów prowadzą do przekształcenia włosów
meszkowych we włosy ostateczne (efekt: hirsutyzm). Z kolei w mieszkach
włosowych tzw. okolic androgenowrażliwych (np. czołowa) androgeny powodują
atrofię i przekształcenie grubych, długich włosów terminalnych we włosy cienkie,
meszkowe (efekt: łysienia androgenowe). Androgenoniezależne mieszki włosowe
występują w rzęsach, brwiach i włosach potylicznej części głowy, dlatego też nie
obserwuje się utraty włosów w tej okolicy ani u mężczyzn, ani u kobiet z tym typem
łysienia.
Rycina 34. Wpływ
dihydrotestosteronu na komórki mieszka włosowego okolicy
androgenowrazliwej
DHT
skraca czas trwania fazy
annagenu, czyli wzrostu
włosa
wydłuża okres, w
którym mieszek
włosowy wytwarza
nowy włos po utracie
włosa telogenowego
powoduje
miniaturyzację mieszka
włosowego, co prowadzi
do powstawania włosów
coraz krótszych,
cieńszych i jaśniejszych
70
Rycina 35. Androgeny o różnej aktywności biologiczne
Diagnoza androgenizacji na poziomie hormonalnym opiera się na:
oznaczeniu
stężenia
wolnego
oraz
całkowitego
testosteronu,
dihydroepiandrosteronu oraz estrogenów (badania podstawowe);
oznaczenie stężenia hormonów tarczycowych: TSH (tyreotropina), T4
(tyroksyna, tetrajodotyronina) oraz ferrytyny (badania zalecane);
oznaczenie stężenia prolaktyny, LH (lutropina), FSH (folitropina) (badania
uzupełniające).
GŁÓWNE
ANDROGENY
siarczan
dehydroepiandrosteronu
(DHEAS)
dehydroepiandrosteron
(DHEA)
androstendion
dihydrotestosteron
(DHT)
testosteron

71
Hormony – molekuły istotne dla medycyny estetycznej
Temat 28: Fitoestrogeny w kosmetyce
FITOESTROGENY (ang. phytoestrogens) – grupa związków chemicznych
pochodzenia roślinnego o budowie i funkcji podobnej do naturalnych estrogenów;
uczestniczą u roślin w procesie fotosyntezy (absorpcja promieniowania UV) oraz w
procesach odpornościowych; dzieli się je na 3 grupy: flawonoidy (Ryc. 33),
kumestany i lignany.
W latach 80
‐tych XX wieku wielką popularnością cieszyły się preparaty
kosmetyczne zawierające estrogeny zwierzęce. Przeciwdziałały one naturalnym
procesom starzenia się skóry poprzez poprawę jej elastyczności oraz spłyceniu
zmarszczek. Okazało się jednak, że stosowanie kosmetyków zawierających estrogeny
pochodzenia zwierzęcego nie ogranicza ich efektów jedynie do miejsca aplikacji
środka. Udowodniono wiele ogólnoustrojowych działań ubocznych tego typu
preparatu. Z tego powodu w wielu krajach (także w Polsce), zabroniono stosowania w
kosmetyce hormonów estrogennych pochodzenia zwierzęcego.
Alternatywą dla estrogenów zwierzęcych stały się substancje roślinne
wykazujące działanie estrogenowe. Fitoestrogeny wykazują bardzo silne właściwości
przeciwutleniające oraz przeciwwolnorodnikowe. Stymulują syntezę proteoglikanów
stanowiących jeden ze składników zewnątrzkomórkowych skóry. Poprawiają
kondycję skóry wpływając pozytywnie na jej ukrwienie, nawilżenie i uelastycznienie.
Dzięki temu zmniejszają ilość i głębokość zmarszczek, są więc bardzo wartościowymi
składnikami kosmetyków przeciwdziałających starzeniu i fotostarzeniu się skóry,
zwłaszcza kobiet w okresie menopauzy.
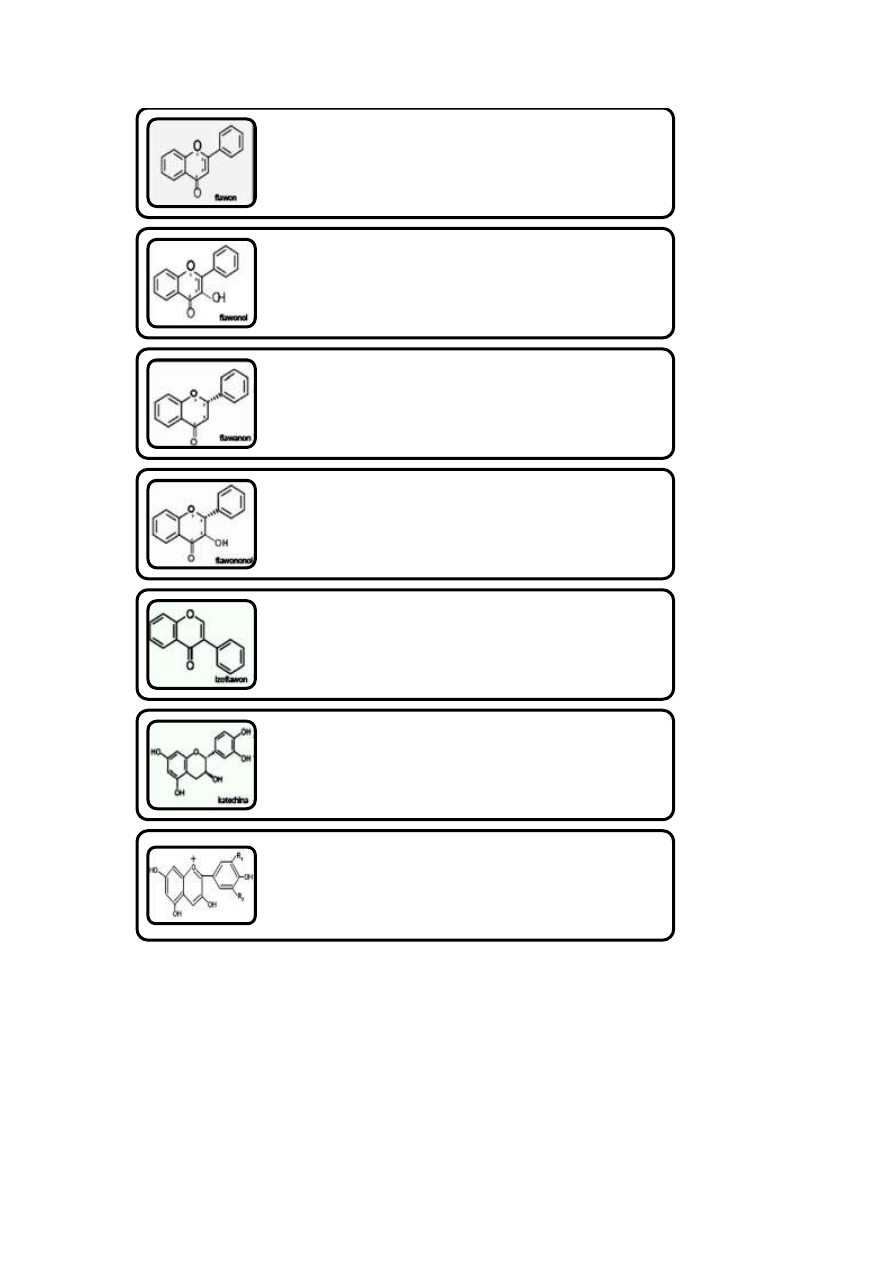
72
Rycina 33. Podział flawonoidów ze względu na budowę chemiczną
FLAWONY
• luteolina, apigenina
FLAWONOLE
• kwercetyna, kemferol, mircetyna, moryna
FLAWANONY
• hysperydyna, naringenina, eryodocytol
FLAWANONOLE
• pinobanksyna, taksyfolina
IZOFLAWONY
• daizeina, genisteina, glicyteina
KATECHINY
• katechina, galusen, epigalakatechiny, tefalwin
ANTOCJANY
• cyjanidyna, delfinidyna, malwidyna,
pelargonidyna, peonidyna, petunidyna

73
Hormony – molekuły zaangażowane w proces nowotworzenia
Temat 29: Od hormonozależności do hormonooporności
(na przykładzie raka gruczoły krokowego)
Zaliczany do klasy nowotworów hormonozależnych rak gruczołu krokowego
składa się w rzeczywistości z subpopulacji komórek (tzw. heterogenność
nowotworów), cechujących się odmienną wrażliwością na hormony – androgeny:
komórki bezwzględnie zależne od androgenów, które obumierają bez
androgenów,
komórki względnie zależne od androgenów, które przestają się dzielić bez
androgenów, jednak nie obumierają,
komórki niezależne od androgenów, które dzielą się pod nieobecność
androgenów.
W czasie leczenia hormonalnego, w wyniku tzw. selekcji środowiskowej
następuje, promowanie wzrostu komórek o mniejszej wrażliwości na androgeny i/lub
hormononiezależnych. Ponadto następuje również tzw. adaptacja komórek
nowotworowych do nowych warunków i/lub dalsza ich ewolucja genetyczna (Ryc.
34).
Zidentyfikowano kilka dróg mogących przyczyniać się do rozwoju
hormonooporności komórek nowotworowych raka stercza:
DROGA PRZEZ NADWRAŻLIWOŚĆ (ang. hypersensitive pathway) –
obejmuje m.in. amplifikację regionu zawierającego geny dla AR
i wytworzenie większej liczby receptorów androgenowych w komórkach raka
stercza; zwiększenie wrażliwości receptorów androgenowych i w konsekwen-
cji ich aktywację mimo znacznie obniżonego stężenia androgenów; wykazano,
że pewne koaktywatory np. białko Ara70 posiadają zdolność zwiększenia
ekspresji genów AR i mogą odpowiadać za zmianę wrażliwości i swoistości
tego receptora.
DROGA NIESPECYFICZNEGO WIĄZANIA (ang. promiscuous
parthway) – na skutek nabywania mutacji w obrębie genu AR receptory
androgenowe mogą być aktywowane przez inne hormony np. estrogeny także
przez niesterydowe antyandrogeny.

74
DROGA NIEUPRAWNIONEJ AKTYWACJI (ang. outlaw pathway) –
receptory dla hormonów steroidowych są aktywowane przez mechanizmy
niezależne od hormonalnego ligandu (np. czynniki wzrostu lub cytokiny);
czynniki wzrostu takie jak: IGF-1, KGF, EGF aktywują kinazy tyrozynowe
(PTKs), które następnie przez aktywację np. szlaku białkowej kinazy B/Akt
lub kinaz aktywowanych miogenem (MAPK) przyczyniają się do fosforylacji
AR; wykazano, że zdolność receptorów steroidowych do transkrypcjonalnej
aktywacji genów pobudzających proliferację, zależy od sposobu ich
ufosforylowania
DROGA PRZEZ OMINIĘCIE (ang. bypass pathway / parallel pathway) -
aktywacja alternatywnych szlaków sygnałowych: autokrynnych, parakrynnych
lub endokrynnych nasilających proliferację komórek nowotworowych i/lub
osłabiających procesy apoptotyczne; przykładowo aktywacja molekuły BCL-2
chroni komórki raka stercza przed programowaną śmiercią w środowisku
pozbawionym testosteronu.
75
Rycina 34. Etapy powstawania nowotworu hormonoopornego
NOWOTWÓR HORMONOOPORNY
nowotwór niereagujący na żadne manipulacje hormonalne
NOWOTWÓR HORMONONIEZALEŻNY
nowotwór ulegający progresji w czasie pierwszego leczenia hormonalnego gdzie u
większości pacjentów zmiana parametrów hormonoterapii prowadzi do przejściowej regresji
NOWOTWÓR HORMONOZALEŻNY
nowotwory pochodzące z tkanek, których prawidłowy wzrost i czynność kontrolowane są
przez jeden lub kilka hormonów; nowotwór poddający się leczeniu hormonalnemu
76
Hormony – molekuły zaangażowane w proces nowotworzenia
Temat 30: Hormonoterapia w leczeniu nowotworów
Nowotwory hormonozależne zgodnie ze swoją nazwą wywodzą się z tkanek,
których wzrost, różnicowanie, metabolizm i czynności komórek podlegają mniejszej
lub większej regulacji hormonalnej (Ryc. 35). W leczeniu tego typu nowotworów,
obok chirurgii, radioterapii i chemioterapii, istotną rolę odgrywa także
hormonoterapia. Wrażliwość komórek nowotworowych na leczenie hormonalne jest
uwarunkowane obecnością specyficznych receptorów zlokalizowanych na ich
powierzchni, w cytoplazmie lub jądrze komórkowym.
NOWOTWORY
HORMONOZALEŻNE
NOWOTWORY
O ŚREDNIEJ
HORMONONIEZALEŻNOŚCI
rak sutka
rak gruczołu krokowego
rak trzonu macicy
rak jajnika
rak szyjki macicy
rak tarczycy
rak nerki
Rycina 35. Nowotwory hormonozależne
Zasada leczenia hormonalnego polega na zmniejszeniu wytwarzania
hormonów i/lub ograniczeniu ich działania na komórki docelowe, poprzez:
mechanizm ablacyjny (polega na usunięciu narządu produkującego hormony, które
sprzyjają rozwojowi nowotworu np. kastracja chirurgiczna, radiologiczna lub
farmakologiczna) lub mechanizm addytywny (polega na podawaniu hormonów lub
substancji podobnych do hormonów, które poprzez działanie antagonistyczne lub na
drodze konkurencji hamują wzrost guza).

77
Hormonoterapia nowotworów znajduje zastosowanie w:
leczeniu noadiuwantowym/indukcyjnym – ma na celu poprawę wyników
leczenia miejscowego i doprowadzenie do możliwości przeprowadzenia
radykalnego leczenia chirurgicznego lub radykalnej radioterapii;
leczeniu uzupełniającym/adiuwantowym – na celu zmniejszenie ryzyka
wznowy miejscowej i rozsiewu nowotworu, wydłużenie całkowitego czasu
przeżycia; stanowi uzupełnienie leczenia operacyjnego i/lub radioterapii;
leczenie objawowym/paliatywnym – ma na celu łagodzenie dolegliwości
i objawów związanymi z nawrotami miejscowymi oraz przerzutami
nowotworowymi z wykorzystaniem działania anabolicznego, przeciwzapal-
nego, przeciwobrzękowego i przeciwbólowego.

78
LITERATURA
CZĘŚĆ I
Berg J.M, Stryer L, Tymoczko J.L, Biochemia Wydawnictwo Naukowe PWN
2009
Grzanka
A,
Jarząb
J,
Niegenomowy
mechanizm
działania
glikokortykosteroidów, Pneumonologia i Alergologia Polska 2009; nr 4: 387–
393
http://www.histologia.cm-uj.krakow.pl/Cytobiologia/Materialy/REC2.doc.
Kopij M, Rapak A, Rola receptorów jądrowych w procesie śmierci komórek,
Postępy Hig Med Dosw. 2008; 62: 571-581
Kowalik M. K, Rękawiecki R, Kotowica J, Genomowy i niegenomowy wpływ
progesteronu na komórki żeńskiego układu rozrodczego, Medycyna Wet.
2008; 64: 528-532
Krzymowskiego T, Przały J, Fizjologia zwierząt, PWRiL 2005.
Kurłowicz A, Budowa i działanie hormonów. Rola hormonów w organizmie
człowieka
[http://biochemiawnoz.wum.edu.pl/files/biochemiawnoz/Hormony.pdf]
Matthews H.R, Freedland R.A, Miesfeld R.L, Biochemia i Biologia
molekularna w zarysie, Prószyński i S-ka SA 2000
Modrzyński M, Zawisza E, Rapiejko P, Tarchalska-Kryńska B, Receptory
komórkowe i zasady komunikacji międzykomórkowej. Część I, Medycyna
Rodzinna 2001
Modrzyński M, Zawisza E, Rapiejko P, Tarchalska-Kryńska B, Receptory
komórkowe i zasady komunikacji międzykomórkowej. Część II Medycyna
Rodzinna 2001
Modrzyński M, Zawisza E, Rapiejko P, Tarchalska-Kryńska B, Receptory
komórkowe i zasady komunikacji międzykomórkowej. Część III Medycyna
Rodzinna 2001; 3/4: 145-147
Murray R.K, Granner D.K, Rodwell V.W, Kokot F, Koj A, Kozik A, Wilczok
T, Biochemia Harpera PZWL 2008
Świtalska M, Strządała L, Niegenomowe działanie estrogenów, Postępy Hig
Med Dosw. 2007; 61: 541-547

79
Witkowska-Zimny M, Oś podwzgórze-przysadka-nadnercze.
[http://zp.baran.be/wp-content/uploads/2008/01/s14_witkowska-zimny_os-
podwzgorze-przysadka-nadnercze.pdf]
CZĘŚĆ II
Augustynek A. Różne oblicza agresji
[http://winntbg.bg.agh.edu.pl/skrypty2/0073/roz10.pdf]
Bakalczuk S, Bakalczuk G, Jakiel G, Andropauza-mit czy rzeczywistość.
Przew Lek, 2002; 5 (7): 64-65
Bazela K, Dąbowska R, Tyszczuk B, Dzwigałowska A, Rogiewicz K, Eris I,
Dermokosmetyki do pielęgnacji skóry z przebarwieniami– ocena skuteczności
działania, Dermatologia Estetyczna 2010; 12, 5: 320-326
Chłosta P, Postępy w chemioterapii raka stercza: początek nowej ery. Urologia
Polska 2006; 59; 3 - na podstawie pracy: KJ. Pienta, DC. Smith. Advances in
Prostate Cancer Chemotherapy: A New Era Begins
1
CA Cancer J Clin 2005;
55:300-318
Chrostowski K, Doping genowy-nowe zagrożenie dla sportu Sport
wyczynowy 2005; 9/10: 489-490
Czerwiński
E,
Osieleniec
J,
Patogeneza
osteoporozy
[http://www.osteoforum.pl/materialy/pdf/200620051441202849734.pdf]
, Borówka A, Mechanizmy leżące u podstaw hormonooporności
raka stercza. Urologia Polska 2006; 59; 3
Dytfeld J, Pupek-Musialik D, Hormony przewodu pokarmowego regulujące
łaknienie: oś jelito – mózg, Endokrynologia, Otyłość i Zaburzenia Przemiany
Materii 2005; 2: 24–30
Feldman B.J, Feldman D, The development of androgen-independent prostate
cancer. Nature Reviews Cancer 2001; 1: 34-45
Grieb P, Teoria ewolucji zakochania, Wiedza i Życie 1996; 5.
Karasek M, Hormony młodości? Endokrynol Pol. 2007; 58 (2): 153-161
Kazimierczak M, Bielecka-Grzela S, Klimowicz A, Łysienie androgenowe u
kobiet jako problem estetyczny i psychologiczny, Rocznik Pomorskiej
Akademii Medycznej w Szczecinie 2008; 54, 3: 126–129

80
Kędzierski W, Mechanizm działania estrogenów na ośrodki centralnego
układu nerwowego regulujące zachowanie seksualne samic, Medycyna Wet.
2009; 65
Kokot-Kierepa M, Rechberger T, Menopauzalna terapia hormonalna (MHT) u
kobiet na różnych etapach okresu przekwitania. Przegląd Menopauzalny 2008;
4: 194–197
Kondarewicz A, Urban F, Marchlewicz M, Wiszniewska B, Estrogeny w
męskim układzie płciowym, Postępy Biochemii Komórki 2008; 4, 35: 499-
516
Konturek S, Cześnikiewicz-Guzik M, Rola osi mózgowo-jelitowej w kontroli
przyjmowania pokarmu. – aspekty teoretyczne i praktyczne Pediatria
Współczesna 2004; 6/4: 351-359
Kostowski W, Współczesne kierunki badań nad patomechanizmem stresu
i depresji i ich znaczenie w kształtowaniu poglądów na działanie leków
przeciwdepresyjnych, Psychiatria 2004; 2: 63–71
Kozłowski W, Szacikowska E, Współczesna interpretacja niepowodzeń
hormonoterapii raka piersi. Współczesna Onkologia 2001; 5; 3: 99–104
Krasnodębski J, Ćwiklicki J, Zapłodnienie pozaustrojowe – temat nadal
aktualny, Gin Prakt 2009; 1: 36-39
Krysiak P, Okopień B, Gdula-Dymek A, Terapia testosteronem u pacjentów z
andropauzą. Wiad Lek 2007; 60(7–8): 356–364
Kulik R, Techniki wspomaganego rozrodu - rozwijający się rynek
[http://www.libramed.com.pl/wpg/numeryarchiwalne/18/05.html]
Kwiatkowski M, Borek D, Żukowski N, Glukokortykoidy w świetle
przepisów antydopingowych, Sport wyczynowy 2006; 1/2: 493-494
Leczenie niepłodności w Polsce w 2008 roku Sekcja Płodności i Niepłodności
PTG (RAPORT) [http://spin.org.pl/raport-leczenie-nieplodnosci-w-polsce-w-
2008-roku/]
Liwa E, Studzińska T, Tatara M.R, Glikokortykosteroidy a metabolizm i
wzrost kości, Medycyna Wet. 2006; 62, 4: 377-379
Łaczmański Ł, Mędraś M, Metabolizm testosteronu w aspekcie kontroli
antydopingowej, Pol J Endocrinol 2009; 60: 58–62

81
Łąck K, Czyżyk K, Hormony a układ sercowo-naczyniowy, Endokrynologia
Polska 2008; 5: 420-432
Markiewicz-Grodzicka E, Hormonoterapia nowotworów. Nowa Medycyna /
Onkologia 2003; 4; 3
McLachlan R.I, Diagnostyka niepłodności męskiej i testy czynnościowe
nasienia (Tłumaczenie: Kretowicz P.)
[http://www.google.com/search?hl=pl&q=Diagnostyka+niep%C5%82odno%
C5%9Bci+m%C4%99skiej+i+testy+czynno%C5%9Bciowe+nasienia]
Mędraś M, Endokrynologia wysiłku fizycznego sportowców z zarysem
endokrynologii ogólnej, MedPharm 2010
Mędraś M, Jóźków P, Zastosowanie testosteronu i steroidów androgenno-
anabolicznych w sporcie, Pol J Endocrinol 2009; 60: 204–209
Milewicz A, Bohdanowicz-Pawlak A, Endokrynologia przekwitania i
starzenia. Przew Lek, 2002; 5 (5): 88-92
Nogal P, Lewiński A, Jadłowstręt psychiczny (anorexia nervosa),
Endokrynologia Polska 2008; 2: 148-155
Olejek A, Binkiewicz P, Bodzek P, Królak I, Problematyka interpretacji
wyników badań hormonalnych wykonywanych w diagnostyce niepłodności,
Gin Prakt 2004, 12; 6: 18-24
Ostrowska Z, Wołkowska-Porywa K, Kos-Kudła B, Świętochowska E, Marek
B, Kajdaniuk D, Pol. Meerk. Lek. 2008; 124: 389-393
Ostrowski K,Histologia, PZWL 1995
Pertyński T, Menopauzalny okres życia kobiety. Przew Lek, 2002; 5 (1/2): 69-
71
Pertyński T, Stachowiak G, Menopauza — fakty i kontrowersje. Endokrynol
Pol. 2006; 5 (57): 525–534
Piłkowski P, Pokrywka A, Mamcarz A, Niedozwolone wspomaganie
farmakologiczne w sporcie a układ sercowo-naczyniowy, Kardiol Pol 2008;
66: 91–98
Pratzer B, Miłość jak narkotyk, Wiedza i Życie 1999; 5
Prusak M. Mechanizm działania preparatów antykoncepcyjnych, Życie i
płodnośc 2009;3: 39-51

82
Rokowska-Waluch A, Kałużyńska K, Chojnicki M, Pawlaczyk M, Wpływ
zmian hormonalnych zachodzących w organizmie kobiety na stan skóry,
Przegl Dermatol 2009; 96: 205–210
Senkus-Konefka E, Wełnicka-Jaoekiewicz M, Jassem J, Rola hormonoterapii
u chorych na raka gruczołu krokowego. Współczesna Onkologia 2003; 7; 3:
198–205
Skalba P, HRT roku 2006. Endokrynol Pol. 2005; 6 (56): 952-955
Skałba P, Szanecki W, Cieoelik K, Melatonina – stale odkrywany hormon.
Gin Prakt 2006, 4: 22-25.
Skałba P, Szanecki W, Nowo poznane neuropeptydy wpływające na
rozrodczość, Ginekologia Praktyczna 2007; 4
Skoczylas A, Więcek A, Ghrelina, nowy hormon uczestniczący nie tylko w
regulacji apetytu, Wiadomości Lekarskie 2006; 9: 697-701
Skowrońska-Jóźwiak E, Lewiński A, Osteoporoza u kobiet i u mężczyzn —
podobieństwa i różnice, Endokrynologia Polska 2006; 3: 260-266
Szamatowicz M, Hormonalna dwuskładnikowa antykoncepcja– dlaczego,
kiedy, jak? Gin. Prakt. 2008; 1, 7: 69-76
Światowa
Agencja
Antydopingowa
(WADA)
Światowy
Kodeks
Antydopingowy;
LISTA
ZABRONIONA
2010;
STANDARD
MIĘDZYNARODOWY
[http://www.antydoping.pl/plik/2009/File/2009/01/lista_zabroniona_wada_20
10_pl.pdf]
Trznadel-Budźko E, Rotsztejn H, Wpływ hormonów na hamowanie procesu
starzenia się skóry, Przegląd Menopauzalny 2007; 6: 381–383
Trznadel-Budźko E, Rotsztejn H, Wpływ hormonów na hamowanie procesu
starzenia się skóry, Przegląd Menopauzalny 2007; 6: 381–383
Wiechno W, Demkow T, Zasady postępowania u chorych na
hormonoopornego raka stercza Przeglądzie Urologicznym 2006; 7/5; 39
Wojanowska D, Chodorowska G, MARIA Juszkiewicz-Borowiec J, Sucha
skóra– patogeneza, klinika i leczenie, PDiA 2003; 2: 98–105
Woroń J, Korbut R, Wpływ starzenia na rytmy biologiczne człowieka -
implikacje terapeutyczne. Endokrynol Pol . 2005; 6(56): 956-959
Zagrodzka J, Skąd w nas tyle zła? Wiedza i Życie 1999; 11

83
Zdrojewicz Z, Dubińska K, Seks a neuroprzekaźniki. Adv Clin Exp Med 2004,
13; 4: 719–724
Zdrojewicz Z, Miłość, hormony i seks, Continuo 2005
Ziemba O, Mroczna strona medalu, Wiedza i Życie 2000; 9
www.pzwl.pl/pdf.php/kid,751,ptitle,fragment-pdf.htm
Wyszukiwarka
Podobne podstrony:
Neuronalne i molekularne podstawy uzależnienia od opiatów
Molekularne podstawy chorób infekcyjnych
Molekularne podstawy chorób roślin 1 4
10 02 podstawy endokrynologi
Molekularnej podstawy starzenia się
Molekularne podstawy karcinogenezy
egzamin endokrynologia2, Studia - ratownictwo medyczne, 2 rok, podstawy endokrynologii
5 Molekularne podstawy dziedziczenia cech
MOLEKULARNE PODSTAWY EWOLUCJI 1 Nieznany
Molekularne podstawy ruchliwości komórek wykład
MOLEKULARNE PODSTAWY DZIEDZICZNOŚCI, pedagogika, semestr II, biomedyczne podstawy rozwoju i wychowan
Endrykrynologia (2), Studia - ratownictwo medyczne, 2 rok, podstawy endokrynologii
Molekularne podstawy
molekularne podstawy ewolucji (ewolucja, biologia, encyklopedia) GKY6LJTIYZOPGBRYWURATYV4IYM65PUVQEL
referat molekularne podstawy blizn i bliznowców
więcej podobnych podstron