
Postępy Biochemii 59 (1) 2013
53
Agata Nowak-Stępniowska
Paulina Pergoł
Alfreda Padzik-Graczyk
Pracownia Biochemii, Instytut Optoelektroni-
ki, Wojskowa Akademia Techniczna, Warsza-
wa
Pracownia Biochemii, Instytut Optoelektroni-
ki, Wojskowa Akademia Techniczna, ul. Kali-
skiego 2, 00-908 Warszawa; tel.: (22) 683 70 17,
e-mail: agata_nowak_stepniowska@interia.pl
Artykuł otrzymano 22 lipca 2012 r.
Artykuł zaakceptowano 11 października 2012
r.
Słowa kluczowe: metoda fotodynamiczna,
fotouczulacze, reaktywne formy tlenu, nowo-
twory
Wykaz skrótów: 5-ALA (ang. 5-aminolaevulinic
acid) — kwas 5-aminolewulinowy; CIN (ang.
cervical intraepithelial neoplasia) — wewnątrzna-
błonkowa neoplazja szyjki macicy; EPR (ang.
enhanced vascular permeability and retention)
— wzmożona przepuszczalność naczyniowa
oraz zatrzymywanie cząsteczek w tkance no-
wotworowej; MLA (ang. methyl ester of 5-ALA)
— ester metylowy kwasu 5-aminolewulinowe-
go; PACT (ang. photodynamic antimicrobial che-
motherapy) — fotodynamiczna antybakteryjna
chemioterapia; PDD (ang. photodynamic dia-
gnosis) — diagnostyka fotodynamiczna; PDT
(ang. photodynamic therapy) — terapia fotody-
namiczna; ROS (ang. reactive oxygen specious)
— reaktywne formy tlenu; RRP (ang. recurrent
respiratory papillomatosis) — nawracająca bro-
dawczakowatość układu oddechowego
Metoda fotodynamiczna diagnostyki i leczenia
nowotworów — mechanizmy i zastosowania
STRESZCZENIE
N
owotwory są diagnozowane u ponad kilku milionów ludzi rocznie. Ze względu m.in.
na słabą antygenowość jak i lekooporność większości nowotworów, PDT może stać się
efektywną alternatywną, bądź uzupełniającą do chirurgii, metodą leczenia. PDT wymaga
trzech elementów: fotouczulacza, źródła światła oraz tlenu. PDT jest z sukcesem stosowana
w wielu klinikach na świecie, również w Polsce. Terapia ta jest wykorzystywana w leczeniu
schorzeń onkologicznych (m.in. nowotwory głowy, szyi, płuc, przełyku, trzustki, pęcherza
moczowego, narządu rodnego), jak i nieonkologicznych (liszaj twardzinowy, gronkowiec
złocisty, brodawczakowatość).
WPROWADZENIE — METODA FOTODYNAMICZNA
Pomimo ogromnego postępu w medycynie, wciąż wiele osób na świecie
umiera z powodu zbyt późnej diagnozy lub braku skutecznych metod leczenia
nowotworów (m.in. oporność wielolekowa komórek nowotworowych w che-
mioterapii stanowi poważny problem kliniczny).
Metoda fotodynamiczna jest nową obiecującą techniką diagnozowania (PDD
— Photodynamic Diagnosis) i leczenia (PDT — Photodynamic Therapy) nowo-
tworów, która została zaakceptowana i jest obecnie stosowana w wielu klinikach
[1]. Metoda ta cieszy się dużym uznaniem, ponieważ pozwala przede wszyst-
kim na selektywne niszczenie tkanki nowotworowej bez zbędnych uszkodzeń
tkanek zdrowych. Cechuje się znacznie mniejszymi efektami ubocznymi w po-
równaniu do standardowych terapii (chirurgia, radio- i chemioterapia) [2,3].
Poza zastosowaniami onkologicznymi PDD i PDT znalazły także zastosowanie
w leczeniu wielu schorzeń nieonkologicznych [4].
Terapia fotodynamiczna (PDT) wymaga trzech składników [5]:
• fotouczulacza, który uczula tkankę nowotworową na działanie światła;
• źródła światła, zdolnego do wzbudzenia skumulowanego w tkance nowo-
tworowej fotouczulacza — źródło światła wzbudzającego musi być dobrane
do stosowanego fotouczulacza (pasmo emisji źródła światła musi się pokry-
wać z pasmem absorpcji fotouczulacza — jest to warunek zainicjowania reak-
cji fotochemicznej);
• tlenu rozpuszczonego w tkance.
MECHANIZMY DZIAŁANIA
Znane są dwa główne mechanizmy reakcji fotodynamicznej, które są ściśle
uzależnione od stężenia tlenu w środowisku reakcji [5-7]. W przypadku obu ty-
pów mechanizmów początkowe reakcje przebiegają podobnie (Ryc. 1). W wy-
niku absorpcji fotonu (fotouczulacz naświetlany światłem o długości fali pokry-
wającej się z jego maksimum absorpcji) fotouczulacz przechodzi z singletowego,
podstawowego stanu energetycznego (
1
P
0
) do wzbudzonego stanu singletowe-
go (
1
P
*
). Część energii
zostaje wypromienio-
wana w postaci kwantu
fluorescencji (składowa
diagnostyczna — PDD),
a część energii na skutek
przejścia
międzysys-
temowego (ISC) prze-
prowadza fotouczulacz
do wzbudzonego stanu
trypletowego (
3
P
*
) (skła-
dowa terapeutyczna —
PDT).
Rycina 1. Reakcje zachodzące w mechanizmie typu I oraz II [5].
54
www.postepybiochemii.pl
W mechanizmie typu I (niskie stężenie tlenu w środo-
wisku reakcji) zachodzą dalej następujące przemiany (Ryc.
1). Między wzbudzonym stanem trypletowym fotouczu-
lacza (
3
P
*
) a substratem (RH) czyli tkanką nowotworową
dochodzi do przeniesienia atomu wodoru lub elektronu,
co prowadzi do wytworzenia rodników (R
·
i PH
·
) i aniono-
rodników (P
·-
i RH
·-
) fotouczulacza i substratu, które reagu-
ją z tlenem będącym w podstawowym stanie trypletowym
(
3
Σ
g
3
O
2
), prowadząc do wytworzenia reaktywnych form tle-
nu (ROS, ang. reactive oxygen species), które niszczą tkankę
nowotworową w procesie utleniania [5,6]. Powstanie anio-
norodnika ponadtlenkowego (O
2
·-
) generuje w środowisku
fizjologicznym kolejne ROS (Ryc. 2) [8].
W mechanizmie typu II (wysokie stężenie tlenu w środo-
wisku reakcji), zachodzą dalej następujące przemiany (Ryc.
1). W wyniku przejścia fotouczulacza do wzbudzonego sta-
nu trypletowego (
3
P
*
), dochodzi do przekazania energii mię-
dzy fotouczulaczem we wzbudzonym stanie trypletowym
(
3
P
*
) a cząsteczką tlenu (
3
Σ
g
3
O
2
), znajdującego się w podsta-
wowym stanie trypletowym (przekazanie energii między
cząsteczkami jest dozwolone, ponieważ oba indywidua
występują w tym samym stanie spinowym). W ten sposób
generowany zostaje tlen w stanie wzbudzonym, tzw. tlen
singletowy (
1
∆
g
1
O
2
*
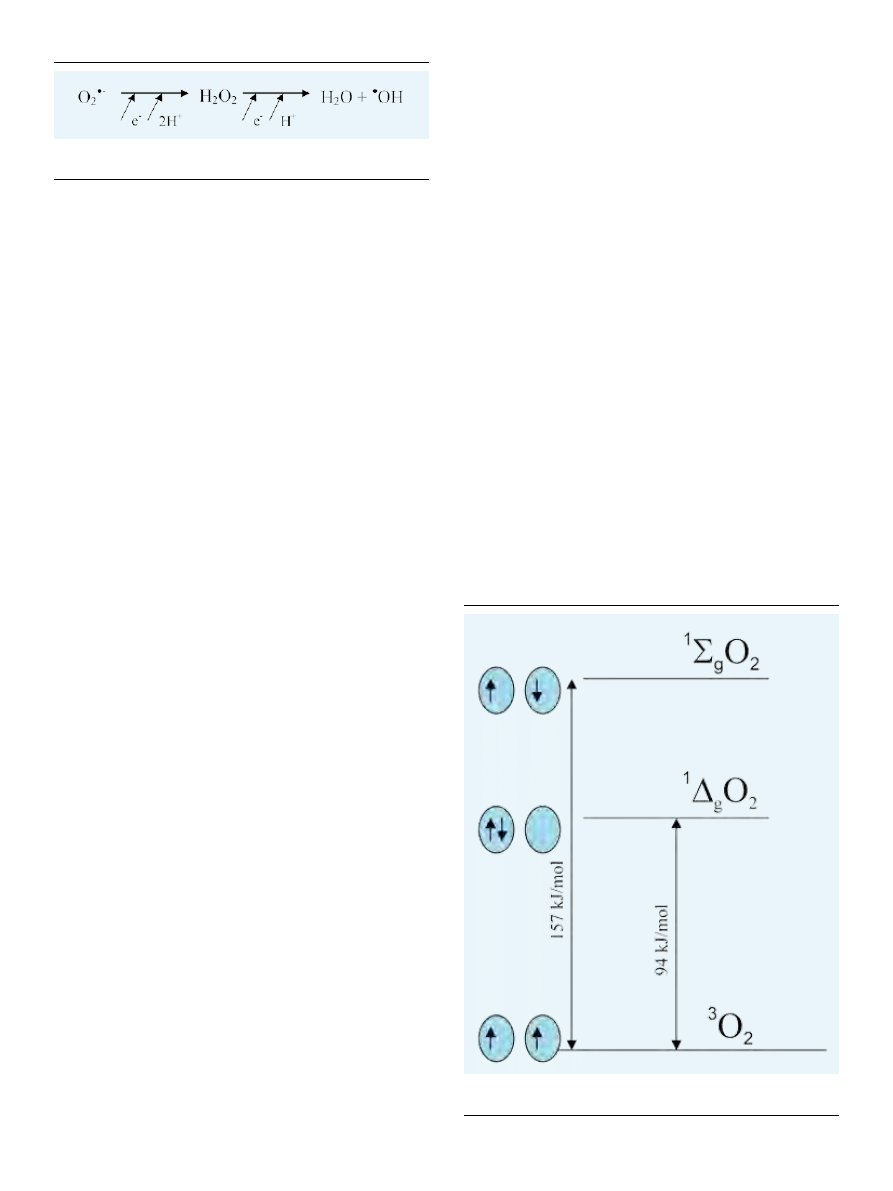
) o silnych właściwościach utleniających.
Stan singletowy charakteryzuje się tym, że wszystkie elek-
trony w atomie są sparowane (spiny antyrównoległe). Na-
tomiast w stanie trypletowym mogą występować atomy
oraz cząsteczki, które posiadają dwa niesparowane elek-
trony (spiny równoległe). Większość związków organicz-
nych występuje w podstawowym stanie singletowym. Tlen
charakteryzuje się trypletowym stanem podstawowym, a
wzbudzonym singletowym. W związku z tym tlen posia-
dając dwa niesparowane elektrony może reagować tylko z
cząsteczką mającą również dwa niesparowane elektrony.
Reaktywność tlenu jest ograniczona, ponieważ znaczna
część cząsteczek ma sparowane elektrony. Dlatego też tlen
w stanie trypletowym, ze względu na trudność ze znale-
zieniem odpowiednich reagentów do reakcji dwuelektro-
nowej, reaguje zazwyczaj ze związkami jednoelektronowo
tj. poprzez przyjęcie od nich jednego elektronu i generując
wolne rodniki. Istnieją dwie formy tlenu singletowego: del-
ta (
1
∆
g
1
O
2
*
) i sigma (
1
Σ
g
1
O
2
*
) (Ryc. 3) [8,9]. W reakcji fotody-
namicznej główną rolę odgrywa jedynie niższy wzbudzony
stan singletowy delta (
1
∆
g
), ponieważ jest to stan metastabil-
ny charakteryzujący się stosunkowo długim okresem półtr-
wania [5].
Mechanizm typu II jest dominujący ze względu na tleno-
wy charakter organizmu ludzkiego. Spadek stężenia tlenu
w czasie, w tkance poddanej fotodynamicznej terapii, jest
proporcjonalny do stężenia fotouczulacza i dawki energii
[7]. W miarę wyczerpywania się tlenu zaczyna przeważać
mechanizm typu pierwszego.
Wolne rodniki są w przeważającej większości czynnika-
mi silnie utleniającymi, ale ze względu na krótkie okresy
półtrwania niszczą struktury komórkowe w najbliższym
sąsiedztwie ich powstawania. Natomiast tlen singletowy
charakteryzuje się dostatecznie długim okresem półtrwania
w środowisku wodnym, aby utlenić także struktury komór-
kowe poza obrębem jego powstania [5].
Reaktywne formy tlenu generowane w wyniku reakcji
fotodynamicznej to czynniki o dużym potencjale destruk-
cyjnym. Czynniki te w pierwszej kolejności niszczą błony
komórek oraz organelli subkomórkowych w szczególności
błony plazmatyczne i mitochondrialne. Jednakże wszystkie
składniki subkomórkowe ulegają uszkodzeniu w zależności
od lokalizacji fotouczulaczy w komórce [5,8,9].
FOTOUCZULACZE
Fotouczulacze stosowane w diagnostyce i terapii metodą
fotodynamiczną muszą spełniać wiele warunków takich jak
[5]:
• powinny być związkami chemicznie czystymi, o znanym
i trwałym składzie;
• powinny wykazywać minimalną toksyczność w ciemno-
ści i być toksyczne tylko w obecności światła;
• powinny selektywnie zatrzymywać się w tkance nowo-
tworowej przez co najmniej kilkadziesiąt godzin;
• nie powinny dawać efektów fototoksycznych w zdro-
wych tkankach;
Rycina 2. Reakcje kolejnych redukcji anionorodnika ponadtlenkowego (w opar-
ciu o [9], zmodyfikowano).
Rycina 3. Formy tlenu singletowego w roztworach wodnych (w oparciu o [9],
zmodyfikowano).
Postępy Biochemii 59 (1) 2013
55
• powinny charakteryzować się wysoką reaktywnością
fotochemiczną, zdolnością do efektywnej produkcji tle-
nu singletowego i innych reaktywnych form tlenu oraz
długim czasem życia stanu trypletowego, co jest podsta-
wą wysokiej cytotoksyczności dla komórek nowotworo-
wych;
• powinny powodować jak najmniejsze skutki uboczne;
• pasma absorpcji fotouczulaczy nie powinny pokrywać
się z pasmami absorpcji barwników wewnątrz organi-
zmu (endogennych).
W rzeczywistości do tej pory nie znaleziono fotouczu-
lacza, który spełniałby wszystkie te wymogi. Najbardziej
rozpowszechnioną grupą fotouczulaczy są pochodne porfi-
rynowe jak protoporfiryna IX [10]. W latach 70. hematopor-
firyna (Hp) oraz mieszaniny pochodnych hematoporfiryny
(HpD) były najczęściej stosowanymi fotouczulaczami okre-
ślanymi jako pierwsza generacja fotouczulaczy. Pionierskie
wysiłki Doughertiego i innych z Centrum Onkologii Ro-
swell Park dały początek rozwojowi PDD i PDT. Dougherty,
Kessel i współpracownicy z sukcesem wyizolowali dimery
i oligomery do n = 8 z HpD tworząc Photofrin II. Jego dzia-
łanie okazało się dwukrotnie skuteczniejsze w stosunku do
stosowanych przez Lipsona pochodnych hematoporfiryny
(HpD). Dzięki temu terapia fotodynamiczna zaczęła być
stosowana w klinikach, a fotouczulacze dostępne komercyj-
nie [5,6].
W latach 80. powstała druga generacja fotouczulaczy
pochodzących z różnych rodzin chemicznych jak: TPPS
n
—
sulfonowana tetrafenyloporfiryna [11], ftalocyjaniny cynko-
we i glinowe [12], m-THPC — meso-tetra(hydroksyfenylo)
chloryny [13], chloryna e6 [14], m-THPP — meso-tetra(3-
-hydroksyfenylo) porfiryna [15], merocyjanina 540 [16],
hyperycyna [17] czy pochodne błękitu metylenowego [18].
Ogromne zainteresowanie wzbudziło także zastosowanie
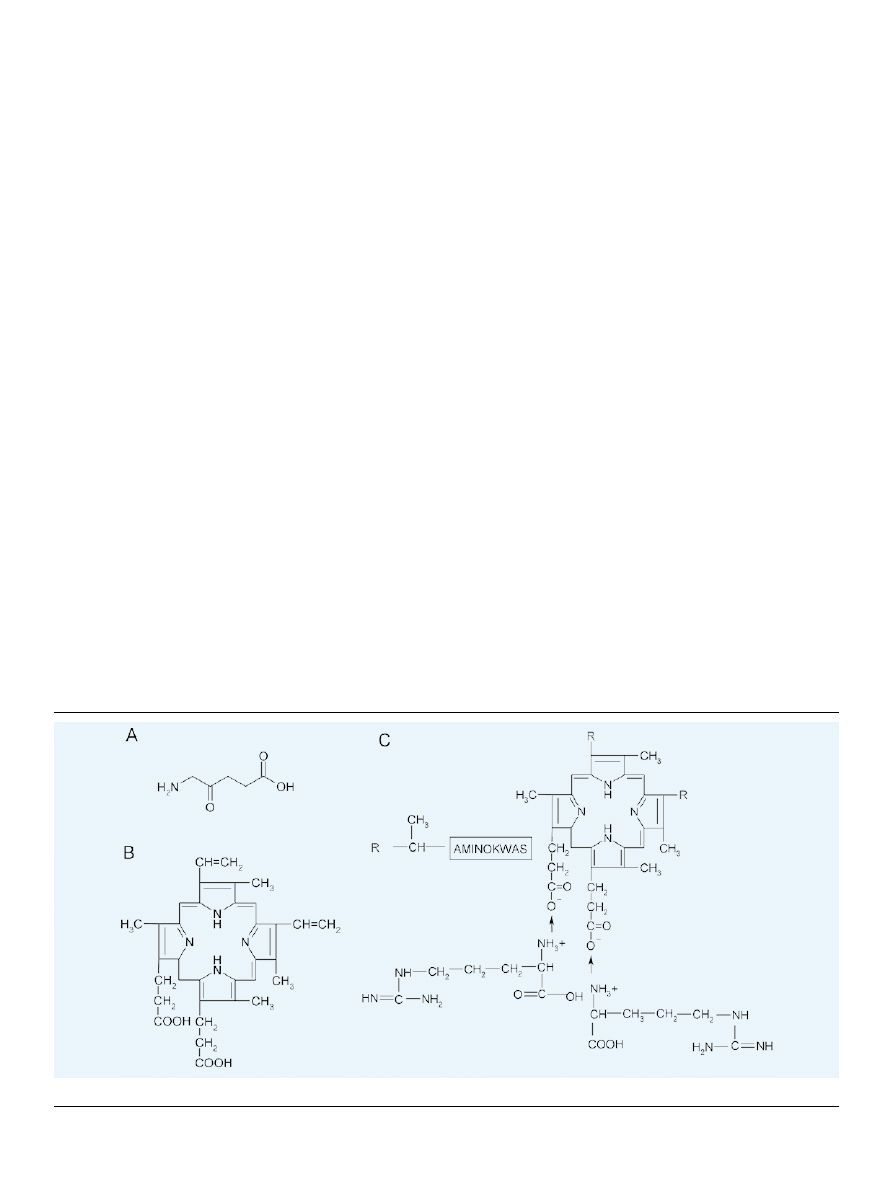
kwasu 5-aminolewulinowego (ALA) (Malik i Lugaci, rok
1987), który jest prekursorem endogennej protoporfiryny IX
— ligandu hemu (Ryc. 4a,b) [5].
Liczne badania pokazują, że najlepsze właściwości wy-
kazują fotouczulacze amfifilowe. Posiadają one w swej
strukturze domeny lipofilowe i zwykłe łańcuchy boczne
wykazujące właściwości hydrofilowe. Związki amfifilowe
dobrze kumulują się w komórkach nowotworowych, gdyż
są podwójnie umocowane; częścią cząsteczki w strukturach
lipidowych, a podstawnikami bocznymi w wodnej części
komórki [5].
W Pracowni Biochemii i Spektroskopii Instytutu Opto-
elektroniki Wojskowej Akademii Technicznej w Warsza-
wie opracowano technologię otrzymywania i oczyszczania
nowej klasy fotosensybilizatorów amfifilowych, będących
diaminokwasowymi pochodnymi protoporfiryny PP(dA-
A)
2
Arg
2
(Ryc. 4c) [19]. Opis otrzymywania PP(dAA)
2
poda-
no w patentach [20,21]. Związki te wykazują właściwości
lipofilowe i tylko w niewielkim stopniu rozpuszczają się w
wodzie. W celu uzyskania związków rozpuszczalnych w
wodzie dwie grupy karboksylowe w resztach kwasu pro-
pionowego pierścienia porfirynowego, wysolono argininą
uzyskując połączenia jonowe, co opisują patenty [22,23]. W
ten sposób otrzymuje się związki PP(dAA)
2
Arg
2
dobrze roz-
puszczalne w wodzie, ale jednocześnie dobrze dyfundujące
przez błony biologiczne.
Założono, że przyłączenie aminokwasowych podstaw-
ników do pierścienia porfirynowego zwiększy efektywność
oddziaływania z receptorami błonowymi komórek nowo-
tworowych, co powinno się przyczynić do ułatwienia trans-
portu tych związków do wnętrza komórek i skuteczniej
zwalczać komórki nowotworowe [5,24,25].
Kilka innych fotouczulaczy jest obecnie używanych eks-
perymentalnie w różnych fazach badań przedklinicznych i
klinicznych.
Rycina 4. Struktury związków: a — 5-ALA, b — protoporfiryny IX, c — PP(dAA)
2
Arg
2
.

56
www.postepybiochemii.pl
SUBKOMóRKOWA LOKALIZACJA FOTOUCZULACZY
Oddziaływanie fotouczulacza z komórkami w obrębie
tkanki docelowej lub nowotworowej znacząco wpływa na
wynik PDT. Kluczowym parametrem tych oddziaływań
jest subkomórkowa lokalizacja fotouczulaczy, ponieważ
fotouczulacze mogą lokować się w obrębie wielu różnych
organelli komórkowych takich jak: mitochondria, lizosomy,
siateczka śródplazmatyczna, aparat Golgiego i błony ko-
mórkowe. Wewnątrzkomórkowa lokalizacja w komórkach
zależy m.in. od struktury fotouczulacza. Fotouczulacze, któ-
re są hydrofobowe mają dwu lub mniejszy ładunek ujemny
(tj.-2,-1,0 itd) mogą dyfundować przez błonę komórkową i
potem przemieścić się do błony organelli wewnątrzkomór-
kowych. Te fotouczulacze także mają zdolność największej
absorpcji w komórkach in vitro, a zwłaszcza gdy są obecne
w stosunkowo niskim stężeniu w obrębie komórkowego
medium. Fotouczulacze, które są mniej hydrofobowe mają
większy niż dwa ładunek ujemny (tj.-2,-3,-4 itd) są zbyt po-
larne, aby dyfundować przez błonę i są w związku z tym
pochłaniane w mechanizmie endocytozy. Absorpcja foto-
uczulacza przez komórki nowotworowe jest kluczowa dla
efektywnego PDT, ponieważ ROS mają krótki okres pół-
trwania i działają blisko miejsca ich powstania. Poznanie
lokalizacji fotouczulacza jest ważne by wybrać najbardziej
efektywny fotouczulacz dla każdego zastosowania [26].
FARMAKOKINETYKA I BIODYSTRYBUCJA
FOTOUCZULACZY
Podany dożylnie fotouczulacz może przyłączyć się do
różnych białek surowicy, co wpływa na jego farmakokine-
tykę i biodystrybucję w obrębie ciała ludzkiego. Farmako-
kinetyka fotouczulaczy zależy od miejsca jego kumulacji
oraz od tego jak mocno wiąże się w obrębie specyficznego
obszaru docelowego (np. komórek nowotworowych). Ta-
kie właściwości farmakokinetyczne fotouczulacza mogą
bezpośrednio wpływać na parametry luminescencji i de-
terminować stopień niszczenia komórek nowotworowych.
Kontakt fotouczulaczy, związanych z białkami surowicy, z
powierzchnią komórek śródbłonka umożliwia związanie z
przydanką naczyń (zewnętrznej błony ściany naczyń). Od
tego etapu, fotouczulacz może albo wiązać się z zewnątrz-
komórkową macierzą albo lokować w obrębie komórek no-
wotworowych. W końcowym etapie, fotouczulacz jest usu-
wany z obszaru docelowego przez naczynia limfatyczne lub
krwionośne i wydalany przez wątrobę lub nerki. Końcowy
efekt PDT w stosunku do komórek nowotworowych zależy
od tego, w którym stadium wchłaniania fotouczulacz zosta-
nie wzbudzany przez światło o odpowiedniej długości fali
[26].
BIOLOGICZNE ASPEKTY ODPOWIEDZI ORGANIZMU
NA TERAPIę FOTODYNMICZNĄ (PDT)
Efekt fotodynamiczny przez szereg lat był uważany jako
efekt działający lokalnie, czyli tylko w tej tkance, w której
został wywołany [5].
Obecnie wiadomo, iż reakcja PDT prowadzi do ogól-
noustrojowej antynowotworowej reakcji immunologicznej
[27,28]. W przypadku nowotworów indukowanych przez
wirusy, układ odpornościowy może rozpoznawać taki an-
tygen wirusowy i go unieszkodliwić. Identyfikacja antyge-
nów związanych z nowotworami jest niezwykle trudna w
przypadku nowotworów nie wywołanych wirusami.
Większość nowotworów posiada mechanizmy, które
utrudniają ich eliminację z organizmu.
Należą do nich m.in.:
• słaba antygenowość,
• częste reakcje krzyżowe z antygenami własnymi,
• immunosupresja,
• zmienność antygenowa.
Komórki nowotworowe charakteryzują się zdolnością
rekrutowania pewnych komórek ze szpiku i krwioobiegu.
Są to m.in. makrofagi, granulocyty, komórki tuczne i fibro-
blasty. Niektóre z rekrutowanych komórek, głównie makro-
fagi i fibroblasty, pod wpływem komórek nowotworowych
podlegają przeprogramowaniu fenotypowemu. W ten spo-
sób powstają charakterystyczne dla nowotworów makro-
fagi TAM (ang. Tumor Associated Macrophages) i fibroblasty
CAF (ang. Carcinoma Associated Fibroblast). Te zmienione
komórki wraz z pozostałymi zrekrutowanymi przez nowo-
twór komórkami łącznie z macierzą pozakomórkową two-
rzą tzw. mikrośrodowisko nowotworowe. To środowisko i
komórki nowotworowe są odpowiedzialne za angiogenezę
i immunosupresję [29,30].
PDT powoduje lub wzmaga odpowiedź antynowotwo-
rową, niszczy strukturę nowotworu i tym samym umoż-
liwia bezpośrednie oddziaływanie pomiędzy komórkami
układu immunologicznego a nowotworowymi, prowadząc
do ogólnoustrojowej antynowotworowej odpowiedzi im-
munologicznej. PDT prowadzi do śmierci komórek nowo-
tworowych na drodze bezpośredniej i pośredniej. Śmierć
na drodze bezpośredniej obserwuje się w wyniku naświe-
tlania, gdy energia jest przekazywana z fotouczulacza w
stanie wzbudzonym do tlenu cząsteczkowego tworząc tlen
singletowy (typ II). Te wysoce reaktywne cząsteczki powo-
dują bezpośrednie fotouszkodzenie białek, tłuszczów i in-
nych cząsteczek w miejscu kumulacji fotouczulacza, prowa-
dząc bezpośrednio do śmierci komórek nowotworowych w
mechanizmie nekrozy i/lub apoptozy. Należy wspomnieć,
że mechanizm śmierci zależy od wielu czynników. Naj-
ważniejsza jest wewnątrzkomórkowa lokalizacja fotouczu-
lacza, ponieważ uszkodzenie mitochondriów generalnie
prowadzi do apoptozy, podczas gdy uszkodzenie np. błon
plazmatycznych może opóźnić lub zatrzymać apoptozę
i indukować nekrozę [31]. Z kolei dawka energii wpływa
na generację nekrozy albo apoptozy. Wysoka dawka ener-
gii dezaktywuje enzymy (kaspaza 3), które są niezbędne
do wywołania apoptozy i prowadzi zazwyczaj do nekrozy
[27,28].
Obserwuje się różnice w ogólnoustrojowej odpowiedzi
immunologicznej, ponieważ nekroza w większym stopniu
niż apoptoza prowadzi do stanu zapalnego, co stanowi
pierwszy krok indukcji specyficznej odpowiedzi immuno-
logicznej.
Fototoksyczne zmiany w śródbłonku naczyń tkanki no-
wotworowej wywołane przez PDT prowadzą do trwałego
niedotlenienia komórek nowotworowych. Efekt naczynio-

Postępy Biochemii 59 (1) 2013
57
wy wywołany PDT prowadzi do zwiększonej przepuszczal-
ności naczyń, okluzji naczyń, a w rezultacie niedokrwiennej
śmierci pozostałych komórek nowotworowych (ścieżka po-
średnia).
Bezpośredni efekt PDT na komórki odpornościowe może
być szkodliwy. Limfocyty kumulują fotouczulacz i też
mogą zostać zniszczone przy naświetlaniu, prowadząc do
lokalnej supresji układu immunologicznego [27,28].
Komórki układu immunologicznego są znajdowane w
podstawie tkanki nowotworowej, oddzielone od komó-
rek nowotworowych przez zewnątrzkomórkową macierz.
PDT niszcząc strukturę tkanki nowotworowej umożliwia
bezpośrednie oddziaływanie między komórkami układu
immunologicznego a nowotworowymi. Po początkowym
uszkodzeniu komórek nowotworowych i komórek układu
odpornościowego silna reakcja zapalna zachodzi lokalnie,
która aktywuje i przyciąga nieuszkodzone leukocyty z in-
nych miejsc. Fotouszkodzenie błon prowadzi do aktywacji
fosfolipaz błonowych powodując masowe uwalnianie pro-
duktów hydrolizy lipidów i metabolitów kwasu arachido-
nowego [30,32]. Oba te czynniki są mediatorami zapalenia.
Co więcej zmiany w ścianach naczyń krwionośnych przy-
ciągają neutrofile i płytki krwi [33-36]. Te komórki uwal-
niają więcej mediatorów zapalnych, które mają właściwo-
ści chemotaktyczne zdolne do masowej rekrutacji komórek
układu odpornościowego i przemieszczania ich do miejsca
uszkodzenia. PDT jest związana z ekspresją genów i pro-
dukcją białka wielu cytokin: IL-1b, IL-2, IL-6, IL-10, TNF-a,
G-CSF [37,38]. Te cytokiny są ważnymi białkami regulujący-
mi proces zapalny. Uwalnianie tych czynników chemotak-
tycznych z tkanki nowotworowej powoduje przyciąganie i
kumulację nielimfoidalnych komórek charakterystycznych
dla procesu zapalnego. Kilka minut po zakończeniu reak-
cji PDT duża liczba neutrofilów przemieszcza się do tego
obszaru [27,28]. Inwazja neutrofilów poprzedza rekrutację
komórek tucznych, limfocytów T, monocytów i makrofa-
gów [27,28]. Fagocyty usuwają martwe komórki [27,28]. W
celu zwalczenia i długoterminowej kontroli nowotworu jest
ważna ścieżka pośrednia jak i bezpośrednia.
Ze względu na wpływ terapii fotodynamicznej na układ
immunologiczny podejmuje się próby modulacji przeciw-
nowotworowej odpowiedzi immunologicznej z wykorzy-
staniem PDT i elementów układu odpornościowego. Poni-
żej opisano jedną z metod.
MODULACJA PRZECIWNOWOTWOROWEJ
ODPOWIEDZI IMMUNOLOGICZNEJ Z UDZIAŁEM
KOMóREK DENDRYTYCZNYCH I PDT
Odpowiedź immunologiczna jest aktywowana m.in.
przez sygnały niebezpieczeństwa (zagrożenia), rozpozna-
wane przez komórki, które stanowią odporność wrodzo-
ną. Z tych komórek, komórki dendrytyczne (profesjonalne
komórki prezentujące antygen limfocytom T) są głównym
łącznikiem między wrodzoną a nabytą odpowiedzią im-
munologiczną [39]. Jednym z najważniejszych czynników
komórkowych indukowanych w wyniku PDT (który jest
uwalniany z nekrotycznych komórek nowotworowych) jest
zewnątrzkomórkowe HSP70 należące do rodziny białek
szoku cieplnego HSPs [40].
Ekspresję genów, które kodują HSPs indukuje wiele
szkodliwych czynników zarówno egzo- jak i endogennych,
na jakie narażona jest komórka (m.in. wolne rodniki, róż-
ne typy promieniowania). W warunkach prawidłowych,
zawartość HSP70 jest niska, wzrasta dopiero w warun-
kach stresu. Rola m.in. HSP70 w procesie nowotworzenia
związana jest przede wszystkim z ich antyapoptotycznymi
właściwościami, gdyż główną funkcją HSPs jest ochrona
przed czynnikami stresu. Co więcej HSP70 i inne (HSP90
i GRP96) zidentyfikowano w przestrzeni pozakomórkowej.
Okazuje się, że zewnątrzkomórkowo umiejscowione białka
biorą udział w odpowiedzi immunologicznej jak również
wpływają na reakcję zapalną, czego wynikiem jest synteza
cytokin zapalnych [41,42].
Komórki dendrytyczne posiadają specyficzne receptory
dla HSPs. Indukcja HSPs w wyniku PDT może stanowić
sygnał zagrożenia stymulujący różnicowanie komórek den-
drytycznych i indukcję syntezy cytokin, włączając IL-15 i
IL-12, a przez to wzmagać prezentację antygenu limfocy-
tom T CD8
+
). Dlatego prowadząc hodowlę komórek den-
drytycznych w obecności lizatu komórek nowotworowych
uszkodzonych PDT można wzmóc przeciwnowotworową
odpowiedź immunologiczną [40].
RODZAJE ŚMIERCI KOMóRKOWEJ
Uszkodzenia komórkowe mogą prowadzić do:
• nekrozy (stanowi szybką i nagłą śmierć komórek, która
obejmuje całe grupy komórek powodując ostry stan za-
palny na skutek utraty integralności błony komórkowej
i wycieku zawartości komórki. Nagłe uwolnienie dużej
objętości masy białkowej może spowodować nieodwra-
calne zatkanie kanalików nerkowych i poważne kompli-
kacje zdrowotne) [5,43-46].
• apoptozy (programowana śmierć trwa znacznie dłużej
niż nekroza. Ponieważ nie następuje utrata integralno-
ści błony nie dochodzi do ostrego zapalenia w obrębie
leczonej tkanki. Dodatkowo, badania in vitro pokazują
obecność oddziaływań między komórką uszkodzoną a
nieuszkodzoną w wyniku PDT. Reakcja ta ma charakter
kaskadowy. Uszkodzona komórka indukuje apoptozę w
komórce nieuszkodzonej co jest zjawiskiem korzystnym
zwłaszcza w przypadku guzów o dużej masie, kiedy to
światło nie może tak głęboko dotrzeć) [5,31,43-52].
• autofagii (trwają badania nad znaczeniem tego mechani-
zmu w procesie PDT) [53].
Ogólnie rzecz biorąc, odpowiedź komórkowa na uszko-
dzenie zależy od kilku czynników sklasyfikowanych jako
zewnętrzne (stężenie fotouczulacza, dawka energii) i we-
wnętrzne (metabolizm komórkowy, faza cyklu komórko-
wego) mających wpływ na wrażliwość komórek na PDT.
Lokalizacja subkomórkowa fotouczulacza wpływa na to czy
zajdzie apoptoza i w jakim stopniu zajdzie indukcja apop-
tozy w wyniku PDT [31]. PDT może bowiem prowadzić
do apoptozy lub nekrozy albo do kombinacji tych dwóch
mechanizmów [43-46]. Z tych względów, w metodzie PDT,
dąży się do generowania śmierci ze znaczną przewagą
apoptozy w stosunku do nekrozy.
58
www.postepybiochemii.pl
Obecnie trwają prace nad optymalizacją warunków reak-
cji fotodynamicznej leczenia różnego typu nowotworów jak
i chorób nienowotworowych. Poniżej zestawiono obszary
medycyny, gdzie z powodzeniem stosuje się metodę PDT w
leczeniu różnych schorzeń.
ZASTOSOWANIA PDD I PDT
ZASTOSOWANIA PDT W LECZENIU NOWOTWORóW
Przełyk
Choroby przełyku można z powodzeniem diagnozować
i leczyć metodą PDT. W UK PDT zaakceptowano do lecze-
nia chorób przełyku [54,55].
Płuca
PDT jest metodą stosowaną w leczeniu nowotworów
płuc. PDT z użyciem lasera Nd:YAG w przypadkach pa-
liatywnych przedłuża czas życia do nawrotu choroby. W
jednym z badań leczono 144 pacjentów w zaawansowanym
stadium nowotworu. U wszystkich pacjentów występowa-
ło 50% zwężenie światła oskrzeli, powodujące duszności.
Wszyscy pacjenci odpowiedzieli na leczenie PDT. Po 8 tygo-
dniach średnica światła oskrzeli wzrosła do 58% u wszyst-
kich pacjentów, zmniejszając duszności. Średnie przeżycie
wyniosło 5 miesięcy. Wśród pacjentów z wczesnym sta-
dium leczono 16 osób. PDT indukowało kompletną odpo-
wiedź już po 1 zabiegu. U osób z nawrotami choroby dalsze
zabiegi PDT również dały kompletną odpowiedź. Średnia
życia wyniosła 69 miesięcy [54,55].
Trzustka
Opisywane są próby kliniczne z wykorzystaniem foto-
uczulaczy: sulfonowanej ftalocyjaniny glinu (AlsPc), kwasu
5-ALA i mTHPC. W badaniach na ludziach (mTHPC (0,15
mg/kg i dawka energii z zakresu 20-40 J) z 16 pacjentów 7
przeżyło więcej niż rok (średnia życia 9,5 miesiąca) [54,55].
Głowa i szyja
PDT w leczeniu nowotworów głowy i szyi jest atrakcyjną
propozycją. mTHPC stosuje się w Europie do leczenia no-
wotworów głowy i szyi. U pacjentów z wczesnym rakiem
płasko-komórkowym 85% zostało wyleczonych (97 z 114
pacjentów). W przypadku stadium zaawansowanego no-
wotworu w badaniu z 45 osób 12 nie zareagowało na lecze-
nie (średnia życia 2 miesiące). U reszty średnia życia wynio-
sła 16 miesięcy [54,55].
Mózg
W przypadku glejaka wielopostaciowego stosuje się za-
bieg chirurgiczny przy wsparciu obrazowania z użyciem
5-ALA i PDT z wykorzystaniem Photofrinu. W jednym z
badań klinicznych na 27 pacjentów (kontrola 14, a 13 leczo-
nych) — przeżycie wyniosło 52,8 tygodni w stosunku do
24,6 tygodni u nie leczonych osób [54,55].
Terapia fotodynamiczna jako nieinwazyjna metoda zna-
lazła olbrzymie zastosowanie w dermatologii w leczeniu
zmian przednowotworowych, nowotworowych jak i nieno-
wotworowych.
W przypadku zmian nowotworowych w dermatolo-
gii [56] stosuje się dwa główne proleki, 5-ALA i jego ester
metylowy (MLA). Główne wskazania dermatologiczne do
miejscowego stosowania PDT to powierzchniowe nieme-
lanomowe nowotwory skóry i dysplazje (nieprawidłowa
budowa tkanki lub narządu powstająca w okresie rozwo-
jowym). Silnie pigmentowane raki jak melanoma nie odpo-
wiadają dobrze po leczeniu PDT, ponieważ melanina absor-
buje promieniowanie czerwone.
Poniżej opisano wyniki przykładowych chorób leczo-
nych PDT. AK — popromienne rogowacenie — uzyskuje
się odpowiedź na poziomie 70-90% (twarzowa i skórna po-
stać dają lepsze rezultaty, a obwodowa słabiej odpowiada
na leczenie — 44-73% i rośnie wznowa do 19% po 3 latach).
PDT i krioterapia dają podobne rezultaty, ale ze względów
kosmetycznych pacjenci wybierają PDT. BCC — rak pod-
stawno komórkowy — uzyskano 87% skuteczność w przy-
padku powierzchniowego i 53% dla postaci guzowatej ze
wznową 18% po 45 miesiącach. BD — choroba Bowen’a —
miejscowe PDT jest tu szeroko stosowane. Skuteczność wy-
nosi 86-93% z 18% wznów w okresie 3-5 lat. Miejscowe PDT
może być potencjalnie używane w leczeniu pacjentów po
przeszczepie organów, w których znacząco wzrosło ryzyko
rozwoju dysplastycznych zmian skórnych i raków niemela-
nomowych skóry.
INNE ZASTOSOWANIA PDT
Rozwój bakterii lekoopornych na standardowe leczenie
wzmogło poszukiwania niestandardowych metod leczenia.
PDT ma szanse być metodą stosowaną do miejscowych in-
fekcji. PDT może zmniejszyć potrzebę używania antybioty-
ków. Stąd wprowadzono pojęcie PACT — fotodynamiczna
antybakteryjna chemioterapia [57].
Tlen singletowy jako czynnik antybakteryjny ma krótki
okres półtrwania i ograniczony dystans dyfuzją (100 nm).
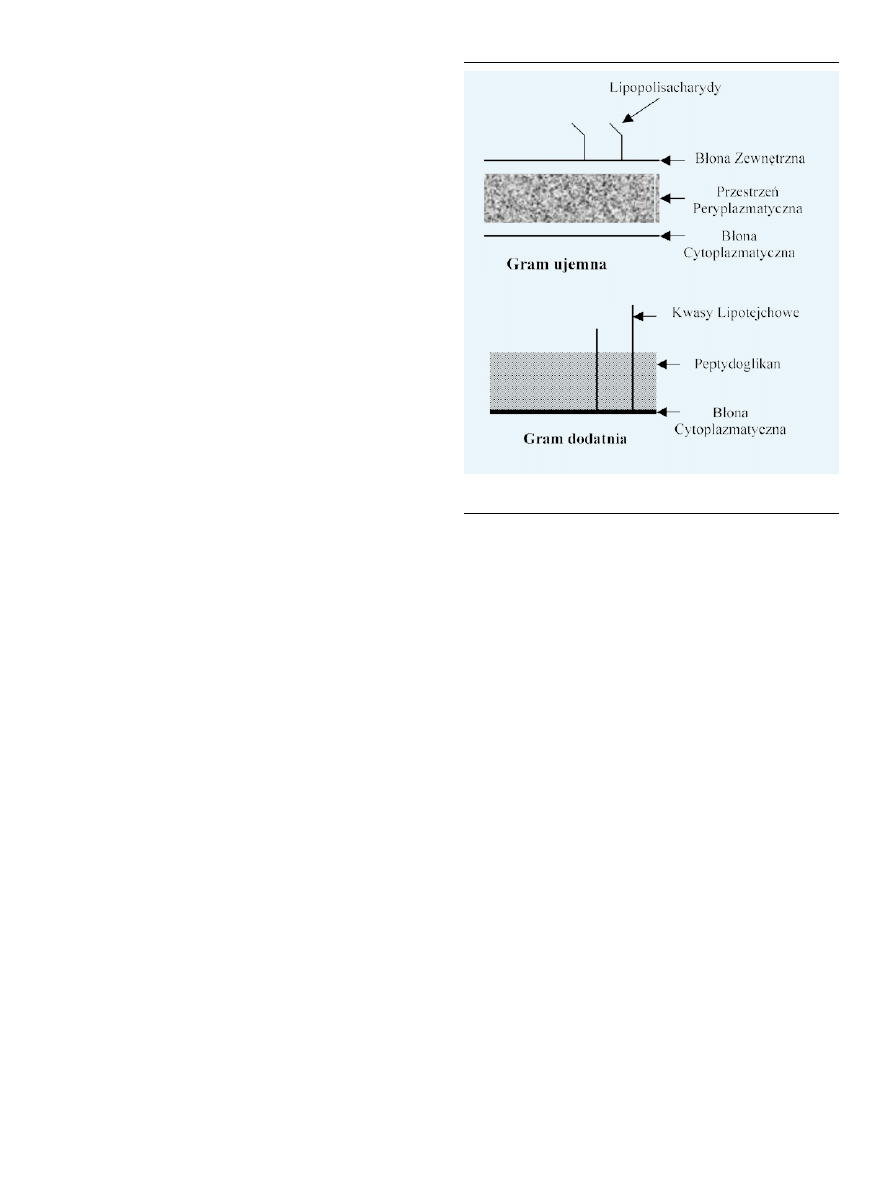
Rycina 5. Porównanie budowy bakterii gram ujemnych i dodatnich (w oparciu o
[57], zmodyfikowano).
Postępy Biochemii 59 (1) 2013
59
W przypadku bakterii, efekt letalny związany z PDT za-
chodzi na poziomie kwasów nukleinowych [58] lub błony
komórkowej [59] lub na obu poziomach jednocześnie [60].
Bakterie gram ujemne mają dwie błony: cytoplazmatyczną
i zewnętrzną (Ryc. 5). Obecność lipopolisacharydów w ze-
wnętrznej błonie bakterii gram ujemnych wiąże się z silnym
ujemnym ładunkiem, który czyni błonę nieprzepuszczalną
dla neutralnych i anionowych związków.
Badania ostatniej dekady pokazały, że anionowe foto-
uczulacze mogłyby być efektywne w połączeniu z czynni-
kami zwiększającymi przepuszczalność zewnętrznej błony
bakterii gram ujemnych m.in. polimiksyną i EDTA [61].
Pokazano, że przyłączenie fotouczulaczy jak ftalocyjaniny,
porfiryny i chloryny do kationowych polipeptydów daje
efektywną inaktywację bakterii gram + i — (Tab. 1)[62].
Metoda fotodynamiczna znalazła także zastosowanie w
leczeniu brodawczakowatości spowodowanej przez ludzki
wirus brodawczaka HPV. Nawracająca brodawczakowa-
tość układu oddechowego (RRP, ang. Recurrent Respiratory
Papillomatosis), wywołana przez HPV typu 6 i 11 jest naj-
częstszym łagodnym nowotworem krtani u dzieci. Kon-
wencjonalne metody nie zapobiegają przed wielokrotnymi
nawrotami choroby. W jednym z badań klinicznych zasto-
sowano miejscowo PDT z wykorzystaniem eteru dihemato-
porfiryny (4,25 mg/kg, 50J) na 48 pacjentach. Zaobserwo-
wano wyraźną poprawę. Obiecujące wyniki uzyskali także
inni badacze (statystycznie 50% poprawy). HPV wywołuje
także brodawczaki układu rozrodczego. U kobiet HPV in-
fekuje szyjkę macicy (typ 16 lub 17) i może prowadzić do
rozwoju wewnątrznabłonkowej neoplazji szyjki macicy
(CIN, ang. Cervical Intraepithelial Neoplasia), a nawet raka
szyjki macicy. W badaniach klinicznych PDT z użyciem ete-
ru/estru polihematoporfiryny (2 mg/kg, laser YAG-OPO)
uzyskano wysoką skuteczność w leczeniu CIN, ale też raka
szyjki macicy. Miejscowo stosuje się PDT z wykorzystaniem
5-ALA lub MLA w leczeniu kłykciny sromu, prącia i po-
chwy (20% 5-ALA, 100 J/cm
2
, skuteczność 95% po 1 zabie-
gu, 100% po 2 zabiegach, % wznów 6,3) [63-65].
Na koniec przedstawiono zastosowania PDT w leczeniu
schorzeń skórnych różnego pochodzenia (Tab. 2).
NANOTECHNOLOGIA W PDT
W terapii fotodynamicznej jednym z problemów ograni-
czających zastosowanie wielu fotouczulaczy jest trudność z
przygotowaniem formuły farmaceutycznej, która umożliwi
ich pozajelitowe podanie.
Problemy fotouczulaczy I-szej generacji to: są mieszani-
nami kilku częściowo niezidentyfikowanych porfiryn, sła-
ba selektywność, niski współczynnik ekstynkcji (wymagają
podania sporej ilości by uzyskać satysfakcjonujący efekt);
słaba penetracja tkanek (maximum absorpcji przy stosun-
kowo krótkich długościach fal, 630 nm) oraz wysoka ku-
mulacja w skórze (6-8 tygodni wrażliwości na światło po
PDT). Problemy Photofrinu II dały rozwój fotouczulaczom
II-ej generacji, które są czyste, dobrze scharakteryzowane,
silnie generują tlen singletowy, mają silne pasma absorpcji
w zakresie 650-800 nm i głęboko penetrują tkanki. Wadą
jest ich hydrofobowość. Słaba rozpuszczalność w wodzie,
hydrofobowych fotouczulaczy ogranicza ich dożylne poda-
nie [68,69].
Z tych powodów powstały różne strategie rozwoju sys-
temów dostarczania leków. Należą do nich m.in. osadzanie
fotouczulacza na nośniku koloidalnym jak: liposomy, czą-
steczki polimerowe czy olejowe układy zdyspergowane;
pułapkowanie fotouczulacza w lipofilowym rdzeniu lipo-
proteiny niskiej gęstości LDL oraz koniugaty fotouczulacz-
-przeciwciało monoklonalne (mAb), fotouczulacz-nanoczą-
steczka-mAb [68-73].
PASYWNE SYSTEMY DOSTARCZANIA FOTOUCZULACZY
Pasywne systemy docelowe wykorzystują naturalne
ścieżki dystrybucji: dyfuzję pasywną, fagocytozę. Zalicza-
my do nich: liposomy, olejowe układy zdyspergowane,
biodegradowalne cząsteczki polimerowe i hydrofilowe po-
limery.
Badania pokazują, że selektywna kumulacja tych nośni-
ków następuje na skutek wzmożonej przepuszczalności
naczyniowej oraz zatrzymywania różnych cząsteczek w
tkance nowotworowej (EPR, ang. Enhanced Vascular Perme-
ability and Retention) [74,75]. Nieszczelna sieć naczyń krwio-
nośnych tkanki nowotworowej prowadzi do wytworzenia
nieprawidłowej bariery śródbłonkowej; słaby drenaż limfa-
tyczny natomiast upośledza układ limfatyczny lub prowa-
dzi do niedrożności limfatycznej i wzrostu przepuszczalno-
ści naczyń. Te mechanizmy dają sposobność nośnikom aby
osiągnąć cel przez dyfuzję prostą. Wzrost przepuszczal-
ności naczyń włosowatych wielu nowotworów następuje
wskutek zaburzenia śródbłonkowej integralności komórki
prowadząc do aktywacji czynników wydzielniczych lub
prozapalnych. Te zjawiska mogą wzmóc zewnątrznaczy-
niowy transport makrocząsteczek. Pasywne gromadzenie
się makrocząsteczek długo krążących w tkance nowotworo-
wej na skutek EPR zwiększa stężenie fotouczulacza w tkan-
ce nowotworowej [68-70].
Tabela 1. Badania przeżywalności gronkowca złocistego pod wpływem PDT w różnych warunkach. Testy in vitro (na podstawie [57], zmodyfikowano).
Szczep gronkowca
lub fenotyp
Stężenie fotouczulacza
Całkowita dawka
energii [J/cm
2
]
Efekt
S. aureus Cowan I
EMRSA-16
Bchlide-IgG (10 µM)
SnCe6-IgG (4,25 µg/ml)
42
21
>99.9%
70-99,9% w zależności od fazy wzrostu
S. aureus NCTC 6571,
MRSA (dwa szczepy:
EMRSA-15 i EMRSA-16)
EMRS-12
MRSA
Dimetylowy błękit metylenowy (0,5-2,0 µM)
Sulfonowana ftalocyjanina glinu (6,0 mg/l)
5-ALA (0,38 mM)
6.3
147
100
100% śmiertelność
100% śmiertelność
100% śmiertelność

60
www.postepybiochemii.pl
Liposomy to lipidowe pęcherzyki złożone z jednej lub
więcej koncentrycznie ułożonych biwarstw fosfolipido-
wych. Ich główne składniki to fosfolipidy i cholesterol,
które są obecne w organizmie w dużych ilościach, dlatego
powinny być biokompatybilne. Prowadzone są badania
eksperymentalne oraz kliniczne z udziałem nośników lipo-
somowych jako efektywnych systemów dostarczania foto-
uczulacza w PDT. Liposomalny BPD-MA zaaprobowano do
leczenia w Szwajcarii i USA [68-70].
Olejowe układy zdyspergowane to m.in. CRM — Cre-
mophor-EL niejonowy polioksyetylowany olej rycynowy
stosowany jako czynnik emulsyfikujący. Badania pokazują
preferencyjne pochłanianie fotouczulacza zdyspergowane-
go w CRM przez tkankę nowotworową. W badaniu PDT z
wykorzystaniem fotouczulacza hematoporfiryny oraz CRM
nastąpiła regresja przeszczepionego nowotworu pęcherza
moczowego u szczura przy znacząco niższym stężeniu foto-
uczulacza w porównaniu z Hp-PDT. Z kolei CRM okazał się
skuteczniejszy niż liposom DPPC (dipalmitylofosfatydylo-
cholina) przy zastosowaniu fotuczulacza SnET
2
w leczeniu
tego samego typu nowotworu [69].
Tabela 2. PDT w leczeniu nienowotworowych chorób skóry [66].
Nienowotworowe choroby skórne odpowiadające na leczenie 5-ALA-PDT
Brodawka wirusowa
Grudkowa zmiana skórna wywołana wirusem HPV. Trwają badania nad PDT
z użyciem 20% kremu 5-ALA i różnych źródeł światła: lampy, LED, lasery, by
osiągnąć najefektywniejsze leczenie przy min. skutkach ubocznych [67].
Trądzik młodzieńczy
(pospolity)
Nie opracowano optymalnych parametrów PDT. Testuje się różne
źródła światła i moce dla PDT z użyciem 5-ALA.
Łuszczyca
Prowadzono badania pilotażowe z użyciem różnych stężeń 5-ALA (0, 2, 10 lub 20 %) i dawek energii
z zakresu 1-30 J/cm
2
. Polepszenie było widoczne u niektórych pacjentów już po 1 zabiegu, ale
efektywne leczenie obserwowano po kilkukrotnych zabiegach. Metoda wymaga dalszych badań.
Ropne zapalenie
gruczołów potowych
Choroba wywołana przez gronkowca wywołująca w gruczołach potowych i otaczającej tkance łącznej stan
zapalny. W leczeniu tej choroby metoda PDT wymaga dalszych badań nad potwierdzeniem skuteczności.
Liszaj twardzinowy
Przewlekła choroba zewnętrznych narządów płciowych. Następuje pogrubienie skóry z
wytworzeniem białawych grudek czemu towarzyszy ból i swędzenie. Uzyskano objawowe
polepszenie po PDT z użyciem 20% kremu 5-ALA i dawki energii 80 J/cm
2
. Po 6-8 tyg. u
10 z 12 kobiet nastąpiła redukcja objawów. Efekt utrzymywał się 3-9 miesięcy.
Twardzina skóry
Przewlekła choroba autoimmunologiczna, charakteryzująca się stwardnieniem skóry i tkanek na skutek
nadmiernego gromadzenia się kolagenu. Stosowano PDT z użyciem 3% 5-ALA i dawki energii 10 J/cm
2
. Zabiegi
przeprowadzano raz lub dwa razy na tydzień, przez 3-6 miesięcy w zależności od odpowiedzi klinicznej.
Choroba cofnęła się. Metoda wymaga dalszych badań aby potwierdzić jej skuteczność w badanych warunkach.
Choroba Darier’a
Genetycznie uwarunkowana choroba skóry wywołana zaburzeniem procesu rogowacenia
w obrębie mieszków włosowych i poza nimi. Zmiany dotyczą skóry, błon śluzowych oraz
paznokci. PDT z użyciem 20% 5-ALA i dawki energii 150 J/cm
2
może być wspomagającą
terapią, ale nie może zastąpić standardowego leczenia retinoidami.
Choroba Hailey-Hailey
Rzadka choroba pęcherzowa o dziedziczeniu autosomalnym, dominującym. Leczono z
powodzeniem 2 pacjentów z wykorzystaniem 20% kremu 5-ALA i naświetlano dawką
energii 120 J/cm
2
. Leczenie powtórzono po 2 miesiącach. Biopsje wykazały prawidłowy
naskórek. Nastąpiły remisje po 19 i 25 tygodniach. Mechanizm jest niejasny.
Nadmierne owłosienie
Prowadzono badania z użyciem 20% 5-ALA, dawek energii 100 i 200 J/cm
2
z wykorzystaniem lasera
argonowego. 3 miesiące po PDT 100 J/cm
2
90% włosów odrosło w stosunku do 50% w obszarach naświetlonych
200 J/cm
2
. Wysokie dawki mogą zapewnić całkowitą utratę owłosienia. Biopsja przed i po leczeniu
wskazuje na selektywne niszczenie naskórka i mieszków włosowych oszczędzając skórę właściwą.
Znamię łojowe
Występuje w postaci pojedynczego guza o zrazikowej lub brodawkowatej powierzchni
i żółtym zabarwieniu. Lokalizuje się zazwyczaj na owłosionej skórze głowy bądź
twarzy. 20% 5-ALA i dawka energii 50 J/cm
2
zapewniają efektywne leczenie.
Prąciowy liszaj płaski
Towarzyszy często chorobom autoimmunologicznym. Jest to przewlekła choroba skóry i błon
śluzowych atakująca często skórę genitaliów. Leczenie z użyciem 20% 5-ALA i dawką energii
50 J/cm
2
dało wyraźne polepszenie po 4 tyg. Po 6 miesiącach nie nastąpił nawrót choroby.
Metoda może być z powodzeniem stosowana w leczeniu prąciowego liszaja płaskiego.
Sarkoidoza
Choroba związana z układem odpornościowym. Charakteryzuje ją powstawanie ziarniniaków,
czyli małych grudek zapalnych nie ulegających martwicy. Guzowata sarkoidoza skórna jest
podatna na leczenie PDT z wykorzystaniem 5-ALA (żel 3% 5-ALA i dawka energii 20 J/
cm
2
). Po 3 miesięcznym leczeniu zmiany ustąpiły. Leczenie bez procesu zapalnego.
Nienowotworowe choroby skórne oporne na działanie 5-ALA-PDT
Międzypalcowe grzybice
Badania nie wykazały skuteczności stosowania PDT z wykorzystaniem 5-ALA. Badacze sądzą,
że pewne dotknięte chorobą obszary skóry mogą nie być osiągalne w leczeniu z powodu
skomplikowanego kształtu przestrzeni między palcowej wyjaśniają słabe rezultaty lecznicze.
Łysienie plackowate
Choroba skórna o nieustalonej do tej pory etiopatogenezie (prawdopodobnie o podłożu genetycznym).
Charakteryzuje się występowaniem przejściowych bądź trwałych ognisk wyłysienia (brak ognisk
zapalnych). Obserwuje się brak efektów leczniczych po PDT z użyciem 5-ALA. Badacze podają,
że być może serie 20 zabiegów leczniczych mogłyby dać zauważalną odpowiedź na terapię.

Postępy Biochemii 59 (1) 2013
61
Biodegradowalne nanocząsteczki (m.in. PLA — poli(D,L-
-kwas mlekowy) są alternatywą dla liposomów dzięki szero-
kiej różnorodności materiałów i procesu wytwarzania. Dla
PDT doświadczenia prowadzono m.in. z hematoporfiryną,
ftalocyjaniną i m-THPC osadzonych na biodegradowal-
nych nanocząsteczkach [68]. Obiecujące wyniki uzyskano
w stosunku do nowotworu EMT-6 z użyciem fotouczulacza
ZnPcF
16
z PLA i emulsji CRM. Uzyskano 100% skuteczność
z PLA w porównaniu do 60% z CRM [69].
Terapeutyczne zastosowania pozajelitowo podanych no-
śników koloidalnych są ograniczone z powodu ich szybkiej
eliminacji z krążenia. Pochłanianie nośników przez jedno-
jądrowe fagocyty jest promowane przez opsonizację. Aby
przedłużyć ich cyrkulację w krwioobiegu dodatkowo mo-
dyfikuje się ich powierzchnię (zmiana ładunku, hydrofobo-
wości, stabilizacja steryczna) [69].
AKTYWNE SYSTEMY DOSTARCZANIA
FOTOUCZULACZY
Selektywne dostarczanie fotouczulacza do tkanki nowo-
tworowej jest możliwe dzięki ukierunkowaniu fotouczula-
cza poprzez tworzenie koniugatów z udziałem cząstek na-
kierowanych na receptor docelowy (fotouczulacz-mAb lub
fotouczulacz-nanocząsteczka-mAb) [68-70]. Do głównych
zalet tej strategii należą: wysokie powinowactwo wiążącej
cząstki do receptora lub antygenu docelowej powierzchni
komórki; bezpośrednia lub bardziej specyficzna lokalizacja
dzięki czemu można zwiększyć wydajność i selektywność
PDT stosując niższe stężenia fotouczulacza. Niezbędnym
wymogiem tej strategii jest nietoksyczność, nieimmuno-
genność i biodegradowalność koniugatów; stabilność ko-
niugatów w krwioobiegu i zdolność do pokonania barier
fizjologicznych i osiągnięcia miejsca docelowego przed in-
ternalizacją.
W tych celach wykorzystuje się m.in. lipoproteiny i prze-
ciwciała monoklonalne. W klasie lipoprotein, lipoproteiny
niskiej gęstości LDL odgrywają ważną rolę w transporcie
i uwalnianiu cząsteczki fotouczulacza do komórek nowo-
tworowych. Synteza receptorów LDL na powierzchni ko-
mórki jest regulowana przez jej zapotrzebowanie na cho-
lesterol. Wiadomo, że szybko proliferujące komórki mają
wysokie zapotrzebowanie na cholesterol do syntezy błon
komórkowych. Badania pokazują, że fotouczulacz złączo-
ny niekowalencyjnie z LDL przed podaniem prowadzi do
wzrostu wydajności PDT w porównaniu z podaniem same-
go fotouczulacza [69,70,73].
Inna strategia zakłada koniugację fotouczulacza z prze-
ciwciałami monoklonalnymi skierowanymi przeciwko spe-
cyficznym antygenom komórek nowotworowych. Istnieją
bowiem różnice między komórkami zdrowymi i nowotwo-
rowymi, m.in. wyższa synteza specyficznych antygentów
i onkobiałek przez komórki nowotworowe [74,76,77]. We
wstępnych badaniach Hp-PDT z przeciwciałami skierowa-
nymi przeciw antygenom mięśniako-mięsaka M1 uzyska-
no 95% skuteczność (równoważne stężenie samego Hp lub
mAb stosowano jako kontrole).
Pomimo zachęcających rezultatów in vitro wiele proble-
mów trzeba jeszcze pokonać przed próbami klinicznymi.
Wydajność in vivo koniugatów fotouczulacz-mAb lub fo-
touczulacz-nanocząsteczka-mAb zależy bowiem od wielu
czynników, które mogą wpływać na dostępność do tkanki
nowotworowej. Zmiany w profilu antygenowym komórek
nowotworowych prowadzą do utraty specyficzności re-
ceptorów. Sugeruje się podawanie mieszanin przeciwciał
skierowanych przeciwko różnym antygenom, aby osiągnąć
maksymalną skuteczność. Do niedawna większość przeciw-
ciał używanych w badaniach klinicznych stanowiły prze-
ciwciała mysie, mogące powodować reakcje antyidiotypo-
we reakcje. Obecnie dostępne są już mniej immunogenne
przeciwciała chimeryczne, humanizowane i ludzkie [69-72].
Wzrost efektu PDT i zmniejszenie stężenia fotouczulacza
można osiągnąć używając specyficznych cząsteczek „wy-
szukujących” komórki nowotworowe jak czynnik wzrostu
EGF, specyficzne białka (transferyna) [78] czy hormony
(insulina) jako alternatywę dla mAb [69,71,72]. Nowe roz-
wiązania pozwalające na większą selektywność, większą
kumulację fotouczulacza, a przez to mniejsze dawki leku
dają obiecujące rezultaty. Przed naukowcami jeszcze wiele
lat badań nad optymalizacją leczenia nowotworów z wyko-
rzystaniem nanotechnologii i ich bezpieczeństwem, ale do-
tychczasowe wyniki dają duże nadzieje.
PDT W POLSCE
W Polsce prowadzone są badania diagnostyczne oraz
terapeutyczne z zakresu: dermatologii, gastroenterologii,
laryngologii, pulmonologii, ginekologii i ortopedii z uży-
ciem 5-ALA i Photofrinu. Do głównych klinik zajmujących
się PDT w Polsce należą: Centrum Laserowej Diagnostyki i
Terapii Fotodynamicznej w Bytomiu i Klinika Urologii Uni-
wersytetu Medycznego w Łodzi oraz Katedra Ginekologii i
Położnictwa Śląskiego Uniwersytetu Medycznego, Klinika
Ginekologii Onkologicznej B Centrum Onkologii w Warsza-
wie oraz Klinika Chorób Przyzębia Uniwersytetu Medycz-
nego w Białymstoku [5,79,80].
PODSUMOWANIE
Opracowywanie nowoczesnych i skutecznych metod
diagnozowania oraz terapii nowotworów jest wciąż waż-
nym elementem medycyny. Metoda fotodynamiczna może
stać się istotnym narzędziem współczesnej onkologii mie-
dzy innymi ze względu na częstą immunosupresję standar-
dowych metod, jak naświetlanie czy chemioterapia. PDT
natomiast w leczeniu miejscowych infekcji bakteryjnych
pozwala w zasadniczy sposób zredukować czas leczenia,
efekty uboczne obserwowane po podaniu antybiotyków i
w wielu przypadkach obniżyć koszty terapii. Zastosowanie
natomiast nanotechnologii w PDT daje bardzo obiecujące
wyniki pozwalające na znaczące podwyższenie efektywno-
ści PDT przy obniżeniu skutków ubocznych terapii.
PIŚMIENNICTWO
1. Schuitmaker JJ, Baas P, van Leengoed HLLM, van der Meulen FW,
Star WM, van Zandwijk N (1996) Photodynamic therapy: a promising
new modality for the treatment of cancer. J Photochem Photobiol B
34: 3-12
2. Sibata CH, Colussi VC, Oleinick NL, Kinsells TJ (2001) Photodynamic
therapy in oncology. Expert Opin Pharmacother 2: 917-927

62
www.postepybiochemii.pl
3. Agostinis P, Berg K, Cengel KA, Foster TH, Girotti AW, Gollnick
SO, Hahn SM, Hamblin MR, Juziene A, Kessel D, Korbelik M, Moan
J, Mroz P, Nowis D, Piette J, Wilson B, Golab J (2011) Photodynamic
Therapy of Cancer: an update. Cancer J Clin 61: 250-281
4. Szeimies RM, Landthaler M, Karrer S (2002) Non-oncologic indica-
tions for ALA-PDT. J Dermatolog Treat 13(Suppl1): 13-18
5. Graczyk A (1999) Photodynamic diagnosis and treatment of cancer,
Bellona, Warszawa, ch.1-2, pp. 21-159 (in Polish)
6. Juzeniene A, Moan J (2007) The history of PDT in Norway Part one:
identification of basic mechanisms of general PDT. Photodiagn Pho-
todyn Ther 4: 3-11
7. Castano AP, Demidova TN, Hamblin MR (2005) Mechanisms in pho-
todynamic therapy: part two-cellular signaling, cell metabolism and
modes of cell death. Photodiagn Photodyn Ther 2: 1-23
8. Bartosz G (2006) Druga twarz tlenu. Wolne rodniki w przyrodzie.
PWN, Warszawa
9. Halliwell B, Gutteridge JM (1984) Free radicals, lipid peroxidation, and
cell damage. Lancet 2: 1095
10. Sternberg ED, Dolphin D (1998) Porphyrin-based photosensitizers for
use in photodynamic therapy. Tetrahedron 54: 4151-4202
11. Evensen JF, Moan J, Winkelman JW (1987) Toxic and phototoxic effects
of tetraphenylpophinesulphonate and haematoporphyrin derivative
in vitro. Int J Radiat Biol Relat Stud Phys Chem Med 51: 477-491
12. Berg K, Bommer JC, Moan J (1989) Evaluation of sulfonated aluminum
phthalocyanines for use in photochemotherapy. A study on the rela-
tive efficiences of photoinactivation. Photochem Photobiol 49: 587-594
13. Ma L, Moan J, Berg K (1994) Evaluation of a new photosensitizer, me-
so-tetra-hydroksyphenyl-chlorin, for use in photodynamic therapy: a
comparison of its photobiological properties with those of two other
photosensitizers. Int J Cancer 57: 883-888
14. Cunderlikova B, Gangeskar L, Moan J (1999) Acid-base properties of
chlorin e6: relation to cellular uptake. J Photochem Photobiol B 53: 81-
90
15. Friberg EG, Cunderlikova B, Pettersen EO, Moan J (2003) PH effects on
the cellular uptake of four photosensitizing drugs evaluated for use in
photodynamic therapy of cancer. Cancer Lett 195: 73-80
16. Cunderlikova B, Sikurova L, Moan J (2003) PH, serum proteins and
ionic strength influence the uptake of merocyanine 540 by WiDr cells
and its interaction with membrane structures. Bioelectrochemistry 59:
1-10
17. Uzdensky AB, Bragin DE, Kolosov MS, Kubin A, Loew HG, Moan J
(2003) Photodynamic effect of hypericin and a water-soluble deriva-
tive on isolated crayfish neuron and surrounding glial cells. J Photo-
chem Photobiol B 72: 27-33
18. Peng Q, Brown SB, Moan J (1993) Biodistribution of a methylene blue
derivative in tumor and normal tissue of rats. J Photochem Photobiol
B 20: 63-71
19. Ye S, Czuba M, Romiszewska A, Karolczak J, Graczyk A (2003) Inves-
tigation of photo-physical properties of selected diaminoacid photo-
porphyrin derivatives PP(AA)Arg
2
. I determination of quantum yield
of fluorescence. Optica Applicata 2-3(XXXIII0): 489-503
20. Padzik-Graczyk A, Konarski J, Sobczyńska J (1994) Sposób otrzymy-
wania hemin. Patent PL 165248 B1/94
21. Konarski J (1990) Sposób otrzymywania nowych pochodnych di(l-ety-
lo)deuteroporfiryny. Patent PL 148775/1990
22. Padzik-Graczyk A, Konarski J (1994) Sposób otrzymywania soli
kompleksowych hematoporfiryny i jej pochodnych. Patent PL165249
B1/1994
23. Graczyk A, Konarski J (1995,1997) Complex salts of hematoporphyrin
and its derivatives, their synthesis and therapeutic agents. Patents US
5, 45, 599A/95, EPO 539960 A2/97
24. Misiewicz-Krzemińska I, Skupińska K, Graczyk A, Kasprzycka-Gutt-
man T (2009) Influence of protoporphyrin IX amino acid substituents
on affinity to human breast adenocarcinoma MCF-7 cells. Biotech His-
tochem 84: 1-7
25. Nowak-Stępniowska A, Wiktorska K, Małecki M, Romiszewska A,
Padzik-Graczyk A (2011) Cytotoxicity of PP(Arg)
2
and PP(Ala)
2
(Arg)
2
-
mediated photodynamic therapy and early stage of apoptosis induc-
tion in prostate cancer in vitro. Acta Biochim Pol 4: 495-505
26. Robertson CA, Hawkins D, Abrahamse H (2009) Photodynamic thera-
py (PDT): A short review on cellular mechanisms and cancer research
applications for PDT. J Photochem Photobiol B 96: 1-8
27. van Duijnhoven FH, Aalbers RIJM, Rovers JP, Terpstra OT, Kuppen P
(2003) The immunological consequences of photodynamic treatment
of cancer, a literature review. Immunobiol 207: 105-113
28. Nowis D, Stokłosa T, Legat M, Issat T, Jakóbisiak M, Gołąb J (2005) The
influence of photodynamic therapy on the immune response. Photodi-
agn Photodyn Ther 2: 283-298
29. Szala S (2009) Angiogeneza i immunosupresja: jin i jang progresji no-
wotworów. Postepy Hig Med Dosw 63: 598-612
30. Jakóbisiak M, Gołąb J (2007) Immunologia. PWN, Warszawa, pp.
31. Oleinick NL, Morris R, Belichenko I (2002) The role of apoptosis in re-
sponse to photodynamic therapy: what, where, why how. Photochem
Photobiol Sci 1: 1-21
32. Almeida RD, Manadas BJ, Carvalho AP, Duarte CB (2004) Intracellu-
lar signaling mechanisms in photodynamic therapy. Biochim Biophys
Acta 1704: 59-86
33. Cecic I, Korbelik M (2002) Mediators of peripheral blood neutrophilia
induced by photodynamic therapy of solid tumors. Cancer Lett 183:
43-51
34. Cecic I, Parkins S, Korbelik M (2001) Induction of systemic neutrphill
response in mice by photodynamic therapy of solis tumors. Photo-
chem Photobiol 74: 712-720
35. Cecic I, Korbelik M (2002) Mediators of peripheral blood neutrophilia
induced by photodynamic therapy of solid tumors. Cancer Lett 183:
43-51
36. Cecic I, Stott B, Korbelik M (2006) Acute phase response-associated
systemic neutrophil mobilization in mice bearing tumors treated by
photodynamic therapy. International Immunopharmacol 6: 1259-1266
37. Gollnick SO, Evans SS, Baumann H, Owczarczak P, Maier P, Vaughan
L, Wang WC, Unger E, Henderson BW (2003) Role of cytokines in
photodynamic therapy-induced local and systemic inflammation. Br
J Cancer 88: 1772-1779
38. de Vree WJA, Essers MC, Koster JF, Sluiter W (1997) Role of interleu-
kin 1 and granulocyte colony-stimulating factor in photofrin-based
photodynamic therapy of rat rhabdomyosarcoma tumors. Cancer Res
57: 2555-2558
39. Kopeć-Szlęzak J (2008) Biologia komórek dendrytycznych. Onkol Pol
11: 106-110
40. Jung NC, Kim HJ, Kang MS, Lee JH, Song JH, Seo HG (2012) Photo-
dynamic therapy-mediated DC immunotherapy is highly effective for
the inhibition of established solid tumors. Cancer Lett 324: 58-65
41. Laskowska E (2007) Małe białka szoku termicznego — rola w apopto-
zie, kancerogenezie i chorobach związanych z agregacją białek. Poste-
py Biochem 1: 19-26
42. Kazimierczuk A, Kiliańska ZM (2009) Plejotropowa aktywność białek
szoku cieplnego. Postepy Hig Med Dosw 63: 502-521
43. Kessel D (2006) Death pathways associated with photodynamic thera-
py. Med Laser Appl 21: 219-224
44. Plaetzer K, Kiesslich T, Verwanger T, Krammer B (2003) The modes
of cell death induced by PDT: an overview. Med Laser Appl 18: 7-19
45. Buytaert E, Dewaele M, Agostinis P (2007) Molecular effectors of mul-
tiple cell death pathways initiated by photodynamic therapy. Biochim
Biophys Acta 1776: 86-107
46. Kłyszejko-Stefanowicz L (2002) Cytobiochemia. Biochemia niektórych
struktur komórkowych. Wydawnictwo naukowe PWN
47. Grądzka I (2006) Mechanizmy i regulacja programowanej śmierci ko-
mórek. Postepy Biochem 2: 157-165
48. Wojtczak L, Zabłocki K (2008) Mitochondria w życiu, chorobie i śmier-
ci komórki. Postepy Biochem 2: 129-141
49. Kmita H, Stobienia O (2006) Kanał VDAC jako regulator funkcji mito-
chondriów. Postepy Biochem 2: 129-136
Postępy Biochemii 59 (1) 2013
63
50. Skalska J, Dębska-Vielhaber G, Głąb M, Kulawiak B, Malińska D, Bed-
narczyk P, Dołowy K, Szewczyk A (2006) Mitochondrialne kanały jo-
nowe. Postepy Biochem 2: 137-144
51. Jóźwiak Z, Marczak A (2006) Rola kanałów jonowych w procesie
apoptozy. Postepy Biochem 4: 373-382
52. Czarna M, Jarmuszkiewicz W (2006) Rola mitochondriów w wytwa-
rzaniu i usuwaniu reaktywnych form tlenu; związek z przesyłaniem
sygnałów i programowaną śmiercią komórki. Postepy Biochem 2: 145-
156
53. Chen N, Karantza-Wadsworth V (2009) Role and regulation of autoph-
agy in cancer. Biochim Biophys Acta 1793: 1516-1523
54. Mitton D, Ackroyd R (2008) A brief overview of photodynamic thera-
py in europe. Photodiagn Photodyn Ther 5: 103-111
55. Bredell MG, Besic E, Maake C, Walt H (2010) The application and chal-
lenges of clinical PD-PDT in the head and neck region: a short review.
J Photochem Photobiol B 101: 185-190
56. Sally H, Ibbotson MBChB (2010) An overview of topical photodynam-
ic therapy in dermatology. Photodiagn Photodyn Ther 7: 16-23
57. O’Riordan K, Akilov OE, Hasan T (2005) The potential for photody-
namic therapy in the treatment of localized infections. Photodiagn
Photodyn Ther 2: 247-262
58. Salmon-Divon M, Nitzan Y, Malik Z (2004) Mechanistic aspects of
Eschericia coli photodynamic inactivation by cationic tetra-meso(N-
methylpyridyl)porphine. Photochem Photobiol Sci 3: 423-429
59. Schafer M, Schmitiz C, Facius R, Horneck G, Milow B, Funken KH,
Ortner J (2000) Systematic study of parameters influencing the action
of rose Bengal with visible light on bacterial cells: comparison between
the biological effect and singlet-oxygen production. Photochem Pho-
tobiol 71: 514-523
60. Bertoloni G, Lauro FM, Cortella G, Merchat M (2000) Photosensitizing
activity of hematoporphyrin on Staphylococcus aureus cells. Biochim
Biophys Acta 1475: 169-174
61. Caminos DA, Spesia MB, Pons P, Durantini EN (2008) Mechanisms
of Escherichia Coli photodynamic inactivation by an amphiphilic trica-
tionic porphyrin and 5,10,15,20-tetra(4-N,N,N-trimethylammonium-
phenyl) porphyrin. Photochem Pchotobiol Sci 7: 1071-1078
62. Hamblin MR, O’Donnell DA, Murthy N, Rajagopalan K, Michaud
N, Sherwood ME, Hasan T (2002) Polycationic photosensitizer conju-
gates: effects of chain length and Gram classification on the photody-
namic inactivation of bacteria. J Antimicrob Chemother 49: 941-951
63. Dai T, Huang YY, Hamblin MR (2009) Photodynamic therapy for local-
ized infections-state of the art. Photodiagn Photodyn Ther 6: 170-188
64. Chen K, chang BZ, Ju M, Zhang XH, Gu H (2007) Comparative study
of photodynamic therapy vs CO
2
laser vaporization in treatment of
condylomata acuminata: a randomized clinical trial. Br J Dermatol 156:
516-520
65. Szeimies RM, Schleyer V, Moll I, Stocker M, Landthaler M, Karrer S
(2009) Adjuvant photodynamic therapy does not prevent reccurence
of condylomata acuminata after carbon dioxide laser ablation-A phase
III, prospective, randomized, bicentric, double-blind study. Dermatol
Surg 35: 757-764
66. Mitra MRCP A, Stables GI (2006) Topical photodynamic therapy for
non-cancerous skin conditions. Photodiagn Photodyn Ther 3: 116-127
67. Wang XL, Wang HW, Zhang LL, Guo MX, Huang Z (2010) Topical
ALA PDT for the treatment of severe acne vulgaris. Photodiagn Pho-
todyn Ther 7: 33-38
68. Chatterjee DK, Fong LS, Zhang Y (2008) Nanoparticles in photody-
namic therapy an emerging pradigm. Adv Drug Del Rev 60: 1627-1637
69. Konan YN, Gurny R, Allemann E (2002) State of the art in the delivery
of photosensitizers for photodynamic therapy. J Photochem Photobiol
B 6: 89-106
70. Paszko E, Ehrhardt C, Senge MO, Kelleher DP, Reynolds JV (2011) Na-
nodrug applications in photodynamic therapy. Photodiagn Photodyn
Ther 8: 14-29
71. Pucińska J, Podbielska H (2009) Nanomateriały we wspomaganiu te-
rapii fotodynamicznej. Acta Bio-Opt Inf Med 2: 178-181
72. Donnelly RF, McCarron PA, Woolfson D (2009) Drug delivery systems
for photodynamic therapy. Recent Pat Drug Deliv Formul 3: 1-7
73. Das M, Mohanty C, Sahoo SK (2009) Ligand-based targeted therapy
for cancer tissue. Expert Opin Drug Deliv 6: 285-304
74. Nerozhay D, Kańska U, Budzyńska R, Boratyński J (2007) Współcze-
sny stan badań nad koniugatami i innymi systemami dostarczania
leków w leczeniu schorzeń nowotworowych i innych jednostek cho-
robowych. Postepy Hig Med Dosw 61: 350-360
75. Maeda H, Bharate GY, Daruwalla J (2009) Polymeric drugs for effi-
cient tumor-targeted drug delivery based on EPR-effect. Eur J Pharm
Biophar 3: 3409-3419
76. Powroźnik B, Kubowicz P, Pękala E (2012) Przeciwciała monoklonal-
ne w terapii celowanej. Postepy Hig Med Dosw 66: 663-673
77. Jóźwiak Z (2010) Rola przeciwciał monoklonalnych w transporcie le-
ków do komórek nowotworowych. Nowotwory 5: 442-450
78. Łubgan D, Marczak A, Distel L, Jóźwiak Z (2006) Koniugaty transfe-
ryny — nadzieja w walce z nowotworami. Postepy Biochem 1: 72-79
79. Sieroń A, Kwiatek S (2009) Twenty years of experience with PDD and
PDT in Poland — review. Photodiagn Photodyn Ther 6: 73-78
80. Sieroń A, Gibinski P, Pustelny T, Kwiatek S, Opilski Z, Kawczyk-
Krupka A, Woznica T, Maciak E, Kubica W, Urbanczyk M, Latos W
(2008) Optical biopsy using spectral camera in BCC and oral leukopla-
kia. Photodiagn Photodyn Ther 5: 271-275
Photodynamic method of cancer diagnosis and
therapy — mechanisms and applications
Agata Nowak-Stępniowska
, Paulina Pergoł, Alfreda Padzik-Graczyk
Biochemistry Laboratory, Institute of Optoelectronics, Military University of Technology, 2 Kaliskiego St., 00-908 Warsaw, Poland
e-mail: agata_nowak_stepniowska@interia.pl
Key words: photodynamic method, photosensitizers, reactive oxygen specious, cancers
ABSTRACT
Cancers are diagnosed in over few millions patients annually. Due to inter alia weak antigenicity as well as drug-fastness of most cancers,
PDT can become an effective alternative or complementary method to surgery. Photodynamic method requires tree elements: photosensitizer,
light energy source and oxygen. Photodynamic therapy is successfully used method in many clinics all over the world, also in Poland. PDT is
used in treatment of oncological (cancers of head, neck, lung, oesophagus, pancreas, urinary bladder and ginecological cancers) as non onco-
logical diseases (
lischen sclerosus, staphylococcus aureus, papillomatosis).
Wyszukiwarka
Podobne podstrony:
711[04] Z2 04 Wykonywanie konse Nieznany (2)
AG 04 id 52754 Nieznany
04 Frytkiid 5022 Nieznany (2)
43 04 id 38675 Nieznany
04 pHid 5134 Nieznany (2)
04 klimarczykid 5049 Nieznany (2)
INF2 2009 Wykl 04 Zaoczne 4na1 Nieznany
04 Halasid 5030 Nieznany (2)
matma dyskretna 04 id 287940 Nieznany
311[10] Z1 04 Opracowywanie prz Nieznany
Fizjologia Cwiczenia 04 id 1743 Nieznany
05 med dosw 4 2013id 5960 Nieznany (2)
lab 04 id 257526 Nieznany
bd lab 04 id 81967 Nieznany (2)
1 rok mgr22,02,2013id 9707 Nieznany
04 Nawiedzenieid 5109 Nieznany (2)
03 PO Geometria 2013id 4609 Nieznany (2)
04 Optykaid 5124 Nieznany
więcej podobnych podstron