
1
ALKOHOLE WIELOWODOROTLENOWE
Alkohole diwodorotlenowe mo na otrzyma poprzez:
hydratacj oksiranów,
hydratacj wi za podwójnych w giel-w giel, w zwi zkach zawieraj cych grup
hydroksylow lub karbonylow , po dalszym uwodornieniu tej grupy,
dihydroksylacja zwi zków olefinowych,
uwodornienie kwasów dikarboksylowych lub ich estrów,
redukcj grup karbonylowych w zwi zkach zawieraj cych ju jedn grup
hydroksylow ,
aldolizacj formaldehydu,
α-aldehydów albo ketonów.

2
1,2-D
IOLE
Glikol Etylenowy
Glikol etylenowy (zwany po prostu glikolem) - trudnopalna ciecz, o temperaturze
wrzenia 197,5
o
C i temperaturze topnienia
−
12,6
o
C.
Glikol etylenowy działa narkotycznie. Mo e ponadto powodowa uszkodzenie
o rodkowego układu nerwowego, rdzenia kr gowego, nerek i w troby.
Pary glikolu działaj dra ni co na drogi oddechowe, oczy i skór . Przy zatruciu
doustnym wyst puj objawy w postaci bólu głowy, zawrotów nudno ci, senno ci.
W ci kich przypadkach mo e wyst pi utrata wiadomo ci, a do pi czki, która
mo e spowodowa uszkodzenie mózgu. Silne zatrucie mo e spowodowa zgon.

3
Metody otrzymywania glikolu etylenowego
Metoda chlorowa poprzez dichloroetan lub chlorohydryn etylenow
CH
2
CH
2
Cl Cl
+ Na
2
CO
3
+ H
2
O
CH
2
CH
2
OH OH
+ 2 NaCl + CO
2
CH
2
CH
2
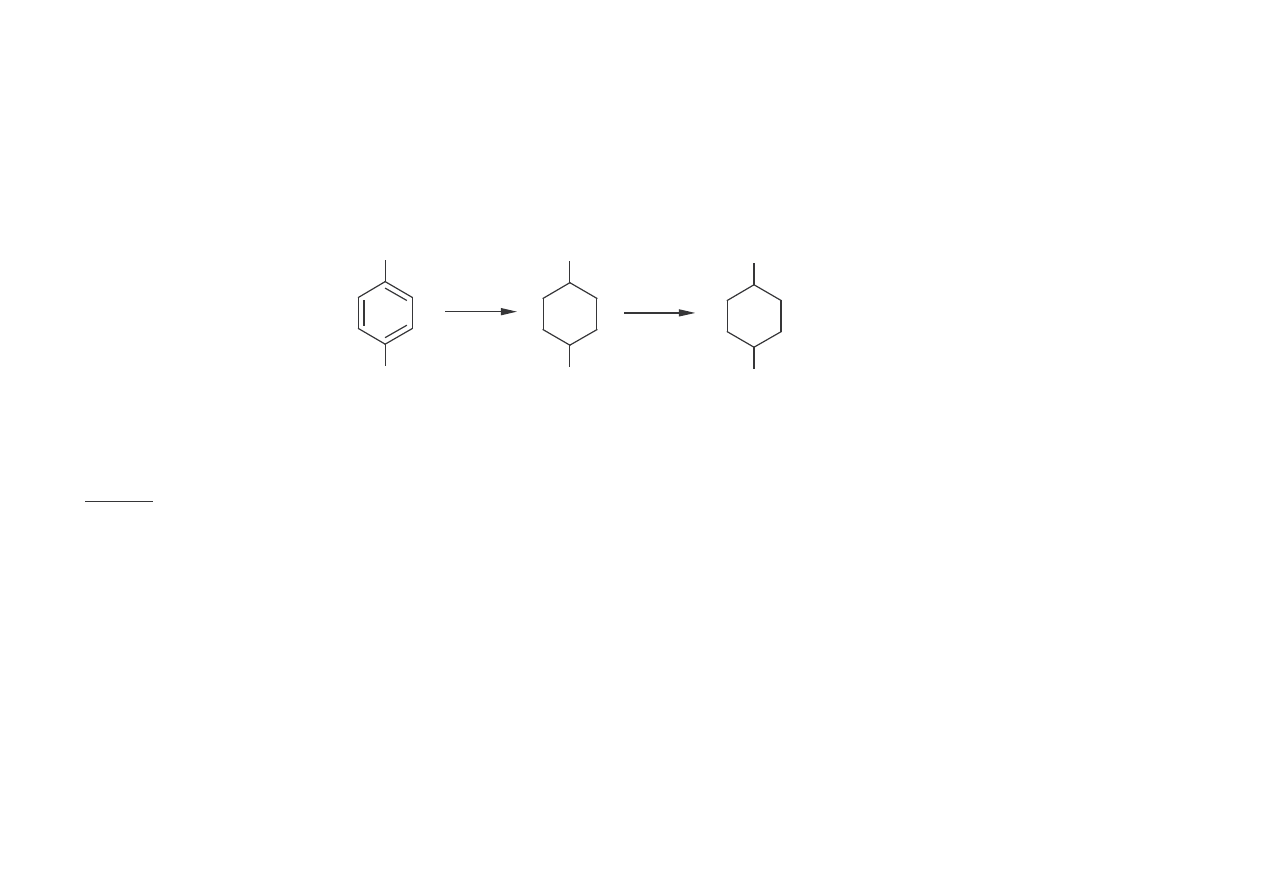
Cl OH
+ NaHCO
3
CH
2
CH
2
OH OH
+ NaCl + CO
2
Hydroliza za pomoc 10% r-ru sody, w temperaturze 190
o
C, pod ci nieniem około 10
MPa.
Reakcja uboczna:
CH
2
CH
2
Cl Cl
+ NaOH
CH
2
=CHCl + NaCl + H
2
O

4
Z tlenku etylenu
CH
2
CH
2
O
O
H
2
HOCH
2
CH
2
OH ,
+
∆H<0 (-80 kJ/mol)
Proces zostanie omówiony szerzej na technologii organicznej.

5
Acetoksylowanie etylenu
CH
2
=CH
2
+
AcOCH
2
CH
2
OAc + H
2
O ,
2 AcOH + 0,5 O
2
∆H= -124 kJ/mol
Reakcja w kwasie octowym, w temperaturze 170
o
C, pod ci nieniem 2,8 MPa w obecno ci
homogenicznego katalizatora – TeO
2
/HBr.
Br
2
+ CH
2
=CH
2
BrCH
2
CH
2
Br
BrCH
2
CH
2
Br + 2 AcOH
AcOCH
2
CH
2
OAc + 2 HBr
Br
2
+ H
2
O
2 HBr + 0,5 O
2
Konwersja etylenu ponad 98%, selektywno do octanów glikolu osi ga 96%.
AcOCH
2
CH
2
OAc +
HOCH
2
CH
2
OH +
∆H= -17 kJ/mol
2 H
2
O
2 HOAc ,
Wydajno hydrolizy 95%.

6
Z gazu syntezowego firmy Union Carbide
2 CO + 3 H
2
HOCH
2
CH
2
OH
Warunki procesu:
• temperatura - 220-280
o
C
• ci nienie >150MPa,
• katalizatory - kompleksy rodu,
• produkty uboczne - glikol propylenowy i gliceryna,
• ł czna wydajno produktów tlenowych wynosi 60-70%,
lub
• katalizatory rutenowe,
• ci nienie poni ej 34 MPa

7
Z gazu syntezowego poprzez szczawiany
2 C
4
H
9
OH + 2 CO + 0.5 O
2
(COOC
4
H
9
)
2
+ H
2
O
(COOC
4
H
9
)
2
+ 4 H
2
(CH
2
OH)
2
+ 2 C
4
H
9
OH
Warunki procesu:
• temperatura - 70-90
o
C
• katalizator - PdCl
2
/CuCl
2

8
Proces, opracowany przez Ube
O
C
O
C
O
CH
3
O
CH
3
2 CH
3
OH + 2 CO + 0,5 O
2
+ H
2
O
CH
3
O
C
O
C
O
CH
3
O
2
+ 4 H
2
HOCH
2
CH
2
OH + 2 CH
3
OH
Warunki procesu:
• temperatura - 110
o
C
• ci nienie - 0,9 MPa
• katalizator - palladowego i 70% HNO
3
,
• wydajno - 97%.

9
Poprzez w glan dimetylu
O
C
H
2
C
H
2
O
C O + 2 CH
3
OH
O
C
H
3
C
H
3
O
C O +
C
H
2
C
H
2
OH
OH
Warunki procesu:
• temperatura - 80-130
o
C
• katalizator - trzeciorz dowe aminy lub czwartorz dowe sole amoniowe
• wydajno - 97%.

10
Poprzez kwas glikolowy
firmy Du Pont (realizowany do 1970 r., obecnie zaniechany)
HCHO + CO + H
2
O
HOCH
2
COOH
HOCH
2
CH
2
OH
1. +CH
3
OH
2. + H
2
Warunki procesu:
• temperatura - 200-250
o
C
• ci nienie - 30-70 MPa
• katalizator - kwas siarkowy lub fluorowodór

11
firmy Chevron
HCHO + CO + H
2
O
HOCH
2
COOH
HOCH
2
COOH + HOCH
2
CH
2
OH
HOCH
2
COOCH
2
CH
2
OH + H
2
O
HOCH
2
COOCH
2
CH
2
OH + 2 H
2
2 HOCH
2
CH
2
OH
Ester uwodarnia si do glikolu etylenowego na katalizatorze miedziowym, w temperaturze
ok. 225
o
C i pod ci nieniem 3,2 MPa.
12
Zastosowanie glikolu etylenowego
wiatowa produkcja glikolu etylenowego w 1999 r. - ok. 14 mln t.
Najwi kszymi producentami glikolu s firmy: Union Carbide, Shell, SABIC, Dow Chemical, BASF,
Occidental, Hoechst i Mitsubishi.
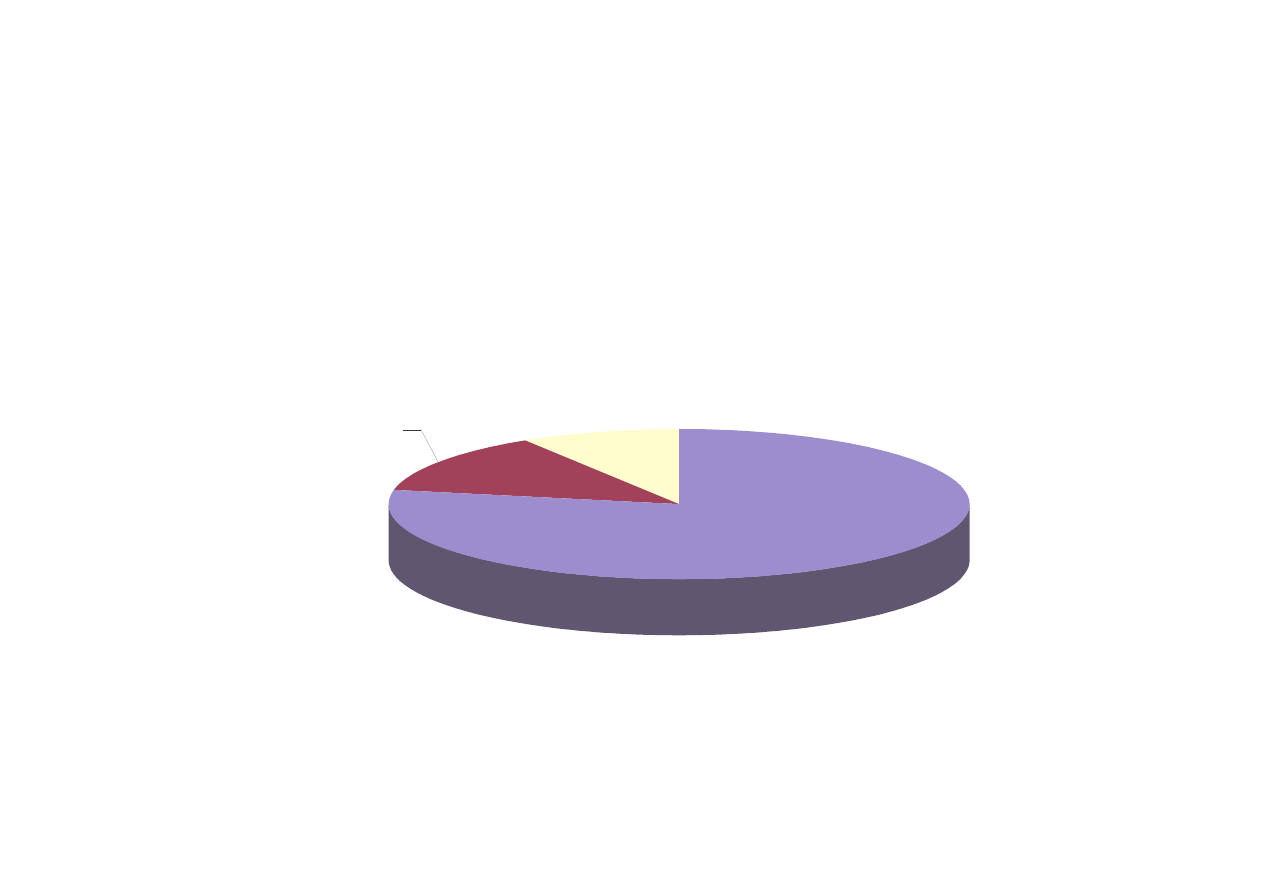
Zastosowanie glikolu etylenowego (w % wag.) w 1999 r. na wiecie
78% poli(tereftalan
etylenu)
13 % rodki
przeciwzamarzaj ce
9 % inne*
* nienasycone ywice poliestrowe, ciecze hydrauliczne, rodki powierzchniowo czynne
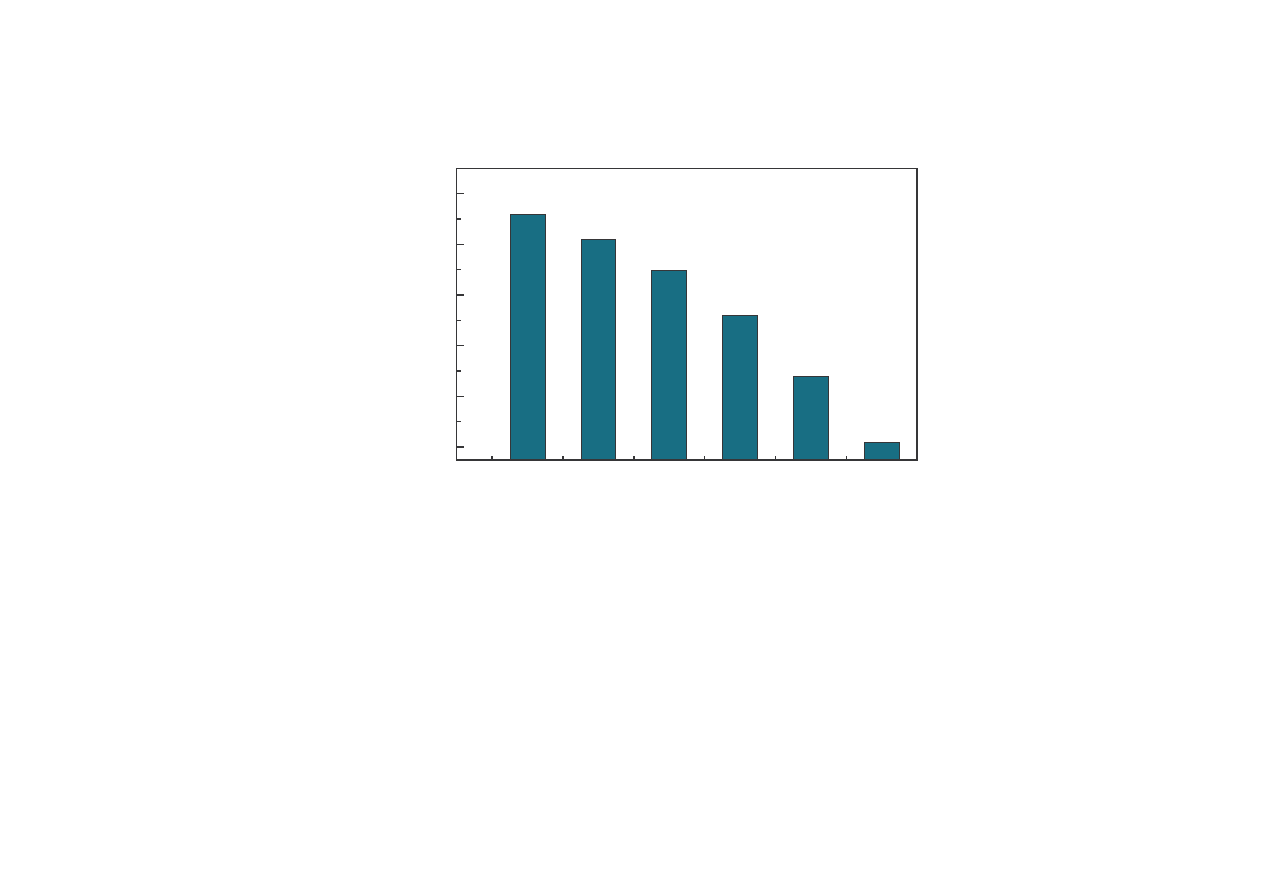
13
Temperatura krzepni cia wodnych roztworów glikolu etylenowego
0
10
20
30
40
50
60
-50
-40
-30
-20
-10
0
Te
m
pe
ra
tu
ra
k
rz
ep
ni
ci
a
ro
zt
w
or
u,
o
C
St enie glikolu w wodzie, %

14
Wzkorzystanie glikolu etylenowego:
• jako płyn hamulcowy,
• zmi kczacz,
• rodek lizgowy (zwil acze, smary),
• oraz plastyfikator,
• rozpuszczalnik (pod tym wzgl dem zbli ony jest do alkoholu etylowego), dobrze
rozpuszczaj cym estry, ywice, barwniki itp.
• w produkcji kosmetyków, w przeróbce skór i futer, jako rodek utrzymuj cy
elastyczno i mi kko skóry w czasie obróbki,
• przy wyka czaniu i barwieniu wyrobów włókienniczych, do nawilgacania tytoniu.
• produkcji plasteliny i atramentów.
15
Inne zastosowania glikolu etylenowego:
• glioksal,
HOCH
2
CH
2
OH + O
2
OHC-CHO + 2 H
2
O
• dioksolan (1,3-dioksocyklopentan) – monomer oraz rozpuszczalnik o wła ciwo ciach
podobnych do THF (do poli(chlorku winylu)),
H
+
HOCH
2
CH
2
OH + HCHO
O
O + H
2
O
• 1,4-dioksan
• cykliczny w glan etylenu
CH
2
CH
2
OH
OH
COCl
2
+
O
C
O
O
+ 2 HCl
• glikol dietylenowy

16
G
LIKOL
P
ROPYLENOWY
Glikol propylenowy + bezbarwna, lepka, higroskopowa ciecz o temperaturze
wrzenia 187,6
o
C. Działa narkotycznie i mo e powodowa uszkodzenie
o rodkowego układu nerwowego, rdzenia kr gowego, nerek i w troby. Pary
glikolu działaj dra ni co na drogi oddechowe, oczy i skór .

17
Metody otrzymywania glikolu propylenowego
Hydratacja propylenu
CH
CH
2
O
CH
3
+ H
2
O
CH
2
CHCH
3
OH OH
Warunki procesu
faza ciekła,
10-20-krotny molowy nadmiar wody
ci nienie bliskie atmosferycznego,
temperatura 50-70
o
C,
katalizatory kwa ne (H
2
SO
4
, H
3
PO
4
, kwas szczawiowy)
albo bezkatalitycznie
temperatura -140-230
o
C,
ci nienie - 2-4 MPa.

18
Z propylenu poprzez reakcj acetoksylowania:
CH
3
CH=CH
2
+
CH
OH
CH
2
OCOCH
3
CH
3
CHCH
2
OH
OCOCH
3
CH
3
0,5 O
2
+ CH
3
COOH
lub
CH
3
CH=CH
2
+
CHCH
2
OCOCH
3
+ H
2
O
OCOCH
3
CH
3
0,5 O
2
+ 2 CH
3
COOH
I etap
temperatura - 150
o
C
katalizator - zwi zki palladu, tytanu, cyrkonu, niklu i in.
selektywno ci - prawie 100%.
II etap
niewielkie nadci nienie,
temperatura - 110
o
C.

19
Zastosowanie glikolu propylenowego
Produkcja glikoli propylenowych na wiecie w 2000 r. wynosiła ok. 1,6 mln ton.
Glikol monopropylenowy:
• nienasycone ywice poliestrowe,
• ywice alkidowe
• ciekłe detergenty.
• jako rodek przeciwzamarzaj cy,
• płyn hamulcowy.

20
Glikol dipropylenowy:
nienasycone ywice poliestrowe,
plastyfikatory,
poliuretany,
ywice alkidowe.
Glikol tripropylenowy:
poliuretany,
akrylan glikolu tripropylenowego,
rozpuszczalnik,
plastyfikatorów.

21
Glikole polipropylenowe – do poliuretanów i rodków powierzchniowo czynnych
HO(C
CH
3
CH
2
O) H
H
n
22
1,3-D
IOLE
1,3-P
ROPANODIOL
Poprzez aldehyd
ββββ
-hydroksypropionowy
firma Degussa
CH
2
=CHCHO + H
2
O
HOCH
2
CH
2
CHO
HOCH
2
CH
2
CH
2
OH
+H
2
firma Shell
HOCH
2
CH
2
CHO
HOCH
2
CH
2
CH
2
OH
+H
2
CH
2
C
H
2
O
+ CO + H
2

23
Proces fermentacyjny z syropu kukurydzianego (firma Du Pont we współpracy z
biotechnologiczn firm Genencor)
Zastowanie 1,3-propanodiolu:
do produkcji włókien poliestrowych, folii i powłok ochronnych.
Firma Shell Chemical produkuje poli(tereftalan trimetylenowy).
Włókno otrzymane z tego poliestru (nazwa handlowa corterra) odznacza si odporno ci
chemiczn wła ciw poliestrom i elastyczno ci nylonu. Polimer ten jest odporny na brud,
daje si łatwo zadrukowa , odznacza si mał chłonno ci wody i ma wła ciwo ci
antystatyczne. Mo e by wykorzystywany w przemy le tekstylnym do produkcji
dywanów, a tak e wyrobów nietkanych.

24
1,3-B
UTANODIOL
1,3-Butanodiol jest bezbarwn , łatwopaln , higroskopijn ciecz o temperaturze
wrzenia 203-204
o
C. Działa dra ni co na skór , oczy oraz układ oddechowy.
Metody otrzymywania
Z acetylenu (opracowana przez firm IG-Farben)
CH CH + H
2
O
CH
3
CHO
2 CH
3
CHO
CH
3
CHCH
2
CHO
OH
CH
3
CHCH
2
CHO
OH
CH
3
CHCH
2
CH
2
OH
OH
+ H
2

25
G
LIKOL NEOPENTYLOWY
(2,2-
DIMETYLO
-1,3-
PROPANODIOL
)
C
CH
3
H
CH
3
CHO
HCHO +
OH
-
C
CH
3
HOCH
2
CH
3
CHO
C
CH
3
HOCH
2
CH
3
CH
2
OH
+H
2
Katalityczne uwodornienie prowadzi si w fazie gazowej lub ciekłej na katalizatorach Co,
Cu, Ni, w temperaturze 80
o
C.

26
Glikol neopentylowy u ywany jest:
• w poliestrach,
• lakierach z ywic syntetycznych,
• syntetycznych smarach i zmi kczaczach.
• do wyrobu ywic ( elkotów), z przeznaczeniem na warstwy powierzchniowe
kształtek.
Estry glikolu neopentylowego stosowane s jako stabilizatory olejów lub jako
plastyfikatory tworzyw sztucznych
27
2-E
TYLO
-1,3-
HEKSANODIOL
OH
-
2CH
3
CH
2
CH
2
CHO
CH
C
3
H
7
OH
CHCHO
C
2
H
5
CH
C
3
H
7
OH
CHCH
2
OH
C
2
H
5
+H
2
Wykorzystywany jest on do produkcji polimerycznych plastyfikatorów.

28
1,4-D
IOLE
1,4-B
UTANODIOL
1,4-Butanodiol - bezbarwna, lepka, higroskopijna ciecz o temperaturze wrzenia
230-232
o
C. Bardzo dobrze rozpuszcza si w wodzie, reaguje gwałtownie z silnymi
utleniaczami.
1,4-Butanodiol jest substancj , która mo e by absorbowana przez organizm
człowieka poprzez układ oddechowy, przez oczy lub skór . Długotrwałe
oddziaływanie par 1,4-butanodiolu mo e spowodowa bóle i zawroty głowy,
kaszel oraz podra nienie oczu. Brak jest danych na temat toksyczno ci tego
zwi zku.
29
Metody otrzymywania 1,4-butanodiolu
Metoda Reppego z acetylenu i formaldehydu (firmy BASF, ISP, GAT-Hülls i Du Pont-
Idemitsu)
2 HCHO + CH CH
C C CH
2
OH
HOCH
2
∆H= - 108,2 kJ/mol
I etap
proces ci gły,
katalizator – acetylenku miedzi, z niewielkimi dodatkami bizmutu, kobaltu, niklu
naniesionym na porowaty no nik krzemionkowy,
temperatura - 70-90
o
C,
ci nienie - 0,1-0,2 MPa,
40% wodny roztwór 1,4-butynodiolu,
wydajno 1,4-butynodiolu - ok. 95%,
produkt uboczny - alkohol propargilowy, który po oddzieleniu zawracany jest do
procesu.
30
II etap
C C CH
2
OH
HOCH
2
HOCH
2
CH
2
CH
2
CH
2
OH ,
+ 2 H
2
∆H = -245 kJ/mol
reaktor rurowy,
temperatura - 110-130
o
C,
ci nienie - 20-30 MPa,
katalizator - niklowo-miedziowy, promotorowany molibdenem, magnezem i manga-
nem,
wodny roztwór 1,4-butanodiolu oczyszczany jest w układzie kolumn rekty-
fikacyjnych, w wyniku czego otrzymuje si produkt praktycznie bezwodny.
wydajno 1,4-butanodiolu w przeliczeniu na acetylen wynosi 91%, a na formaldehyd
– 80%.
główne produkty uboczne: alkohol propargilowy, 1,4-butynodiol i 1,4-butanodiol.

31
Alkohol propargilowy,
CH C CH
2
OH
stosowany w przemy le jako rozpuszczalnik do ywic poliamidowych oraz półprodukt w
syntezie:
1,6-heksanodiolu,
aldehydu propargilowego,
aldehydu propionowego,
alkoholu chloroallilowego,
hydroksyacetonu (CH
3
COCH
2
OH)
pestycydów i rodków zapachowych,
oraz 2-aminopirymidyny, wa nego półproduktu do leków sulfamidowych.
32
Z bezwodnika maleinowego
O
O
O
O
O
O
O
O
HOCH
2
CH
2
CH
2
CH
2
OH
+H
2
+H
2
-H
2
O
+2H
2
Uwodornienie bezwodnika:
faza ciekła,
katalizator nikiel Raneya,
temperatura - 200-280
o
C, ci nienie 6-12 MPa
produkty po rednie: bezwodnik kwasu bursztynowego i
γ-butyrolakton.
Uwodornienie
γ-butyrolaktonu:
katalizator - Ni-Co-ThO
2
na krzemionce,
temperatura - 250
o
C, ci nienie - 10 MPa,
selektywno 98% procesu, przy 100% stopniu konwersji,
główny produkt uboczny - tetrahydrofuran.
33
Z bezwodnika poprzez ester (technologia firmy Davy Mc Kee).
O
O
O
+H
2
-H
2
O
+4 H
2
CHCOOR
CHCOOR
+2 ROH
CH
2
COOR
CH
2
COOR
-2 ROH
CH
2
CH
2
OH
CH
2
CH
2
OH
w której: R= CH
3
, C
2
H
5
Katalizator uwodornieniq maleinian dialkilu - miedziowo-chromowy, stabilizowany
borem lub manganem.
W procesie mo na otrzyma alternatywnie 1,4-butanodiol,
γ-butyrolakton i
tetrahydrofuran w ró nych proporcjach.
Technologi Davy stosuj obecnie firmy Tonen Chemical w Japonii i Shinwha
Petrochemical w Korei Płd.

34
Z butadienu poprzez chlorobuteny (firma Toyo-Soda)
ClCH
2
CH=CHCH
2
Cl + 2 HCOONa + 2 H
2
O
HOCH
2
CH=CHCH
2
OH + 2 HCOOH + 2 NaCl
Warunki hydrolizy:
temperatura - 110
o
C.
konwersja prawie 100%,
selektywno do 1,4-butanodiolu ponad 90%.
HOCH
2
CH=CHCH
2
OH + H
2
HOCH
2
CH
2
CH
2
CH
2
OH
Warunki uwodornienia:
katalizator Ni/Al
temperatura - 100
o
C,
ci nienie - 27 MPa.
Instalacje produkuj ce 1,4-butanodiol t metod zostały zamkni te pod koniec lat 80-tych.

35
Butadienu poprzez acetoksylowanie
O
O
CH
2
=CH-CH=CH
2
+ 2 CH
3
COOH + 0,5 O
2
- H
2
O
CH
3
COCH
2
-CH=CH-CH
2
OCCH
3
Warunki acetoksylowania:
faza ciekła,
katalizator palladowo-tellurowy na w glu aktywnym,
temperatura - 80
o
C, ci nieniem - 2,7 MPa.
wydajno ponad 90%.

36
CH
3
COCH
2
-CH=CH-CH
2
OCCH
3
O
O
+ H
2
CH
3
COCH
2
CH
2
CH
2
CH
2
OCCH
3
O
O
Warunki acetoksylowania:
katalizator niklowo-cynkowego na ziemi okrzemkowej,
temperatura - 80
o
C, pod ci nieniem 6 MPa, w czasie 90 min.
+ 2 H
2
O
CH
3
COCH
2
CH
2
CH
2
CH
2
OCCH
3
O
O
HOCH
2
CH
2
CH
2
CH
2
OH + 2 CH
3
COOH
Wydajno 1,4-butanodiolu ok. 84% w przeliczeniu na butadien.
Obecnie, według tej technologii, pracuje jedna instalacja nale ca do japo skiej firmy
Mitsubishi Kasei.
37
Z propylenu poprzez hydroformylowanie alkoholu allilowego
I etap
CH-CH
3
CH
2
O
CH
2
=CH-CH
2
OH
katalizator - Li
3
PO
4
, temperatura - 230-270
o
C.
II etap
CH
2
=CHCH
2
OH + H
2
+ CO
HOCH
2
CH
2
CH
2
CHO
reakcja w rozpuszczalniku aromatycznym,
temperatura - 50-80
o
C,
ci nienie - 0,08 MPa
katalizator - kompleks rodu z dodatkiem trifenylofosfiny,
selektywno reakcji wynosi ok. 80%.
produkty uboczne - 1-propanol, aldehyd propionowy oraz aldehyd
metyloksypropionowy.

38
III etap
HOCH
2
CH
2
CH
2
CHO + 2 H
2
HOCH
2
CH
2
CH
2
CH
2
OH
katalizator nikiel Raneya,
temperatura - 80-130oC,
ci nienie – niskie,
selektywno do 1,4-butanodiolu ok. 93%.
Technologia ta została opracowana w latach siedemdziesi tych przez japo sk firm
Kurary Co.
W 1990 r. firma Arco Chem. w oparciu o t technologi uruchomiła pierwsz instalacj
przemysłow .

39
procesem Geminox z butanu
(firmy niemiecka Lurgi Öl-Gas-Chemie i brytyjska BP Chemicals,
1995 r.)
etap I - utlenianie butanu do bezwodnika maleinowego,
etap II - uwodornienie bezwodnika maleinowego do 1,4-butanodiolu.
Reakcje przebiegaj w reaktorze fluidalnym.
Ł czna wydajno otrzymywania u ytecznych produktów wynosi w tym procesie 96,7%.
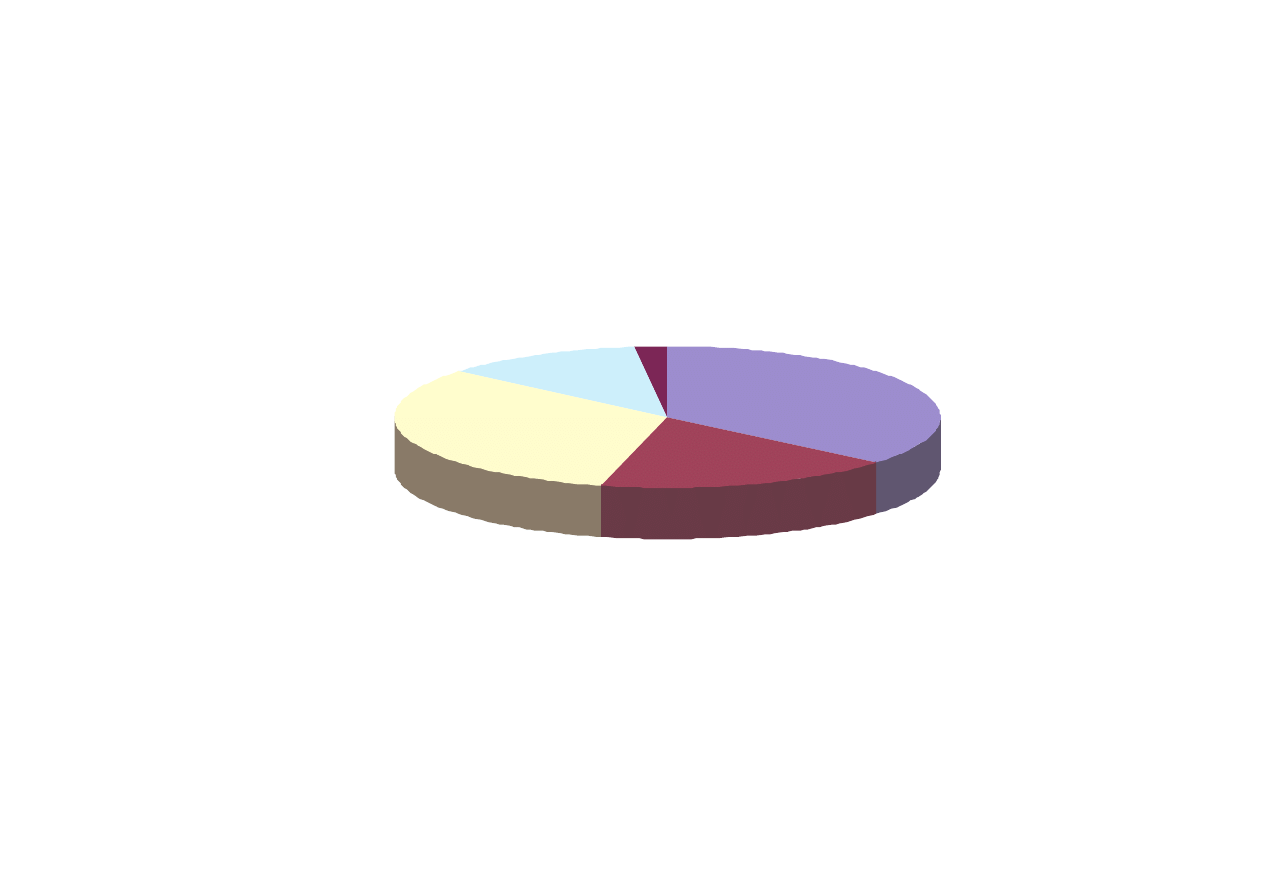
40
Zastosowanie 1,4-butanodiolu
wiatowa produkcja 1,4-butanodiolu w 2000 r. ok. 640 tys. t.
36% tetrahydrofuran
18%
chemikalia Reppe'go
32%
ywice
polibutylenotereftalo
we
2% inne
12% poliuretany
Struktura zu ycia 1,4-butanodiolu w 2000 r.
Na podstawie: Weissermel K., Arpe H.J., Industrial Organic Chemistry, Weinheim, New
York, Basel, Cambridge, Tokyo, VCH 2003.

41
Tetrahydrofuran
Tetrahydrofuran (THF) jest ciecz łatwopaln , o temperaturze wrzenia
65,95
o
C. Wykazuje stosunkow wysok pr no par w temperaturze pokojowej i
szybko wyparowuje na powietrzu. Pary snuj si głównie nad powierzchnia ziemi
lub w dolnych partiach pomieszcze , gromadz si w zagł bieniach terenu i w
obiektach budowlanych. Pary THF tworz mieszaniny wybuchowe z powietrzem,
tak e nad powierzchni roztworów wodnych. Palne s nawet mało st one
roztwory wodne. Przy kontakcie THF z powietrzem i wiatłem powstaj
wybuchowe nadtlenki. Zwykle jest on stabilizowany w celu zapewnienia
bezpiecze stwa w magazynowaniu i transporcie.
Tetrahydrofuran działa dra ni co na błony luzowe, a w wy szych st eniach
działa silnie narkotycznie. THF działa dra ni co i uczulaj co na skór . Przenika
do organizmu przez drogi oddechowe i skór . Jednorazowe wchłoni cie par
powoduje zawroty i bóle głowy, podra nienie błon luzowych dróg oddechowych i
oczu. Przy zatruciu przez układ oddechowy mog wyst pi wymioty, spadek
ci nienia krwi. W ci szych przypadkach nast puje silne osłabienie, duszno ,
obrz k twarzy, podra nienie górnych dróg oddechowych i spojówek, wysypka na
ciele, czasowa głuchota, a nast pnie narkoza.
42
Metody otrzymywania THF
• katalityczne odwodnienie 1,4-butanodiolu (Du Pont, BASF i GAF-Hülls)
HOCH
2
CH
2
CH
2
CH
2
OH
O
- H
2
O
o
katalizator - H3PO4, H2SO4 albo kwa ne ywice jonowymienne.
o
temperatura - 110-120oC,
o
ci nieniem 10 MPa,
o
selektywno ok. 95%, przy praktycznie ilo ciowej konwersji 1,4-butanodiolu
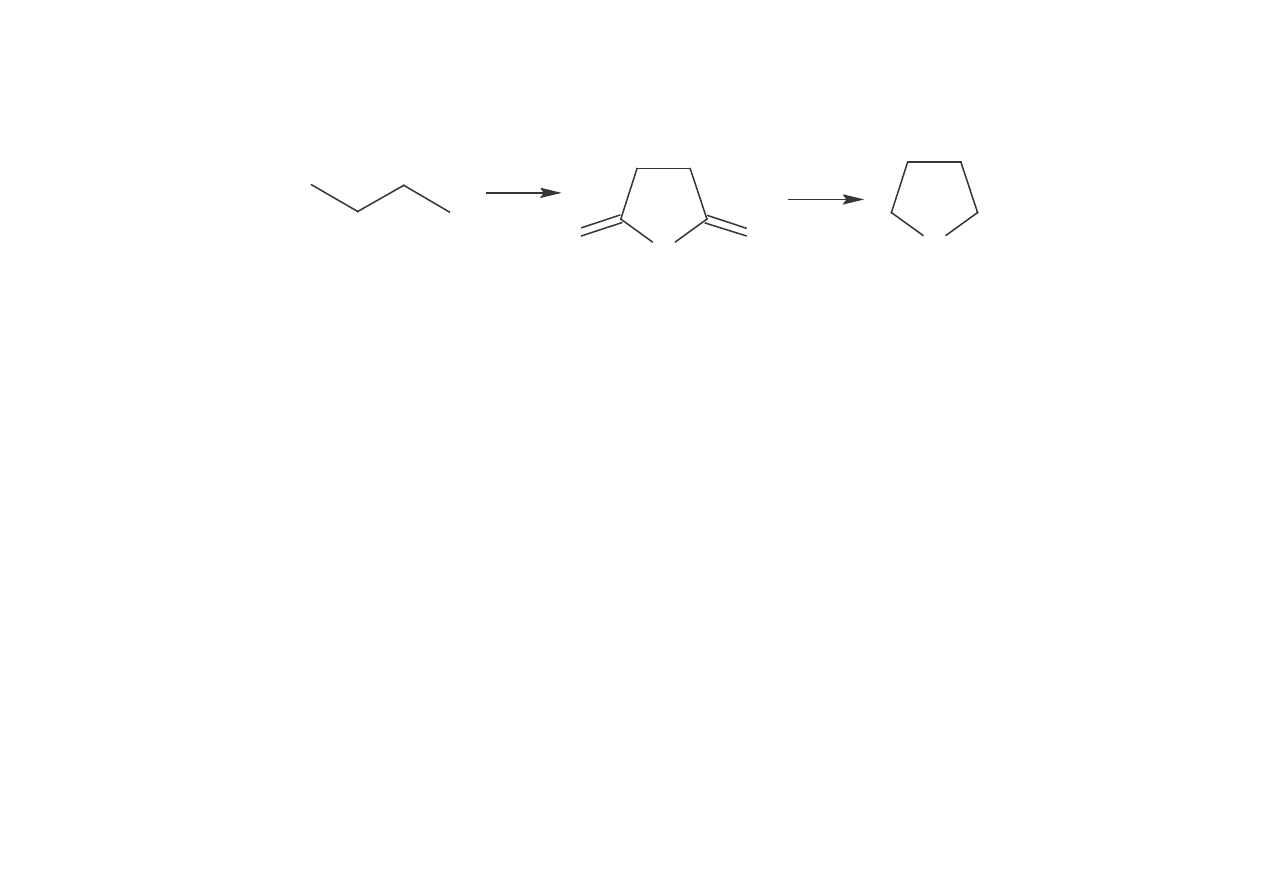
43
• metoda dwustopniowa z butanu (Du Pont)
O
H
2
O
O
O
O
2
W procesie tym nast puje najpierw utlenienie butanu w zło u fluidalnym do
bezwodnika kwasu maleinowego, a nast pnie powstały bezwodnik zostaje redukowany
wodorem do tetrahydrofuranu w obecno ci katalizatora zawieraj cego 1-6% wag.
palladu i 3-6% wag. renu osadzonych na no niku w glowym oraz małych ilo ci potasu,
sodu, litu lub magnezu jako promotorów.
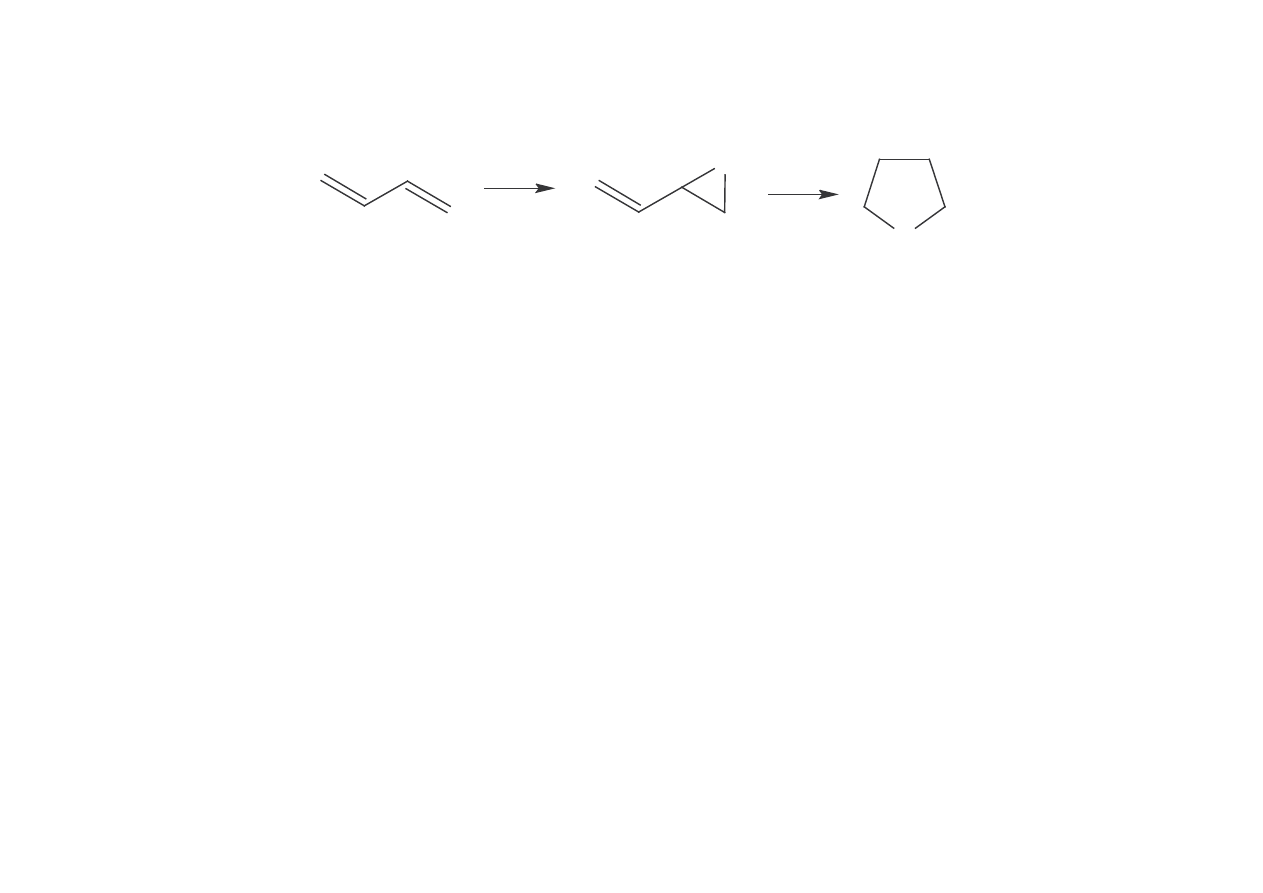
44
• z 1,3-butadienu poprzez epoksybuten (Eastman Chemical Co.)
O
O
[O]
• z trzciny cukrowej (stosowany przez firm Great Lakes Chemical i prawdopodobnie
przez jedn wytwórni w Rosji)
Polega na traktowaniu bagassy kwasem siarkowym, w wyniku czego z zawartych w niej
pentoz tworzy si furfural, z którego przez dekarbonylacj otrzymuje si furan, ten za po
uwodornieniu daje tetrahydrofuran.

45
Zastosowanie THF
Swiatowa zdolno produkcyjna THF w 1998 r. – 276000 ton.
Zdecydowana wi kszo THF zu ywana jest do produkcji poli(tetrametylenoglikolu),
polimeru produkowanego przez firm (Du Pont),
(CH
2
)
4
-O
O
H
H
n
(masa czasteczkowa 600-3000)
prekursora do produkcji elastycznych włókien typu spandex i lycra, termoplastycznych
uretanowych elastomerów, a tak e elastomeru poliestrowego.
Włókna spandex odznaczaj si bardzo du ym wydłu eniem przy zerwaniu, a w
porównaniu z ni mi gumowymi 2
÷3-krotnie wi ksz wytrzymało ci na zerwanie.

46
Inne zastosowania THF:
• rozpuszczalnik w produkcji tworzyw sztucznych, jak np. poli(chlorku winylu),
polistyrenu, ywic akrylonitrylowo-butadienowo-styrenowych, ywic alkidowych,
poliuretanów, ywic epoksydowych, pochodnych celulozy;
• rozpuszczalnik do produkcji ta m klej cych i w syntezie farmaceutycznej (głównie
jako medium w reakcji Grignarda)
• synteza pirolidyny, półproduktu stosowanego w przemy le farmaceutycznym i w
produkcji fungicydów.

47
γγγγ
-Butyrolakton
γ
-Butyrolakton jest ciecz paln , o temperaturze wrzenia 204
o
C. Pary tworz z
powietrzem mieszaniny wybuchowe w szerokim zakresie st e .
γ
-Butyrolakton działa dra ni co na błony luzowe, a w wy szych st eniach
narkotycznie. Działa dra ni co i uczulaj co na skór . Przenika do organizmu
przez drogi oddechowe i skór . Jednorazowe wchłoni cie par powoduje zawroty
głowy, podra nienie błon luzowych, dróg oddechowych i oczu, bóle głowy. Przy
zatruciu przez układ oddechowy mog wyst pi wymioty, spadek ci nienia krwi.

48
Metody otrzymywania:
• dehydrocyklizacja 1,4-butanodiolu
+ 2 H
2
HOCH
2
CH
2
CH
2
CH
2
OH
O
O
o
faza gazowa lub ciekłej,
o
zwykle za pomoc katalizatorów miedziowych
o
temperatura - 200-250
o
C,
o
wydajno do 90%

49
• katalityczne uwodornianie bezwodnika maleinowego
Katalizatorem procesu jest Pd/Ni na no niku krzemionkowym. Reakcj prowadzi si w
temperaturze 235
o
C, pod ci nieniem 9,5 MPa. Proces został opracowany przez belgijsk
firm UCA SpA (Bruksela).
i
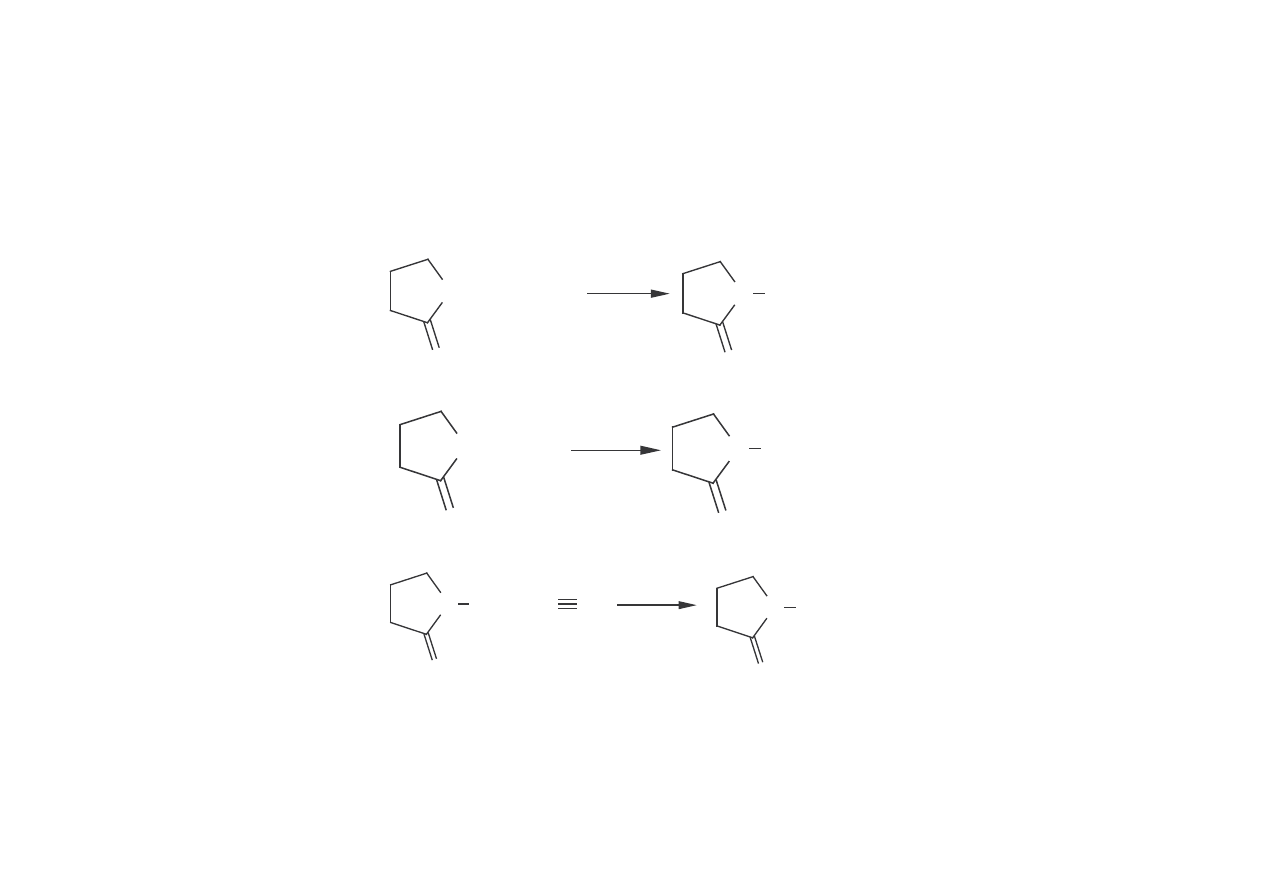
50
Zastosowanie
γ-butyrolaktonu:
• Rozpuszczalnik
• Synteza N-metylopirolidonu (wa ny rozpuszczalnik) i N-winylopirolidonu.
+ CH
3
NH
2
O
O
N
O
CH
3
+ H
2
O
+ NH
3
O
O
N
O
H + H
2
O
N
O
H
C
H
CH
+
N
O
CH=CH
2

51
Inne wybrane zastosowania 1,4-butanodiol
• produkt reakcji 1,6-diizocyjanianu heksametylenu z 1,4-butanodiolem, otrzymywany
jest w Niemczech pod nazw perlon U. Włókna typu perlon charakteryzuj si dobr
odporno ci chemiczn na działanie kwasów, tlenu i promieniowania widzialnego. Ze
wzgl du na swoj sztywno u ywane s w postaci yłki do wyrobu szczotek, a w
postaci prz dzy jako materiał izolacyjny.
• 1,4-Butanodiol w reakcji z kwasem adypinowym daje poliole poliestrowe,
półprodukty do elastomerów, pianek, powłok i klejów poliuretanowych.
• ywice polibutylenotereftalowe (krystaliczne termoplasty o doskonałych
własno ciach fizycznych i elektrycznych); znalazły zastosowanie w przemy le
samochodowym (zderzaki, cz ci silników) oraz w przemy le elektrycznym i
elektronicznym (ł czniki, izolatory oraz przeka niki). Ponadto s stosowane do
wyrobu włókien, folii i klejów.

52
1,6-DIOLE
1,6-H
EKSANODIOL
1,6-Heksanodiol jest białym, woskowatym i higroskopijnym ciałem stałym, o
temperaturze topnienia 41-43
o
C. Dobrze rozpuszcza si w wodzie, gwałtownie
reaguje z utleniaczami. Jest substancj łatwopaln , drobno zdyspegowany
proszek 1,6-heksanodiolu w powietrzu mo e by przyczyn eksplozji.
1,6-Heksanodiol mo e by kumulowany w organi mie poprzez układ oddechowy.
Krótka ekspozycja z heksanodiolem mo e by przyczyn podra nie oczu.

53
Metody otrzymywania 1,6-heksanodiolu
Z kwasu adypinowego
RO C
O
(CH
2
)
4
C
O
OR + 4 H
2
HO(CH
2
)
6
OH + 2 ROH
w której: R=H, C
2
H
5
Proces uwodornienia kwasu adypinowego prowadzi si w rodowisku wodnym, w
temperaturze 170-240
o
C, pod ci nieniem 15-30 MPa na katalizatorach Cu, Co lub Mn.
Jako zwi zek wyj ciowy do wytwarzania 1,6-heksanodiolu, oprócz kwasu adypinowego
mo e posłu y tak e kwas
ω-hydroksykapronowy.

54
Z
εεεε
-kaprolaktonu
+ H
2
HO(CH
2
)
6
OH + H
2
O
O
O
• Temperatura - 250
o
C,
• Ci nienie – ok. 30 MPa,
• Katalizator - mied -Raneya lub chromin miedziowy,
• Wydajno prawie 100%.
ε-Kaprolakton otrzymuje si przez utlenienie cykloheksanonu kwasem nadoctowym.
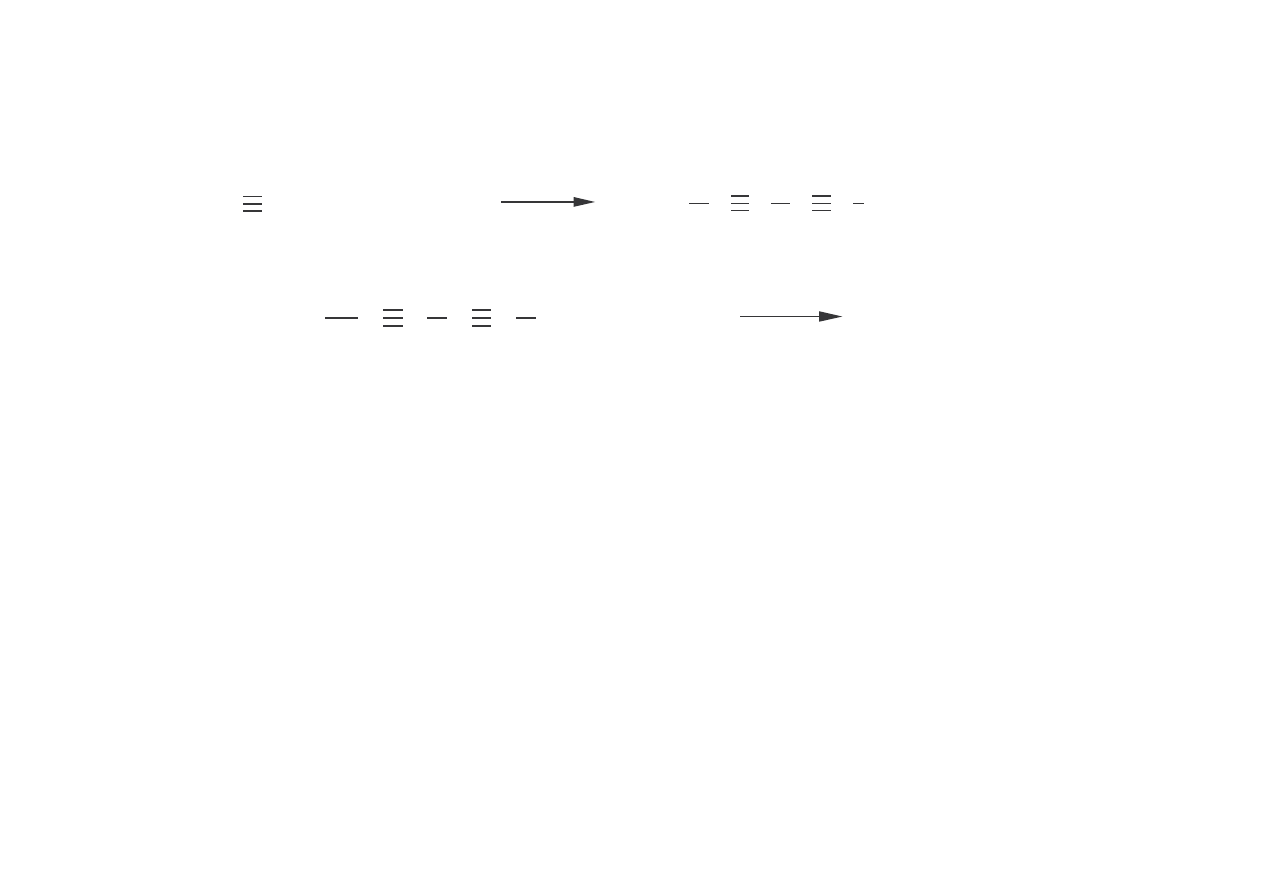
55
Z alkoholu propargilowego
CuC CCH
2
OH
HOCH
2
C C C C CH
2
OH
2
+ 2 CuCl
2
+ 2 Cu
2
Cl
2
HOCH
2
C C C C CH
2
OH + 4 H
2
HO(CH
2
)
6
OH
Uwodornienie w temperaturze 40-60
o
C w obecno ci katalizatora niklowego.
wiatowa produkcja 1,6-heksanodiolu wynosi około 22 tys. t/rocznie.
1,6-Heksanodiol wykorzystywany jest przede wszystkim do otrzymywania poliestrów i
poliuretanów, a tak e do otrzymywania heksametylenodiaminy (HMDA).
56
1,4-D
IMETYLOLOCYKLOHEKSAN
(1,4-
DIHYDROKSYMETYLOCYKLOHEKSAN
)
COOCH
3
COOCH
3
COOCH
3
COOCH
3
CH
2
OH
CH
2
OH
+3 H
2
+4 H
2
+ 2 CH
3
OH
I etap
• faza ciekła; katalizator palladowy, temperatura - 160-180
o
C, ci nienie - 30-40 MPa.
• otrzymuje si mieszanin dwóch izomerycznych produktów – izomer trans (ok. 51-
54%) i izomer cis,
• rozdział izomerów przez wielokrotn krystalizacj .
• Wysokie ciepło reakcji (-197 kJ/mol) odprowadza si przez obieg uwodarnianego
estru.
• Selektywno - 96-98% (je li wychodzi si z estru o jako ci włókonotwórczej).

57
II etap:
• katalizator typu kontaktu Adkinsa – np. chromin miedziowy.
• niezale nie od wyj ciowego stosunku cis-trans estru dimetylowego, ustala si nowa
mieszanina izomerów, zale na od warunków reakcji, jak równie składu katalizatora.
1,4-Bis(hydroksymetylolo)cykloheksan, jako substrat diolowy, wykorzystywany jest do
produkcji włókien poliestrowych, poliuretanów i poliw glanów.
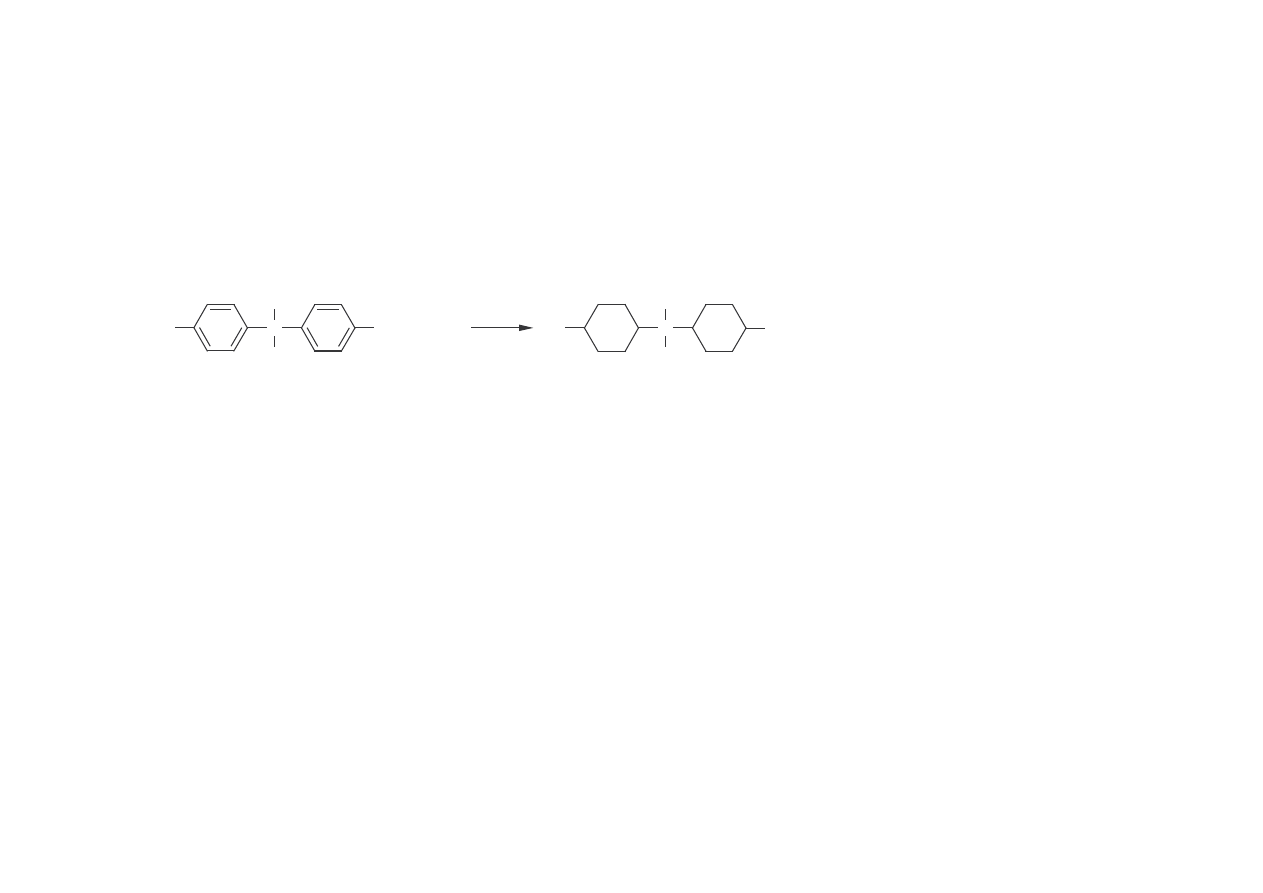
58
I
NNE DIOLE
2,2-B
IS
(4-
HYDROKSYCYKLOHEKSYLO
)
PROPAN
C
CH
3
CH
3
O
H
OH
C
CH
3
CH
3
O
H
OH + 4 H
2
Katalityczne uwodornienie, w temperaturze 200
o
C, pod ci nieniem 25 MPa, wobec
katalizatora Ni, Co, Ru.
Zastosowanie: jako diol do produkcji poliestrów, poliuretanów i poliw glanów. Wymiana
grupy -OH na aminow pozwala uzyska diamin wykorzystywan przy wytwarzaniu
prze roczystych poliamidów.

59
T
RIOLE
G
LICERYNA
Gliceryna (glicerol, 1,2,3-propanotriol) jest oleist , lepk , bezbarwn ,
bezwonn ciecz o słodkim smaku i temperaturze wrzenia 290
o
C. W
temperaturze 0
o
C tworzy rombowe kryształy, które topi si w temperaturze 18
o
C.
Wykazuje silne wła ciwo ci higroskopijne – chłonie wod z powietrza w ilo ci do
50% swojej masy. Miesza si z wod we wszystkich stosunkach.
Gliceryna ze wzgl du na mał lotno , stwarza zagro enie przy wysokich
temperaturach lub w przypadku wypicia du ej dawki. Przy zatruciu doustnym
wyst puj objawy w postaci bólu głowy, zawrotów, nudno ci, senno ci. W
ci kich przypadkach mo e nast pi utrata wiadomo ci a do pi czki, która
mo e wywoła uszkodzenie mózgu. Inne objawy mog ce wyst pi po zatruciu
gliceryn to niewydolno układu oddechowego, białkomocz, a tak e ci kie
uszkodzenie nerek.

60
Metody otrzymywania gliceryny
Gliceryna pochodzenia naturalnego
• zmydlanie tłuszczów, prowadz ce do uzyskania mydła i gliceryny,
CH
2
CH
CH
2
RCOO
RCOO
RCOO
+ 3 NaOH
CH
2
CH
CH
2
O
H
O
H
O
H
+ 3 RCOONa

61
• rozszczepianie tłuszczów (w rodowisku oboj tnym lub kwa nym, w obecno ci
katalizatorów lub emulgatorów), prowadz ce do uzyskania mieszaniny wy szych
kwasów tłuszczowych i gliceryny,
CH
2
CH
CH
2
RCOO
RCOO
RCOO
+ 3 H
2
O
CH
2
CH
CH
2
O
H
O
H
O
H
+ 3 RCOOH

62
Warianty hydrolizy tłuszczów:
• Metody ci nieniowe:
a. hydrolizie tłuszczu w autoklawie, wobec przegrzanej pary wodnej, w
temperaturze 200
o
C, pod ci nieniem do 5 MPa.
b. Hydroliza katalityczna; katalizator, np. CaO, ZnO, MgO (dodawany w ilo ci ok.
1% wag.), rozszczepienie zachodzi w ni szej temperaturze i pod ni szym
ci nieniem (150
o
C, do 1MPa).
• Metody bezci nieniowe::
a. tzw. metoda kwasowa, polega na zadaniu tłuszczu st onym kwasem siarkowym,
w ilo ci 5-8% wag., w temperaturze 120
o
C. W procesie uzyskuje si 15% wod
glicerynow i 90-98% mieszanin kwasów tłuszczowych
CH
3
(CH
2
)
7
CH=CH(CH
2
)
7
COOH + H
2
SO
4
CH
3
(CH
2
)
8
CH(CH
2
)
7
COOH
OSO
3
H
b. metoda katalityczna, polega na gotowaniu tłuszczu, w obecno ci pary
bezpo redniej, z dodatkiem mieszaniny kwasu siarkowego i kwasu benzeno-
stearynosulfonowego
(tzw.
katalizator
Twitschella)
lub
kwasu
naftenosulfonowego (katalizator Pietrowa).

63
• produkcja paliwa biodiesel(katalizowana metanolanem sodu)
CH
2
CH
CH
2
RCOO
RCOO
RCOO
CH
2
CH
CH
2
O
H
O
H
O
H
+ 3 R'OH
+ 3 RCOOR'
• gliceryna z sacharozy zawartej w melasie. Fermentacja tego surowca w obecno ci
siarczynów pozwala uzyska 230 g gliceryny z 1 kg sacharozy. (obecnie metoda ta ma
bardzo małe znaczenie)
64
Gliceryna syntetyczna
• Metody chlorowe
a.
z chlorku allilu (od 1943 r. przez IG Farben oraz od 1948 r. przez firm Stell).
metoda Williamsa
CH
2
CH
CH
2
Cl
CH
2
CH
CH
2
OH
CHOH
CH
2
OH
CH
2
Cl
CHCl
CH
2
OH
CH
2
OH
+
CHOH
CH
2
OH
CH
2
OH
+NaOH
-NaCl
-NaCl
+NaOH
+HOCl
lub
CH
2
CH
CH
2
Cl
CHOH
CH
2
Cl
CH
2
Cl
CHCl
CH
2
Cl
CH
2
OH
CHOH
CH
2
OH
CH
2
OH
+
-NaCl
+NaOH
+HOCl

65
Poprzez epichlorohydryn (najwa niejsza metoda syntetyczna)
CHOH
CH
2
OH
CH
2
Cl
CHOH
CH
2
OH
CH
2
OH
-HCl
+H
2
O
CH
CH
2
O
CH
2
Cl
+H
2
O
CH
CH
2
O
CH
2
OH
Hydroliza do gliceryny, pod zwi kszonym ci nieniem, w temperaturze 100-200
o
C.
Czynnik hydrolizuj cy - 5-10% wodne roztwory Na
2
CO
3
lub NaOH w 10-25-krotnym
nadmiarze w stosunku do ilo ci stechiometrycznej.
W procesach ci głych stosuje si reaktory typu rurowego. Układ reakcyjny utrzymuje si
w stanie zemulgowania przy pomocy zewn trznej pompy.
Je eli skala produkcji jest niewielka, wówczas prowadzi si proces w sposób okresowy w
autoklawach z mieszadłem.
Uzyskany wodny roztwór gliceryny zat a si , odsala, i rektyfikuje do st enia 98%.
Alkohol allilowy wchodz cy w sklad frakcji gazowej zawraca si do procesu.
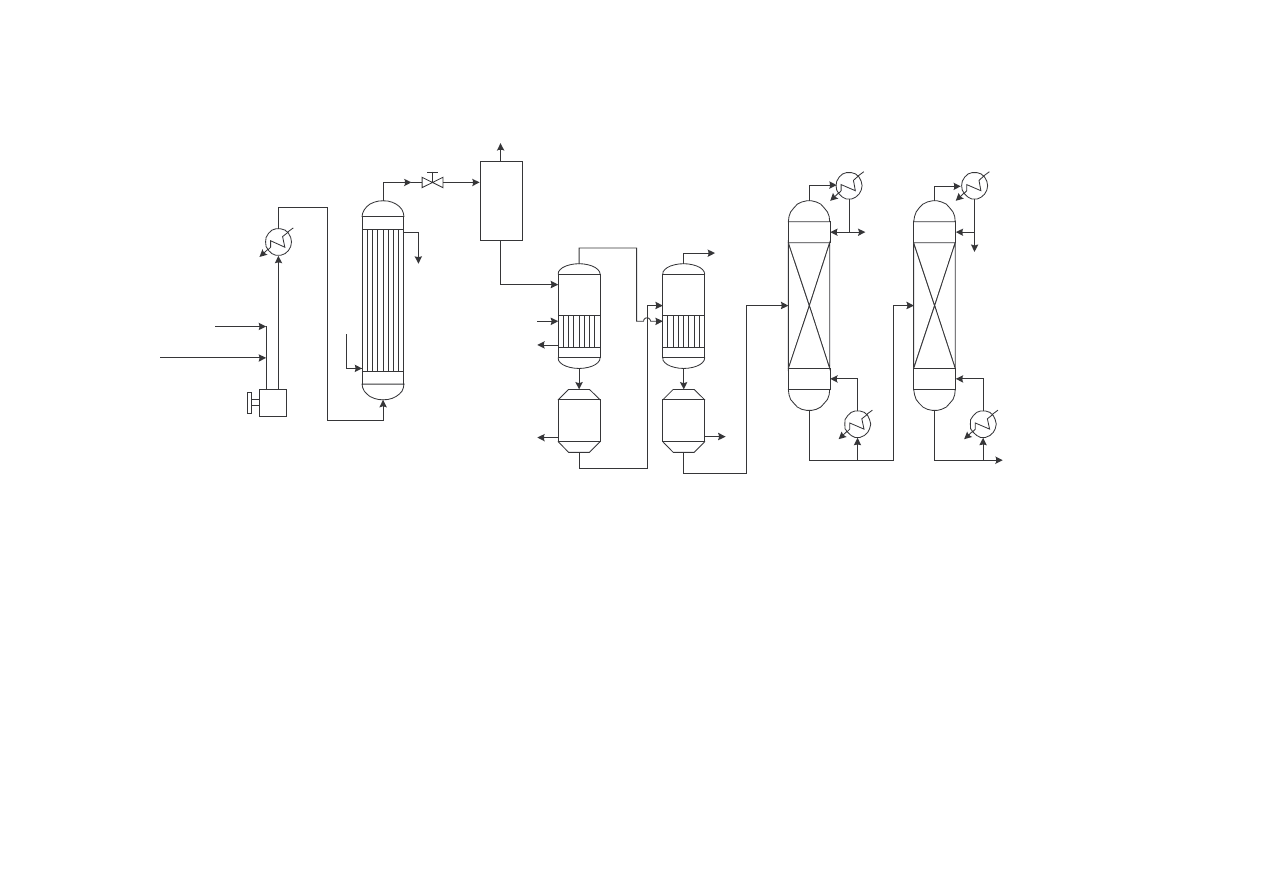
66
Schemat instalacji produkuj cej gliceryn t metod przedstawiono na rys. 4.4.
Na
2
CO
3
epichlorohydryna
1
2
H
2
O
H
2
O
3
4
5
CO
2
, H
2
O
6
6
para
para
7
7
NaCl
NaCl
8
9
gliceryna
frakcja ci ka
H
2
O
Schemat instalacji produkuj cej gliceryn metod chlorow .
1 - pompa, 2 - podgrzewacz, 3 - reaktor, 4 - zawór rozpr aj cy, 5 - separator, 6 - kolumny
odparowywuj ce, 7 - filtry, 8 - kolumna usuwania wody, 9 - kolumna usuwania ci szych
frakcji
Na podstawie: Lebiediew N.N., Chimija i technologija osnownovo, organicieskovo i
neftechimicieskovo sinteza, Moskva Chimija, 1988.

67
Metody bezchlorowe
Proces Shell
CH
2
=CHCH
2
OH + H
2
O
2
CH
CH
2
O
CH
2
OH
+H
2
O
-H
2
O
CH
2
OH
CH
OH
CH
2
OH
Alkohol allilowy hydroksyluje si poprzez etap alkoholu glicydylowego za pomoc
roztworu H
2
O
2
w fazie ciekłej w temperaturze 60-70
o
C, w obecno ci trójtlenku wolframu
albo soli kwasu wolframowego (np. NaHWO
4
) jako katalizatora.
Wydajno gliceryny wynosi w tej metodzie ok. 90% (w przeliczeniu na alkohol allilowy i
H
2
O
2
).

68
metoda FMC (Food Machinery Corp.
W miejsce nadtlenku wodoru do epoksydowania alkoholu allilowego wykorzystuje si
kwas nadtlenooctowy z wysokowrz cym ketonem lub estrem jako rozpuszczalnikiem w
temperaturze 50-75
o
C.
proces firmy Olin Mathieson
Wychodzi si równie z alkoholu allilowego otrzymanego w wyniku izomeryzacji tlenku
propylenu, jednak e w nast pnym etapie wytwarza si monochlorohydryn gliceryny
(HOCH
2
CH(OH)CH
2
Cl) w reakcji z kwasem podchlorawym, któr nast pnie zmydla si
do gliceryny. W metodzie tej oszcz dza si cz
chloru w porównaniu do metody
wychodz cej z chlorku allilu.

69
Z akroleiny
CH
2
=CHCHO + H
2
O
2
CH
2
OH
CHCHO
OH
CH
2
OH
CHCHO
OH
CH
2
OH
CH
OH
CH
2
OH
+ H
2
70
ZASTOSOWANIE GLICERYNY
wiatowe zu ycie gliceryny wynosi obecnie ok. 4,7 mln t rocznie.
Kierunki zastosowania:
• jako rodek przeciwzamarzaj cy, do produkcji preparatów kosmetycznych i
farmaceutycznych, jako rodek zwil aj cy tyto , a tak e jako rodek pomocniczy do
farb drukarskich, atramentów, kitów i innych.
• półprodukt do wytwarzania ywic alkidowych przez estryfikacj wielozasadowymi
kwasami, jak np. kwasem ftalowym. ywice glicerynowo-ftalowe (z bezwodnika
ftalowego) – ywice gliptalowe –najwa niejsze ywice poliestrowymi stosowanymi w
przemy le lakierów.
CH
2
OH
CH
OH
CH
2
OH
C
O
C
O
O
+ n
n
-n H
2
O
C
C
O
OCH
2
CHCH
2
O
O
n
• produkty propoksylowania gliceryny do pianek poliuretanowych oraz rodki
powierzchniowo-czynne.

71
• Mono- i diestry gliceryny słu w du ym zakresie przy wyrobie rodków
ywno ciowych.
• do wyrobu azotanu gliceryny, który zaadsorbowany na ziemi okrzemkowej był pierwsz
pochodn , dzi ki której w 1866 r. gliceryna nabrała technicznego znaczenia.
• zmi kczacz do celofanu, zwłaszcza tego u ywanego do produkcji sztucznych jelit do
wyrobu kiełbas,
• w medycynie, w chorobach układu kr enia (triazotan gliceryny),
• w przemy le artykułów biurowych – materiały do kopiowania, ta my do maszyn do
pisania, poduszki do stemplowania, kalki,
• do wyrobu pasty do butów,
• jako olej ci nieniowy w amortyzatorach zderze ,
• do produkcji digliceryny – bis(2,3-dihydroksypropylo)eteru – estry kwasów
tłuszczowych digliceryny maj zastosowanie, m.in. w produkcji
rodków
antystatycznych i do ekstrakcji cukru, a tak e jako czynniki emulguj ce w przemy le
spo ywczym, kosmetycznym, farmaceutycznym, tworzyw sztucznych i smarów.
ii
72
INNE TRIOLE
TRIMETYLOLOPROPAN
-HCOOH
+HCHO, H
2
O
3 HCHO + CH
3
CH
2
CH
2
CHO
Ca(OH)
2
CH
2
OH
C
CH
2
OH
CH
3
CH
2
CHO
CH
2
OH
C
CH
2
OH
CH
3
CH
2
CH
2
OH

73
Zastosowanie:
bezpo rednio albo po etoksylowaniu lub propoksylowaniu w dziedzinie poliestrów i
poliuretanów (gi tkie pianki), a tak e ywic lakierniczych i materiałów wybuchowych
oraz do syntezy smarów w reakcji estryfikacji z kwasami tłuszczowymi. Alkilowe etery
trimetylolopropanu u ywane s jako czynniki sieciuj ce np. układy ywic akrylowych.
W skali wiatowej produkuje si ok.100 tys. t/r trimetylolopropanu
W Polsce w 1998 r. ruszyła instalacja do wiadczalno-produkcyjna trimetylolopropanu w
Zakładach Azotowych „K dzierzyn”.
iii

74
TRIMETYLOLOETAN
OH
-
-HCOOH
+HCHO, H
2
O
2 HCHO + CH
3
CH
2
CHO
CH
2
OH
C
CH
2
OH
CH
3
CHO
CH
2
OH
C
CH
2
OH
CH
3
CH
2
OH
1,2,4-BUTANOTRIOL
H
2
HOH
2
CC CCH
2
OH + H
2
O
HOH
2
C C
O
CH
2
CH
2
OH
HOH
2
C CH
OH
CH
2
CH
2
OH
1,2,6-HEKSANOTRIOL
H
2
O, H
2
CH
2
=CH-CHO
2
O
CHO
CH
HOH
2
C
OH
(CH
2
)
3
CH
2
OH
Mo e by u ywany do otrzymywania gum alkidowych i poliestrów.

75
TETRAOLE
PENTAERYTRYT
Pentaerytryt jest najprostszym alkoholem czterowodorotlenowym o pi ciu
atomach w gla. Jest to ciało stałe, o temperaturze topnienia 260,5
o
C.

76
Otrzymywanie
OH
-
3 HCHO + CH
3
CHO
CH
2
OH
C
CH
2
OH
HOCH
2
CHO
OH
-
+ HCHO + H
2
O
CH
2
OH
C
CH
2
OH
HOCH
2
CHO
CH
2
OH
C
CH
2
OH
CH
3
CH
2
OH + HCOOH
Warunki:
• Czterokrotny nadmiar formaldehydu; pozwala utrzyma na niewielkim poziomie
tworzenie si dipentaerytrytu czyli monoeteru pentaerytrytu [(HOCH
2
)
3
CCH
2
]
2
O
• Proces ci gły lub okresowy.
• Katalizator –Ca(OH)
2
(w nadmiarze 20%) lub NOH,
• Temperatura od 30 do 50
o
C.
• Selektywno wyznaczona metod analityczn ok. 91%; du e straty podczas
wydzielania.
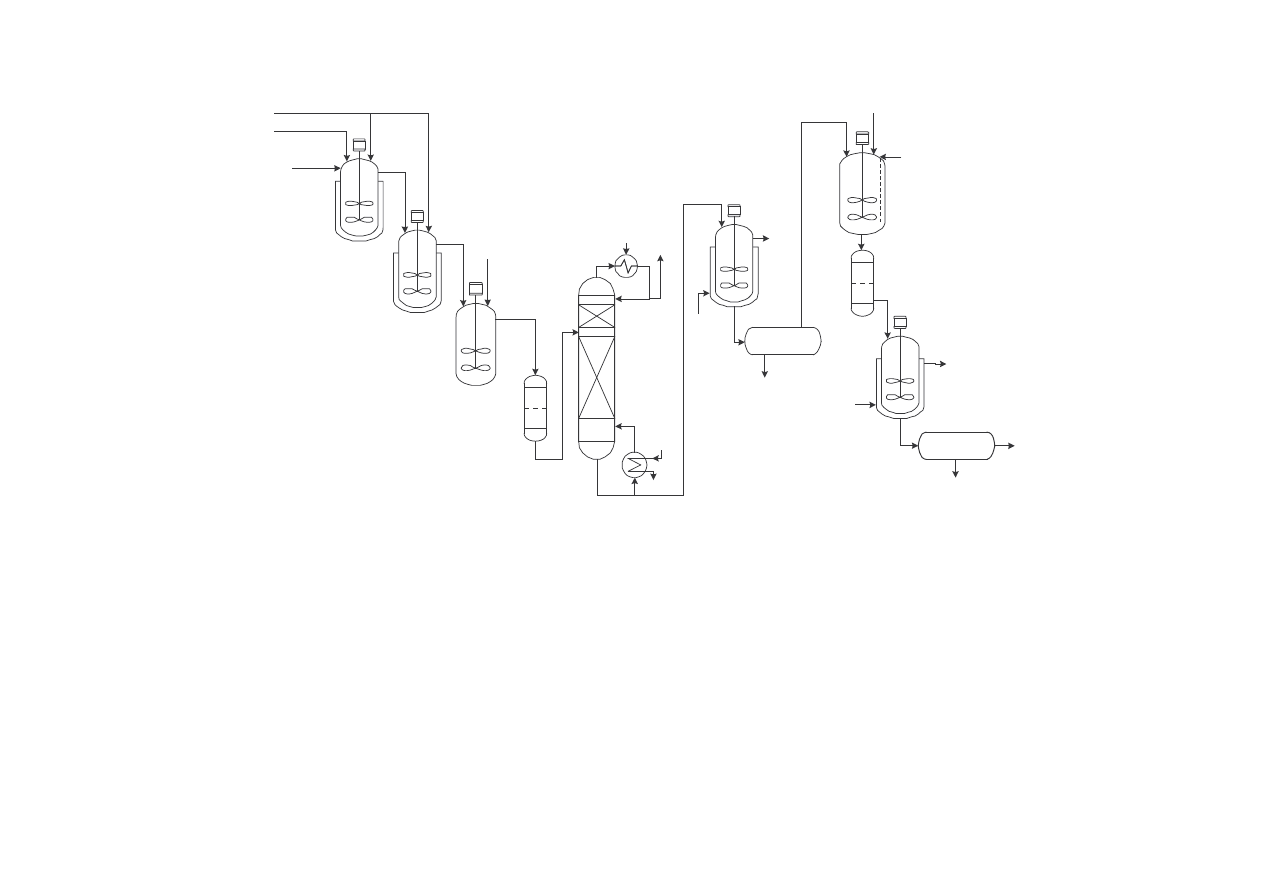
77
aldehyd octowy
formalina
NaOH
1
2
3
H
2
SO
4
4
5
6
woda
para
woda
7
8
9
woda
i w giel aktywny
para
10
11
woda
12
pentaerytryt
Rys. Schemat instalacji produkuj cej pentaerytryt.
1, 2 - reaktory, 3 - neutralizator, 4, 8, 10, 12 - filtry, 5 - kolumna destylacyjna, 6 -
kondensator, 7, 11 - krystalizatory, 9 - aparat do rozpuszczenia produktu
Na podstawie: Lebiediew N.N., Chimija i technologija osnownovo, organicieskovo i
neftechimicieskovo sinteza, Moskva Chimija, 1988.

78
ZASTOSOWANIE PENTAERYTRYTU
• do wytwarzania ywic alkidowych jako materiałów lakierniczych.
• do produkcji ywic pentaftalowych (produkty poliestryfikacji z bezwodnikiem
ftalowym), maj cych podobne wła ciwo ci do ywic gliptalowych, ale o wi kszej
trwało ci.
• w mieszaninie z innymi alkoholami wielowodorotlenowymi (glikolem,
heksanotriolem) u ywany jest do otrzymywania wodoodpornych lakierów
szybkoschn cych.
• Estry pentaerytrytu z wy szymi kwasami tłuszczowymi słu jako dodatki do olejów
smarnych, zmi kczacze i emulgatory,
• estry z kwasem azotowym (tetraazotan pentaerytrytu - C(CH
2
ONO
2
)
4
– tzw. pentryt)
u ywany jest jako materiał wybuchowy, dorównuj cy sił wybuchu nitroglicerynie
wiatowa produkcja pentaerytrytu wynosi ok. 260 tys. t/r.

79
i
Chem. Eng. 1991, 98(9), 17 - Chemik 1/1992, 25.
ii
Informations Chimie 1986, 227, 199 - Przemysł Chemiczny 1987, 66/6, 307.
iii
Kalendarium dziejów Zakładów Azotowych „K dzierzyn” - Przemysł Chemiczny 77/5 (1998).
Wyszukiwarka
Podobne podstrony:
Alkohole i fenole 3 id 58102 Nieznany
Alkohole 13 id 58087 Nieznany (2)
alkohole i fenole 2 id 58101 Nieznany (2)
alkohol i kierowca id 58052 Nieznany
Alkohole monohydroksylowe id 58 Nieznany (2)
alkohole i fenole 2 id 58114 Nieznany (2)
Alkohole 09 id 58086 Nieznany (2)
Alkohole polihydroksylowe id 58 Nieznany (2)
Alkohole i etery 3 id 58099 Nieznany
Alkohole i fenole 3 id 58102 Nieznany
cw 16 odpowiedzi do pytan id 1 Nieznany
Opracowanie FINAL miniaturka id Nieznany
How to read the equine ECG id 2 Nieznany
PNADD523 USAID SARi Report id 3 Nieznany
OPERAT STABLE VERSION ugoda id Nieznany
biuletyn katechetyczny pdf id 8 Nieznany
Finanse publiczne cw 4 E S id 1 Nieznany
7 uklady rownowagi fazowej id 4 Nieznany
więcej podobnych podstron