Alkohole i fenole – zakres podstawowy
- 1 -
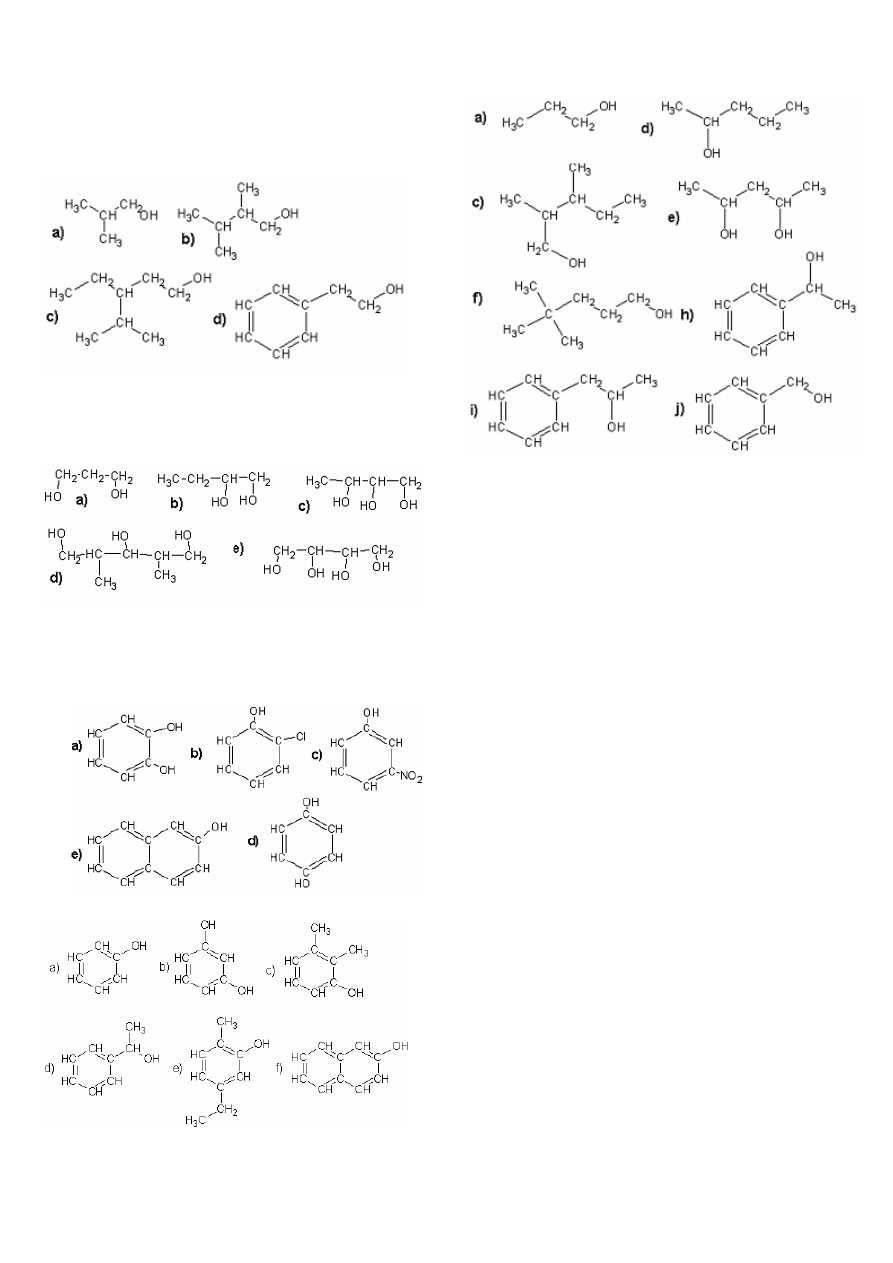
1.
Podaj
wzory
pólstrukturalne
związków:
a) 2-metylopropan-l-olu,
b) 2,3-dimetylobutan-l-olu,
c) 3-izopropylopentan-1-olu,
d) 2-fenyloetanolu.
Odp.:
2.
Podaj
wzory
półstrukturalne
związków:
a) propano-l,3-diolu,
e) butano-l,2,3,4-tetraolu,
b) butano-l,2-diolu,
c) butano-l,2,3-triolu,
d) 2,4-dimetylopentano-l ,3,5-triolu,
Odp.:
3.
Podaj wzory półstrukturalne związków o nazwach:
a) benzeno-l,2-diol,
d) benzeno-l,4-diol (hydrochinon),
b) o-chlorofenol, e) 2-naftol,
c) m-nitrofenol,
Odp.:
4.
Podaj nazwy związków:
Odp.:
a) fenol b) benzeno-1,3-diol c) 2,3-dimetylofenol
d) 1-fenyloetanol e) 5-etylo-2-metylofenol f) 2-naftol
5.
Podaj nazwy związków:
Odp.:
a) n-propanol
c) 2,3-dimetylopentan-1-ol
d) pentan-2-ol
e) pentano-2,4-diol
f) 4,4dimetylopentan-1-ol h) 1-fenyloetanol
i) 1-fenylopropan-2-ol
j) fenylometanol
6.
Podaj wzory półstrukturalne i nazwy systematyczne
wszystkich izomerycznych alkoholi o wzorze C
5
H
12
O.
7.
Zapisz równania reakcji (wzorami półstrukturalnymi)
spalania propanolu i butanolu do:
a) tlenku węgla(IV) i pary wodnej,
b) tlenku węgla(II) i pary wodnej.
c) węgla i pary wodnej
8.
Zapisz równania reakcji za pomocą których można
dokonać następujących przemian (należy używać tylko wzorów
półstrukturalnych). Uwzględnij warunki reakcji:
a) propan
1-chloropropan
propan-1-ol
propan-1-olan potasu,
b) but-2-en
butan-2-ol
2-chlorobutan,
c) butan-1-ol
but-l-en
butan-2-ol,
d) propan-1-ol
propen
2-chloropropan
propan-2-ol.
e) acetylen
alken
alkohol
halogenek alkilu
węglowodór nasycony (reakcja Würtza).
f) benzen
chlorobenzen
fenolan sodu
fenol
2,4,6-tribromofenol,
Odp.:
a) CH
3
-CH
2
-CH
3
+ Cl
2
→
υ
h
CH
3
-CH
2
-CH
2
Cl + HCl
CH
3
-CH
2
-CH
2
Cl + KOH
→
O
H
2
CH
3
-CH
2
-CH
2
OH + KCl
2CH
3
-CH
2
-CH
2
OH + 2K
→
2CH
3
-CH
2
-CH
2
OK + H
2
b) CH
3
-CH=CH-CH
3
+ H
2
O
→
+
H
CH
3
-CH
2
-CH(OH)-CH
3
CH
3
-CH
2
-CH(OH)-CH
3
+ HCl
CH
3
-CH
2
-CHCl-CH
3
+ H
2
O
c) CH
3
-CH
2
-CH
2
-CH
2
OH
→
T
O
Al ,
3
2
CH
3
-CH
2
-CH=CH
2
+ H
2
O
CH
3
-CH
2
-CH=CH
2
+ H
2
O
→
+
H
CH
3
-CH
2
-CH(OH)-CH
3
d) CH
3
-CH
2
-CH
2
OH
→
T
O
Al
,
3
2
CH
3
-CH=CH
2
+ H
2
O
CH
3
-CH=CH
2
+ HCl
→
CH
3
-CHCl-CH
3
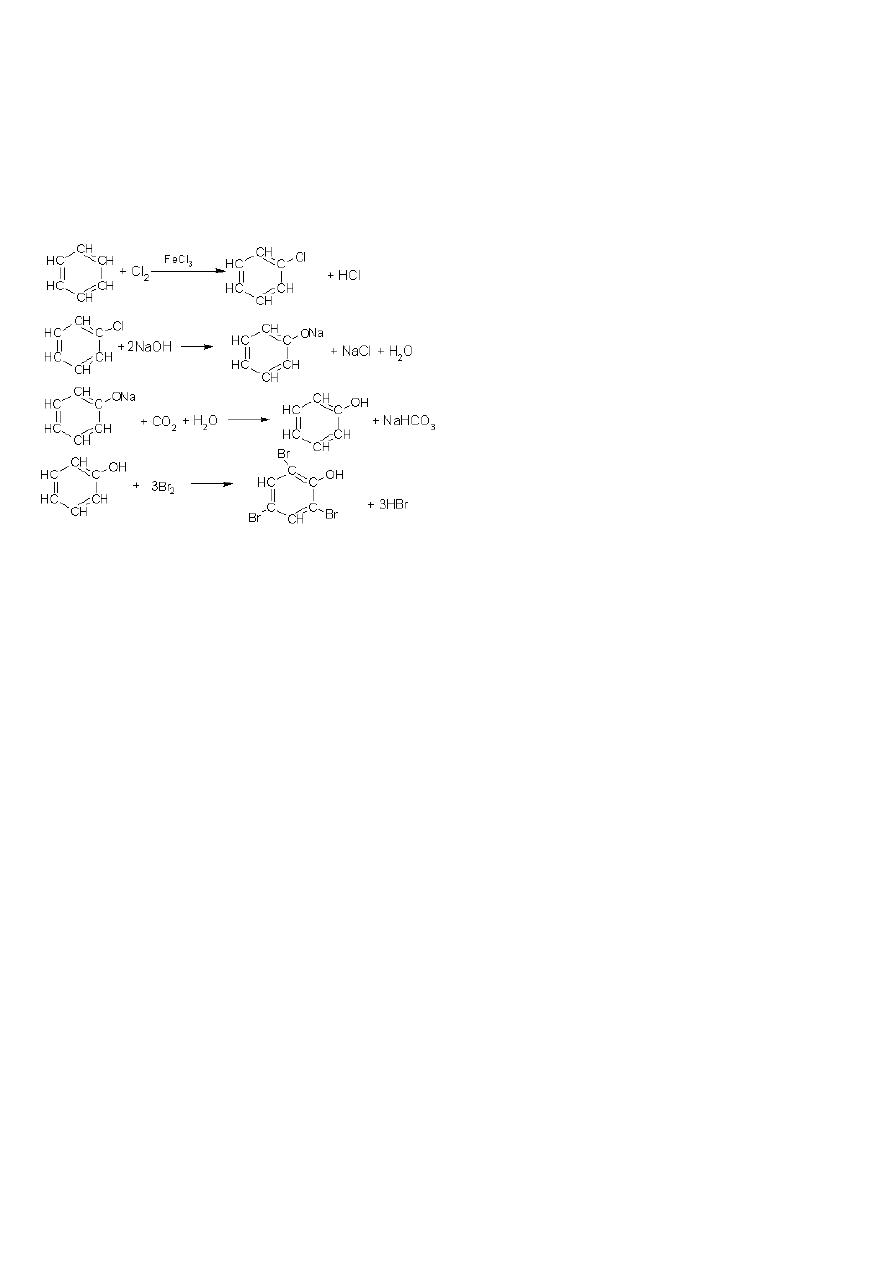
Alkohole i fenole – zakres podstawowy
- 2 -
CH
3
-CHCl-CH
3
+ NaOH
→
O
H
2
CH
3
-CH(OH)-CH
3
e) CH
≡
CH + H
2
→
Ni
CH
2
=CH
2
CH
2
=CH
2
+ H
2
O
→
+
H
CH
3
-CH
2
OH
CH
3
-CH
2
OH + HCl
→
.
temp
CH
3
-CH
2
Cl + H
2
O
2CH
3
-CH
2
Cl + 2Na
→
CH
3
-CH
2
-CH
2
-CH
3
+ 2NaCl
f)
9.
Zaproponuj cykl reakcji pozwalających otrzymać
z etanolu (należy używać tylko wzorów półstrukturalnych):
a) glikol etylowy,
b) 1,1,2,2-tetrabromoetan,
c) etan,
d) butan.
Odp.:
a) CH
3
-CH
2
OH
2
3
Al O
.
temp
→
CH
2
=CH
2
+ H
2
O
CH
2
=CH
2
+ Cl
2
→
CH
2
Cl-CH
2
Cl
CH
2
Cl-CH
2
Cl + 2KOH
→
O
H
2
CH
2
OH-CH
2
OH + 2KCl
b) CH
3
-CH
2
OH
2
3
Al O
.
temp
→
CH
2
=CH
2
+ H
2
O
CH
2
=CH
2
+ Cl
2
→
CH
2
Cl-CH
2
Cl
CH
2
Cl-CH
2
Cl + 2KOH
→
alkohol
CH
≡
CH + 2KCl + 2H
2
O
CH
≡
CH + 2Br
2
→
CHBr
2
–CHBr
2
c) CH
3
-CH
2
OH
2
3
Al O
.
temp
→
CH
2
=CH
2
+ H
2
O
CH
2
=CH
2
+ H
2
→
CH
3
-CH
3
d) CH
3
-CH
2
OH
2
3
Al O
.
temp
→
CH
2
=CH
2
+ H
2
O
CH
2
=CH
2
+ HCl
→
CH
3
-CH
2
Cl
2CH
3
-CH
2
Cl + 2Na
→
CH
3
-CH
2
-CH
2
-CH
3
+ 2NaCl
10.
Zapisz
równania
poniższych
reakcji
wzorami
półstrukturalnymi lub zaznacz, że reakcja nie zachodzi
Uwzględnij
warunki
reakcji:
a) 1-naftol + NaOH
b)
propan-1-olan
wapnia
+
HCl
c) etano-l,2-diolan dipotasu + H
2
O
d)
benzeno-l,3-diol
+
HNO
3(rozc)
f)
propan-1-olan
potasu
+
H
2
O
g) benzeno-l,2-diolan disodu + H
2
O
11.
Zaproponuj dwa doświadczenia pozwalające odróżnić
glikol etylenowy od fenylometanolu mając do dyspozycji
Cu(OH)
2
, HNO
3
oraz FeCl
3
. Podaj schematy doświadczeń,
obserwacje i wnioski.
Odp.: (tekst poniżej jest informacją naprowadzającą na
odpowiedź,
nie
jest
odpowiedzią)
1) można do obydwu roztworów dodać świeżo strąconego
Cu(OH)
2
, zawartość probówki z glikolem etylenowym
zabarwi się na szfirowo, w probówce z fenylometanolem nie
zajdzie żadna reakcja.
2) można do obydwu roztworów dodać HNO
3
, zawartość
probówki
z
fenylometanolem
zabarwi
się
na
ż
ółto,
w probówce z glikolem etylenowym nie zajdzie żadna reakcja.
12.
Do
trzech
probówek
zawierających
metanol
wprowadzono: do 1 potas, do 2 magnez, do 3 glin. Zapisz
równania ewentualnych reakcji, oraz podaj warunki, w jakich
ewentualne reakcje zachodzą. Czego dowodzą te reakcje?
Odp.: potas reaguje z metanolem bardzo energicznie:
CH
3
OH
+
K
CH
3
OK
+
H
2
Magnez
reaguje
z
metanolem
po
podgrzaniu:
2CH
3
OH + Mg
(CH
3
O)
2
Mg + H
2
Glin nie reaguje z metanolem. Świadczy to o malejącej
reaktywności w szeregu K, Mg, Al
13.
Zapisz równania poniższych reakcji lub zaznacz, że
reakcja nie zachodzi:
I.
CH
3
OH + NaOH
II.
CH
3
OH
→
]
[O
III.
CH
3
OH
→
3
2
O
Al
IV.
CH
3
OH + HBr
V.
CH
3
OH
→
temp.
niska
,
SO
H
4
2
Odp.:
I – nie zachodzi
II CH
3
OH
→
]
[O
HCHO
III – nie zachodzi
IV CH
3
OH + HBr
CH
3
Br + H
2
O
V
2CH
3
OH
→
temp.
niska
,
SO
H
4
2
CH
3
OCH
3
+ H
2
O
14.
Ułóż równania kolejnych reakcji prowadzących do
otrzymania (wszystkie związki organiczne należy przedstawiać
wzorami
półstrukturalnymi):
a) etanolanu sodu, mając do dyspozycji karbid i dowolne
odczynniki nieorganiczne,
b) metanolu, mając do dyspozycji węglik glinu i dowolne
odczynniki nieorganiczne,
c) metanolu, mając do dyspozycji metan i dowolne odczynniki
nieorganiczne
d) etanolu, mając do dyspozycji eten i dowolne odczynniki
nieorganiczne
e) etenu, mając do dyspozycji etan i dowolne odczynniki
nieorganiczne
f) butan-2-olu, mając do dyspozycji węglik wapnia i dowolne
odczynniki nieorganiczne,
g) fenylometanolu, mając do dyspozycji benzen, metan
i dowolne odczynniki nieorganiczne.
h) glikolu etylenowego, mając do dyspozycji eten i dowolne
odczynniki nieorganiczne
i) glikolu etylenowego, mając do dyspozycji etanol i dowolne
odczynniki nieorganiczne
j) fenolu, mając do dyspozycji eten i dowolne odczynniki
nieorganiczne
k) fenolanu sodu, mając do dyspozycji karbid i dowolne
odczynniki nieorganiczne

Alkohole i fenole – zakres podstawowy
- 3 -
l) fenylometanolu, mając do dyspozycji karbid, metan
i dowolne odczynniki nieorganiczne
m) cykloheksanolu, mając do dyspozycji karbid i dowolne
odczynniki nieorganiczne
n) cykloheksanolu, mając do dyspozycji acetylen i dowolne
odczynniki nieorganiczne
Odp.:
a)
CaC
2
+
2H
2
O
→
CH
≡
CH
+
Ca(OH)
2
CH
≡
CH
+
H
2
→
CH
2
=CH
2
CH
2
=CH
2
+
H
2
O
H
+
→
CH
3
-CH
2
OH
b)
Al
4
C
3
+
12HCl
→
3CH
4
+
4AlCl
3
CH
4
+
Cl
2
h
ν
→
CH
3
Cl
+
HCl
CH
3
Cl + KOH
2
H O
→
CH
3
OH + KCl
c)
CH
4
+
Cl
2
h
ν
→
CH
3
Cl
+
HCl
CH
3
Cl + KOH
2
H O
→
CH
3
OH + KCl
d)
CH
2
=CH
2
+
H
2
O
H
+
→
CH
3
-CH
2
OH
e)
CH
3
–CH
3
+
Cl
2
h
ν
→
CH
3
–CH
2
Cl
+
HCl
CH
3
–CH
2
Cl + KOH
2
H O
→
CH
3
–CH
2
OH + KCl
CH
3
-CH
2
OH
2
3
Al O
.
temp
→
CH
2
=CH
2
+
H
2
O
f)
CaC
2
+
2H
2
O
→
CH
≡
CH
+
Ca(OH)
2
CH
≡
CH
+
H
2
→
CH
2
=CH
2
CH
2
=CH
2
+
HCl
→
CH
3
-CH
2
Cl
2CH
3
-CH
2
Cl + 2Na
→
CH
3
-CH
2
-CH
2
-CH
3
+ 2NaCl
CH
3
-CH
2
-CH
2
-CH
3
+ Cl
2
h
ν
→
CH
3
-CH
2
-CHCl-CH
3
+ HCl
CH
3
-CH
2
-CHCl-CH
3
+
KOH
2
H O
→
CH
3
-CH
2
-CH(OH)-CH
3
+
KCl
g)
CH
4
+
Cl
2
h
ν
→
CH
3
Cl
+
HCl
C
6
H
6
+ CH
3
Cl
3
AlCl
→
C
6
H
5
CH
3
+ HCl
C
6
H
5
CH
3
+ Cl
2
h
ν
→
C
6
H
5
CH
2
Cl + HCl
C
6
H
5
CH
2
Cl + KOH
2
H O
→
C
6
H
5
CH
2
OH + KCl
h)
CH
2
=CH
2
+
Cl
2
→
CH
2
Cl-CH
2
Cl
CH
2
Cl-CH
2
Cl + KOH
→
O
H
2
CH
2
OH-CH
2
OH + KCl
i)
CH
3
-CH
2
OH
2
3
Al O
.
temp
→
CH
2
=CH
2
+
H
2
O
CH
2
=CH
2
+
Cl
2
→
CH
2
Cl-CH
2
Cl
CH
2
Cl-CH
2
Cl + KOH
→
O
H
2
CH
2
OH-CH
2
OH + KCl
j)
CH
2
=CH
2
+
Cl
2
→
CH
2
Cl-CH
2
Cl
CH
2
Cl-CH
2
Cl + 2KOH
→
alkohol
CH
≡
CH + 2KCl + 2H
2
O
3CH
≡
CH
ś
.
ci nienie
temp
→
C
6
H
6
C
6
H
6
+
Cl
2
3
AlCl
→
C
6
H
5
Cl
+
HCl
C
6
H
5
Cl + 2NaOH
→
C
6
H
5
ONa + NaCl + H
2
O
C
6
H
5
ONa + CO
2
+ H
2
O
→
C
6
H
5
OH + NaHCO
3
k)
CaC
2
+
2H
2
O
→
CH
≡
CH
+
Ca(OH)
2
3CH
≡
CH
ś
.
ci nienie
temp
→
C
6
H
6
C
6
H
6
+
Cl
2
3
AlCl
→
C
6
H
5
Cl
+
HCl
C
6
H
5
Cl + 2NaOH
→
C
6
H
5
ONa + NaCl + H
2
O
l)
CaC
2
+
2H
2
O
→
CH
≡
CH
+
Ca(OH)
2
3CH
≡
CH
ś
.
ci nienie
temp
→
C
6
H
6
CH
4
+
Cl
2
h
ν
→
CH
3
Cl
+
HCl
C
6
H
6
+ CH
3
Cl
3
AlCl
→
C
6
H
5
CH
3
+ HCl
C
6
H
5
CH
3
+ Cl
2
h
ν
→
C
6
H
5
CH
2
Cl + HCl
C
6
H
5
CH
2
Cl + KOH
2
H O
→
C
6
H
5
CH
2
OH + KCl
m)
CaC
2
+
2H
2
O
→
CH
≡
CH
+
Ca(OH)
2
3CH
≡
CH
ś
.
ci nienie
temp
→
C
6
H
6
C
6
H
6
+
3H
2
→
C
6
H
12
C
6
H
12
+
Cl
2
h
ν
→
C
6
H
11
Cl
+
HCl
C
6
H
11
Cl + KOH
2
H O
→
C
6
H
11
OH + KCl
n)
3CH
≡
CH
ś
.
ci nienie
temp
→
C
6
H
6
C
6
H
6
+
3H
2
→
C
6
H
12
C
6
H
12
+
Cl
2
h
ν
→
C
6
H
11
Cl
+
HCl
C
6
H
11
Cl + KOH
2
H O
→
C
6
H
11
OH + KCl
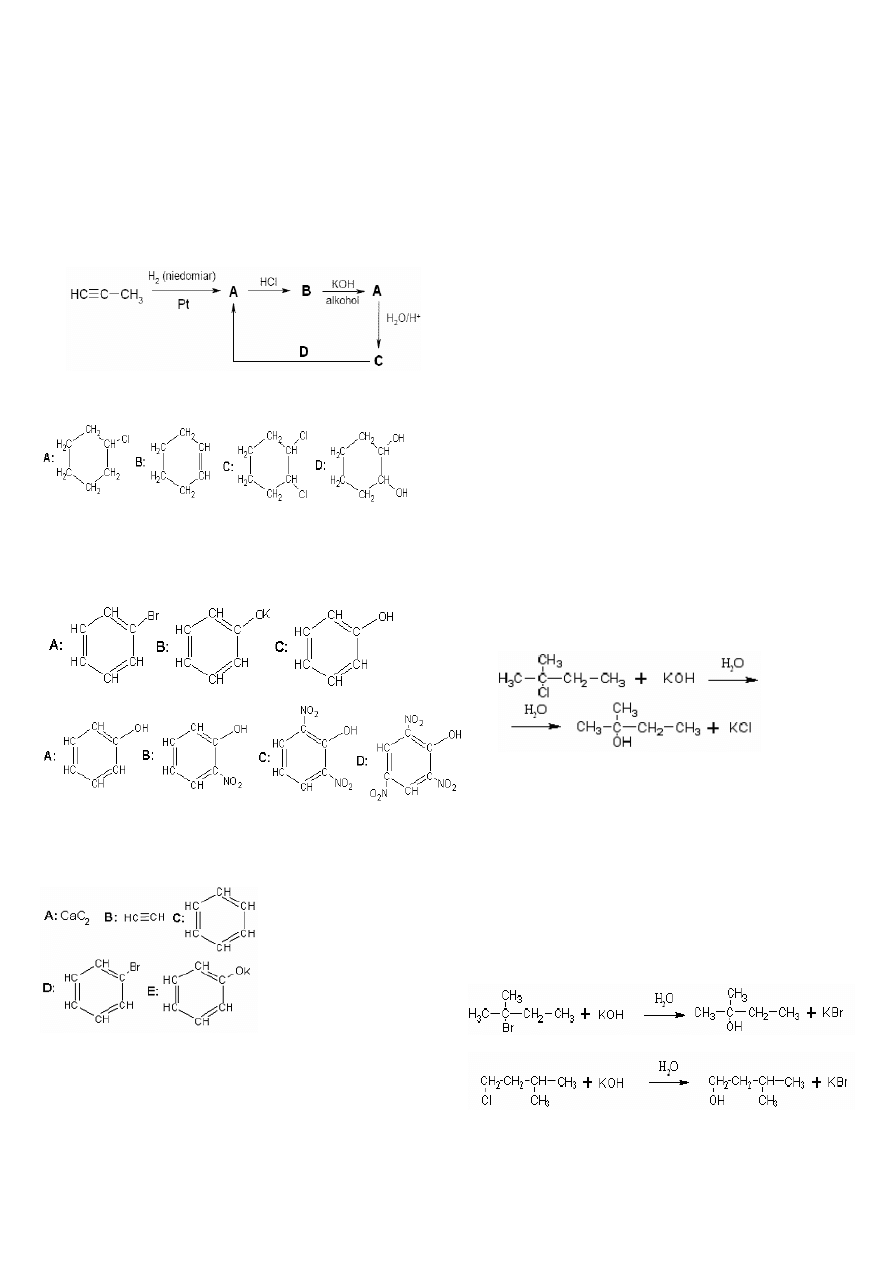
15.
Wstaw w miejsce liter A, B, C, D, E wzory
półstrukturalne
odpowiednich
związków:
a)
but-2-en
→
υ
h
Cl ,
2
A
→
alkohol
KOH ,
B
B
→
2
1H
C
→
2
1Cl
D
→
O
H
KOH
2
,
E
b)
CH
3
-CH=CH
2
→
HCl
A
→
O
H
KOH
2
,
B
B
→
K
C
c)
CH
3
-CH=CH-CH
3
→
2
Cl
A
→
O
H
KOH
2
,
B
B
→
K
C
d)
benzen
→
3
2
,FeBr
Br
A
→
O
H
KOH
2
,
B
B
→
O
H
CO
2
2
,
C
e)
fenol
→
3
HNO
A
→
3
HNO
B
→
3
HNO
C
C
→
KOH
D
f)
A
→
O
H
2
B
→
2
H
C
→
υ
h
Cl ,
2
D
D
→
KOH
CH
3
-CH
2
OH
g)
A
→
T
O
Al
,
3
2
B
→
2
Cl
C
→
O
H
KOH
2
,
D
D
→
K
C
H
2
C
H
2
O
O
K
K
Alkohole i fenole – zakres podstawowy
- 4 -
h)
A
→
O
H
2
B
→
pT
C
→
3
2
,FeBr
Br
D
D
→
O
H
KOH
2
,
E
→
O
H
CO
2
2
,
C
6
H
5
OH
i)
A
→
3
3
, AlCl
Cl
CH
B
→
υ
h
Cl ,
2
C
C
→
O
H
KOH
2
,
C
6
H
5
CH
2
OH
j)
Odp.:
a)
b) A: CH
3
-CHCl-CH
3
B: CH
3
-CH(OH)-CH
3
C: CH
3
-CH(OK)-CH
3
c) A: CH
3
-CHCl-CHCl-CH
3
B: CH
3
-CH(OH)-CH(OH)-CH
3
C: CH
3
-CH(OK)-CH(OK)-CH
3
d)
e)
f) A: CaC
2
B: CH
≡
CH C: CH
3
-CH
3
D: CH
3
-CH
2
Cl
g) A: CH
3
-CH
2
OH
B: CH
2
=CH
2
C: CH
2
Cl-CH
2
Cl
D: CH
2
(OH)-CH
2
(OH)
h)
j) A: CH
2
=CH-CH
3
B: CH
3
-CHCl-CH
3
C: CH
3
-CH(OH)-CH
3
D: Al
2
O
3
16.
Zidentyfikuj
związek,
z
którego
w
wyniku:
a) addycji wody do związku otrzymamy alkohol
monohydroksylowy,
b) reakcji z chlorowodorem otrzymamy tylko jedną
monochlorowcopochodną?
c) po spaleniu związku w tlenie otrzymujemy
dwutlenek węgla i wodę w stosunku molowym 1:1.
Odp.: CH
2
=CH
2
17.
Wskaż zdanie prawdziwe:
Ze
wzrostem
długości
łańcucha
węglowego
alkoholi:
A. rośnie ich rozpuszczalność w wodzie, dzięki
wytwarzającym
się
wiązaniom
wodorowym
B. zmniejsza się reaktywność grupy hydroksylowej
C. rosną ich temperatury wrzenia, które są wyższe od
alkanów
o
zbliżonej
masie
cząsteczkowej
D. prawidłowe są odpowiedzi B i C
Odp.: D
18.
Wskaż zdanie prawdziwe:
Wymiana
fluorowca
we
fluorowcoalkanie
na
grupę
hydroksylową
przebiega
najłatwiej
w
przypadku:
A. halogenku I rzędowego
B. halogenku II rzędowego
C. halogenku III rzędowego
D. rzędowość halogenku nie ma znaczenia
Odp.: C
19.
Reakcja związku organicznego, np.: gliceryny,
glukozy,
z
roztworem
siarczanu(VI)
miedzi(II)
i zasady sodowej, na zimno służy do wykrywania:
a) właściwości redukujących,
b) pierścienia aromatycznego,
c) grupy hydroksylowej,
d)
więcej
niż
jednej
grupy
hydroksylowej.
Odp.: d)
20.
W wyniku hydrolizy w środowisku zasadowym
monochloropochodna alkanu o pięciu atomach węgla tworzy
III-rzędowy alkohol. Posługując się wzorami półstrukturalnymi
(grupowymi) związków organicznych, napisz równanie reakcji
otrzymywania
tego
alkoholu
podaną
metodą.
Odp.:
21.
Podaj wzory półstrukturalne związków, jakie mogą
powstać w wyniku działania stężonego roztworu kwasu
siarkowego(VI)
na
mieszaninę
etanolu
i
metanolu.
Odp.: CH
2
=CH
2
, CH
3
-O-CH
3
, CH
3
-O-CH
2
-CH
3
,
CH
3
-CH
2
-O-CH
2
-CH
3
,
22.
Jakie alkohole można otrzymać z następujących
chlorowcopochodnych:
a) 2-bromo-2-metylobutanu,
b) l-chloro-3-metylobutanu?
Napisz równania odpowiednich przemian chemicznych.
Odp.:
a)
b)
23.
Wyjaśnij, dlaczego metanol i etanol są dobrze
rozpuszczalne w wodzie, podczas węglowodory o podobnej
liczbie atomów węgla w cząsteczce rozpuszczają się w wodzie
bardzo
słabo.
Alkohole i fenole – zakres podstawowy
- 5 -
Odp.: Metanol i etanol to związki o wzorze R-OH, a więc mają
budowę podobną do wody ( H-OH ) dzięki czemu rozpuszczają
się w niej w przeciwieństwie do węglowodorów. Związki
o
budowie
polarnej
np.
alkohole
rozpuszczają
się
w rozpuszczalnikach polarnych np. woda.
24.
Zidentyfikuj
związki
A
i
B
mając
dane:
a) zbudowane są z węgla, wodoru i tlenu
b) masa cząsteczkowa związku A= 32u, masa
cząsteczkowa związku B = 46u.
c) obydwa reagują z chlorowodorem, a mieszanina
otrzymanych substancji, w wyniku reakcji z sodem,
daje trzy węglowodory. Napisz równania zachodzących reakcji.
Odp.: A – metanol
B – etanol
25.
Związek A o wzorze C
3
H
6
O podczas uwodornienia
przyłącza jedną cząsteczkę wodoru i powstaje substancja B.
Związki A i B reagują z sodem, przy czym wydziela się wodór.
Jedna cząsteczka związku B reaguje z jedną cząsteczką
bromowodoru, zaś jedna cząsteczka związku A reaguje
z dwiema cząsteczkami bromowodoru. W obydwu przypadkach
wydziela się jedna cząsteczka wody. Podać wzory i nazwy
związków A i B oraz równania omawianych reakcji.
Odp.: A - CH
2
=CH-CH
2
OH
B - CH
3
-CH
2
-CH
2
OH
26.
Porównaj temperatury wrzenia n-alkanów i n-alkoholi,
zawierających w cząsteczce od 1 do 5 atomów węgla. Z czego
wynikają różnice między temperaturami wrzenia tych
związków?
Odp.: Temperatury wrzenia alkoholi są wyższe, ponieważ
pomiędzy
cząsteczkami
alkoholi
występują
wiązania
wodorowe.
27.
Przepuszczając pary alkoholu etylowego nad tlenkiem
glinu w temp. 420-500 K, otrzymujemy gaz, który
przepuszczamy przez wodę bromową. Następnie produkt
bromowania poddajemy hydrolizie w wodnym roztworze
węglanu sodu. i otrzymujemy słodką toksyczną ciecz, dobrze
rozpuszczalną w wodzie. Określ, jaką substancję otrzymano
w czasie omawianych procesów chemicznych i napisz równania
wszystkich zachodzących przemian wzorami półstrukturalnymi.
Odp.: Otrzymano glikol etylenowy.
CH
3
-CH
2
OH
2
3
Al O
.
temp
→
CH
2
=CH
2
+
H
2
O
CH
2
=CH
2
+
Cl
2
→
CH
2
Cl-CH
2
Cl
CH
2
Cl-CH
2
Cl + KOH
→
O
H
2
CH
2
OH-CH
2
OH + KCl
28.
Jak
można
doświadczalnie
odróżnić:
a) roztwór alkoholu monohydroksylowego w benzenie
od
roztworu
fenolu
w
benzenie?
b)
wodne
roztwory
etanolu
i
fenolu,
c)
fenolan
potasu
i
etanolan
potasu,
d)
etanol
i
etano-l,2-diol,
e)
prop-2-en-l-ol
i
propan-1-ol,
f)
n-propanol
i
propano-1,2-diol,
g)
propan-2-ol
i
propan-1-ol.
Wybierz konieczne odczynniki, podaj schematy doświadczeń,
spodziewane obserwacje, wnioski, oraz zapisz równania
ewentualnych
reakcji
wzorami
półstrukturalnymi.
Odp.: (tekst poniżej jest informacją naprowadzającą na
odpowiedź,
nie
jest
odpowiedzią)
a) np.: dodając roztworu FeCl
3
– roztwór zawierający
fenol
zabarwi
się
na
fioletowo,
b) np.: dodając roztworu FeCl
3
– roztwór zawierający
fenol zabarwi się na fioletowo, lub za pomocą mieszaniny
nitrującej – roztwór zawierający fenol zabarwi się na żółto.
c) dodajemy mocnego kwasu np.: HCl lub H
2
SO
4
–
fenol wytrąci się z roztworu w postaci osadu. Jeżeli fenolu jest
zbyt mało aby się wytrącił, postępujemy jak w punkcie b).
d) dodajemy do obu roztworów świeżo strąconego
Cu(OH)
2
– w roztworze zawierającym propano-1,2-diol osad
Cu(OH)
2
rozpuszcza się, a roztwór zabarwia się na granatowo.
e) dodajemy wodę bromową do obu roztworów,
roztwór zawierający prop-2-en-l-ol odbarwi wodę bromową.
f) dodajemy do obu roztworów świeżo strąconego
Cu(OH)
2
– w roztworze zawierającym propano-1,2-diol osad
Cu(OH)
2
rozpuszcza się, a roztwór zabarwia się na granatowo.
g)
próba
Lucasa.
Dodajemy
roztwór
ZnCl
2
w stężonym HCl i wstrząsamy. W naczyniu zawierającym
propan-2-ol zmętnienie pojawi się po kilku minutach, w drugim
naczyniu nie pojawi się zmętnienie.
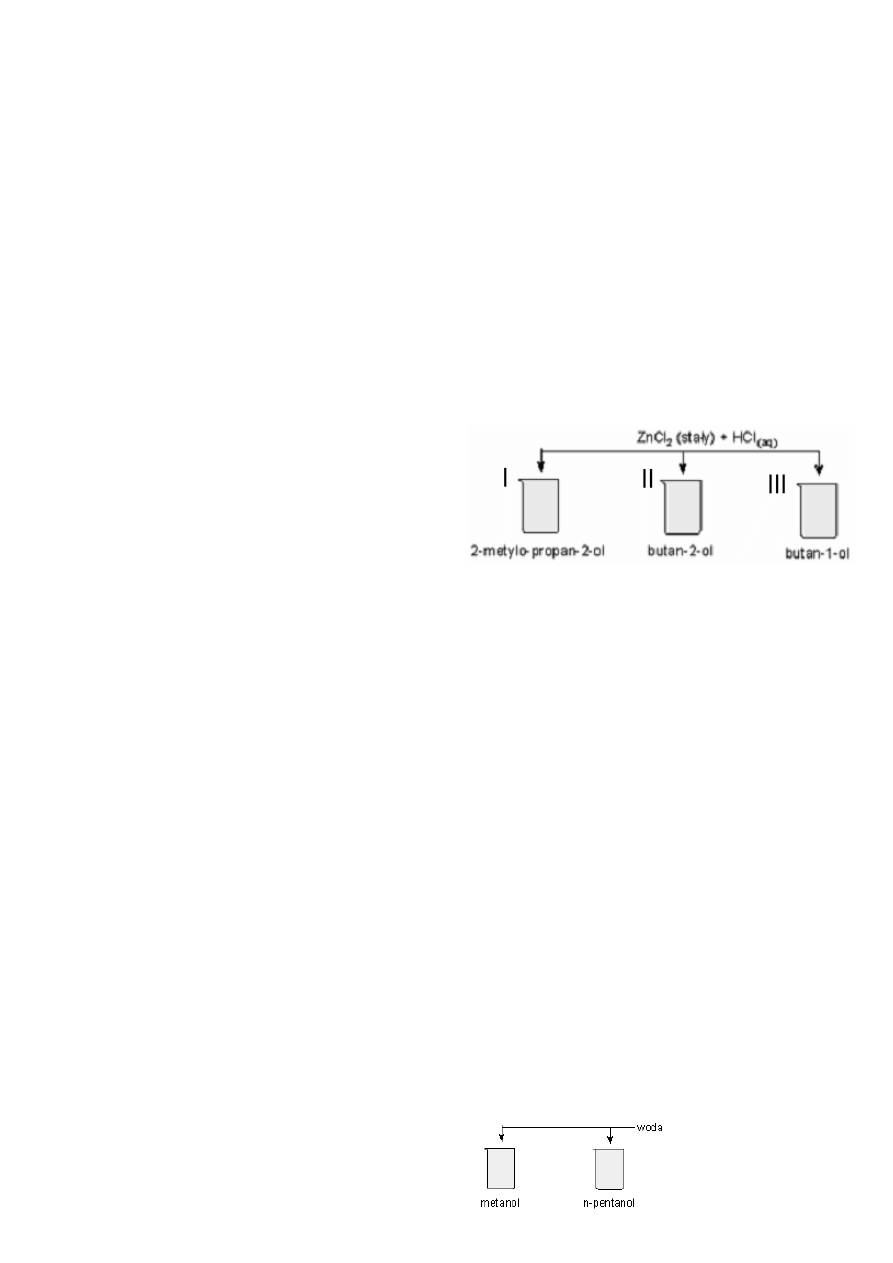
29.
Zaproponuj doświadczenie pozwalające na odróżnienie
2-metylopropan-2-olu, butan-2-olu i butan-1-olu. Podaj
schemat doświadczenia, obserwacje, wnioski, oraz zapisz
równania zachodzących reakcji wzorami półstrukturalnymi.
Odp.: (tekst poniżej jest informacją naprowadzającą na
odpowiedź,
nie
jest
odpowiedzią)
Do wszystkich probówek dodajemy stałego ZnCl
2
w stężonym
kwasie
solnym
(odczynnik
Lucasa).
W
zlewce
z alkoholem III rzędowym (nr III) zmętnienie pojawi się
natychmiast, w zlewce z alkoholem II rzędowym (nr II) po
kilku minutach, natomiast w zlewce z alkoholem I rzędowym
(nr III) wcale się nie pojawi.
30.
Alkohole można zapisać wzorem ogólnym R-OH
a wodorotlenki Me(OH)
n
. Wyjaśnij dlaczego wodne roztwory
wodorotlenków przewodzą prąd elektryczny, a wodne roztwory
alkoholi nie?
Odp.: wodorotlenki po rozpuszczeniu w wodzie ulegają
dysocjacji elektrolitycznej. Dzięki temu w roztworach
wodorotlenków znajdują się jony, dzięki którym przewodzą
prąd elektryczny.
31.
Podczas
mieszania
etanolu
z
wodą
możemy
zaobserwować zjawisko zwane kontrakcją. Wyjaśnij, na czym
ono
polega
i
co
jest
jego
przyczyną?
Odp.: Kontrakcja polega na tym, że suma objętości roztworów
przed zmieszaniem jest większa niż objętość roztworu
po zmieszaniu. W przypadku mieszaniny woda-alkohol
odpowiedzialne są za to wiązania wodorowe.
32.
Próba Lucasa polega na wytrząsaniu badanego
alkoholu z roztworem stałego ZnCl
2
w stężonym HCl,
opisz,
co
można
określić
na
jej
podstawie.
Odp.: odpowiedź znajduje się w podręczniku.
33.
Jak można odróżnić metanol od n-pentanolu, wykorzy-
stując ich właściwości:
a) fizyczne,
b) chemiczne.
Podaj schematy doświadczeń, obserwacje i wnioski.
Odp.: (tekst poniżej jest informacją naprowadzającą na
odpowiedź, nie jest
odpowiedzią)
a) obserwacje: w jednej
probówce badany roztwór

Alkohole i fenole – zakres podstawowy
- 6 -
rozpuścił się, się, a n-pentanol nie.
b) do obu roztworów dodajemy sód. W probówce z metanolem
reakcja zajdzie szybciej.
34.
Opisz, za pomocą jakiej substancji można wykryć
fenol i jego pochodne w roztworach. Co zaobserwujemy, jeżeli
w roztworze znajduje się fenol lub jego pochodne?
Odp.: fenol i jego pochodne można wykryć w reakcji
z roztworem chlorku żelaza(III). Zaobserwujemy zmianę barwy
roztworu na fioletową.
35.
Zaproponuj doświadczenie pozwalające na otrzymanie
alkoholu
etylowego
z
chloroetanu.
Podaj
schemat
doświadczenia, obserwacje, oraz zapisz równania zachodzących
reakcji wzorami półstrukturalnymi.
36.
Zaproponuj doświadczenie pozwalające na otrzymanie
etylenu z alkoholu etylowego. Otrzymany etylen należy zebrać
do probówki. Podaj schemat doświadczenia, obserwacje, oraz
zapisz
równania
zachodzących
reakcji
wzorami
półstrukturalnymi.
37.
Zaproponuj doświadczenie pozwalające na otrzymanie
wodoru mając do dyspozycji glicerynę i metal alkaliczny.
Otrzymany wodór należy zebrać do probówki. Podaj schemat
doświadczenia, obserwacje, oraz zapisz równania zachodzących
reakcji wzorami półstrukturalnymi.
38.
Zaproponuj doświadczenie pozwalające odróżnić
alkohol I-rzędowy od III-rzędowego za pomocą blaszki
miedzianej. Podaj opis doświadczenia, obserwacje, oraz zapisz
równania zachodzących reakcji wzorami półstrukturalnymi.
39.
Zapisz równanie fermentacji alkoholowej dla glukozy
oraz oblicz, ile kilogramów tego cukru uległo fermentacji
wiedząc, że otrzymano 11,5 kg etanolu, a wydajność procesu
wynosiła 84%.
Odp.: 26,8 kg
40.
Obliczyć, ile gramów alkoholu można otrzymać
z 0,5 mola jodku etylu, jeżeli wydajność reakcji z NaOH
wynosi 80%.
Odp.: 18,4g
41.
Obliczyć, ile m
3
tlenku węgla(II) i ile m
3
wodoru
potrzeba
do
syntezy
0,8t
alkoholu
metylowego.
Odp.: 560m
3
CO i 1120m
3
H
2
42.
Oblicz, ilość metrów sześciennych etylenu (warunki
normalne), jakiej trzeba użyć, aby otrzymać 250 kg mieszaniny
składającej się w 95% z etanolu i 5% z wody.
Odp.: 115,7m
3
Informacja do zadań dotyczących ustalania wzorów
związków:
zadania te należy liczyć z dokładnością do 3
÷4 cyfr
znaczących po przecinku
43.
Podaj
wzór
elementarny
monohydroksylowego
alkoholu zawierającego wagowo 64,9% węgla i 13,5% wodoru.
Odp.: C
4
H
9
OH
44.
Oblicz
wzór
elementarny
alkoholu
mono-
hydroksylowego, wiedząc, że do całkowitego spalenia
0,1 mola tego związku zużyto 16,8 dm
3
tlenu (odmierzonego
w warunkach normalnych), otrzymując 10,8 g wody.
Odp.: C
5
H
11
OH
45.
W reakcji 3,7 g alkoholu monohydroksylowego
z sodem otrzymano 560 cm
3
wodoru (odmierzonego
w warunkach normalnych). Oblicz wzór sumaryczny alkoholu.
Odp.: C
4
H
9
OH
46.
W reakcji 3,73 g pewnego alkoholu nienasyconego
jednowodorotlenowego z sodem otrzymano 720 cm
3
wodoru
(warunki normalne). Oblicz wzór elementarny alkoholu.
Odp.: C
3
H
5
OH
47.
W pewnym alkoholu stosunek mas węgla, wodoru
i tlenu wynosi 9:2:4. Oblicz wzór sumaryczny najprostszego
alkoholu
spełniającego
ten
warunek.
Odp.: C
3
H
7
OH
48.
Spalono 4,5 g alkoholu polihydroksylowego otrzymu-
jąc 4,48 dm
3
CO
2
(warunki normalne) i 4,5 g wody.
Ustal wzór rzeczywisty tego alkoholu, wiedząc, że jego masa
molowa
wynosi
90
g/mol.
Odp.: C
4
H
8
(OH)
2
49.
Oblicz wydajność reakcji etanolu z bromowodorem,
wiedząc, że w wyniku reakcji 5 g etanolu otrzymano 9g
bromoetanu.
Odp.: 76%
50.
Do propan-1-olu wrzucono 3,9 g metalicznego potasu.
Oblicz stężenie molowe KOH powstałego w wyniku hydrolizy
otrzymanego alkoholanu, jeżeli objętość roztworu wynosiła 200
cm
3
.
Odp.: 0,5mol/dm
3
51.
3,01•10
22
cząsteczek tlenku węgla (II) przereagowało
z 6,02 • 10
22
cząsteczkami wodoru. Obliczyć, ile powstało:
a) moli,
b) gramów,
c) pojedynczych cząsteczek metanolu.
Odp.: a) 0,05 mola b) 1,6 g c) 3,01 • 10
22
cząsteczek
52.
Oblicz wzór rzeczywisty związku organicznego
wiedząc, że próbka o masie 0,038 g, w wyniku spalenia dała
0,073 g dwutlenku węgla i 0,045 g wody. Wyznaczona masa
cząsteczkowa
tego
związku
wynosi
46u.
Odp.: C
2
H
6
O (C
2
H
5
OH lub CH
3
-O-CH
3
)
53.
Podaj
wzór
elementarny
alkoholu
jednowodorotlenowego wiedząc, że w wyniku reakcji 2,78 g
tego alkoholu z metalicznym potasem, otrzymano 420 cm
3
wodoru
(warunki
normalne).
Odp.: C
4
H
9
OH
54.
Sporządź wykres ilustrujący procentową zależność
zawartości tlenu od liczby atomów węgla w szeregu
homologicznym alkoholi jednowodorotlenowych.
55.
Oblicz ile dm
3
etylenu (warunki normalne) można
otrzymać przez dehydratację 2,3 g etanolu w podwyższonej
temperaturze i w obecności tlenku glinu jako katalizatora?
Odp.: 1,12 dm
3
56.
W wyniku reakcji 112 dm
3
tlenku węgla(II) z wodorem
otrzymano metanol, który następnie rozpuszczono w 0,4 dm
3
wody destylowanej. Obliczyć stężenie procentowe otrzymanego
roztworu.
Odp.: 28,57%
57.
Oblicz wydajność procesu utleniania metanolu
wiedząc, że z 3cm
3
tej substancji po wrzuceniu rozżarzonej
siatki miedzianej wydzieliło się 1,12 dm
3
gazowego
formaldehydu.
Gęstość
metanolu
wynosi
0,79g/cm
3
.
Odp.: 67,5%
58.
Obliczyć, ile dm
3
dwutlenku węgla powstanie
w procesie całkowitego spalania 23 g alkoholu etylowego.
Odp.: 22,4dm
3

Alkohole i fenole – zakres podstawowy
- 7 -
59.
W wyniku reakcji gliceryny z sodem wydzieliło się
5,6 dm
3
wodoru
(warunki
normalne).
Oblicz, ile a) moli b) gram gliceryny wzięto do reakcji.
Odp.: a) 0,167mola
b) 15,33g
60.
Oblicz, ile dm
3
wodoru (warunki normalne) wydzieli
się
w
reakcji
3
moli
gliceryny
z
potasem.
Odp.: 101 dm
3
61.
Ile dm
3
wodoru (warunki normalne) wydzieli się
w
reakcji
alkoholu
etylowego
z
3g
magnezu.
Odp.: a) 2,8 dm
3
62.
Do 100 g metanolu wrzucono 2,3 g sodu. Obliczyć, ja-
ka będzie zawartość procentowa masowa alkoholu w mieszani-
nie powstałej w wyniku reakcji. Pomiń masę wydzielonego
wodoru.
Odp.: 94,72%
63.
Do roztworu zawierającego 46 g etanolu wrzucono
4,6 g sodu. Oblicz, ile moli etanolu przypada na jeden mol
etanolanu
sodu
w
roztworze
po
reakcji.
Odp.: 4 mole na 1 mol
64.
Do naczynia z propanolem wrzucono 1,95 g
metalicznego potasu. Oblicz: a) ile dm
3
wodoru wydzieliło się
w tej reakcji? b) ile
gramów
alkoholanu
otrzymano?
Odp.: a) 0,56 dm
3
b) 4,9g
Wyszukiwarka
Podobne podstrony:
Alkohole i fenole 3 id 58102 Nieznany
alkohole i fenole 2 id 58101 Nieznany (2)
Alkohole i fenole 3 id 58102 Nieznany
Alkohole 13 id 58087 Nieznany (2)
alkohol i kierowca id 58052 Nieznany
Alkohole monohydroksylowe id 58 Nieznany (2)
Alkohole 09 id 58086 Nieznany (2)
Alkohole polihydroksylowe id 58 Nieznany (2)
Alkohole i etery 3 id 58099 Nieznany
Alkohole i fenole(12) id 58122 Nieznany
Alkohole, fenole i etery id 580 Nieznany (2)
Alkohole id 58069 Nieznany (2)
Fermentacja alkoholowa id 16925 Nieznany
ALKOHOLE WIELOWODOROTLENOWE id Nieznany (2)
Fermentacja alkoholowa 3 id 169 Nieznany
problemy alkoholowe02 id 538275 Nieznany
problemy alkoholowe01 id 538274 Nieznany
ALKOHOLIZM(1) id 58168 Nieznany
ALKOHOL id 58035 Nieznany
więcej podobnych podstron