
Alkohole, fenole i ich analogi siarkowe
R-
OH
,
Ar-
OH
R-
SH
,
Ar-
SH
Nomenklatura alkoholi
przyrostek
-ol
CH
3
-CH-CH
3
OH
propan-2-
ol
CH
3
-CH-CH
2
OH
CH
3
2-metylopropan
ol
(CH
3
)
3
OH
(2-metylopropan-2-
ol)
CH
3
OH
metan
ol
CH
3
CH
2
OH
etan
ol
OH
cykloheksan
ol
alkohol tert-butylowy
grupa hydroksylowa
-OH
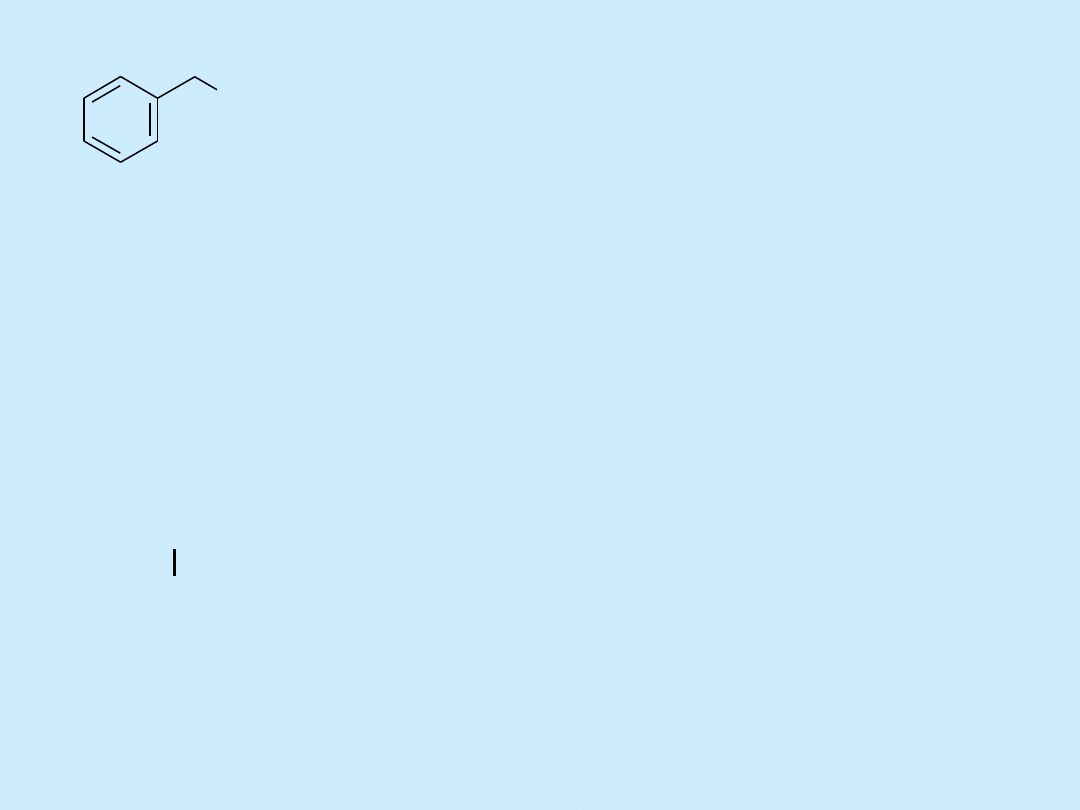
OH
alkohol benzylowy (fenylo
metanol
)
CH
2
=CHCH
2
OH
alkohol allilowy (2-propen-1-
ol
)
HO
CH
2
CH
2
OH
glikol etylenowy (etan
o-1,2-diol)
OH
CH
2
-CH-CH
2
OH
OH
gliceryna (glicerol, propan
o-1,2,3-triol
)
przyrostek
-tiol
CH
3
CH
2
SH
etano
tiol
SH
cykloheksano
tiol
grupa merkaptanowa
-SH
SH
HOOC
kwas m-
merkapto
benzoesowy
R
CH
2
OH
R
CHOH
R
R
C
R
R
OH
Rzędowość alkoholi
pierwszorzędowy 1
o
drugorzędowy 2
o
trzeciorzędowy 3
o
reaktywność alkoholi
zależy od ich rzędowości

Nomenklatura fenoli
OH
OH
O
2
N
OH
Br
OH
COOH
fenol
m-nitrofenol
p-bromofenol
kwas o-hydrosybenzoesowy
kwas salicylowy
SH
tiofenol
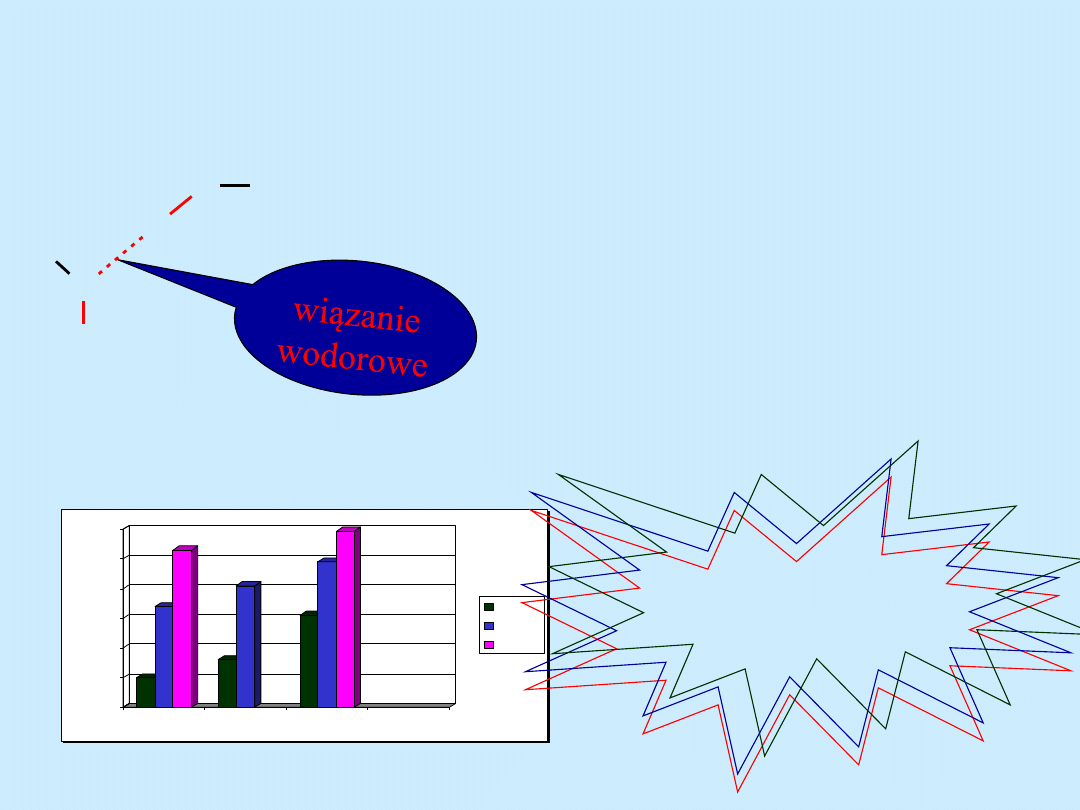
wiązanie pomiędzy atomem tlenu i wodoru jest silnie polaryzowane.
Atom wodoru może połączyć się z dwoma atomami
tlenu.Wiązanie to jest wiązaniem słabym (20 – 40 k/mol).
d
-
d
+
O
R
H
O
R
H
d
-
d
+
Wiązania wodorowe
Wiązania wodorowe mogą łączyć
bardzo dużą ilość cząsteczek tworząc
asocjaty
-200
-150
-100
-50
0
50
100
R = Me
R = Et
R = Pr
R-H
R-Cl
R-OH
wzrost
temperatury wrzenia
Własności alkoholi
kwasowość i zasadowość
Alkohole podobnie jak woda są zarówno
słabymi kwasami jak i słabymi zasadami
R-O-H
:
:
+ HX
R-O-H
:
H
+
X-
jon oksoniowy
R-O-H
:
:
+ H
2
O
R-O
:
-
:
:
+ H
3
O+
jon alkoksylowy
CH
3
OH
Na
CH
3
O
-
Na
+
+ 1/2H
2
NaH
CH
3
O
-
Na
+
+ H
2
NaNH
2
CH
3
O
-
Na
+
+ NH
3
O
:
:
-
O
: :
-
O
: :
-
O
: :
-
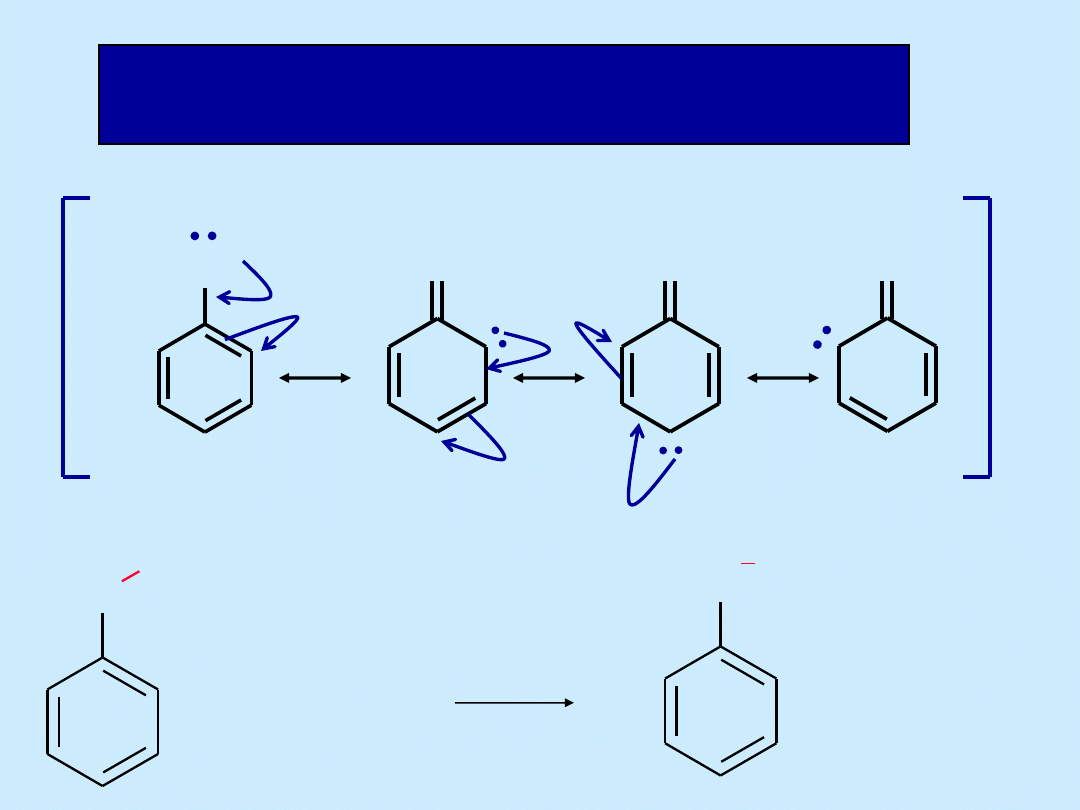
Stabilizacja anionu fenolanowego przez rezonans
O
H
NaOH
O
Na
+
O
H
2
+
+
K
a
=
[A
-
] [H
3
O]
+
[HA]
Stała kwasowości
pK
a
= -log K
a
tert-Butanol
18,0
Etanol
16,0
Woda
15,7
Metanol
15,5
Trifluorometanol
12,4
K
a
Fenol
10,0
p-Nitrofenol
7,2
Kwas solny
-7,0
Wz
rost
k
w
asow
ości
Reakcje
alkoholi
ROH
halogenki alkilowe
alkeny
aldehydy
ketony
kwasy karboksylowe
estry
etery
Dehydratacja alkoholi
Reakcja eliminacji może przebiegać według mechanizmu E1 lub E2
(CH
3
)
3
C-OH + H
+
+ HOH
(CH
3
)
3
C-OH
2
+
(CH
3
)
2
C
+
CH
2
H
(CH
3
)
2
C=CH
2
tert-butanol
2-metylopropen

Dehydratacja alkoholi
Reakcja rozpoczyna się od protonowania grupy hydroksylowej
E1
odszczepienie cząsteczki wody, utworzenie karbokationu
odejście protonu od atomu węgla sąsiadującego z atomem,
przy którym zlokalizowany jest ładunek dodatni
E2
równoczesne oderwanie protonu
i odszczepienie cząsteczki wody
Łatwość dehydratacji alkoholi jest taka
jak stabilność karbokationów

Łatwość dehydratacji alkoholi jest taka jak stabilność
karbokationów
3
o
ulegają łatwo dehydratacji
2
o
reakcja musi być prowadzona
przy użyciu stężonych
kwasów i w wysokich temperaturach (75% H
2
SO
4
, 100
0
C)
1
o
95% H
2
SO
4,
150
o
C
Reakcje alkoholi z halogenowodorami
W zależności od struktury alkoholu reakcja
biegnie według mechanizmu S
N
1 lub S
N
2
3
o
łatwo z HCl, HBr
1
o
i
2
o
w reakcjach z SOCl
2
,
PBr
3
R-OH
SOCl
2
R-Cl + SO
2
+ HCl
PBr
3
R-Br + HOPBr
3
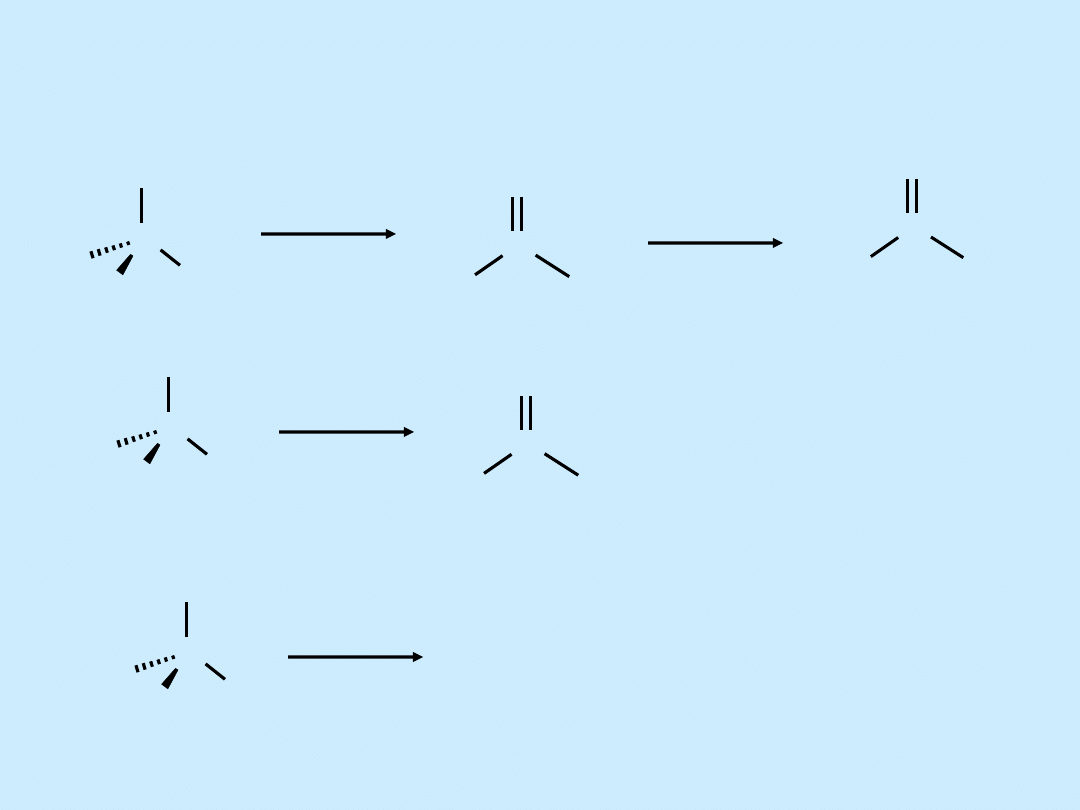
Reakcje utleniania alkoholi
C
R
R
OH
R
[
O
]
Reakcja nie zachodzi
C
H
R
OH
R
[
O
]
C
R
R
O
keton
C
H
H
OH
R
[
O
]
[
O
]
C
OH
R
O
kwas karboksylowy
C
H
R
O
aldehyd
Czynniki utleniające
KMnO
4
K
2
Cr
2
O
7
CrO
3
N H
+
CrO
3
Cl
-
(PCC)

Reakcje utleniania tioli
2 R-SH
R-S-S-R
Tiol Disulfid
utlenianie
redukcja
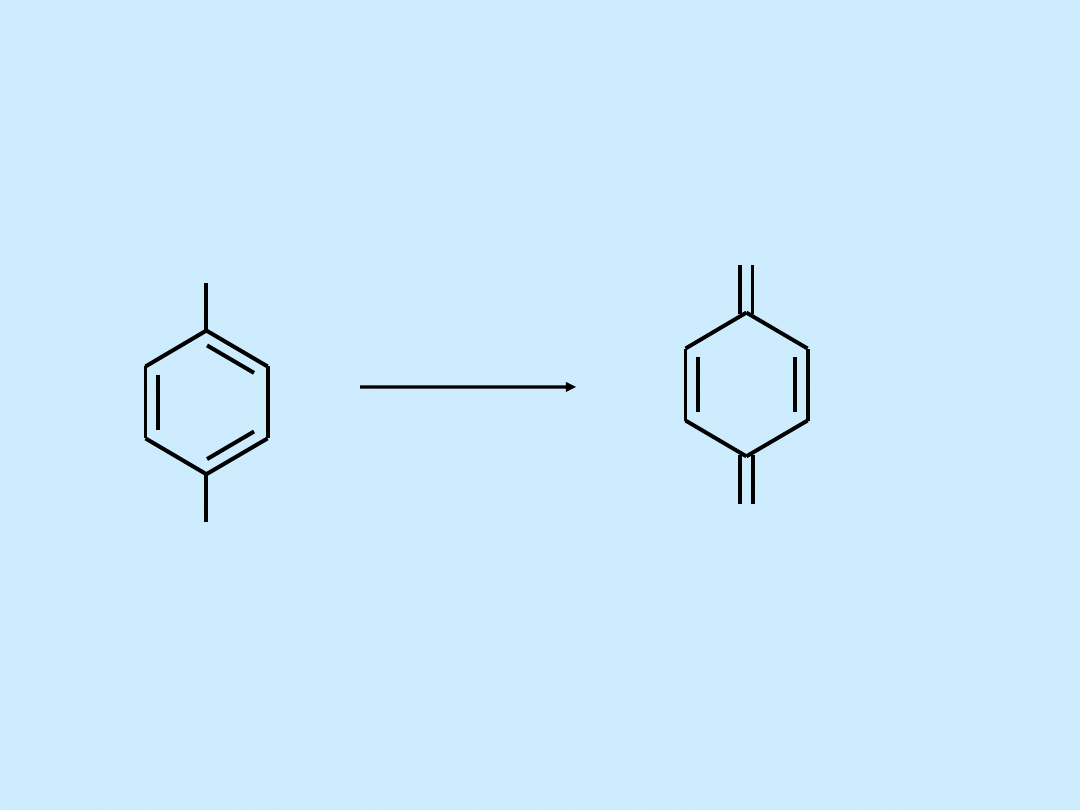
Reakcje utleniania fenoli
OH
OH
O
O
[O]

Wyszukiwarka
Podobne podstrony:
Fermentacja alkoholowa id 16925 Nieznany
Fermentacja alkoholowa 3 id 169 Nieznany
problemy alkoholowe02 id 538275 Nieznany
problemy alkoholowe01 id 538274 Nieznany
ALKOHOLIZM(1) id 58168 Nieznany
ALKOHOL id 58035 Nieznany
Alkohole i fenole 3 id 58102 Nieznany
Alkohole 13 id 58087 Nieznany (2)
alkohole i fenole 2 id 58101 Nieznany (2)
alkohol i kierowca id 58052 Nieznany
Alkohole monohydroksylowe id 58 Nieznany (2)
alkohole i fenole 2 id 58114 Nieznany (2)
Alkohole i fenole(12) id 58122 Nieznany
Alkohole 09 id 58086 Nieznany (2)
Alkohole polihydroksylowe id 58 Nieznany (2)
Alkohole i etery 3 id 58099 Nieznany
Alkohole, fenole i etery id 580 Nieznany (2)
Alkohole i fenole 3 id 58102 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
więcej podobnych podstron