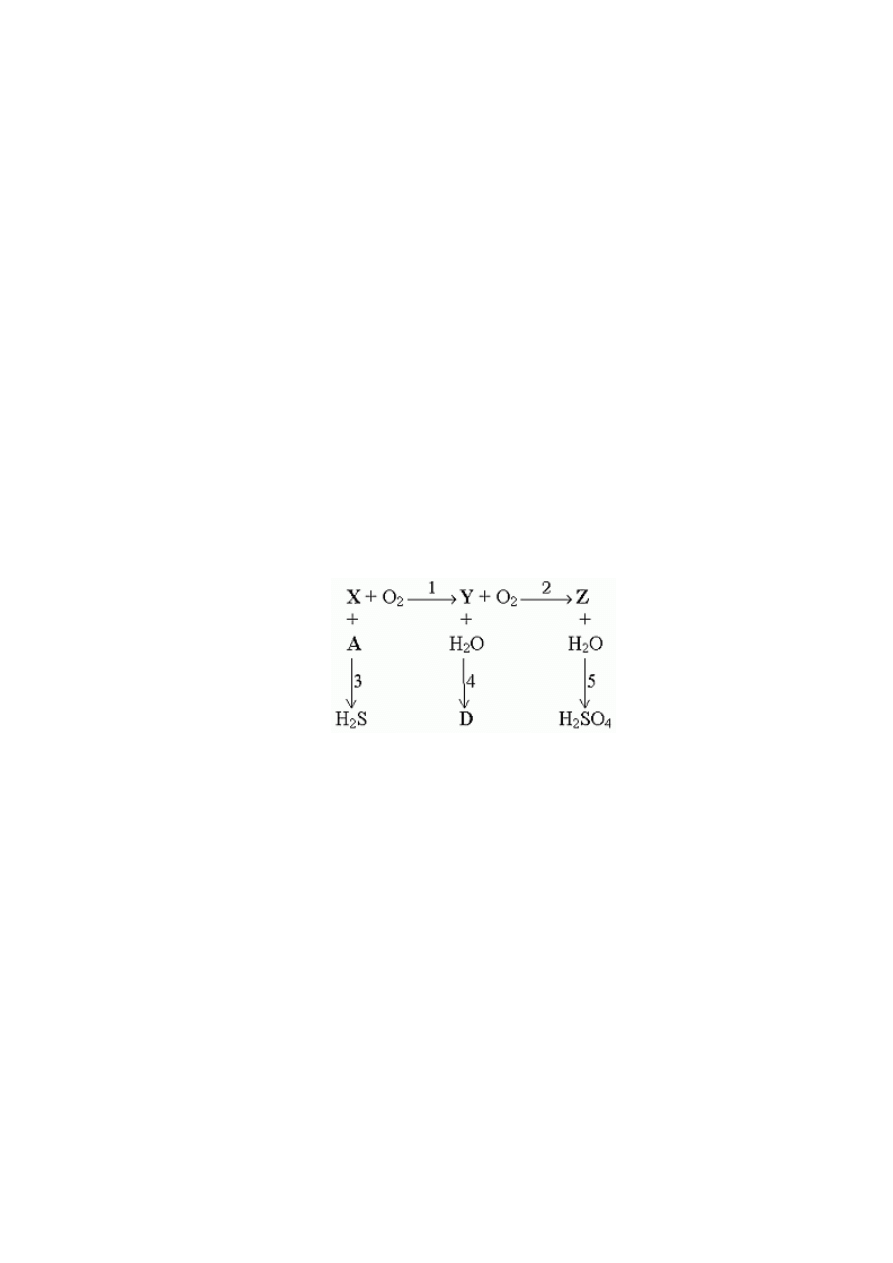
..………………………………….
15 listopada 2004, godzina 13.30
imię i nazwisko
KONKURS CHEMICZNY DLA GIMNAZJUM – ETAP I
Czas pracy: 60 minut
1. (0-1) O masie jądra atomowego decydują:
A. protony i elektrony,
B. protony i neutrony,
C. neutrony i elektrony,
D. protony, neutrony i elektrony.
2. (0-1) Które ze zdań opisujących cząsteczkę wody jest prawdziwe?
A. Cząsteczka wody ma budowę liniową.
B. Kąt miedzy wiązaniami H - O - H wynosi 120°.
C. Kąt miedzy wiązaniami H - O - H wynosi 105°.
D. Kąt miedzy wiązaniami H - O - H wynosi 90°.
3. (0-10) Rozwiąż chemograf, tzn. odgadnij, co kryje się pod symbolami A, D, X, Y, Z.
Zapisz i uzgodnij odpowiednie równania reakcji (1-5).
1………………………………………………………………………………………..
2………………………………………………………………………………………..
3………………………………………………………………………………………..
4………………………………………………………………………………………..
5………………………………………………………………………………………..
A =…………………..
D =…………………..
X=………………………
Y =…………………..
Z =……………………
4. (0-1) Jedna cząsteczka kwasu siarkowego(VI) zawiera łącznie:
A. 9 atomów,
B. 7 atomów,
C. 6 atomów,
D. 5 atomów.
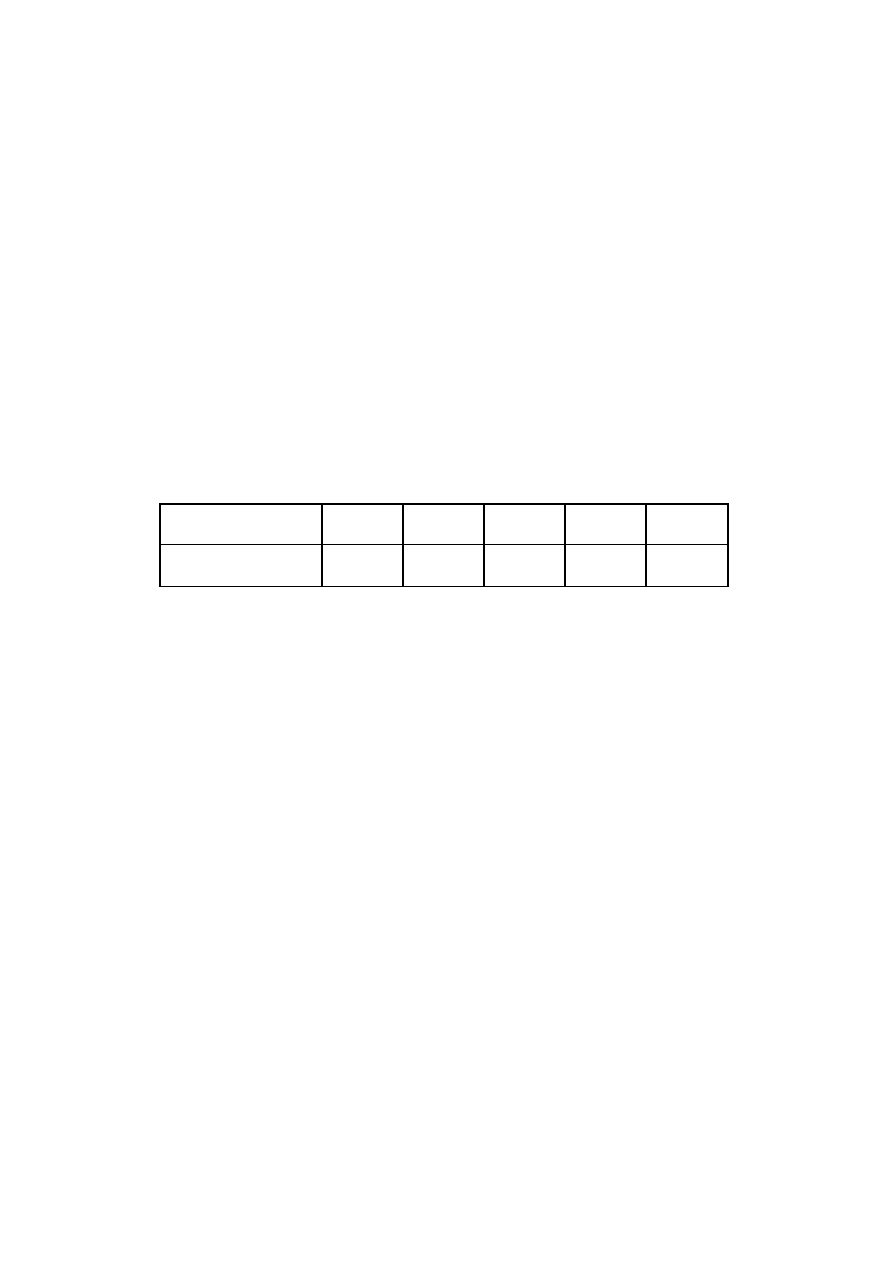
5. (0-1) Którą substancję należy rozpuścić w wodzie, aby otrzymany roztwór zawierał
dwa razy więcej kationów niż anionów:
A. węglan potasu,
B. siarczan(VI) magnezu,
C. chlorek wapnia,
D. azotan (V) sodu?
6. (0-1) Jeżeli na powietrzu pozostawimy Ca, CaO, Ca(OH)
2
,
to odpowiednim
przemianom chemicznym będą ulegać:
A. tylko wapń,
B. wapń i tlenek wapnia,
C. tlenek i wodorotlenek wapnia,
D. wszystkie te substancje.
7. (0-2) Zapisz dwa równania reakcji biegnących w zadaniu 6.
1…………………………………………………………………………………………
2…………………………………………………………………………………………
8. (0-2) Z 200 gramów nasyconego w temperaturze 40°C roztworu cukru odparowano
połowę wody, a następnie ochłodzono do 0°C. Ile gramów cukru wykrystalizowało?
temperatura [
°
C]
0
20
40
60
80
rozpuszczalność
[g/100g wody]
179
204
245
294
350
Obliczenia:
Odpowiedź: …………………………………………………………………………….
9. (0-1) Suma współczynników stechiometrycznych w równaniu reakcji kwasu
fosforowego(V) z chlorkiem wapnia wynosi:
A. 12,
B. 10,
C. 8,
D. 4.
10. (0-2) W wyniku reakcji chlorku sodu z azotanem(V) srebra wytrąciło się 143,5g
chlorku srebra. W reakcji wzięło udział:
A. 27g AgNO
3
,
B. 58,5g AgNO
3
,
C. 170g AgNO
3
,
D. 585g AgNO
3
.
11. (0-1) Substancja, która w reakcji z NaOH na pewno nie utworzy soli to:
A. CaO,
B. CO
2
,
C. HNO
3
,
D. Cu(NO
3
)
2
12. (0-1) Stosunek masowy magnezu do siarki w siarczku magnezu wynosi:
A. 1 : 1,
B. 3 : 4,
C. 4 : 3,
D. 1 : 2.
13. (0-1) Które spośród przedstawionych sformułowań dotyczących układu okresowego
jest fałszywe:
A. pierwiastki umieszczone w lewej dolnej części układu okresowego są
metalami,
B. każdy okres kończy się gazem szlachetnym,
C. numer grupy informuje o liczbie powłok elektronowych,
D. pierwiastki należące do tej samej grupy mają podobne właściwości chemiczne.
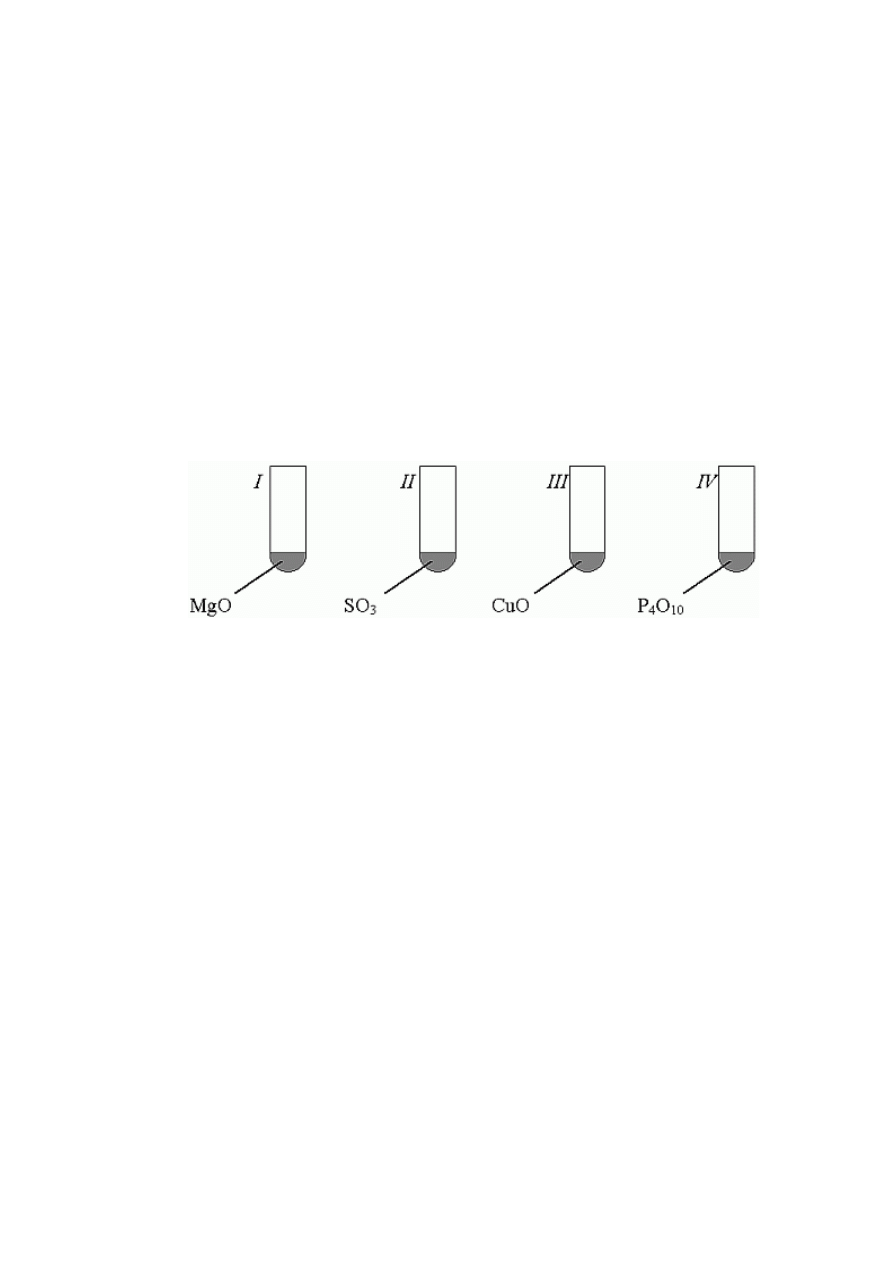
14. (0-1) Do probówek, w których znajdowały się tlenki:
dodano wody, a następnie oranżu metylowego. Zauważono, że roztwór zabarwił się na
czerwono w probówkach:
A. I i III,
B. tylko w II,
C. I i IV,
D. II i IV.
15. (0-2) Korzystając z tablicy rozpuszczalności podaj wzór i nazwę dowolnej trudno
rozpuszczalnej soli żelaza(II).
Wzór:…………………
Nazwa: ………………………………………………
.
16. (0-4) Zaproponuj dwie metody otrzymywania soli z poprzedniego zadania, mając do
dyspozycji wyłącznie roztwory innych soli. Napisz równania odpowiednich reakcji.
1. Substraty:………………………………………………………………………..
Równanie: ………………………………………………………………………
2. Substraty:………………………………………………………………………..
Równanie: ……………………………………………………………………....
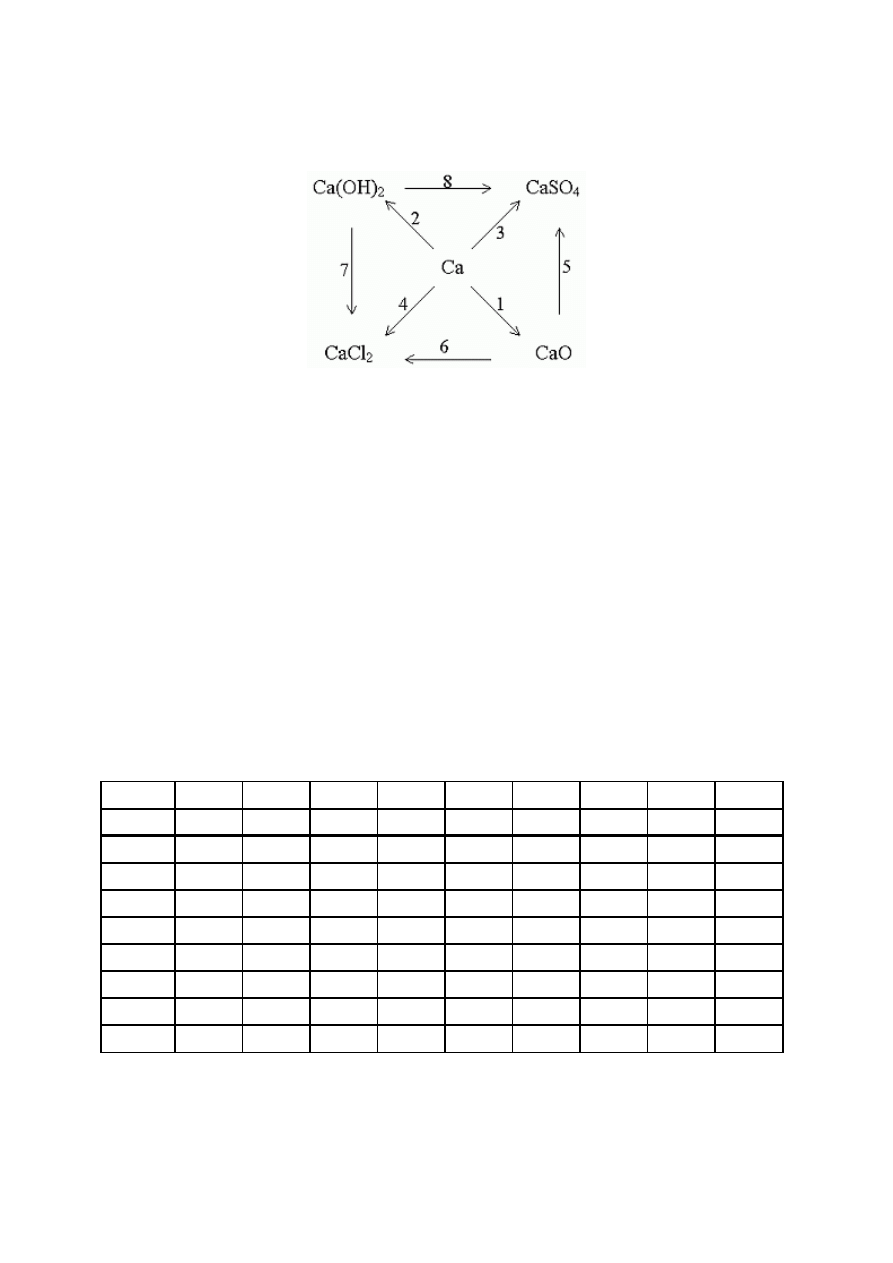
17. (0-8) Ułóż równania reakcji chemicznych, za pomocą których można dokonać
przemian przedstawionych poniższym chemografem.
1…………………………………………………………………………………..
2…………………………………………………………………………………..
3…………………………………………………………………………………..
4…………………………………………………………………………………..
5…………………………………………………………………………………..
6…………………………………………………………………………………..
7…………………………………………………………………………………..
8…………………………………………………………………………………..
Tablica rozpuszczalności („↓” oznacza związek trudno rozpuszczalny, „O” – dobrze
rozpuszczalny, „X” – substancja w roztworze wodnym nie istnieje)
Jon
OH
-
Cl
-
S
2-
SO
3
2-
SO
4
2-
NO
3
-
CO
3
2-
PO
4
3-
SiO
3
2-
K
+
O
O
O
O
O
O
O
O
O
Na
+
O
O
O
O
O
O
O
O
O
Ca
2+
O
O
X
↓
↓
O
↓
↓
↓
Mg
2+
O
O
X
↓
O
O
↓
↓
↓
Ba
2+
O
O
X
↓
↓
O
↓
↓
↓
Al
3+
↓
O
X
X
O
O
↓
↓
↓
Fe
2+
↓
O
↓
↓
O
O
↓
↓
↓
Fe
3+
↓
O
↓
X
O
O
X
↓
↓
Cu
2+
↓
O
↓
X
O
O
↓
↓
↓
Wyszukiwarka
Podobne podstrony:
2004 05 Sybase SQL Anywhere Studio 9 0 [Bazy Danych]
2004 05 Rozproszone fraktale [Bazy Danych]
test 2004 05 D
test 2004 05 A
test 2004 05 C
2004 05 kolokwium 1
SZCZEGOLOWY PODZIAL ROKU 2004 05, PRZYDATNE W SZKOLE, WF, AWF
test 2004 05 B
Jasełka 2004 - 05, jasełka - scenariusze
KOLOKWIA 2004-05, MEDYCYNA O, Patofizjologia
Onkogeneza, apoptoza, Onkogeneza i apoptoza, 17 maja 2004-05-17
2004 05 zadania(1)
FARMAKOLOGIA, test z psychotropow, Farmakologia 6 2004/05
KOLOKWIUM 2004, KOLOKWIUM 2004/ 05
Patomorfa Kolo 1 (2004-05)
autostrady artykul 2004 05 56
2004 05 05 „Filozofia i edukacja” – III Sympozjum Program
więcej podobnych podstron