2009-11-24
1
Chemia VI
Termochemia
Termochemia
Charakterystyka zmian energii
towarzyszących przemianom
chemicznym, w tym
także procesom przebiegającym w
złożonych
układach
makrocząsteczkowych
jest
przedmiotem
termodynamiki
,
działu
nauki
o
szczególnie logicznej konstrukcji.
Trzy
zwięzłe twierdzenia, trzy zasady termodynamiki
stanowią najbardziej zwarty obraz naszej wiedzy o energii,
a logiczne konsekwencje tych zasad
dotyczą każdego
zjawiska fizycznego i chemicznego.
2009-11-24
2
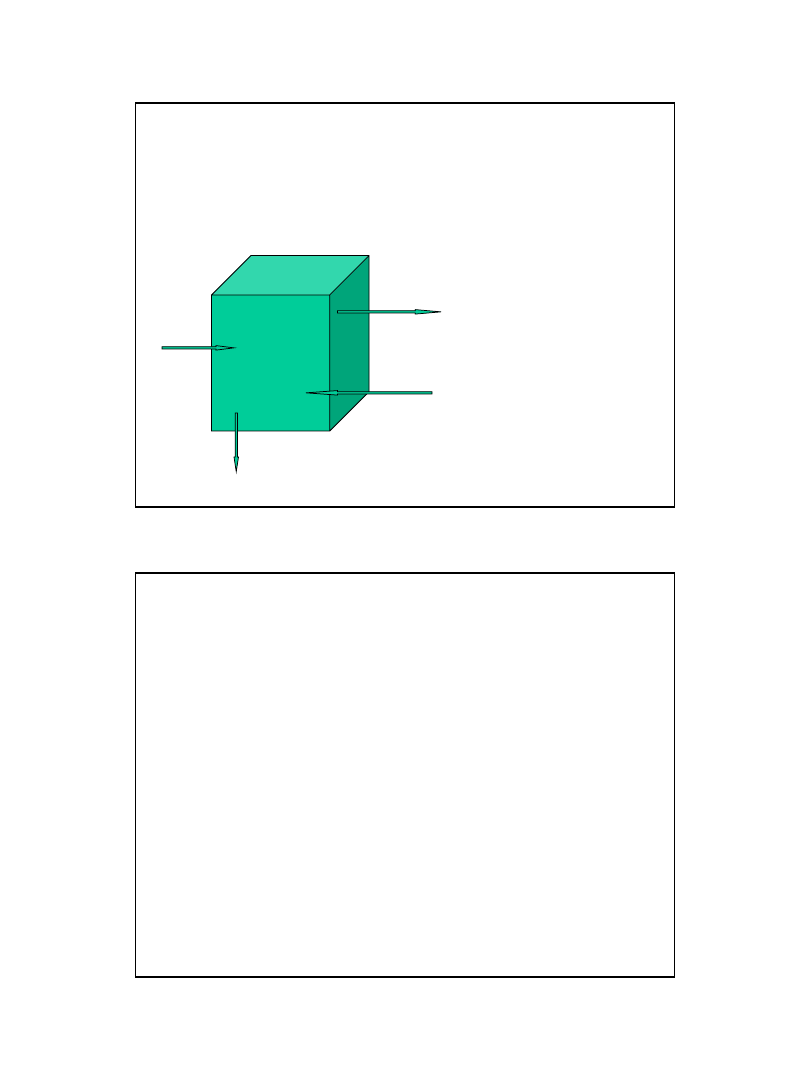
• Otoczenie
Energia
Układ
Probówka, w której zachodzi reakcja chemiczna, kolba z
reagentami, naczynie kuchenne - 1 mol gazowego SO
2
w
izolowanym naczyniu,
roztwór 0,4 molowego KNO
3
lub
pojedynczy kryształ-NaCl.
Układ
• nie wymieniający z otoczeniem materii jest
nazywany
układem zamkniętym
• wymieniający materię z otoczeniem -
układem otwartym
.
• nie wymieniający z otoczeniem ani materii,
ani energii (nie oddziałujący z otoczeniem)
nazywa się
układem izolowanym
2009-11-24
3
Zasady termodynamiki
• pierwsza zasada termodynamiki
- zmiana energii
wewnętrznej układu równa jest różnicy ciepła
dostarczonego do układu i pracy wykonanej przez
ten układ.
• druga zasada termodynamiki
- istnieje entropia
będąca funkcją stanu układu, stałą w odwracalnych
procesach adiabatycznych i rosnącą we wszystkich
innych.
• trzecia zasada termodynamiki
-
entropia układu o
ustalonych parametrach (np. o stałym ciśnieniu lub
objętości) i temperaturze zmierzającej do zera
bezwzględnego zmierza również do zera.
Proces adiabatyczny
• Proces adiabatyczny to proces, w którym
gaz nie wymienia ciepła z otoczeniem
• Proces taki zachodzi w układzie dobrze
izolowanym termicznie, albo gdy
przeprowadzony zostanie na tyle szybko, by
gaz nie zdążył wymienić ciepła z otoczeniem.
• Otrzymanie równania wiążącego ze sobą
parametry gazu w procesie adiabatycznym.
• pV =nRT
gdzie n-l. moli, R - st. Rydberga
• p
1
V
1
= p
2
V
2
2009-11-24
4
Pojęcia
• W celu precyzyjnego zrozumienia zasad
termodynamicznych niezbędne jest
zrozumienie i przyswojenie niektórych pojęć
z dziedziny termodynamiki chemicznej,
takich jak;
układ, energia cieplna, energia
chemiczna, energia wewnętrzna, ciepło
reakcji, entalpia, entropia.
Typ układu
• Układ nie wymieniający z otoczeniem
materii jest nazywany
układem
zamkniętym
, a układ wymieniający
materię z otoczeniem -
układem
otwartym
. Układ nie wymieniający z
otoczeniem ani materii, ani energii (nie
oddziałujący z otoczeniem) nazywa się
układem izolowanym
2009-11-24
5
Stan układu, praktycznie określa się przez
podanie makroskopowych wielkości
• temperatura
• ciśnienie
• objętość
• skład chemiczny,
• stężenia składników,
Wielkościami termodynamicznymi
służącymi do opisywania pod względem energetycznym
stanu układu są:
• energia wewnętrzna - U
• entalpia - H
• entropia - S
• entalpia swobodna – G
• molowa energia wewnetrzna - U
m
= U/n
• entalipa molowa - H
m
= H/n
• entropia molowa - S
m
= S/n
• molowa entalia swobodna - G
m
= G/n
2009-11-24
6
Energia wewnętrzna U
-
energia układu związana z wzajemnymi ruchami i
oddziaływaniami poszczególnych jego części:
cząsteczek, atomów i jonów. Składa się z energii
kinetycznej (U
kin
) cząsteczek, atomów i jonów,
energii potencjalnej (U
pot
) wzajemnego
oddziaływania cząsteczek oraz energii kinetycznej
(U
jadr
) jąder atomowych.
• U = U
kin
+ U
pot
+ U
jadr
Energia
• Energia cieplna
-
jest to część energii wewnętrznej
układu, której zródłem jest energia kinetyczna ruchu
cząsteczek.
• Energia chemiczna
-
część energii wewnetrznej
układu w postaci energii potencjalnej wiązań
wewnątrzcząsteczkowych i wzajemnych
oddziaływań cząsteczek.
Podczas przebiegu reakcji chemicznej w wyniku
tworzenia
wiązań część energii chemicznej
przekształca się w inne rodzaje energii, np. jako
energia elektryczna.
2009-11-24
7
Pierwsza zasada termodynamiki
• znana jest także pod nazwą zasady zachowania
energii.
Jeżeli przyjmiemy, że masa reagującego układu
praktycznie nie ulega zmianie w czasie zachodzących
w nim procesów fizycznych i chemicznych to pierwsza
zasada termodynamiki mówi nam, że;
zmiana energii wewnętrznej układu U będzie wynikiem
wymiany energii przez układ na sposób ciepła Q oraz
przekazania energii przez układ otoczeniu, bądź
dostarczeniu energii do układu z otoczenia na sposób
pracy W.
• Wiąże to następująca zależność:
U = Q + W
Przemiana izochoryczna
• Dla przypadku, kiedy proces zachodzi w
stałej objętości - objętość układu
reagującego nie ulega zmianie i nie ma w
związku z tym wymiany pracy między
układem a otoczeniem (W=0) :
U = Q
v
• ciepło przemiany zachodzącej w stałej
objętości
jest
równe
zmianie
energii
wewnętrznej układu
2009-11-24
8
Ciepło molowe
• Jezeli przez C
v
oznaczymy ciepło molowe w
stałej objętości, czyli ciepło potrzebne do
ogrzania 1 mola substancji o 1
o
K w stałej
objetości, to wtedy dla jednego mola
otrzymujemy zależność:
U = C
v
* T
Przemiana izobaryczna
• Jeżeli układ w czasie przemiany zmienia
objętość, to wówczas energia wewnętrzna
tego układu zmienia się zarówno na skutek
wymiany ciepła jak i pracy z otoczeniem.
Gdy zmiana objetości odbywa się, pod
stałym ciśnieniem zewnętrznym p, wtedy:
• W = -p V
2009-11-24
9
Większość procesów chemicznych przebiega w
czasie przemiany chemicznej pod stałym
ciśnieniem atmosferycznym.
• równanie wyrażające I zasadę termodynamiki
przyjmie prostszą postać:
U = Q
p
- p V
czyli
Q
p
= U + p V
Q
p
- oznacza
ilość ciepła wymienioną przez
układ z otoczeniem w procesie izobarycznym
Entalpia
• Wyrażenie U + pV jest więc funkcją
stanu. Funkcję tę nazywamy
entalpią
(symbol H) lub zawartością cieplną
układu:
• U + pV = H
2009-11-24
10
Zmiana entalpii układu
• Dla stanu początkowego przed przemianą
mamy więc:
• U
1
+ pV
1
= H
1
a dla stanu końcowego:
• U
2
+ pV
2
= H
2
Zatem
• Q = H
2
- H
1
= H
Równanie to oznacza, że ciepło reakcji
zachodzącej pod stałym ciśnieniem jest
równe zmianie entalpii.
Zmiany entalpii zależą od temperatury
• Jeżeli przez C
p
to
ciepło molowe pod stałym ciśnieniem, czyli
ilość ciepła potrzebną do ogrzania 1 mola substancji o 1
o
K
przy p = const, to dla jednego mola otrzymamy:
H = C
p
T
Efekt cieplny jest
indywidualną cechą każdej reakcji,
• zależną od ilości reagentów i stanu ich skupienia.
• opisując przemianę, należy podawać równanie chemiczne,
ilość głównego reagentu, stany skupienia wszystkich
reagentów - indeksy s, c, g, aq do fazy stałej, ciekłej, gazowej
oraz rozcieńczonego roztworu wodnego. Oto przykład.
• H
2(g)
+ 1/2O
2(g)
---> H
2
O
(c)
2009-11-24
11
Zmiany
• Bezwzględne wartości entalpii, podobnie jak energii
wewnętrznej, nie są mierzalne bezpośrednio-
odnosząc te zmiany najczęściej względem tzw. stanu
standardowego.
• standardowa energia i standardowa entalpia reakcji
są wyłącznie funkcjami temperatury; są na ogół
podawane wartości w temperaturze 298,15 K
(25,00
o
C).
Dla celów termochemicznych przyjęto umownie, że
molowe entalpie standardowe wszystkich
pierwiastków w ich stanach standardowych są równe
zeru.
Stanem standardowym
• reagentów gazowych, stałych i ciekłych jest
czysta substancja pod ciśnieniem P
o
= 10
5
Pa
(1 bar -
dokładnie) w podanej temperaturze.
• Stanem standardowym reagentów będących
składnikami roztworu jest fikcyjny roztwór
doskonały o molalności 1mol/1000g
rozpuszczalnika.
• Funkcje standardowe oznacza się kółeczkiem
w prawym górnym indekse, np. H
o
(298 K).
2009-11-24
12
Standardowe efekty cieplne
• odnoszą się do fikcyjnej reakcji, w której z czystych
substratów powstają czyste produkty lub do reakcji
jonowej przebiegającej w fikcyjnym roztworze
doskonałym (bez oddziaływań między-jonowych).
Na tej podstawie możemy zdefiniować
molowe
ciepło tworzenia związku chemicznego
• Molowe ciepło tworzenia związku chemicznego jest
to ciepło tworzenia 1 mola tego związku z
pierwiastków w stanie standardowym.
Na przykład molowe ciepło tworzenia dwutlenku
węgla będzie równe:
• C
grafit(s)
+ O
2(g)
--> CO
2(g)
H
o
298
= - 393,42 kJ/mol
Pierwsze prawo termochemiczne -
prawo Laplace'a
• molowa entalpia reakcji rozkładu związku
chemicznego na pierwiastki jest równa molowej
entalpii reakcji tworzenia się tego związku, wziętej ze
znakiem przeciwnym
CO
g
+ H
2
O
(g)
--> CO
2(g)
+ H
2(g)
H
o
298
= -41,59kJ/mol
• jest
egzotermiczna
,
reakcja odwrotna
CO
2(g)
+ H
2(g)
--> CO
(g)
+ H
2
O
(g)
H
o
298
= +41,59 kJ/mol
• jest
endotermiczną
2009-11-24
13
Prawo Laplace'a
Pierwsze prawo termodynamiki
Jeżeli A + B → C + Q
tw
to C → A + B -Q
tw
Prawo to można uogólnić na wszystkie reakcje
chemiczne. Jeżeli reakcja przebiega w obydwu
kierunkach, to przy zmianie kierunku reakcji
wielkości ΔH liczbowo nie ulegają zmianie, a
jedynie przyjmują przeciwne znaki.
Drugie prawo termochemiczne
(prawo Hessa)
• molowa entalpia przemiany zależy jedynie od
stanu początkowego i końcowego reagującego
układu, a nie zależy od drogi przemiany.
Z prawa Hessa -
ciepło dowolnej reakcji Q
r
równa się sumie ciepeł tworzenia produktów,
pomniejszonej o sumę ciepeł tworzenia
substratów (z uwzględnieniem liczby moli n
każdego produktu i substratu).
• Q
r
= n
i
Q
p
- n
i
Q
s
2009-11-24
14
Drugie prawo termochemiczne
(prawo Hessa)
• Odpowiednio standardowa entalpia molowa
reakcji, równa jest sumie standardowych
entalpii molowych tworzenia produktów
n
i p
H
o
298
pomniejszonej o sumę
standardowych molowych tworzenia
substratów n
i s
H
o
298
.
r
H
o
298
= n
i p
H
o
298
- n
i s
H
o
298
Prawo Hessa
Drugie prawo termodynamiki:
Efekt cieplny reakcji chemicznej nie zależy od
drogi przemiany danych substratów w
określone produkty, jeżeli tylko wszystkie
przemiany
są
izobaryczne
lub
izochoryczne (przebiegają pod stałym
ciśnieniem lub w stałej objętości) i nie
towarzyszy im praca nieobjętościowa.
2009-11-24
15
Metoda I
• NH
3(g)
+ HCl
(g)
--> NH
4
Cl
(s)
H = -176,15 kJ/mol
• NH
4
Cl
(s)
+ H
2
O
(c)
-->NH
4
Cl
(aq)
H = +16,32 kJ/mol
ogólny efekt cieplny H = -159,83 kJ/mol
Metoda II
• NH
3(g)
+ H
2
O
(c)
--> NH
3(aq)
H = -35,15 kJ/mol
• HCl
(g)
+ H
2
O
(c)
--> HCl
(aq)
H = -72,38 kj/mol
• NH
3(aq)
+ HCl
(aq)
--> NH
4
Cl
(aq)
H = -52,30 kJ/mol
ogólny efekt cieplny H = -159,83 kJ/mol
2009-11-24
16
Ciepło właściwe - c (pojemność cieplna)
jest to ilość energii jaką musimy dostarczyć na sposób ciepła
aby ogrzać 1kg substancji o 1K.
Jednostką ciepła właściwego jest J
.
kg
-1.
K
-1
c=Q
.
m
-1.
ΔT
-1
.
Substancję możemy ogrzewać izochorycznie lub izobarycznie
.
Dla ciał stałych i cieczy nie ma to większego znaczenia
Na ogrzanie substancji gazowej
- przy stałym ciśnieniu potrzeba dostarczyć nieco większej
ilości ciepła niż na ogrzanie identycznej ilości substancji w
stałej objętości.
c
p
- ciepło wł. przy p=const, c
v
-ciepło wł. w V=const.
Najczęściej mamy do czynienia z ciepłem właściwym przy
stałym ciśnieniu.
Molowe ciepło właściwe - C
Ilość energii jaką musimy dostarczyć na sposób ciepła by
ogrzać 1mol substancji o 1K.
Jednostką molowego ciepła właściwego jest J
.
Mol
-1.
K
-1
C=Q
.
n
-1.
ΔT
-1
.
substancję możemy ogrzewać przy stałym ciśnieniu - C
p
lub w stałej objętości C
v
.
Dla ciał stałych ciepła te są praktycznie sobie równe.
Dla substancji gazowych C
p
>C
v
ponieważ przy stałym
ciśnieniu ogrzewany gaz rozpręża się i wykonuje
dodatkową pracę (pracę objętościową). Dlatego musimy
dostarczyć dodatkową ilość energii równą pracy
objętościowej.
2009-11-24
17
Ciepło spalania
• nazywany jest efekt cieplny towarzyszący
spalaniu jednego mola substancji. Najczęściej
ciepło spalania podawane jest dla reakcji
przebiegającej w warunkach standardowych
(temp 298,15K, ciśnienie P=1013,25hPa).
• W takich warunkach produktami reakcji są
gazowy tlenek węgla(IV), ciekła woda i
niekiedy azot.
Ciepło tworzenia ( Entalpia tworzenia)
Każda substancja chemiczna ma charakterystyczne dla
siebie ciepło tworzenia.
Ciepłem tworzenia Q
tw
związku chemicznego nazywa się
efekt cieplny towarzyszący syntezie jednego mola tego
związku w warunkach standardowych (temp. 298,15K,
ciśnienie P=1013,25hPa) z substancji prostych
(pierwiastków) w postaci trwałej w podanych warunkach.
Umownie ciepło tworzenia substancji prostych (N
2
, Na, Fe,
O
2
, S, P) trwałych w warunkach standardowych jest
równe zeru. Jednakże odmiany alotropowe jak ozon,
siarka jednoskośna, fosfor biały lub czarny mają w tych
warunkach ciepła tworzenia różne od zera. Ciepło
tworzenia Q
tw
to standardowa entalpia tworzenia ΔH
298
o
.
2009-11-24
18
Zadanie
• Oblicz entalpię rekakcji
• 3C
(s)
+ 4H
2(g)
= C
3
H
8(g)
• widząc, że:
C
3
H
8(g)
+ 5O
2(g)
=3CO
2(g)
+ 4H
2
O
(c)
ΔH=-2220kJ
2H
2(g)
+ O
2
= 2H
2
O
(c)
ΔH=-572kJ
C
(s)
+ O
2(g)
= CO
2(g)
ΔH=-394kJ
• Należy dodać stronami równania (1-3) tak by
otrzymać poszukiwane równanie reakcji:
• C
3
H
8(g)
+ 5O
2(g)
→3CO
2(g)
+ 4H
2
O
(c)
-2220kJ (1)
•
2H
2(g)
+ O
2
→ 2H
2
O
(c)
-572kJ (2)
• C
(s)
+ O
2(g)
→ CO
2(g)
-394kJ (3)
• 3C
(s)
+ 4H
2(g)
→ C
3
H
8(g)
+Q
Rozwiązanie
2009-11-24
19
Rozwiązanie c.d.
• W poszukiwanym równaniu
termochemicznym występują 3 mole węgla i
4 mole wodoru.
• Równania (2) i (3) należy pomnożyć
odpowiednio przez 2 i 3:
4H
2(g)
+ 2O
2
→ 4H
2
O
(c)
-1144kJ (4)
3C
(s)
+ 3O
2(g)
→ 3CO
2(g)
-1182kJ (5)
Rozwiązanie c.d.
• W poszukiwanym równaniu propan jest po stronie
produktów. Równanie (1) należy więc przekształcić
korzystając z prawa Laplace'a:
3CO
2(g)
+ 4H
2
O
(c)
→ C
3
H
8(g)
+ 5O
2(g)
+2220kJ (6)
• Po dodaniu stronami równań (4-6) i redukcji
wyrazów podobnych otrzymamy poszukiwane
równanie:
3C
(s)
+ 4H
2(g)
→ C
3
H
8(g)
-106kJ
2009-11-24
20
Przemiana samorzutna
• jest to przemiana, która zachodzi bez potrzeby napędzania
przez zewnętrzny bodziec
• wymianę energii na sposób ciepła, wykonywanie pracy
objętościowej, dyfuzję (wyrównanie stężeń) i reakcje
chemiczne (w określonych warunkach ciśnienia i
temperatury reakcja chemiczna przebiega w określonym
kierunku).
• Szybkość przemiany samorzutnej maleje w miarę upływu
czasu i układ zamknięty zbliża się do stanu równowagi
termodynamicznej.
Entropia -
S
• Entropia, podobnie jak energia wewnętrzna U i
entalpia H, jest funkcją stanu, tzn, jej zmiany
wyznacza jedynie stan początkowy i końcowy układu,
a nie zależą one od drogi przemiany.
• Jest miarą nieuporządkowania
• duża entropia - tj. wielkiego nieładu, z dużą ilością
energii w postaci cieplnych ruchów rozproszonych
atomów i cząsteczek – mała entropia - tj.
uporządkowanego ułożenia, niewielkiej ilości energii w
układzie, z atomami i cząsteczkami zlokalizowanymi.
Entropia substancji może wzrosnąć w dwojaki sposób;
• w wyniku ogrzewania
• w wyniku zwiększenia się liczby miejsc.
2009-11-24
21
Entalpia swobodna
całkowita zmiana entropii = zmiana entropii
układu + zmiana entropii otoczenia
S
całk.
= S + S
otocz.
Wyrażenie -T S
całk.
określa zmianę tzw.
entalpii swobodnej G
.
Entalpia swobodna definiowana jest wzorem:
G = H - TS
G = H - T S
• Ogrzewając zwiększamy
nieporządek
termiczny
-
nieład wynikający z cieplnych
ruchów cząsteczek.
• Zwiększenie liczby miejsc możemy uzyskać w
wyniku zwiększenia objętości lub zmieszania
substancji z inną substancją.
• Takie zwiększenie objętości lub zmieszanie z
inną substancją rozprzestrzenia cząsteczki
substancji na dodatkowych miejscach, co
nazywamy
nieporządkiem pozycyjnym.
2009-11-24
22
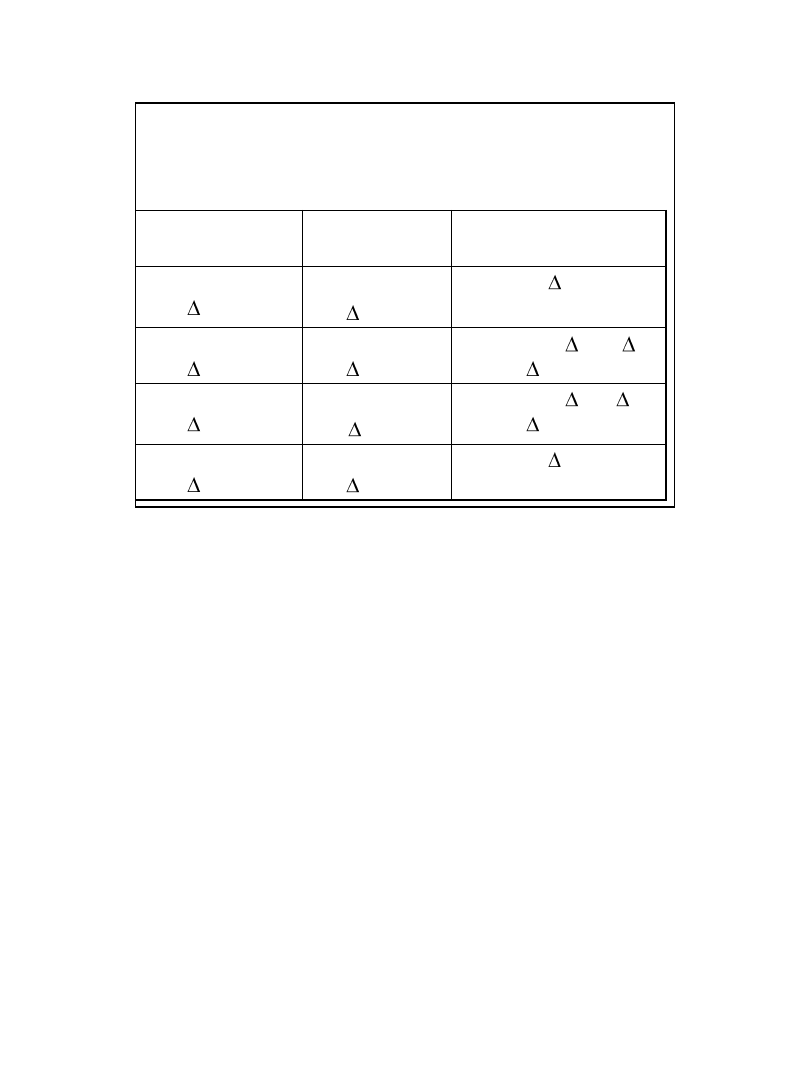
Czynniki sprzyjające samorzutności
Zmiana entalpii
Zmiana
entropii
Proces samorzutny
Egzotermiczna,
( H < 0)
Wzrost,
( S > 0)
Tak, G < 0
Egzotermiczna,
( H < 0)
Zmniejszenie
( S < 0)
Tak, jeśli |T S| < H,
G < 0
Endotermiczna,
( H > 0)
Wzrost,
( S > 0)
Tak, jeśli T S > H,
G < 0
Endotermiczna,
( H > 0)
Zmniejszenie
( S < 0)
Nie, G > 0
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia VI, Semestr 1, Chemia laboratorium, chemia budowlana sprawozdania, Chemia Budowlana, Chemia -
chemia fizyczna lab id 112228 Nieznany
Chemia kliniczna kontrola id 11 Nieznany
chemia okiem niechemika id 1126 Nieznany
chemia fizyczna egzamin id 1122 Nieznany
chemia maj 2005 id 112453 Nieznany
chemia przykladowe zad id 11281 Nieznany
Chemia Organiczna Cz1 id 112665 Nieznany
chemia tematy 1kolos id 112928 Nieznany
Chemia Wyklad 4c id 111678
Chemia fizyczna sciaga id 112218
program IV VI AO id 395233 Nieznany
Chemia polimerow II id 113148 Nieznany
Chemia Wyklad 4b id 111677
Chemia zadania 13 id 113043 Nieznany
więcej podobnych podstron