3. RÓWNOWAGA CHEMICZNA
Zadania przykładowe
3.1.
Do naczynia o objętości 2
⋅10
-2
m
3
wprowadzono 0,1 mola gazowego N
2
O
4
w temperaturze
298 K. Sumaryczne ciśnienie mieszaniny równowagowej wynosi 1,425
⋅10
5
Pa. Obliczyć ciśnieniową
stałą równowagi reakcji rozpadu N
2
O
4
do NO
2
oraz prężności cząstkowe reagentów w stanie
równowagi.
Rozwiązanie
Rozpad
N
2
O
4
do NO
2
zachodzi zgodnie z reakcją:
N
2
O
4
= 2NO
2
Ciśnieniowa stała równowagi tej reakcji dana jest zależnością:
K
P
P
P
P
p
NO
s
N O
s
=
2
2
4
2
gdzie:
P
i P
NO
N O
2
2 4
- to równowagowe ciśnienia odpowiednio NO
2
i N
2
O
4
,
P
s
jest ciśnieniem standardowym.
Obliczamy początkowe ciśnienie (P
p
) wprowadzonego N
2
O
4
.
P N O
nRT
V
Pa
p
(
)
,
,
,
2
4
3
5
01 8 314 298
2 10
1 239 10
=
=
⋅
⋅
⋅
=
⋅
−
Jeżeli przyjmiemy, że równowagowe ciśnienie NO
2
wynosi x, to ze stechiometrii reakcji wynika,
że ciśnienie N
2
O
4
w stanie równowagi wynosi P
p
(N
2
O
4
) - 0,5x. Stałą równowagi możemy zatem
zapisać w postaci zależności:
(
)
K
x
P
P N O
x
P
x
P N O
x P
p
s
p
s
p
s
=
−
=
−
⋅
2
2
4
2
2
4
0 5
0 5
(
)
,
(
,
Prężność sumaryczna w stanie równowagi wynosi 1,425
.
10
5
Pa i jest równa sumie prężności
cząstkowych reagentów
1,425
⋅ 10
5
= (P
p
(N
2
O
4
) - 0,5x) + x
Ponieważ ciśnienie początkowe N
2
O
4
wynosi 1,239
⋅10
5
Pa, zatem
1,425
⋅ 10
5
= (1,239
⋅ 10
5
- 0,5x) + x
stąd
x
=
0,372
⋅ 10
5
Pa
Po podstawieniu tej wartości do wzoru na stałą równowagi otrzymujemy
(
)
(
)
K
p
=
⋅
⋅
−
⋅
⋅
⋅
=
0 372 10
1239 10
0 5 0 372 10
10
0131
5 2
5
5
5
,
,
.
,
,
Prężności cząstkowe w stanie równowagi wynoszą:
P(NO
2
) = x = 0,372
⋅ 10
5
Pa
P(N
2
O
4
) = P
p
(N
2
O
4
) - 0,5x = 1,239
⋅ 10
5
- 0.5
⋅ 0,372 ⋅ 10
5
=1,053
⋅ 10
5
Pa

3.2.
W stanie równowagi mieszanina reakcyjna znajdująca się w naczyniu o objętości 10
-2
m
3
w
temp. 500 K zawiera 4 mole Br
2
, 2,5 mola H
2
i 1 mol HBr. Obliczyć stałą równowagi reakcji: 2HBr =
H
2
+ Br
2
.
W innym doświadczeniu prowadzonym w tych samych warunkach do pustego naczynia
wprowadzono pewną ilość HBr. Po ustaleniu się stanu równowagi okazało się, że w mieszaninie
znajduje się 8 moli bromu. Wyznaczyć liczby moli poszczególnych reagentów w stanie równowagi, a
także liczbę moli wprowadzonego na początku bromowodoru.
Rozwiązanie
Wyrażamy stałą K
p
za pomocą K
n
K
K
P
P N
p
n
s
n
=
∆
gdzie:
K
n
- jest równowagowym ilorazem liczby moli reagentów; K
n
nie jest stałą równowagi,
ponieważ wielkość ta jest zależna od ciśnienia i sumarycznej liczby moli reagentów,
P - sumaryczne ciśnienie równowagowe,
N - sumaryczna liczba moli reagentów w stanie równowagi,
∆n - różnica liczby moli gazowych produktów i substratów
reakcji
(zgodnie z zapisem reakcji).
Wobec faktu, że
∆n dla powyższej reakcji równe jest zeru, zatem K
p
= K
n
.
Stąd
(
)
K
K
n
n
n
p
n
H
Br
HBr
=
=
⋅
=
⋅
=
2
2
2
2
2 5 4
1
10
,
Stała równowagi jest oczywiście równa 10 także dla drugiego doświadczenia, ponieważ temperatura
jest ta sama.
Z zapisu reakcji wynika, że jeżeli w stanie równowagi mamy 8 moli bromu, to w naczyniu musi
się znajdować także 8 moli wodoru, gdyż do naczynia wprowadzono jedynie bromowodór.
Liczbę moli bromowodoru w stanie równowagi obliczymy z wyrażenia na stałą równowagi
(
)
10
8 8
2
=
⋅
n
HBr
skąd:
n
HBr
=
2,53 mola
Obliczając liczbę moli HBr wprowadzonego na początku do naczynia, musimy uwzględnić liczbę moli
HBr znajdującą się w naczyniu w stanie równowagi oraz liczbę moli HBr, która musiała
przereagować, aby powstało 8 moli Br
2
. Ze stechiometrii reakcji wynika, że musiało przereagować 16
moli HBr. Liczba moli HBr wprowadzonego na początku do naczynia wynosi zatem n
HBr
= 2,53 + 16
= 18,53 moli.
3.3.
Wyznaczyć stopień dysocjacji gazowego PCl
5
w temperaturze 550 K. Równowagowe
ciśnienie sumaryczne wynosi 2
.
10
5
Pa, a stała równowagi reakcji dysocjacji PCl
5
= PCl
3
+ Cl
2
wynosi
w tych warunkach K
p
= 1,98.
Rozwiązanie
Wyrazimy
stałą dysocjacji K
p
za pomocą K
n
.
K
n
n
n
P
P N
p
PCl
Cl
PCl
s
n
=
⋅
3
∆
Jeżeli stopień dysocjacji oznaczymy jako
α , to w stanie równowagi liczba moli Cl
2
i PCl
3
będzie
równa iloczynowi liczby moli wprowadzonego PCl
5
i stopnia dysocjacji, czyli w tym przypadku n
o
α.

Liczba moli PCl
5
w stanie równowagi jest równa n
o
(1 -
α).
Sumaryczna liczba moli w stanie równowagi będzie równa
N = n
o
α + n
o
α + n
o
(1 − α) = n
o
(1 + α)
Różnica liczby moli gazowych produktów i substratów reakcji wynosi w tym przypadku 1. Po
podstawieniu do równania na stałą równowagi otrzymujemy:
K
p
=
−
⋅
+
=
−
α
α
α
α
α
2
5
5
1
2
2
1
2 10
10 1
2
1
(
)
Zwróćmy uwagę, że początkowa liczba moli PCl
5
(n
o
) nie występuje w wyrażeniu na stałą równowagi.
Po podstawieniu za K
p
wartości 1,98 otrzymujemy
198
2
1
2
2
,
=
−
α
α
stąd
α = 0,70
3.4.
Stała równowagi K
p
dla reakcji N
2
+ 3H
2
= 2NH
3
w temperaturze 400
o
C wynosi 1,64
⋅10
-4
.
Czy mieszanina, w której prężności cząstkowe wszystkich reagentów wynoszą po 2
⋅10
5
Pa
przereaguje w kierunku tworzenia amoniaku?
Rozwiązanie
Informację o kierunku przebiegu reakcji otrzymamy określając zmianę entalpii swobodnej (
∆G) .
Jeżeli
∆G < 0 , to reakcja przebiega zgodnie z zapisem, jeżeli ∆G > 0, to w kierunku odwrotnym.
Korzystamy z równania izotermy Van't Hoffa, które dla podanej reakcji przyjmuje postać:
∆
∆
G
G
RT
P NH
P
P H
P
P N
P
o
s
s
s
=
+
ln
(
)
(
)
(
)
3
2
2
3
2
gdzie prężności reagentów występujące w równaniu nie są prężnościami równo-wagowymi , a
aktualnymi.
Ponieważ
∆G
o
= -RT lnK
p
, to:
∆G
RT
K
RT
P NH
P
P H
P N
p
s
= −
+
⋅
⋅
ln
ln
(
)
(
)
(
)
2
3
2
3
2
2
(
) ( )
(
)
∆G
J
= −
⋅
⋅
+
⋅
⋅
⋅
⋅ ⋅
=
−
8 314 673
164 10
8 314 673
2 10
10
2 10
2 10
41010
4
5 2
5 2
5 3
5
,
ln ,
,
ln
Wartość
∆G jest dodatnia, zatem reakcja przebiega w przeciwnym kierunku do zapisu, czyli w
kierunku rozpadu amoniaku. Odpowiedź: nie.
3.5.
Wyznaczyć równowagowe ciśnienia H
2
i H
2
S w temperaturze 298 K, jeżeli sumaryczne
ciśnienie mieszaniny równowagowej wynosi 10
5
Pa. Czy ze wzrostem temperatury zawartość H
2
w
mieszaninie równowagowej wzrośnie, zmaleje, czy też pozostanie bez zmian?
Dane potrzebne do obliczeń należy znaleźć w literaturze.

Rozwiązanie
Gazowy wodór i siarkowodór będą współistniały w temperaturze 298 K w obecności stałej
siarki rombowej, co możemy przedstawić równaniem reakcji:
H
2
+ S(s) = H
2
S.
Ciśnieniową stałą równowagi tej reakcji (K
p
) przedstawia równanie:
K
P H S
P
P H
P
P H S
P H
p
s
s
=
=
(
)
(
)
(
)
(
)
2
2
2
2
W zapisie stałej równowagi nie uwzględniono oczywiście siarki (faza stała). Stałą równowagi
obliczymy z zależności:
∆G
o
= -RT ln K
p
.
Wartość standardowej entalpii swobodnej wyliczymy korzystając ze wzoru:
∆G
o
=
∆H
o
- T
∆S
o
. Wartości
∆H
o
i S
o
reagentów w temp. 298 K znajdujemy w tablicach
termochemicznych.
Reagent
∆H
o
[
kJ
⋅mol
-
1
]
S
o
[J
⋅mol
-
1
⋅K
-1
]
H
2
0
130,6
S(r) 0 31,88
H
2
S -20,15
205,64
∆
∆
∆
∆
H
H
H S
H
H
H
S
kJ
o
o
o
o
298
298
2
298
2
298
2015
=
−
−
= −
(
)
(
)
( )
,
( )
(
)
∆S
S
H S
S
H
S
S r
J K
o
o
o
o
298
298
2
298
2
298
205 64 130 6 3188 4316
=
−
−
=
−
−
=
(
)
(
)
,
,
,
,
/
∆
∆
∆
G
H
T S
J
kJ
o
o
o
298
298
298
20150 298 4316
330116
33 01
=
−
= −
−
⋅
= −
=
,
,
,
∆G
RT
K
o
p
298
= −
ln
stąd:
ln
,
,
,
K
G
RT
K
p
o
p
=
−
=
⋅
=
⇒
=
⋅
∆
298
5
33010
8 314 298
13 324
6114 10
Ciśnienie sumaryczne w stanie równowagi wynosi 10
5
Pa, zatem P(H
2
S)+P(H
2
) = 10
5
Pa, z
kolei wartość stałej równowagi daje nam wartość stosunku P(H
2
S)/P(H
2
) = 6,114
.
10
5
.
Rozwiązujemy układ dwóch równań:
P(H
2
S) + P(H
2
) = 10
5
suma ciśnień równowagowych H
2
i H
2
S
wynosi 10
5
Pa
P(H
2
S)/P(H
2
) = 6,114
.
10
5
stosunek ciśnień H
2
S do H
2
równy jest
wartości stałej równowagi
stąd: P(H
2
) = 0,163 Pa, P(H
2
S)
≈ 10
5
Pa
Ponieważ reakcja jest egzotermiczna (
∆H < 0), zatem ze wzrostem temperatury stała równowagi
zmaleje i tym samym, co wynika ze wzoru na stałą równowagi, zwiększy się ilość H
2
.
3.6.
Dla reakcji CO +
1
2
O
2
= CO
2
zależność stałej równowagi od temperatury dana jest
zależnością:
ln
,
K
T
p
=
−
34015
10 45
Obliczyć wartość
∆H
o
i
∆S
o
reakcji w temperaturze 298 K.

Rozwiązanie
Zapiszmy równanie izobary Van’t Hoffa.
d
K
dT
H
RT
p
o
ln
=
∆
2
Po scałkowaniu powyższego równania, przy założeniu, że
∆H
o
nie jest funkcją temperatury,
otrzymujemy:
ln K
H
RT
B
p
o
= −
+
∆
gdzie: B - jest stałą całkowania.
Porównując uzyskane równanie z podanym w treści zadania dochodzimy do wniosku, że -
∆H
o
/R =
34015, stąd
∆H
o
= -34015
.
8,314 = -282800 J = -282,8 kJ
∆S
o
reakcji znajdujemy z zależności:
∆G
o
=
∆H
o
- T
∆S
o
(
*
)
W tym celu musimy znaleźć wartość standardowej entalpii swobodnej (
∆G
o
), której związek ze stałą
równowagi K
p
ma postać:
∆G
o
= -RT lnK
p
Po podstawieniu do równania zależności podanej w zadaniu otrzymamy:
∆G
RT
T
R
RT
o
= −
−
= − ⋅
+
⋅
34015
10 45
34015
10 45
,
,
Porównując uzyskane równanie z równaniem opatrzonym gwiazdką (
*
) otrzymujemy
∆S
o
= -R
.
10,45 = -86,88 J
⋅K
-1
3.7.
W temperaturze 1000 K w stanie równowagi w naczyniu zawierającym stały węgiel
znajduje się równomolowa mieszanina CO
2
i CO. Ciśnienie sumaryczne wynosi 1,4
.
10
6
Pa. W jakiej
temperaturze, przy tym samym ciśnieniu sumarycznym, stosunek ciśnień P(CO)/P(CO
2
) wyniesie 4?
Dla reakcji:
CO
2
+ C(s) = 2CO
∆H
o
wynosi 170 kJ i nie zależy od temperatury.
Rozwiązanie
Stała równowagi reakcji K
p
dana jest zależnością:
K
P CO
P
P CO
P
P CO
P CO
P
p
s
s
s
=
=
⋅
(
)
(
)
(
)
(
)
2
2
2
2
Ciśnienia cząstkowe CO i CO
2
w stanie równowagi dane są zależnościami:
P(CO) = x(CO) P
r
oraz P(CO
2
) = x(CO
2
) P
r
gdzie:
x - oznacza ułamek molowy w mieszaninie równowagowej,
P
r
- jest równowagowym ciśnieniem sumarycznym.
Obliczamy teraz K
p
w temp. 1000 K. Ponieważ mamy mieszaninę równomolową, to x(CO) = x(CO
2
)
= 0,5. Prężności cząstkowe CO
2
i CO wynoszą zatem:
P(CO) = P(CO
2
) = 0,5
.
1,4
.
10
6
= 0,7
.
10
6
Pa

Po podstawieniu do wyrażenia na K
p
otrzymujemy:
(
)
K
K
p
(
)
,
,
1000
0 7 10
0 7 10 10
7
6 2
6
5
=
⋅
⋅
⋅
=
Obliczamy wartość K
p
w poszukiwanej temperaturze T. Skoro stosunek prężności cząstkowych CO i
CO
2
wynosi 4, to odpowiada to także stosunkowi molowemu n(CO)/n(CO
2
) = 4. Zatem na n moli CO
2
przypada 4n moli CO. Ułamki molowe CO i CO
2
wynoszą:
x CO
n CO
n CO
n CO
n
n n
(
)
(
)
(
)
(
)
,
=
+
=
+
=
2
4
4
0 8
oraz
x CO
n CO
n CO
n CO
n
n n
(
)
(
)
(
)
(
)
,
2
2
2
4
0 2
=
+
=
+
=
Stąd prężności cząstkowe w temperaturze T wyniosą:
P(CO) = 0,8
⋅ 1,4
.
10
6
Pa
P(CO
2
) = 0,2
⋅ 1,4
.
10
6
Pa
Po podstawieniu prężności do wyrażenia na K
p
otrzymujemy:
(
)
K
p
=
⋅ ⋅
⋅ ⋅
⋅
=
0 8 14 10
0 2 14 10 10
40
6 2
6
5
,
,
,
,
Obliczamy temperaturę, w której stała równowagi K
p
wynosi 40, korzystając z zależności:
ln
( )
( )
K T
K T
H
R
T
T
o
2
2
1
1
1
2
1
1
=
−
∆
otrzymanej przez całkowanie równania izobary Van’t Hoffa w granicach od T
1
do T
2
przy założeniu,
że
∆H
o
reakcji nie jest funkcją temperatury. Po podstawieniu danych otrzymujemy:
ln
,
40
7
170000
8 314
1
1000
1
2
=
−
T
stąd: T
2
= 1093 K
ZADANIA
3.1.
Dla reakcji:
PCl
5
= PCl
3
+ Cl
2
w temperaturze 550 K,
∆G
o
= -3,123 kJ i
∆S
o
= 173 J
⋅K
-1
.
a) Obliczyć stopień dysocjacji gazowego PCl
5
w temperaturze 550 K, jeżeli 1 mol tego związku
umieścimy w naczyniu o pojemności V. Równowagowe ciśnienie sumaryczne wynosi 2
⋅10
5
Pa.
b) Czy stopień dysocjacji wzrośnie, zmaleje, czy też pozostanie bez zmian, gdy objętość naczynia
zmniejszymy o połowę?
c) Jak wpłynie wzrost temperatury na stałą równowagi reakcji?
3.2.
Ile moli PCl
5
należy wprowadzić do pustego naczynia o objętości 1 dm
3
, aby
równowagowe stężenie chloru wynosiło w temperaturze 327
o
C
0,1 mol
⋅dm
-3
? K
p
reakcji dysocjacji PCl
5
wynosi w tych warunkach 2.
3.3.
W naczyniu o pojemności 0,5 dm
3
w temperaturze 25
o
C początkowo znajduje się
1,588 g N
2
O
4
. Po ustaleniu się stanu równowagi ciśnienie mieszaniny gazowej składającej się z NO
2
i
N
2
O
4
wynosi 10
5
Pa. Obliczyć stopień dysocjacji N
2
O
4
oraz stałą równowagi K
p
. Czy stopień

dysocjacji zmaleje, wzrośnie, czy pozostanie bez zmian, jeżeli ciśnienie równowagowe wyniesie 2
⋅10
5
Pa?
3.4.
W temperaturze 523 K pod ciśnieniem 1,013
⋅10
5
Pa stopień dysocjacji fosgenu (COCl
2
)
na tlenek węgla i chlor wynosi 0,7. Obliczyć stałą równowagi K
p
oraz równowagowy iloraz liczby
moli reagentów K
n
, jeżeli do opróżnionego naczynia wprowadzono 1 mol fosgenu w tej temperaturze.
Do obliczenia której z ww. wielkości potrzebna jest informacja o początkowej liczbie moli fosgenu?
3.5.
W stanie równowagi w temperaturze T w naczyniu o objętości V znajdują się wodór,
chlor i chlorowodór , których prężności cząstkowe wynoszą 10
5
Pa,
∆H
o
reakcji wynosi -92,3 kJ.
a) Obliczyć stałą równowagi K
p
reakcji H
2
+ Cl
2
= 2HCl(g).
b) W którą stronę przesunie się położenie równowagi, jeżeli objętość naczynia dwukrotnie
zwiększymy?
c) Czy stała równowagi wzrośnie, zmaleje, czy pozostanie bez zmian, jeżeli temperaturę podwoimy?
3.6
.
Ile moli CO
2
należy dodać do naczynia zawierającego stały CaO, aby w temperaturze
1200 K otrzymać 1 mol stałego CaCO
3
? Skorzystać z tablic.
a) Odpowiedź podać w postaci zależności liczby moli od objętości naczynia.
b) Wykonać obliczenia dla objętości naczynia równej 1 dm
3
.
3.7.
Dla reakcji:
2NO + O
2
= 2NO
2
stała równowagi K
p
w temperaturze 298 K wynosi 4,6
⋅10
23
,
∆S
o
298
= -170 J
⋅K
-1
, a
∆C
p
= 0. Obliczyć
∆G
o
i K
p
reakcji w temperaturze 700 K.
3.8.
Znaleźć zależność stałej równowagi od temperatury dla reakcji:
SO
2
+
1
2
O
2
= SO
3
wiedząc, że
∆H
o
298
i
∆S
o
298
dla powyższej reakcji wynoszą odpowiednio: -98,3 kJ oraz -94,38 J
⋅K
-1
.
Zakładamy, że
∆C
p
= 0.
3.9.
Wyznaczyć prężność CO
2
nad tlenkiem baru w temperaturze 800 K korzystając z danych
tablicowych zakładając, że dla reakcji rozkładu węglanu baru
∆C
p
= 0. Jak wpłynie wzrost
temperatury na prężność CO
2
?
3.10.
Wyznaczyć
∆H
o
,
∆S
o
oraz stałą równowagi K
p
reakcji
FeO(s) + CO
2
= FeCO
3
(s)
w temperaturze 298 K wykorzystując dane tablicowe. Obliczyć także stałą równowagi tej reakcji w
temperaturze 1000 K zakładając, że ciepło reakcji jest niezależne od temperatury.
3.11.
Stała równowagi K
p
reakcji:
FeO(s) + CO(g) = Fe(s) + CO
2
wynosi 0,871 w temperaturze 600
o
C oraz 0,403 w temperaturze 1000
o
C. Obliczyć
∆H
o
reakcji oraz
stałą równowagi w temperaturze 1000 K.
Zakładamy, że
∆C
p
= 0.
3.12.
Dla reakcji:
C + 2H
2
(g) = CH
4
(g)
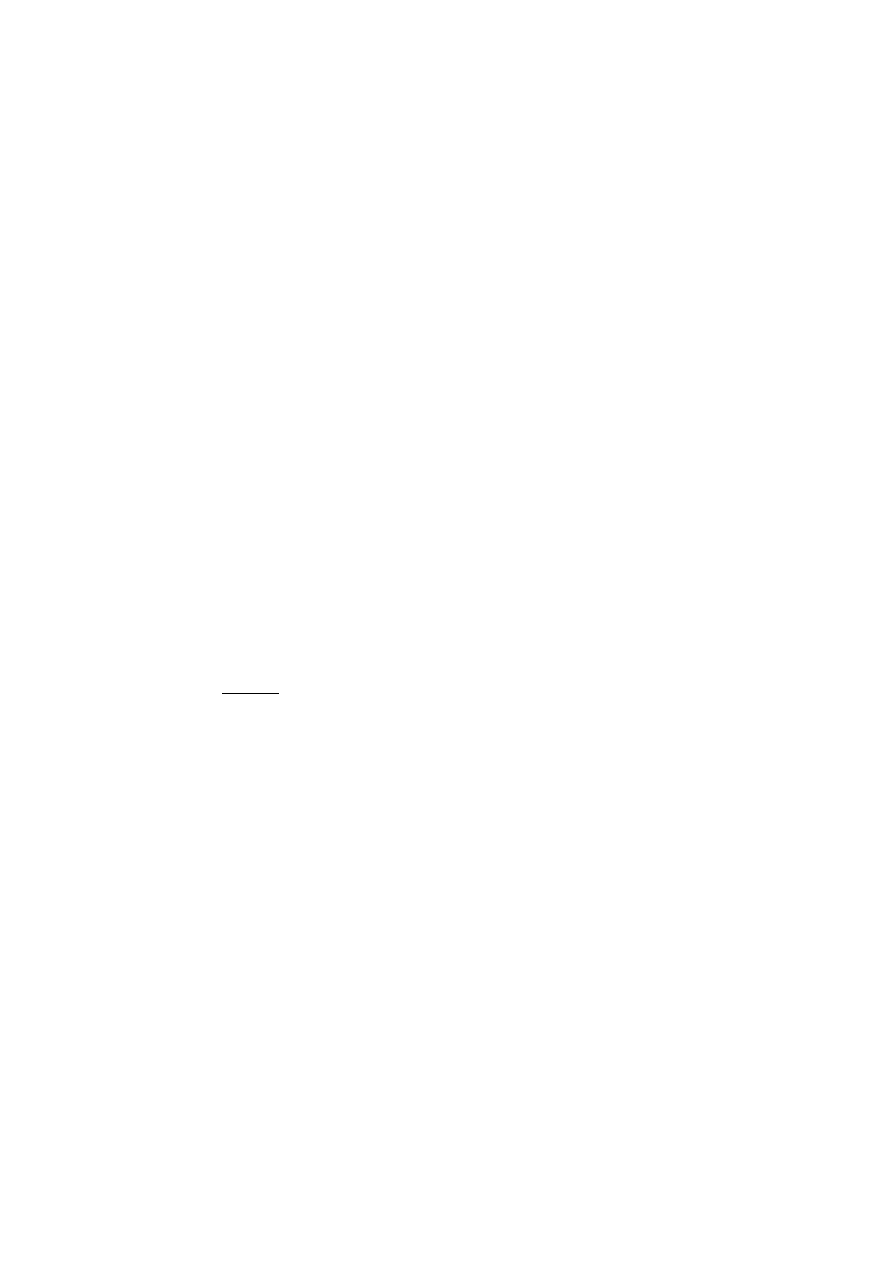
zależność stałej równowagi od temperatury ma postać: lnK
p
= 9000,5/T - 9,712. Obliczyć
∆H
o
i
∆S
o
reakcji.
3.13.
Czy mieszanina zawierająca NO
2
o ciśnieniu P = 10
5
Pa oraz N
2
O
4
o ciśnieniu P = 10
6
Pa w
temperaturze 25
o
C będzie reagować w kierunku tworzenia N
2
O
4
? Dla reakcji: 2NO
2
= N
2
O
4
standardowa zmiana entalpii swobodnej
∆G
o
wynosi -4860 J.
3.14.
Obliczyć stałą równowagi reakcji:
NiO(s) + CO(g) = Ni(s) + CO
2
(g)
w temperaturze 298 oraz 500 K korzystając z danych tablicowych. Zakładamy, że
∆C
p
reakcji wynosi
0.
ODPOWIEDZI DO ZADAŃ
3.1.
a)
α = 0,70;
b)
α zmaleje;
c)
stała równowagi wzrośnie.
3.2.
0,35 mola PCl
5
.
3.3.
α = 0,169; K
p
= 0,1184;
α zmaleje.
3.4.
K
p
= 0,961; K
n
= 1,633; Znajomość początkowej liczby moli fosgenu jest potrzebna do
obliczenia K
n
.
3.5.
a) K
p
= 1;
b)
położenie równowagi nie zmieni się (
∆n = 0);
c)
K
p
zmaleje.
3.6.
a) n = 1 + 46,608
⋅ V;
b) n = 1,047 mola CO
2
.
3.7.
∆G
o
700
= -66,651 kJ; K
p
= 9,41
⋅10
4
.
3.8.
ln
,
,
K
T
p
=
−
11823 4
1135
.
3.9.
P(CO
2
) = 3,37
⋅10
-3
Pa; ze wzrostem temperatury prężność CO
2
wzrośnie.
3.10.
∆H
o
298
= -90,49 kJ;
∆S
o
298
= -179,51 J
⋅K
-1
; K
p
(298 K) = 3,05
⋅10
6
; K
p
(1000 K) = 2,23
⋅10
-5
.
3.11.
∆H
o
= -17,82 kJ; K
p
(1000 K) = 0,637.
3.12.
∆H
o
= -74,83 kJ;
∆S
o
= -80,75 J
⋅K
-1
.
3.13.
∆G = 844,8 J > 0; nie.
3.14.
K
p
(298 K) = 1,02
⋅10
8
; K
p
(500 K) = 8,75
⋅10
4
.
4. ELEKTROCHEMIA
Zadania przykładowe
4.1.
W naczyńku konduktometrycznym elektrody o powierzchni 1 cm
2
są umieszczone w
odległości 2 cm. Zmierzona w tym naczyńku rezystancja (R) roztworu HCl o stężeniu 0,01 mol
⋅dm
-3
wynosi 487,8
Ω.
a) Obliczyć przewodnictwo właściwe i równoważnikowe roztworu HCl.
b) Ile wyniosłaby rezystancja roztworu NaOH o stężeniu 0,01 mol
⋅dm
-3
w tym naczyńku?
Przewodnictwo molowe roztworu NaOH o stężeniu 0,01mol
⋅dm
-3
wynosi 240 S
⋅cm
2
⋅mol
-1
.
Rozwiązanie
Stała naczyńka konduktometrycznego dana jest zależnością:
k
l
s
cm
= = =
−
2
1
2
1
gdzie:
l - odległość pomiędzy elektrodami
s - powierzchnia elektrody
a) Przewodnictwo właściwe obliczamy z zależności:
κ =
=
=
⋅
⋅
−
−
k
R
S cm
2
487 8
410 10
3
1
,
,
Natomiast przewodnictwo równoważnikowe, równe w przypadku elektrolitu
1,1-wartościowościowego przewodnictwu molowemu, wyliczamy ze wzoru:
Λ
r
c
S cm
=
=
⋅
⋅
=
⋅
−
1000
1000 410 10
0 01
410
3
2
κ
,
,
⋅ równ.
-1
b) Ze wzoru definiującego przewodnictwo równoważnikowe wynika, że
κ =
=
k
R
c
Λ
1000
Stąd:
R
k
c
=
⋅
⋅
=
⋅
⋅
=
1000
1000 2
240 0 01
833 33
Λ
Ω
,
,
4.2.
Rezystancja (R) roztworu zawierającego 0,871 g K
2
SO
4
w 1 dm
3
roztworu, zmierzona w
naczyńku konduktometrycznym o stałej równej 150 m
- 1
, wynosi 1000
Ω. Obliczyć przewodnictwo
właściwe, molowe i równoważnikowe roztworu K
2
SO
4
. M (K
2
SO
4
) = 174,2 g
⋅mol
-1
.
Rozwiązanie
Przewodnictwo
właściwe roztworu obliczamy z zależności:
κ =
k
R
gdzie:
κ - przewodnictwo właściwe,
k - stała naczyńka,
R - rezystancja roztworu.
Po podstawieniu
κ =
=
⋅
−
150
1000
015
1
, S m
Aby znaleźć przewodnictwo molowe i równoważnikowe, obliczamy stężenie roztworu K
2
SO
4
w
molach
⋅ m
-3
.
c
n
v
m
M
v
m
mol m
K SO
=
=
=
=
⋅
−
−
2
4
0 871
174 2
10
5
3
3
3
,
,
Przewodnictwo molowe obliczamy z zależności:
(
)
Λ K SO
c
S m mol
2
4
2
1
015
5
0 03
= =
=
⋅
⋅
−
κ
,
,
Przewodnictwo równoważnikowe, czyli przewodnictwo połowy mola K
2
SO
4
, obliczamy z zależności:

Λ
1
2
2
015
2 5
0 015
2
4
2
K SO
c
S m
=
=
⋅
=
⋅
κ
,
,
⋅
równ
.
-1
Należy zwrócić uwagę na to, że w większości podręczników i tablic podaje się wartości
przewodnictw równoważnikowych w S
⋅cm
2
⋅równ.
-1
, a przewodnictw właściwych w S
⋅cm
-1
, i tymi
jednostkami będziemy się posługiwać w tym skrypcie. Stała naczyńka k po zmianie jednostek wynosi
1,5 cm
-1
, przewodnictwo właściwe równe jest zatem
κ =
=
=
⋅
⋅
−
−
k
R
S cm
15
1000
15 10
3
1
,
,
Przewodnictwo molowe obliczamy z zależności:
(
)
Λ K SO
c
S cm mol
2
4
3
3
2
1
1000
1000 15 10
5 10
300
=
=
⋅
⋅
⋅
=
⋅
⋅
−
−
−
κ
,
gdzie
κ wyrażone jest w S⋅cm
-1
, a stężenie w molach
⋅dm
-3
.
Przewodnictwo równoważnikowe jest równe odpowiednio:
Λ
1
2
1000 15 10
2 5 10
150
2
4
3
3
2
K SO
S cm
=
⋅
⋅
⋅ ⋅
=
⋅
⋅
−
−
,
równ.
-1
4.3.
100 cm
3
roztworu NaOH miareczkowano za pomocą 0,5 molowego roztworu H
2
SO
4
.
Przewodnictwo mierzono stosując zanurzeniowe naczyńko konduktometryczne o stałej równej
0,2 cm
-1
. Wiedząc, że w punkcie równoważnikowym rezystancja roztworu wynosi 153,85
Ω, obliczyć
ilość moli NaOH zawartą w roztworze oraz jego stężenie przed miareczkowaniem. Przewodnictwa
równoważnikowe jonów Na
+
i SO
4
-
wynoszą odpowiednio: 50 i 80 S
⋅cm
2
⋅równ.
-1
. Efekt
rozcieńczania należy pominąć.
Rozwiązanie
Podczas miareczkowania roztworu NaOH za pomocą roztworu H
2
SO
4
zachodzi reakcja:
2NaOH + H
2
SO
4
= Na
2
SO
4
+ 2H
2
O
W punkcie równoważnikowym znajduje się w roztworze jedynie siarczan sodowy, którego stężenie
molowe obliczamy wykorzystując zależności:
(
)
(
)
κ
κ
Na SO
k
R
Na SO
Na SO
c
2
4
2
4
2
4
1
2
1000
2
=
=
⋅
⋅
Λ
Połączenie obu równań daje wyrażenie:
(
)
c Na SO
k
R
Na SO
2
4
2
4
1000
2
1
2
=
⋅
⋅ ⋅
Λ
gdzie:
(
)
Λ
1
2
1
2
50 80 130
2
4
4
2
2
Na SO
Na
SO
S cm
=
+
=
+
=
⋅
⋅
+
−
λ
λ
równ.
-1
Po podstawieniu danych otrzymujemy:
(
)
c Na SO
mol dm
2
4
3
3
1000 0 2
2 153 85 130
5 10
=
⋅
⋅
⋅
= ⋅
⋅
−
−
,
,
Zatem w 100 cm
3
roztworu (pomijamy efekt rozcieńczania) znajduje się

5
⋅10
-3
mol
⋅dm
-3
⋅0,1 dm
3
= 5
⋅10
-4
mola Na
2
SO
4
Z zapisanej reakcji wynika, że dla powstania 1 mola Na
2
SO
4
muszą przereagować 2 mole NaOH. Stąd
w wyjściowym roztworze musiało znajdować się 2
⋅5⋅10
-4
= 1
⋅10
-3
mola NaOH.
Stężenie wyjściowego roztworu NaOH wynosiło:
c
n
v
mol dm
=
=
= ⋅
⋅
−
−
−
−
10
10
1 10
3
1
2
3
4.4.
Przewodnictwo właściwe roztworu HCl o stężeniu 0,1 mol
⋅dm
-3
wynosi 4,10
⋅10
-2
S
⋅cm
-1
.
Jeżeli do tego roztworu zostanie dodana identyczna objętość roztworu KOH o stężeniu 0,1 mol
⋅dm
-3
,
to przewodnictwo zmaleje do wartości 6,25
⋅10
-3
S
⋅cm
-1
. Dodanie drugiej, takiej samej objętości
roztworu KOH o stężeniu 0,1 mol
⋅dm
-3
powoduje z kolei wzrost przewodnictwa właściwego roztworu
do wartości 1,204
⋅10
-2
S
⋅cm
-1
. Obliczyć:
a) przewodnictwo równoważnikowe HCl,
b) przewodnictwo równoważnikowe KCl,
c) przewodnictwo równoważnikowe KOH,
d) sumę przewodnictw jonowych H
+
i OH
-
.
Rozwiązanie
a) Przewodnictwo równoważnikowe HCl obliczamy z zależności:
(
)
Λ HCl
c
S cm
=
⋅
=
⋅
⋅
=
⋅
⋅
−
1000
410 10
1000
01
410
2
2
κ
,
,
równ.
-1
b) Po dodaniu do roztworu HCl o stężeniu 0,1 mol
⋅dm
-3
identycznej objętości roztworu KOH o
stężeniu 0,1 mol
⋅dm
-3
otrzymamy zgodnie z reakcją:
HCl + KOH = KCl + H
2
O
wodny roztwór KCl o stężeniu równym połowie stężeń wyjściowych, czyli 0,05 mol
⋅dm
-3
.
Zatem
(
)
Λ KCl
S cm
=
⋅
⋅
=
⋅
⋅
−
1000 6 25 10
0 05
125
3
2
,
,
równ.
-1
c) Jeżeli do roztworu otrzymanego w punkcie b) dodamy kolejną, identyczną objętość roztworu KOH
o stężeniu 0,01 mol
⋅dm
-3
, to w uzyskanej mieszaninie znajdzie się KCl o stężeniu 0,033 mol
⋅dm
-3
(objętość roztworu KCl zwiększona została o 1/3) oraz KOH o stężeniu 0,033 mol
⋅dm
-3
(jedną
objętość roztworu KOH dodano do dwóch objętości).
Przewodnictwo
właściwe mieszaniny równe jest sumie przewodnictw KCl i KOH.
(
)
(
)
κ κ
κ
=
+
K Cl
K OH
Po podstawieniu w miejsce
κ wyrażenia
Λ ⋅ c
1000
otrzymujemy:
(
) (
)
(
) (
)
κ =
⋅
+
⋅
Λ
Λ
KCl c KCl
KOH c KOH
1000
1000
gdzie
niewiadomą jest poszukiwana wartość przewodnictwa równoważnikowego KOH.
Wstawiając dane otrzymamy:
(
)
1204 10
125 0 033
1000
0 033
1000
2
,
,
,
⋅
=
⋅
+
⋅
−
Λ KOH
Stąd
Λ(KOH) = 240,0 S⋅cm
2
⋅równ.
-1
.
d) Aby obliczyć sumę przewodnictw jonowych H
+
i OH
-
, skorzystamy z prawa niezależnej wędrówki
jonów Kohlrauscha.

( ) (
)
( ) ( ) ( ) ( ) ( ) (
)
(
)
(
)
(
)
λ
λ
λ
λ
λ
λ
λ
λ
H
OH
H
Cl
K
Cl
K
OH
HCl
KCl
KOH
+
−
+
−
+
−
+
−
+
=
+
−
−
+
+
↓
↓
↓
Λ
Λ
Λ
Po podstawieniu danych otrzymujemy:
( ) (
)
λ
λ
H
OH
S cm
+
−
+
=
−
+
=
⋅
⋅
410 125 240 525
2
równ.
-1
4.5
.
Miareczkując konduktometrycznie 100 cm
3
pewnego roztworu HCl za pomocą
roztworuNaOH o stężeniu 0,5 mol
⋅dm
-3
uzyskano następujące wyniki:
NaOH [cm
3
]
0 2,0 4,0 6,0 8,0 10,0
κ⋅10
3
[S
⋅cm
-1
]
20,0 14,3 8,75 7,35 9,95 12,5
Obliczyć liczbę moli HCl zawartą w wyjściowym roztworze oraz jego stężenie.
Rozwiązanie
Podczas miareczkowania roztworu HCl roztworem NaOH zachodzi reakcja:
H
+
+ Cl
-
+ Na
+
+ OH
-
= Na
+
+ Cl
-
+ H
2
O
Celem wyznaczenia punktu równoważnikowego wykonuje się wykres zależności przewodnictwa
właściwego roztworu w funkcji objętości dodawanego roztworu NaOH. Przez punkty
eksperymentalne prowadzimy linie proste, których przecięcie wyznaczy punkt równoważnikowy. Z
pokazanego rysunku wynika, że punkt równoważnikowy osiągamy po dodaniu 5 cm
3
roztworu
NaOH o stężeniu 0,5 mol
⋅dm
-3
, co odpowiada 5
⋅10
-3
dm
3
⋅ 0,5 mol⋅dm
-3
= 2,5
⋅10
-3
mola NaOH.
Z reakcji wynika, że liczba moli HCl zawarta w wyjściowym roztworze jest równa liczbie moli
zużytego NaOH, czyli wynosi 2,5
⋅10
-3
moli.
Ponieważ 2,5
⋅10
-3
moli HCl znajdowało się w 100 cm
3
roztworu, zatem stężenie wyjściowe
roztworu HCl wynosiło:
c HCl
n
V
mol dm
(
)
,
,
,
=
=
⋅
=
⋅
−
−
2 5 10
01
0 025
3
3
V [cm ]
10 S cm
0
5
10
15
20
0
5
10
Krzywa miareczkowania konduktometrycznego roztworu HCl roztworem NaOH
4.6.
W aparacie Hittorfa o platynowych elektrodach znajduje się roztwór NaOH o stężeniu 0,10
mol
⋅dm
-3
. Po przepłynięciu przez roztwór ładunku 5
⋅10
-3
F do przestrzeni katodowej przybyło 1
⋅10
-3

mola NaOH. Obliczyć liczbę przenoszenia jonu OH
-
w tym roztworze oraz końcowe stężenie NaOH w
przestrzeni katodowej i anodowej. W obu przestrzeniach znajduje się po 100 cm
3
roztworu.
Rozwiązanie
Na elektrodach platynowych zajdą następujące reakcje elektrodowe:
katoda: H
2
O + e =
1
2
H
2
+ OH
-
anoda:
1
2
H
2
O =
1
4
O
2
+ H
+
+ e
Wykonujemy bilans materiałowy dla obu przestrzeni przy przepływie ładunku 1 F:
Przestrzeń katodowa: wskutek reakcji elektrodowej przybywa 1 gR OH
-
wskutek wędrówki jonów
przybywa t gR Na
ubywa t gR OH
+
+
−
−
____________________________
po podsumowaniu:
1 gR OH
-
+ t
+
gR Na
+
- t
-
gR OH
-
Uwzględniając, że 1 - t
-
= t
+
, otrzymujemy: + t
+
gR NaOH
Przestrzeń anodowa: wskutek reakcji elektrodowej przybywa 1 gR H
+
wskutek wędrówki jonów
przybywa t gR OH
ubywa
t
gR Na
−
−
+
+
__________________________
po podsumowaniu:
1 gR H
+
+ t
-
gR OH
-
- t
+
gR Na
+
Zastępując t
-
gR OH
-
przez (1 - t
+
) gR OH
-
otrzymujemy:
1gR H
+
+ 1gR OH
-
- t
+
gR OH
-
+ t
+
gRNa
+
,
a ponieważ jony H
+
z jonami OH
-
utworzą cząsteczkę H
2
O otrzymamy ostatecznie 1 gR H
2
O - t
+
gR
NaOH.
Z bilansu przestrzeni katodowej wynika, że ze zmian liczby moli NaOH w tej przestrzeni możemy
wyliczyć liczbę przenoszenia jonu Na
+
z zależności:
(
)
t Na
n
Q
+
=
∆
∆ n = 1⋅10
-3
mola, Q = 5
⋅10
-3
F.
Po podstawieniu otrzymamy:
(
)
t Na
+
−
−
=
⋅
⋅
=
1 10
5 10
0 20
3
3
,
stąd
(
)
(
)
t OH
t Na
−
+
= −
= −
=
1
1 0 2 0 8
,
,
Obliczamy stężenie końcowe NaOH w przestrzeni katodowej. W 100 cm
3
roztworu NaOH o stężeniu
0,10 znajduje się 0,010 mola NaOH. Ponieważ przybyło 1
⋅10
-3
mola NaOH, zatem po elektrolizie w
przestrzeni katodowej znajduje się 0,011 mola NaOH w 100cm
3
, co odpowiada stężeniu 0,11mol
⋅dm
-3
.
W przestrzeni anodowej mamy do czynienia z ubytkiem 1
⋅10
-3
mola NaOH. Po elektrolizie w
przestrzeni anodowej znajduje się 0,010 - 0,001 = 0,0099 mola NaOH, co odpowiada stężeniu 0,099
mol
⋅dm
-3
.
4.7.
W aparacie Hittorfa, w którym katoda jest platynowa, a anoda chlorosrebrna, znajduje się
roztwór KCl o stężeniu 0,10 mol
⋅dm
-3
. Po przepuszczeniu przez roztwór ładunku 1
⋅10
-2
F z
przestrzeni anodowej ubyło 4,9
⋅10
-3
mola KCl. Obliczyć liczbę przenoszenia jonu Cl
-
w tym roztworze

oraz końcowe stężenie KCl w przestrzeniach katodowej i anodowej. W obu przestrzeniach znajduje
się po 100 cm
3
roztworu.
Rozwiązanie
Reakcja
zachodząca na anodzie jest reakcją utleniania
Ag + Cl
-
= AgCl + e
Bilans przestrzeni anodowej przy przepływie ładunku 1F:
wskutek reakcji elektrodowej z przestrzeni anodowej ubywa -1 gR Cl
-
wskutek wędrówki
jonów
przybywa t
gR Cl
ubywa
t
gR K
−
−
+
+
____________________________________
Po podsumowaniu:
-1 gR Cl
-
- t
+
gR K
+
+ t
-
gR Cl
-
= -t
+
gR KCl.
Zatem ze zmian liczby moli KCl w przestrzeni anodowej można obliczyć liczbę przenoszenia jonu
t(K
+
). Korzystamy z zależności:
( )
t K
n
Q
+
=
∆
gdzie:
∆n = 4,9⋅10
-3
, a Q = 1
⋅10
-2
F.
Po podstawieniu otrzymamy:
( )
t K
+
−
−
=
⋅
=
4 9 10
10
0 49
3
2
,
,
stąd
( )
( )
t Cl
t K
−
+
= −
= −
=
1
1 0 49 0 51
,
,
.
Stężenie końcowe KCl w przestrzeni anodowej:
w 100 cm
3
znajdowało się 0,010 mola KCl, ubyło 4,9
⋅10
-3
mola KCl, zatem pozostało 5,1
⋅10
-3
mola
KCl w 100 cm
3
, czyli stężenie wynosi 0,051 mol
⋅dm
-3
.
W przestrzeni katodowej:
na platynowej katodzie zachodzi rozkład wody z wydzieleniem wodoru
H
2
O + e =
1
2
H
2
+ OH
-
Bilans materiałowy dla tej przestrzeni przy przepływie 1 F:
wskutek reakcji elektrodowej
przybywa 1 gR OH
-
wskutek wędrówki jonów
przybywa
ubywa
t
gR Cl
t
+
gR K+
−
−
___________________________
Po podsumowaniu:
1 gR OH
-
+ t
+
gR K
+
- t
-
gR Cl
-
.
Po zastąpieniu t
+
(K
+
) przez (1 - t
-
)(K
+
) otrzymujemy:
1
1
1
gR OH
gR K
t gR K
t gR KCl
gR K OH t gR K Cl
−
+
−
+
−
−
+
−
−
=
−
Z przestrzeni katodowej ubywa t
-
gR KCl. Ubytek liczby moli KCl z przestrzeni katodowej obliczymy
z zależności:
( )
∆ n Q t Cl
mola
= ⋅
= ⋅
⋅
=
⋅
−
−
−
1 10
0 51 51 10
2
3
,
,

W 100 cm
3
roztworu katodowego znajdowało się 0 010 mola KCl, ubyło 5,1
⋅10
-3
mola, pozostało
zatem 0,0049 mola KCl. Stężenie końcowe KCl w roztworze katodowym wynosi 0,049 mol
⋅dm
-3
.
4.8.
Przed elektrolizą przestrzeń anodowa aparatu Hittorfa zawierała 10,42g CdSO
4
w 1 kg
wody. Przepuszczono ładunek 1,5
⋅10
-3
F. Liczba przenoszenia jonu Cd
2+
w CdSO
4
wynosi 0,37.
M(CdSO
4
) = 208,4 g
⋅mol
-1
.
Zapisać bilans materiałowy i obliczyć molalność siarczanu kadmu w przestrzeni anodowej
zawierającej 50 g H
2
O w przypadku, gdy:
a) anoda jest platynowa,
b) anoda jest kadmowa.
Rozwiązanie
a) Reakcja zachodząca podczas elektrolizy CdSO
4
na anodzie platynowej jest reakcją rozkładu wody z
wydzieleniem tlenu.
1
2
H
2
O
→
1
4
O
2
+ H
+
+ e
Bilans materiałowy dla przestrzeni anodowej przy przepływie 1 F ładunku przedstawia się
następująco:
wskutek reakcji elektrodowej do przestrzeni anodowej przybywa 1 gR H
+
wskutek wędrówki jonów
przybywa t
gR SO
ubywa
t
gR Cd
−
+
−
+
4
2
2
___________________________
Po podsumowaniu:
1 gR H
+
+ t
-
gR SO
4
2-
- t
+
gR Cd
2+
Zastępując t
-
przez 1 - t
+
otrzymujemy:
1
1
1
4
2
2
4
2
2
4
4
gR H
gR SO
t gR Cd
t gR SO
gR H SO
t gR CdSO
+
−
+
+
+
−
+
+
−
−
=
−
Z
przeprowadzonego bilansu wynika, że ze zmiany liczby gramorównoważników CdSO
4
w przestrzeni
anodowej możemy obliczyć liczbę przenoszenia jonów Cd
2+
. Liczba przenoszenia jonów Cd
2+
dana
jest zależnością:
(
)
t Cd
n
Q
2
+
=
∆
gdzie:
∆ n - ubytek CdSO
4
wyrażony w gramorównoważnikach,
Q - ładunek, który przepłynął przez roztwór.
Ponieważ znana jest liczba przenoszenia jonu Cd
2+
oraz ładunek, możemy obliczyć
∆ n.
(
)
∆ n Q t Cd
gR CdSO
= ⋅
=
⋅
⋅
=
⋅
+
−
−
2
3
4
4
15 10
0 37 5 55 10
,
,
,
co odpowiada 2,775
⋅10
-4
mola CdSO
4
.
Obliczamy początkową zawartość CdSO
4
w 50 g H
2
O.
W 1kg H
2
O znajdowało się
10 42
208 4
0 05
,
,
,
=
mola CdSO
4
W 50 g H
2
O znajdowało się
0 05
20
0 0025
,
,
=
mola CdSO
4
.
Wskutek elektrolizy ubyło 2,775
⋅10
-4
mola CdSO
4
, stąd po elektrolizie w 50 g H
2
O znajduje się
2,5
⋅10
-3
- 0,2775
⋅10
-3
= 2,2225
⋅10
-3
mola CdSO
4
. W 1000 g H
2
O po elektrolizie znajduje się 0,04445
mola CdSO
4
.
b) Reakcja zachodząca na kadmowej anodzie jest reakcją utleniania kadmu do jonów Cd
2+
:
1
2
Cd
→
1
2
Cd
2+
+ e
Bilans materiałowy przestrzeni anodowej.
Wskutek reakcji elektrodowej przybywa 1 gR Cd
2+

Wskutek wędrówki jonów
przybywa
gR SO
ubywa
gR Cd
t
t
−
−
+
+
4
2
2
Po uwzględnieniu, że 1 gR Cd
2+
- t
+
gR Cd
2+
= +t
-
gR Cd
2+
, okazuje się, że do przestrzeni anodowej
przybyło t
-
gR CdSO
4
.
W tym przypadku słuszna będzie zależność:
(
)
t SO
n
Q
4
2
−
=
∆
Ponieważ t(SO
4
2-
) = 1 - t(Cd
2+
) = 1 - 0,37 = 0,63, zatem
∆n (przybytek liczby gramorównoważników
CdSO
4
) wynosi 0,63
⋅1,5⋅10
-3
= 0,945
⋅10
-3
gR CdSO
4
, czyli 0,4725
⋅ 10
-3
moli CdSO
4
.
Uwzględniając obliczenia wykonane w punkcie a) otrzymujemy, że liczba moli CdSO
4
w 50 g H
2
O
po elektrolizie wynosi 2,5
⋅ 10
-3
+ 0,4725
⋅ 10
-3
= 2,9725
⋅10
-3
moli, co odpowiada zawartości 0,05945
mola w 1000 g H
2
O.
4.9.
Zapisać reakcję zachodzącą w ogniwie:
Ag | AgCl
(s) | HCl(aq) | H
2
(1,013
⋅10
5
Pa) |Pt
oraz obliczyć jej stałą równowagi w temperaturze 298 K korzystając z danych literaturowych.
Rozwiązanie
Według zalecanej przez UIPAC (International Union of Pure and Applied Chemistry)
konwencji półogniwo umieszczone po stronie lewej stanowi anodę, a półogniwo umieszczone po
stronie prawej katodę ogniwa. Na anodzie zachodzi reakcja utleniania, a na katodzie reakcja redukcji.
Reakcje elektrodowe:
Katoda:
H
+
+ e =
1
2
H
2
Anoda:
Ag
+
Cl
-
= AgCl(s) + e
_____________________________________________
Reakcja sumaryczna: Ag + H
+
+ Cl
-
=
1
2
H
2
+ AgCl
Stałą równowagi reakcji zachodzącej w ogniwie obliczamy, wykorzystując związki pomiędzy
standardową entalpią swobodną (
∆G
o
) a standardową siłą elektromotoryczną (E
o
)
∆G
o
= -zFE
o
gdzie:
z - liczba wymienionych elektronów podczas reakcji,
F - stała Faradaya równa 96500 C,
oraz związek pomiędzy standardową entalpią swobodną a stałą równowagi reakcji (K)
∆G
o
= - RT lnK
gdzie:
T - temperatura w Kelwinach,
R - stała gazowa.
Porównanie lewych stron obu równań daje zależność:
ln K
zF
RT
E
o
=
Standardową siłę elektromotoryczną ogniwa obliczamy zgodnie ze stosowaną konwencją jako różnicę
potencjałów standardowych półogniwa prawego i lewego.
E
o
= E
o
p
- E
o
l
= E
o
(H
+
| H
2
|Pt) - E
o
(Ag | AgCl | Cl
-
)
Wartości potencjałów standardowych półogniw w Poradniku fizykochemicznym wynoszą:

E
o
298K
(H
+
|H
2
) = 0 V i E
o
298K
(Ag | AgCl | Cl
-
) = 0,222 V
stąd standardowa
siła elektromotoryczna ogniwa wynosi:
E
o
298K
= 0 - 0,222 = -0,222 V
Po wstawieniu tej wartości do wzoru na stałą równowagi otrzymujemy:
(
)
ln
,
,
,
K
=
⋅
⋅
⋅ −
= −
1 96500
8 314 298
0 222
8 647
Stała równowagi reakcji zachodzącej w ogniwie wynosi K = 1,76
⋅10
-4
.
4.10
.
Obliczyć iloczyn rozpuszczalności PbSO
4
w temperaturze 298 K mając dane:
E
o
298
(Pb
2+
| Pb) = -0,126 V,
E
o
298
(Pb | PbSO
4
|SO
4
2-
) = -0,359 V.
Rozwiązanie
Iloczyn
rozpuszczalności (I
r
), czyli stała równowagi reakcji
PbSO
4
(s) = Pb
2+
+ SO
4
2-
(4.10.1)
związana jest ze zmianą entalpii swobodnej reakcji zależnością:
∆G
o
1
= - RT ln I
r
Zapisujemy reakcje elektrodowe półogniw i odpowiadające im wartości
∆G
o
w ten sposób, aby po ich
dodaniu otrzymać reakcję (4.10.1).
PbSO
4
+ 2e = Pb + SO
4
2-
(4.10.2)
∆G
o
2
= -2FE
o
(Pb | PbSO
4
| SO
4
2-
) = -2F(-0,359)
Pb = Pb
2+
+ 2e (4.10.3)
∆G
o
3
= -2F(-E
o
(Pb
2+
| Pb)) = -2F
⋅0,126
Ponieważ reakcję elektrodową zapisano jak reakcję utleniania, a potencjały standardowe są
potencjałami dla reakcji redukcji, zmieniono zatem znak potencjału standardowego półogniwa.
Dodanie reakcji (4.10.2) i (4.10.3) daje reakcję (4.10.1), zatem:
∆G
o
1
=
∆G
o
2
+
∆G
o
3
.
Po podstawieniu:
-RT ln I
r
= +2F
⋅0,359 - 2F⋅0,126 ⇒ I
r
= 1,31
⋅10
-8
4.11.
Zamierzamy wyznaczyć potencjometrycznie stężenie jonów Sn
4+
w roztworze. Dobierz
czynnik miareczkujący i uzasadnij jego wybór. Do dyspozycji mamy następujące układy utleniająco-
redukujące:
a) Cr
3+
| Cr
2+
⇒ E
o
298
= -0,58 V
b) Cu
2+
| Cu
+
⇒ E
o
298
= 0,15 V
c) Fe
3+
| Fe
2+
⇒ E
o
298
= 0,771 V
Potencjał standardowy półogniwa Sn
4+
| Sn
2+
= 0,15 V.
Rozwiązanie
Podczas miareczkowania potencjometrycznego jony Sn
4+
mają być redukowane do Sn
2+
.
Zatem czynnik miareczkujący powinien charakteryzować się silnymi własnościami redukującymi.
Własności redukujące półogniw są tym większe, im niższy jest potencjał standardowy półogniwa. W
tym przypadku półogniwem o najniższym potencjale jest półogniwo Cr
3+
| Cr
2+
.
Podczas miareczkowania potencjometrycznego będzie zachodziła reakcja:
Sn
4+
+ 2Cr
2+
= Sn
2+
+ 2Cr
3+
Wyznaczenie punktu równoważnikowego miareczkowania będzie tym łatwiejsze, im większa będzie
różnica między potencjałami standardowymi obu użytych układów utleniająco-redukujących, a wobec
zależności
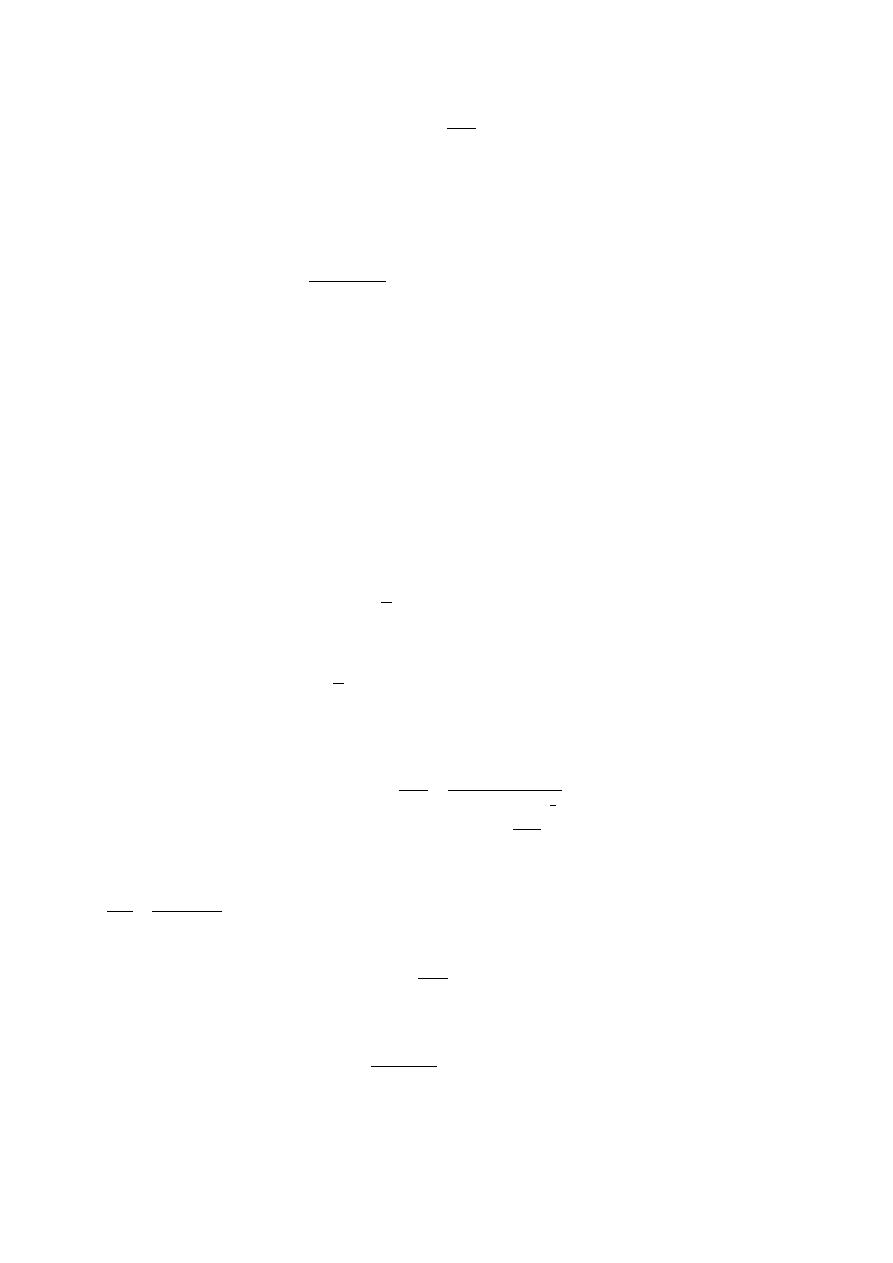
ln K
zF
RT
E
o
=
im większa będzie stała równowagi reakcji.
Różnica potencjałów standardowych będzie równa różnicy potencjału katody (zachodzi na niej reakcja
redukcji) i anody (reakcja utleniania).
Stąd E
o
= E
o
(Sn
4+
| Sn
2+
) - E
o
(Cr
3+
| Cr
2+
) = 0,15 - (-0,58) = 0,73 V.
Po podstawieniu wartości E
o
do wzoru na stałą równowagi otrzymamy:
ln
,
,
,
,
K
K
=
⋅
⋅
⋅
=
⇒
=
⋅
2 96500
8 314 298
0 73 56 87
4 97 10
24
Ta bardzo duża wartość stałej równowagi wskazuje, że w punkcie równoważnikowym, czyli w stanie
równowagi, zdecydowanie dominują produkty reakcji, czyli praktycznie występują tylko jony Sn
2+
.
4.12.
Mamy ogniwo:
Pt | H
2
(1,013
⋅10
5
Pa) | HBr(0,01 mol
⋅kg
-1
) | AgBr(s) | Ag
a) Zapisać reakcję zachodzącą w ogniwie.
b) Obliczyć siłę elektromotoryczną ogniwa w temperaturze 298 K.
c) Obliczyć
∆G, ∆H i ∆S reakcji zachodzącej w ogniwie wiedząc, że
dE/dT = 0,002 V
⋅K
-1
.
Potencjał standardowy półogniwa Ag | AgBr | Br
-
wynosi 0,071V w temperaturze 298 K.
Rozwiązanie
a) W ogniwie przebiegają następujące reakcje:
anoda:
1
2
H
2
= H
+
(m) + e
katoda:
AgBr(s) + e = Ag + Br
-
(m)
______________________________________________________
reakcja sumaryczna
1
2
H
2
+ AgBr(s) = H
+
(m) + Br
-
(m) + Ag
b) Równanie Nernsta dla danego przypadku ma postać:
[ ][ ]
[ ]
[
]
E E
RT
F
H
Br
Ag
AgBr
P
P
o
H
s
=
−
⋅
+
−
1
2
1
2
ln
Wziąwszy pod uwagę, że stężenia faz stałych przyjmujemy jako równe 1, a wyrażenie
P
P
H
s
2
1013 10
1013 10
1
5
5
=
⋅
⋅
=
,
,
, otrzymujemy ostatecznie zależność:
[ ][ ]
E E
RT
F
H
Br
o
=
−
⋅
+
−
1
ln
gdzie:
E
o
= E
o
p
- E
o
l
=E
o
(Ag | AgBr | Br
-
) - E
o
(H
2
| H
+
) = 0,071 - 0 = 0,071 V.
Stąd
(
)
E
V
=
−
⋅
⋅
⋅
=
0 071
8 31 298
1 96500
0 01 0 01
0 307
,
,
ln ,
,
,
c) Związek między zmianą entalpii swobodnej a siłą elektromotoryczną ogniwa ma postać:
∆G
zFE
= −
Po
podstawieniu:
∆G
J
kJ
= − ⋅
⋅
= −
= −
1 96500 0 307
29625
29 625
,
,
Zmiana entropii reakcji zachodzącej w ogniwie dana jest wyrażeniem:
∆S zF
dE
dT
=
po podstawieniu otrzymujemy:
∆S
J K
= ⋅
⋅
=
⋅
−
1 96500 0 002 193
1
,
Zmianę entalpii reakcji znajdziemy z zależności:
∆G = ∆H - T∆S
stąd
∆H = ∆G + Τ∆S
Po podstawieniu:
∆H = -29625 + 298 ⋅ 193 = 27889 J
ZADANIA
4.1.
Obliczyć graniczne przewodnictwo równoważnikowe AgNO
3
na podstawie znanych
granicznych przewodnictw równoważnikowych AgIO
3
, KIO
3
i KNO
3
, równych w 298K odpowiednio:
102,7; 114,3 i 144,9 S
⋅cm
2
⋅mol
-1
.
4.2.
Wiedząc, że
Λ
o
(AgNO
3
) = 133,3,
λ
o
(K
+
) = 73,5 S
⋅cm
2
⋅mol
-1
oraz t
o
(Ag
+
) = 0,464, obliczyć:
a) graniczne przewodnictwa równoważnikowe jonów Ag
+
i NO
3
-
,
b) liczbę przenoszenia jonu K
+
w bardzo rozcieńczonym roztworze KNO
3
.
4.3.
Zmieszano 100 cm
3
wodnego roztworu NaCl o stężeniu 0,01 mol
⋅dm
-3
i 100 cm
3
roztworu
HCl o stężeniu 0,01 mol
⋅dm
-3
. Przewodnictwa równoważnikowe jonów Na
+
, H
+
i Cl
-
wynoszą
odpowiednio: 45; 330 i 70 S
⋅cm
2
⋅mol
-1
.
Obliczyć:
a) przewodnictwo właściwe otrzymanego roztworu,
b) liczbę przenoszenia jonu Cl
-
w tym roztworze.
4.4.
Zmieszano 200 cm
3
roztworu AgNO
3
o stężeniu 0,03 mol
⋅dm
-3
oraz 100 cm
3
NaCl o
stężeniu 0,06 mol
⋅dm
-3
. Przewodnictwa równoważnikowe jonów Na
+
i NO
3
-
wynoszą odpowiednio: 45
i 65 S
⋅cm
2
⋅mol
-1
.
Obliczyć:
a) przewodnictwo właściwe otrzymanego roztworu,
b) liczbę przenoszenia jonu Na
+
w tym roztworze.
4.5.
Miareczkując konduktometrycznie 200 cm
3
roztworu NH
4
OH za po-mocą roztworu HCl o
stężeniu 0,5 mol
⋅dm
-3
otrzymano następujące wyniki:
HCl [cm
3
]
0 2,0 4,0 6,0 8,0 10,0
κ⋅10
3
[S
⋅cm
-1
]
0,41 2,65 4,86 7,09 14,0 21,3
Obliczyć liczbę moli NH
4
OH zawartą w roztworze wyjściowym oraz jego stężenie.
4.6.
Miareczkując konduktometrycznie 50 cm
3
roztworu kwasu octowego (CH
3
COOH)
roztworem NH
4
OH o stężeniu 1 mol
⋅dm
-3
otrzymano następujące wyniki:
NH
4
OH [cm
3
]
0 2,0 4,0 6,0 8,0 10,0
Rezystancja roztworu [
Ω] 97,0 74,0 51,5 40,5 41,0 42,5

Obliczyć liczbę moli CH
3
COOH zawartą w roztworze wyjściowym oraz jego stężenie.
4.7.
Podczas elektrolizy roztworu CuSO
4
przyrost masy platynowej katody wyniósł 0,6354 g.
Obliczyć:
a) Jaki ładunek przepłynął przez roztwór?
b) Jak zmieniła się masa miedzianej anody?
c) Jak zmieniłaby się masa platynowej katody, gdyby ten sam ładunek przepłynął przez roztwór
AgNO
3
?
M(Cu) = 63,54, M(Ag) = 107,9g
⋅mol
-1
.
4.8.
Podczas elektrolizy wodnego roztworu Na
2
SO
4
na elektrodach platynowych w naczyniu, w
którym przestrzenie anodowa i katodowa są rozdzielone, zebrano znad przestrzeni katodowej gaz,
który w warunkach normalnych zajmuje objętość 44,8 cm
3
.
a) Określić, jaki to gaz oraz jaki ładunek przepłynął przez roztwór.
b) Jaka substancja i w jakiej ilości wydzieli się w tych warunkach na anodzie?
4.9.
W naczyniu Hittorfa znajduje się roztwór AgNO
3
o stężeniu 0,2 mol
⋅dm
3
, a elektrody
wykonane są z platyny. Po elektrolizie okazało się, że roztwór katodowy, którego było 100 cm
3
,
zawiera AgNO
3
o stężeniu 0,1894 mol
⋅dm
-3
. Przestrzeń anodowa o objętości 100 cm
3
zawierała po
elektrolizie kwas azotowy o stężeniu 0,02 mol
⋅dm
-3
Napisać reakcje elektrodowe oraz bilanse materiałowe dla przestrzeni katodowej i anodowej
przy przepływie ładunku 1 F . Obliczyć liczbę przenoszenia jonu Ag
+
w AgNO
3
.
4.10.
W aparacie Hittorfa, w którym katoda i anoda są miedziane, znajduje się roztwór CuSO
4
o
stężeniu 0,05 mol
⋅dm
-3
. Po przepłynięciu ładunku 4
⋅10
-3
F do przestrzeni anodowej wskutek reakcji
elektrodowej i wędrówki jonów przybyło 1,2
⋅10
-3
mola CuSO
4
. Obliczyć liczbę przenoszenia jonu
Cu
2+
w tym roztworze oraz końcowe stężenia CuSO
4
w przestrzeniach katodowej i anodowej. W obu
przestrzeniach znajdowało się po 200 cm
3
roztworu.
4.11.
W aparacie Hittorfa o platynowych elektrodach poddano elektrolizie wodne roztwory
HNO
3
, NaOH i ZnSO
4
.
Zapisać reakcje elektrodowe oraz bilanse materiałowe dla przestrzeni katodowej i anodowej przy
przepływie ładunku 1 F. Wskazać, którą z liczb przenoszenia można wyznaczyć na podstawie zmian
ilościowych elektrolitu w przestrzeni katodowej, spowodowanych elektrolizą.
4.12.
Zapisać reakcje zachodzące w ogniwach oraz obliczyć wartości standardowych sił
elektromotorycznych korzystając z danych literaturowych.
a) Pb | PbSO
4
(s) | H
2
SO
4
(aq) | H
2
| Pt
b) Zn | ZnSO
4
||CuSO
4
| Cu
c) Pt | H
2
| HBr
(aq) | AgBr(s) | Ag
d) Pt |SnCl
4
, SnCl
2
||FeCl
2
, FeCl
3
| Pt
4.13.
Zapisać ogniwa, w których zachodzą następujące reakcje:
a) AgCl +
1
2
H
2
= Ag + HCl
b) Pb + H
2
SO
4
= PbSO
4
(s) + H
2
c) FeCl
2
+
1
2
Hg
2
Cl
2
= FeCl
3
+ Hg
4.14.
Mamy ogniwo:
Cu | CuBr
2
(aq) | AgBr(s) | Ag
.

Potencjały standardowe półogniw wynoszą odpowiednio:
E
o
298
(Cu
2+
| Cu) = 0,340 V,
E
o
298
(Ag | AgBr(s) | Br
-
) = 0,071 V.
a) Zapisz reakcję zachodzącą w ogniwie.
b) Oblicz E
o
298
tego ogniwa.
c) Co można powiedzieć o kierunku przebiegu reakcji w czasie pracy ogniwa? Przy jakim stężeniu
CuBr
2
nastąpi odwrócenie kierunku reakcji?
4.15.
Standardowa siła elektromotoryczna ogniwa :
Pb | PbSO
4
(s) | H
2
SO
4
(0,01 mol
⋅kg
-1
) | H
2
(1,015
⋅10
5
Pa)
| Pt
wynosi 0,359 V.
a) Zapisać reakcję zachodzącą w ogniwie.
b) Obliczyć siłę elektromotoryczną ogniwa w temperaturze 298 K.
c) Obliczyć
∆G
o
,
∆H
o
i
∆S
o
reakcji zachodzącej w ogniwie w temperaturze 298 K wiedząc, że
współczynnik dE
o
/dT = 0,002 V
⋅K
-1
.
4.16
.
W ogniwie:
Sn | Sn
2+
(m
1
)||Pb
2+
(m
2
) | Pb
m
1
= 0,01 mol
⋅kg
-1
, m
2
= 0,02 mol
⋅kg
-1
,
potencjały standardowe półogniw wynoszą odpowiednio:
E
o
298
(Sn
2+
| Sn) = -0,136 V,
E
o
298
(Pb
2+
| Pb) = - 0,126 V.
a) Obliczyć siłę elektromotoryczną ogniwa w temperaturze 298 K i wskazać kierunek biegu reakcji
zachodzącej w ogniwie.
b) Czy kierunek biegu reakcji zmieni się, gdy stężenie m
1
zwiększymy dziesięć razy
(m
1
= 0,1 mol
⋅kg
-1
)?
4.17.
Zapisać reakcję zachodzącą w ogniwie
Ag | Ag
2
SO
4
(s)|H
2
SO
4
| H
2
| Pt
oraz obliczyć wartość jej stałej równowagi w temperaturze 298 K korzystając z danych literaturowych.
4.18.
W ogniwie
Zn | ZnSO
4
(m
1
)||FeSO
4
(m
2
) | Fe
m
1
= 0,02 mol
⋅kg
-1
, m
2
= 0,01 mol
⋅kg
-1
,
potencjały standardowe półogniw wynoszą odpowiednio:
E
o
298
(Zn
2+
| Zn) = -0,763 V,
E
o
298
(Fe
2+
| Fe) = -0,440 V.
a) Zapisać reakcję zachodzącą w ogniwie.
b) Obliczyć siłę elektromotoryczną ogniwa w temperaturze 298 K i wskazać
kie
runek biegu reakcji
zachodzącej w ogniwie.
c) Czy kierunek biegu reakcji zachodzącej w ogniwie zmieni się, gdy zwiększymy
dziesięciokrotnie stężenie ZnSO
4
(m
1
= 0,2 mol
⋅kg
-1
)?
4.19.
Obliczyć standardowy potencjał półogniwa Ag | AgI | I
-
mając dane:
E
o
298
(Ag
+
| Ag) = 0,800 V oraz iloczyn rozpuszczalności AgI; I
r
= 8,1
⋅10
-17
.
4.20.
Spośród podanych niżej układów utleniająco-redukujących wybrać układ mogący posłużyć
do oznaczenia stężenia jonów V
2+
na drodze miareczkowania potencjometrycznego.
a) Cr
3+
| Cr
2+
⇒ E
o
298
(Cr
3+
| Cr
2+
| Pt) = -0,58 V,
b) Cu
2+
| Cu
+
⇒ E
o
298
(Cu
2+
| Cu
+
| Pt) = 0,15 V,
c) Sn
4+
| Sn
2+
⇒ E
o
298
(Sn
4+
| Sn
2+
| Pt) = 0,15 V.
Potencjał standardowy półogniwa V
3+
| V
2+
wynosi -0,225 V. Odpowiedź uzasadnić.

4.21.
Czy można oznaczyć stężenie jonów Fe
3+
na drodze miareczkowania potencjometrycznego,
redukując je jonami Sn
2+
? Odpowiedź uzasadnić, np. przez wyznaczenie stałej równowagi
zachodzącej reakcji. Wykorzystać wartości potencjałów elektrodowych podanych w zadaniu
przykładowym nr 4.11.
ODPOWIEDZI DO ZADAŃ
4.1.
Λ
o
(AgNO
3
) = 133,3 S
⋅cm
2
⋅mol
-1
4.2.
a)
λ
ο
(Ag
+
) = 61,85 S
⋅cm
2
⋅mol
-1
;
λ
o
(NO
3
-
) = 71,45 S
⋅cm⋅mol
-1
;
b) t (K
+
) = 0,507.
4.3.
κ = 2,575⋅10
-3
S
⋅cm
-1
; t (Cl
-
) = 0,272.
4.4.
a)
κ = 2,2⋅10
-3
S
⋅cm
-1
;
b) t (Na
+
) = 0,41.
4.5.
3
⋅10
-3
mola; c = 0,015 mol
⋅dm
-3
.
4.6.
5
⋅10
-3
mola; c = 0,1 mol
⋅dm
-3
.
4.7.
a) Q = 2
⋅10
-3
F;
b) masa anody zmniejszyła się o 0,6354 g;
c) przyrost masy wyniósłby 0,2158 g Ag.
4.8.
a) H
2
; Q = 4
⋅10
-3
F;
b)
O
2
; 22,4 cm
3
.
4.9.
t (Ag
+
) = 0,470.
4.10.
t (Cu
2+
) = 0,40; przestrzeń anodowa c(CuSO
4
) = 0,056 mol
⋅dm
-3
;
przestrzeń katodowa c(CuSO
4
) = 0,044 mol
⋅dm
-3
.
4.11.
Roztwór HNO
3
⇒ t (NO
3
-
); roztwór NaOH
⇒ t (Na
+
); roztwór ZnSO
4
⇒ t (SO
4
2-
).
4.12.
a) 0,359 V;
b) 1,10 V;
c) 0,017 V;
d) 0,621 V.
4.14.
a) Cu + 2AgBr = 2Ag + Cu
2+
+ 2Br
-
;
b)
E
o
= -0,269 V;
c) ponieważ E
o
< 0, reakcja przebiega w kierunku tworzenia metalicznej miedzi i
bromku srebra. Zmiana kierunku reakcji nastąpi, gdy E zmieni znak na dodatni, czyli
dla
m
(CuBr
2
) < 5,83
⋅10
-4
mol
⋅kg
-1
.
4.15.
b) E = 0,199 V;
c)
∆G
o
298
= -69,287 kJ;
∆S
o
298
= 386 J
⋅K
-1
;
∆H
o
298
= 45,74 kJ.
4.16.
a) E = 0,019; ponieważ E > 0, to
∆G < 0, zatem reakcja zachodzi w kierunku redukcji
jonów Pb
2+
do Pb;
b) E = -0,107 V; w tym przypadku
∆G > 0, zatem reakcja w ogniwie przebiega w
kierunku przeciwnym, to znaczy w kierunku redukcji jonów Sn
2+
do Sn.
4.17.
K = 7,5
⋅10
-23
.
4.18.
b) E = 0,314 V
⇒ ∆G < 0, reakcja biegnie w kierunku redukcji jonów Fe
2+
do Fe;
c) E = 0,284 V
⇒ ∆G < 0, kierunek reakcji jak w punkcie b).
4.19.
E
o
298
(Ag | AgI (s)| I
-
) = -0,151 V.
4.20.
b) K = 2,2
⋅10
6
lub c) K = 4,86
⋅10
12
.
4.21.
Można, stała równowagi redukcji jonów Fe
3+
jonami Sn
2+
wynosi 10
21
.

LITERATURA
1. Poradnik fizykochemiczny. Praca zbiorowa. Warszawa: WNT 1974.
2. Miszczenko K.P., Rawdiel A.A.: Zbiór wielkości fizykochemicznych. Warszawa: PWN 1974.
3. Mizerski W.: Tablice chemiczne. Warszawa: Wydawnictwo Adamantan 1993.
4. Adamson A.W.: Zadania z chemii fizycznej. Warszawa: PWN 1978.
5. Zbiór zadań z chemii fizycznej. Praca zbiorowa. Gdańsk: Wydawnictwo Politechniki Gdańskiej 1985.
Wyszukiwarka
Podobne podstrony:
chf im sem 1c
05 Konduktometria, naoh,nh3h2o,ch3cooh, Marek Mokrzycki IM sem
Polimery-IM sem.V-zagadnienia na zaliczenie, Studia, AiR, SEMESTR II, TSiIW
01 Pomiar stałych fizykochemicznych cieczy, stałe fizyko chemiczne, Marek Mokrzycki IM sem
06 Średnia Masa Cząsteczkowa Polimeru, wiskozymetria (glikol), Marek Mokrzycki IM sem
6 SEM IM Mdpsib
Chemia fizyczna - Loska, OŚ, sem II 1 SOWiG, Chemia Fizyczna, ChF laboratoria
ccs, Politechnika, Rok 2, sem 3, chf
CHF PYTANIA, OŚ, sem II 1 SOWiG, Chemia Fizyczna
Chemia fizyczna - kolokwium 1b, OŚ, sem II 1 SOWiG, Chemia Fizyczna, ChF laboratoria
tensometrosretroPOPRfinal, Politechnika, Rok 2, sem 3, chf
tensometrosretro, Politechnika, Rok 2, sem 3, chf
Chemia fizyczna - kolokwium 1a, OŚ, sem II 1 SOWiG, Chemia Fizyczna, ChF laboratoria
spis lab I sem 2010
Zastosowanie SEM
Mała chirurgia II Sem IV MOD
skórne niepożądane odczyny polekowe, 2 czesci 9 sem
więcej podobnych podstron