
1
1
2. RÓWNOWAGI FAZOWE
Zadania przykładowe
2.1.
Obliczyć wyrażenia dT/dP dla procesu parowania wody i topnienia
lodu, jeżeli ciepło parowania wody w temperaturze 100
o
C wynosi 40,66 kJ
⋅mol
-1
, a ciepło topnienia lodu wynosi 6,0 kJ
⋅mol
-1
w temperaturze 0
o
C. Gęstości lodu i
wody w temp. 0
o
C wynoszą odpowiednio 0,920 g
⋅cm
-3
i 0,999 g
⋅cm
-3
.
Rozwiązanie
Równanie Clausiusa-Clapeyrona dla przemiany ciało stałe - ciecz można
zapisać następująco:
(
)
dP
dT
H
T V
V
t
c
s
=
−
∆
(2.1.1)
gdzie:
∆H
t
- molowe ciepło topnienia lodu,
V
s
i V
c
- odpowiednio objętości molowe wody stałej i ciekłej.
( )
V
M H O
d H O
cm mol
m mol
s
s
=
=
=
=
⋅
−
−
−
(
)
(
)
,
,
,
2
2
3
1
6
3
1
18
0 920
19 565
19 565 10
(
)
V
M H O
d H O c
cm mol
m mol
c
=
=
=
=
⋅
−
−
−
(
)
( )
,
,
,
2
2
3
1
6
3
1
18
0 999
18 018
18 018 10
Przekształcamy równanie (2.1.1) i podstawiamy dane.
(
)
(
)
dT
dP
T V
V
H
K Pa
c
s
t
=
−
=
⋅
−
⋅
= −
⋅
−
−
−
−
∆
273 18 018 10
19 565 10
6000
7 04 10
6
6
8
1
,
,
,
Do obliczenia wartości dT/dP, słusznej dla zakresu temperatur bliskich tempe-
raturze wrzenia wody, skorzystamy ze zmodyfikowanego równania Clausiusa-
Clapeyrona
dP
dT
P H
RT
p
=
∆
2
st¹d

2
2
dT
dP
RT
P H
K Pa
p
=
=
⋅
⋅
⋅
=
⋅
⋅
−
−
2
2
5
4
1
8 314 373
1013 10 40660
2 81 10
∆
,
,
,
Jak widać, wpływ ciśnienia zewnętrznego na temperaturę wrzenia jest około 4
rzędy większy niż na temperaturę topnienia.
2.2.
Wyznaczyć współrzędne punktu potrójnego benzenu, jeżeli w
temp.10
o
C prężność par nad ciekłym benzenem wynosi 6170 Pa, natomiast w
temp. 0
o
C prężność par nad stałym benzenem wynosi 3330 Pa.Ciepło topnienia
benzenu wynosi 10,6 kJ
⋅mol
-1
, natomiast ciepło sublimacji 43,9 kJ
⋅mol
-1
.
Rozwiązanie
Skorzystamy z równania Clausiusa-Clapeyrona w postaci:
lg
,
P
P
H
R T
T
2
1
1
2
2 3
1
1
=
−
∆
gdzie:
∆H - jest odpowiednio ciepłem parowania lub sublimacji
.
Równanie to jest słuszne dla przemian ciecz-para i ciało stałe-para przy zało-
żeniach:
a) ciepło parowania lub sublimacji nie jest funkcją temperatury,
b) objętości fazy stałej i ciekłej są do pominięcia wobec objętości fazy gazowej,
c) pary substancji zachowują się jak gazy doskonałe.
W temperaturze punktu potrójnego (T
pp
) prężność par nad ciekłym i stałym
benzenem będzie taka sama (P
pp
).
Zapiszmy powyższe równanie dla procesu parowania i sublimacji zastępując P
1
i T
1
współrzędnymi punktu potrójnego.
lg
,
lg
,
P
P
H
R T
T
i
P
P
H
R T
T
s
pp
s
pp
s
c
pp
p
pp
c
=
−
=
−
∆
∆
2 3
1
1
2 3
1
1
Po podstawieniu danych otrzymujemy:
lg
,
lg
,
3330 43900
2 3
1
1
273
6170 33300
2 3
1
1
283
P
R T
i
P
R T
pp
pp
pp
pp
=
−
=
−
Ciepło parowania obliczamy z zależności:
∆H
p
=
∆H
s
-
∆H
t
= 43,9 - 10,6 = 33,3 kJ
⋅ mol
-1
Po rozwiązaniu układu równań otrzymujemy:
T
pp
= 278,86 K
P
pp
= 5
.
10
3
Pa

3
3
2.3.
Prężność par nad stałym VF
6
dana jest równaniem:
lg
,
,
P
T
s
=
−
⋅
12 763 25591
1
(2.3.1)
a nad ciekłym:
lg
,
,
P
T
c
=
−
⋅
9 678 15113
1
(2.3.2)
Wyznaczyć temperaturę i ciśnienie odpowiadające punktowi potrójnemu oraz
obliczyć ciepło parowania i topnienia VF
6
.
Rozwiązanie
W punkcie potrójnym prężność par nad stałym i ciekłym VF
6
jest taka
sama. Porównując zatem prawe strony przedstawionych zależności otrzymamy:
12 763 25591
1
9 678 15113
1
,
,
,
,
−
⋅
=
−
⋅
T
T
pp
pp
stąd
T
pp
=339,6 K
Podstawienie wyznaczonej temperatury punktu potrójnego do dowolnego z
równań daje nam wartość ciśnienia w punkcie potrójnym
P
pp
= 1,68
.
10
5
Pa
Zależność prężności pary nad cieczą lub fazą stałą od temperatury przy
założeniu, że ciepło parowania lub sublimacji nie zależy od temperatury, dana
jest równaniem:
ln P
H
RT
const
= −
+
∆
(2.3.3)
Zamieniając logarytm dziesiętny w równaniu (2.3.1) na naturalny otrzymujemy:
ln
,
,
,
,
P
T
s
= −
⋅
+
⋅
2 3 25591
2 3 12 763
(2.3.4)
z porównania równania (2.3.3) z równaniem (2.3.4) wynika, że
∆H
R
s
=
⋅
2 3 25591
,
,
stąd
∆H
s
= 48935 J
⋅mol
-1
= 48,94 kJ
⋅mol
-1
Postępując podobnie z równaniem (2.3.2) otrzymamy:
∆H
R
p
=
⋅
2 3 15113
,
,
stąd
∆H
p
= 28899 J
⋅mol
-1
= 28,90 kJ
⋅mol
-1
Wiadomo, że ciepło sublimacji równe jest sumie ciepeł topnienia i parowania
zatem:
∆H
t
=
∆H
s
-
∆H
p
= 48,94 - 28,90 = 20,04 kJ
⋅mol
-1

4
4
2.4.
Obliczyć ciepło parowania eteru dietylowego w normalnej
temperaturze wrzenia 307,9 K, jeżeli dP/dT = 3,53
⋅10
3
Pa
⋅
K
-1
. Obliczyć także
temperaturę wrzenia eteru dietylowego pod ciśnieniem 1020 hPa.
Rozwiązanie
Przy
założeniu, że pary eteru dietylowego zachowują się jak gaz doskonały,
i przy pominięciu objętości cieczy zmodyfikowane równanie Clausiusa-
Clapeyrona można zapisać w postaci:
dP
dT
P H
RT
p
=
∆
2
st¹d
∆H
RT
P
dP
dT
kJ mol
p
=
⋅
=
⋅
⋅
⋅
⋅
=
⋅
−
2
2
5
3
1
8 314 307 9
1013 10
3 53 10
27 47
,
,
,
,
,
Do obliczenia temperatury wrzenia eteru dietylowego pod ciśnieniem 1020 hPa
= 1,02
⋅
10
5
Pa potrzebna nam jest zależność dT/dP, a więc zmiana temperatury
wrzenia ze zmianą ciśnienia o 1 Pa.:
dP/dT = 3,53
⋅
10
3
Pa K
-1
; dT/dP = 2,832
⋅
10
-4
K
⋅Pa
-1
Poszukiwaną temperaturę wrzenia pod ciśnieniem 1,02
⋅
10
5
Pa obliczymy ze
wzoru:
T
w
(P=1,02
⋅
10
5
) = T
w
(1,013
⋅
10
5
) + (dT/dP)
⋅
∆P
zatem
T = 307,9 + 2,832
⋅
10
-4
(1,02
⋅
10
5
- 1,013
⋅
10
5
) = 308,1 K
2.5.
Ciecze A i B tworzą roztwór doskonały. Prężności par nad czystymi
składnikami wynoszą P
o
A
= 6
⋅
10
4
Pa i P
o
B
= 4
⋅
10
4
Pa w temperaturze 310 K.
Obliczyć sumaryczne ciśnienie nad roztworem, w którym ułamek molowy
składnika A wynosi 0,5 w temperaturze 310 K oraz skład par nad tym
roztworem.
Rozwiązanie
Sumaryczna
prężność par nad roztworem równa jest sumie prężności
cząstkowych składników
P = P
A
+ P
B
Prężności cząstkowe znajdziemy z prawa Raoulta
P
i
= P
o
i
⋅
X
i

5
5
gdzie:
P
o
i
- prężność pary nad czystym składnikiem,
X
i
- ułamek molowy składnika w roztworze.
Zatem:
P = P
o
A
⋅
X
A
+ P
o
B
⋅
X
B
Suma ułamków molowych składników roztworu równa jest oczywiście jedności.
Stąd:
X
B
= 1 - X
A
= 1 - 0,5 = 0,5
Po podstawieniu otrzymujemy:
P = 6
⋅
10
4
.
0,5 + 4
⋅
10
4
.
0,5 =5
⋅10
4
Pa
Ułamek molowy składnika mieszaniny gazowej (para) dany jest równaniem:
Y
A
= (P
A
/ P)
P
A
wyrazimy za pomocą znanej już zależności P
A
= P
o
A
⋅ X
A
st¹d:
Y
P
X
P
A
A
o
A
=
⋅
=
⋅
⋅
⋅
=
6 10 0 5
5 10
0 6
4
4
,
,
Y
B
= 1 - Y
A
= 0,4
2.6.
Prężność par nad roztworem doskonałym zawierającym 3 mole
składnika A i 7 moli składnika B wynosi 1
⋅
10
5
Pa w temperaturze 338 K. Do-
datek 4 moli składnika A do tego roztworu powoduje wzrost prężności par do
1,2
⋅
10
5
Pa w tej samej temperaturze. Obliczyć P
o
A
i P
o
B
oraz skład par znajdu-
jących się w równowadze z pierwszym roztworem w temperaturze 338 K.
Rozwiązanie
Ułamek molowy składnika roztworu dany jest zależnością:
X
n
n
i
i
i
=
∑
gdzie:
n
i
- oznacza liczbę moli danego składnika,
n
i
∑
- sumaryczną liczbę moli wszystkich składników roztworu.
Dla pierwszego roztworu
X
X
A
B
=
+
=
⇒
= −
=
3
3 7
0 3
1 0 3 0 7
,
,
,
dla drugiego roztworu
X
X
A
B
=
+
=
⇒
= −
=
3 4
14
0 5
1 0 5 0 5
,
,
,

6
6
Napiszmy dla obu roztworów równania na sumaryczną prężność par nad
roztworem:
10
5
= P
o
A
.
0,3 + P
o
B
.
0,7
1,2
.
10
5
= P
o
A
.
0,5 + P
o
B
.
0,5
Rozwiązanie układu równań daje:
P
o
A
= 1,7
⋅
10
5
Pa
P
o
B
= 7
⋅
10
4
Pa
Skład par znajdujących się w równowadze z pierwszym roztworem (X
A
=0,3)
znajdziemy z zależności:
Y
P
P
P X
A
A
A
o
A
=
=
⋅
=
⋅
⋅
=
10
1 7 10 0 3
10
0 51
5
5
5
,
,
,
Y
B
= 0 49
,
2.7.
Ciecze A i B tworzą roztwór doskonały. Roztwór zawierający
początkowo 0,3 mola A i 0,7 mola B poddano destylacji. Po osiągnięciu tempe-
ratury 80
o
C okazało się, że ułamek molowy składnika B w pozostałości (X’
B
) wynosi 0,6, natomiast w destylacie (Y
B
) 0,8. Obliczyć liczbę moli destylatu i
cieczy pozostałej.
Rozwiązanie
Bilans
materiałowy składnika B w układzie przedstawia równanie:
n
⋅
X
B
= n
p
⋅
Y
B
+ n
c
⋅
X'
B
(2.7.1)
gdzie:
n - sumaryczna liczba moli,
n
p
- liczba moli pary,
n
c
- liczba moli pozostałej cieczy,
zatem: n
⋅ X
B
- liczba moli składnika B w układzie,
n
p
⋅Y
B
- liczba moli składnika B w destylacie,
n
c
⋅X'
B
- liczba moli składnika B w pozostałości po destylacji.
Jeżeli równanie (2.7.1) uzupełnimy zależnością
n = n
p
+ n
c
to otrzymamy układ równań, który zastosujemy do obliczenia szukanych
wielkości.
(n
p
+ n
c
)
⋅ 0,7 = n
p
⋅
0,8 + n
c
⋅ 0,6
n
p
+ n
c
= 1
Rozwiązując ten układ równań otrzymamy liczbę moli destylatu: n
p
= 0,5 mola i
cieczy pozostałej n
c
= 0,5 mola.

7
7
2.8.
Obliczyć prężność pary w temperaturze 100
o
C nad roztworem zawie-
rającym 51,35 g sacharozy (M=342 g
⋅mol
-1
) w 1000 g H
2
O. Jaka jest tempe-
ratura wrzenia pod ciśnieniem normalnym tego roztworu, jeżeli stała ebulio-
skopowa wody wynosi 0,516 K
⋅kg⋅mol
-1
? Zakładamy, że roztwór sacharozy w
wodzie jest roztworem doskonałym.
Rozwiązanie
Aby
obliczyć prężność pary nad roztworem, skorzystamy ze wzoru:
P
P
P
X
o
o
−
=
2
(2.8.1)
gdzie:
P
o
- prężność pary czystego rozpuszczalnika (woda),
P - prężność pary nad roztworem,
X
2
- ułamek molowy substancji rozpuszczonej.
Wszystkie wielkości odnoszą się do tej samej temperatury.
Obliczamy ułamek molowy sacharozy w wodzie (X
2
)
X
n
n
n
m
M
m
M
m
M
s
s
w
s
s
s
s
w
w
2
=
+
=
+
gdzie:
n, m i M - oznaczają odpowiednio liczbę moli, masę i molową masę cząsteczkową.
Po podstawieniu otrzymujemy:
X
2
3
5135
342
5135
342
1000
18
2 695 10
=
+
=
⋅
−
,
,
,
Po podstawieniu otrzymanej wartości do równania (2.8.1) mamy:
1013 10
1013 10
2 695 10
5
5
3
,
,
,
⋅
−
⋅
=
⋅
−
P
Stąd szukana prężność pary wynosi 1,010
⋅
10
5
Pa.
Temperaturę wrzenia tego roztworu znajdziemy wykorzystując zależność
∆T = K
e
⋅
m
(2.8.2)
gdzie:
∆T - jest różnicą temperatur wrzenia roztworu i czystego rozpuszczalnika,
K
e
- stałą ebulioskopową rozpuszczalnika (woda),
m - molalnością.

8
8
Równanie (2.8.2) jest słuszne dla roztworów rozcieńczonych, a ponadto
spełniane jest wyłącznie przez substancje nie dysocjujące i nie asocjujące w
roztworze.
Obliczamy molalność, czyli liczbę moli substancji rozpuszczonej w 1000 g
wody.
m
mol kg
=
=
⋅
−
5135
342
0150
1
,
,
Obliczamy podwyższenie temperatury wrzenia
∆T = K
e
⋅
m = 0,516
⋅
0,150 = 0,0774 K
Zatem temperatura wrzenia roztworu wynosi 100,077
o
C
≈ 100,08
o
C.
2.9.
Obliczyć obniżenie temperatury krzepnięcia wodnych roztworów
zawierających w 1000 g H
2
O:
a) 0,6006 g mocznika (nieelektrolit) (NH
2
)
2
CO,
b) 0,5845 g chlorku sodowego (mocny elektrolit),
c) 0,6006 g mocznika i 0,5845 g chlorku sodowego.
Stała krioskopowa wody wynosi 1,86 K
⋅kg⋅mol
-1
.
Rozwiązanie
Skorzystamy z zależności na obniżenie temperatury krzepnięcia.
∆T = K
k
⋅
m
⋅ i
gdzie:
K
k
- stała krioskopowa rozpuszczalnika,
m - molalność substancji rozpuszczonej,
i - współczynnik izotoniczny równy:
i = 1 +
α(ν - 1), przy czym α jest stopniem dysocjacji, a ν liczbą jonów , na które dyso-
cjuje substancja rozpuszczona. Współczynnik izotoniczny przyjmuje wartość od 1, gdy
substancja rozpuszczona jest nieelektrolitem, do
ν w sytuacji, gdy α = 1.
a) Mocznik jest nieelektrolitem (
α = 0) zatem i = 1.
Molalnoœć wynosi:
m
mol kg
=
=
⋅
−
0 6006
60 06
0 01
1
,
,
,
st¹d
∆T = K
k
⋅ m = 1,86 ⋅ 0,01 = 0,0186 K
b) Chlorek sodowy dysocjuje na dwa jony i jeżeli
α = 1, to i = 2.
Molalność chlorku sodowego wynosi:
m
mol kg
=
=
⋅
−
0 5845
58 45
0 01
1
,
,
,

9
9
st¹d
∆T = K
k
⋅ m ⋅ i
= 1,86
⋅ 0,01 ⋅ 2 = 0,0372 K
c) Obniżenie temperatury krzepnięcia mieszaniny będzie sumą wartości
otrzymanych w punkcie a) i b).
∆T = 0,0186 + 0,0372 = 0,0558 K
2.10
.
Rozpuszczono 3 g nieznanej substancji w 100 g wody. Stwierdzono,
że roztwór krzepnie w temperaturze -0,401
o
C, a wrze w 100,111
o
C. Obliczyć
molową masę cząsteczkową nieznanej substancji oraz ciepło topnienia i paro-
wania wody, jeżeli ciepło sublimacji wody wynosi 46,4 kJ
⋅
mol
-1
.
Przyjmujemy, że czysta woda krzepnie w warunkach zadania w 0,0
o
C, a wrze w
100,0
o
C.
Rozwiązanie
Mamy tu do czynienia z obniżeniem temperatury krzepnięcia oraz
podwyższeniem temperatury wrzenia. Jeżeli przyjmiemy, że roztwór jest
rozcieńczony, to słuszne są zależności:
∆T
k
= K
k
⋅ m ,
∆T
e
= K
e
⋅ m
gdzie: stała krioskopowa K
k
i ebulioskopowa K
e
dane są zależnościami:
K
RT M
H
k
k
t
=
⇒
2
1000
186
∆
,
oraz
K
RT M
H
e
w
p
=
2
1000
∆
T
k
i T
w
są odpowiednio równe temperaturom krzepnięcia i wrzenia rozpusz-
czalnika.
∆H
p
i
∆H
t
są molowymi ciepłami parowania i topnienia rozpusz-
czalnika. M jest masą molową rozpuszczalnika.
Po podstawieniu do równań na obniżenie temperatury krzepnięcia i
podwyższenie temperatury wrzenia wyrażeń na stałą krioskopową i
ebulioskopową uzyskamy zależności:
∆
∆
T
RT M
H
m
k
k
t
=
⋅
⋅
2
1000
oraz
∆
∆
T
RT M
H
m
e
w
p
=
⋅
⋅
2
1000
Po podzieleniu równań stronami przez siebie otrzymujemy:
∆
∆
∆
∆
∆
∆
∆
∆
T
T
T
H
T
H
H
H
T
T
T
T
k
e
k
p
w
t
p
t
k
e
w
k
=
⋅
⋅
⇒
=
⋅
2
2
2
2
st¹d
∆
∆
H
H
p
t
=
⋅
⋅
=
0 401 373
0111 273
6 74
2
2
,
,
,
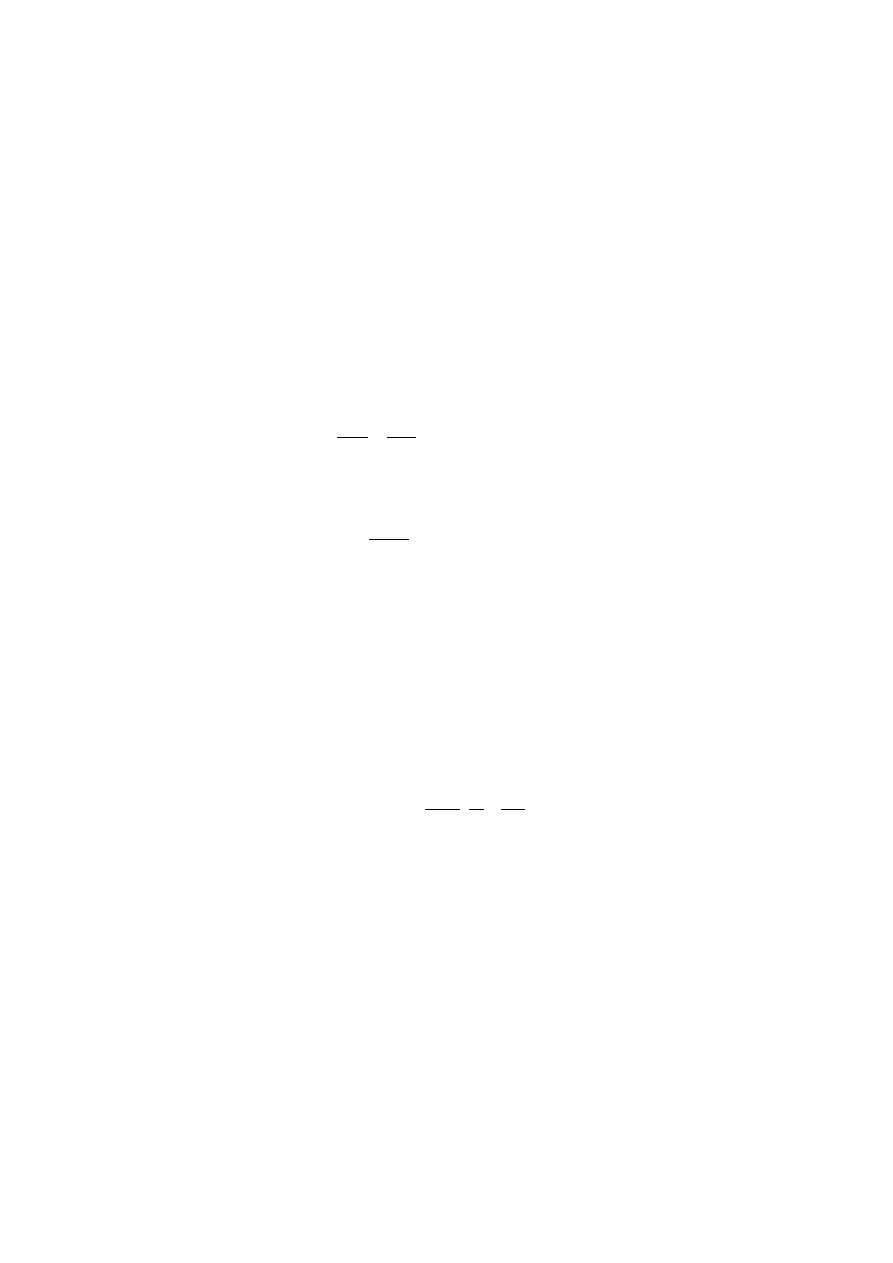
10
10
Ponieważ suma ciepeł topnienia i parowania równa jest wartości ciepła sublima-
cji, możemy zapisać układ równań:
∆H
p
= 6,74
.
∆H
t
;
∆H
p
+
∆H
t
= 46,4
st¹d: H
t
= 6,0 kJ
H
p
= 40,44 kJ
⋅mol
-1
Aby obliczyć masę molową nieznanej substancji, skorzystać możemy z jednej z
podanych uprzednio zależności, np.
∆T
t
=K
k
⋅ m. Wyliczona stała krioskopowa
ma wartość 1,86, stąd molalność
m
T
K
mol kg H O
t
k
=
=
=
⋅
−
∆
0 4
186
0 215
1
2
,
,
,
Jak wynika z treści zadania, 3 g substancji rozpuszczono w 100 g H
2
O, zatem w
1000 g H
2
O jest jej 30 g, co stanowi 0,215 mola. Masa jednego mola wynosi:
30
0 215
139 5
1
,
,
=
⋅
−
g mol
2.11.
Temperatura topnienia naftalenu wynosi 80
o
C, a molowe ciepło
topnienia 18,8 kJ
⋅
mol
-1
. Wyznaczyć rozpuszczalność naftalenu w chloroformie
w procentach wagowych w temperaturze 50
o
C zakładając, że naftalen w
chloroformie tworzy roztwór doskonały. Molowe masy cząsteczkowe naftalenu i
chloroformu wynoszą odpowiednio: 128 i 119,5 g
⋅mol
-1
.
Rozwiązanie
Równanie na obniżenie temperatury krzepnięcia ma postać:
−
=
−
ln X
H
R
T
T
t
t
o
∆
1
1
gdzie:
X - ułamek molowy składnika znajdującego się w obu fazach, czyli wydzielającego się
z
roztworu (rozpuszczalnik),
∆H
t
- molowe ciepło topnienia substancji o ułamku molowym X,
T
o
t
- normalna temperatura topnienia czystej substancji,
T - temperatura krzepnięcia składnika o ułamku molowym X w roztworze.
Równanie powyższe jest słuszne w całym zakresie zmienności ułamków
molowych pod warunkiem, że roztwór jest roztworem doskonałym.
Poszukujemy
ułamka molowego naftalenu (N), przy którym zaczyna on
wydzielać się z roztworu w temperaturze 323 K.
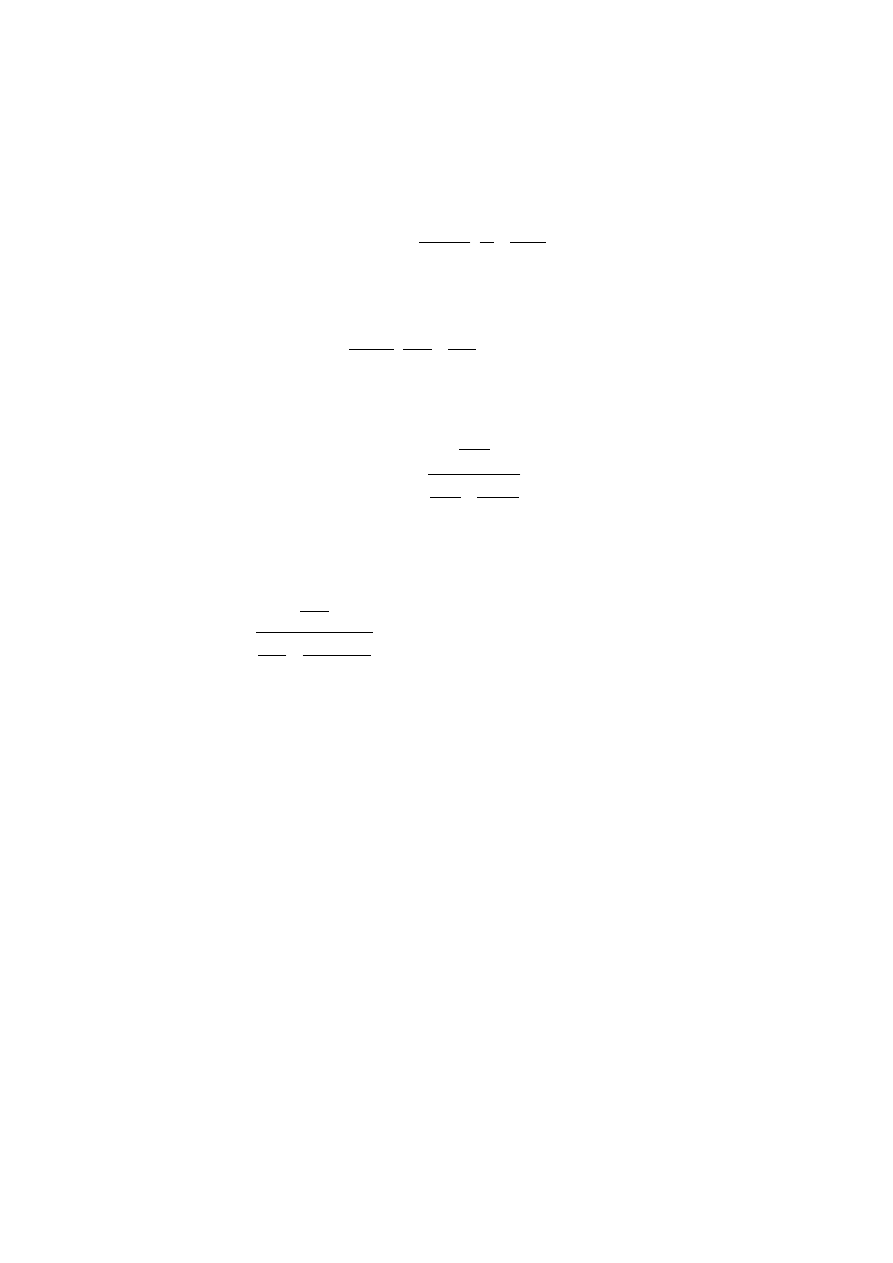
11
11
( )
( )
−
=
−
ln X
H
R
T T
N
t N
t N
o
∆
1
1
Po podstawieniu danych otrzymujemy:
−
=
−
⇒
=
ln
,
,
X
X
N
N
18800
8 314
1
323
1
353
0 552
Dokonujemy przeliczenia ułamka molowego na procent wagowy. Z definicji
ułamka molowego otrzymujemy:
X
m
M
m
M
m
M
N
N
N
N
N
Chl
Chl
=
+
.
.
Przyjmując, że masa roztworu wynosi 100 g, czyli m
N
+ m
Chl.
= 100,
otrzymamy:
0 552
128
128
100
119 5
56 9
56 9%
,
,
,
,
=
+
−
⇒
=
⇒
m
m
m
m
g
wagowych
N
N
N
N
.
ZADANIA
2.1.
Czy można w tyglu o pojemności 1,4 dm
3
stopić 10 kg cyny, jeżeli jej
ciepło topnienia wynosi 59,400 kJ
⋅
kg
-1
w temperaturze topnienia 232
o
C, gęstość
stałej cyny wynosi 7,18 kg
⋅
dm
-3
, a współczynnik (dT/dP) = 3,27
⋅
10
-8
K
⋅
Pa
-1
?
2.2.
Temperatura topnienia bizmutu pod normalnym ciśnieniem wynosi
271,0
o
C. W tych warunkach gęstość bizmutu ciekłego wynosi 10g
⋅
cm
-3
, nato-
miast temperatura obniża się o 3,49
⋅
10
-8
K, gdy ciśnienie wzrasta o 1 Pa. Obli-
czyć gęstość stałego bizmutu, jeżeli ciepło topnienia bizmutu w tych warunkach
wynosi 11,0 kJ
⋅
mol
-1
. (M(Bi) = 209g
⋅mol
-1
)
.

12
12
2.3.
Przemiana jodku rtęci(II) czerwonego w żółty odbywa się w
temperaturze 127
o
C. Obliczyć ciepło przemiany, jeżeli zmiana objętości
molowej jest równa 5,4 cm
3
⋅
mol
-1
, przy czym gęstość odmiany czerwonej jest
mniejsza (dT/dP = - 1,73
⋅
10
-6
K
⋅
Pa
-1
).
2.4
.
Prężność par chloru nad stałym chlorem wynosi 348 Pa w
temperaturze -112
o
C oraz 34 Pa w temperaturze -126,5
o
C. Obliczyć ciepło
sublimacji i parowania chloru, jeżeli ciepło topnienia chloru wynosi 9,1
kJ
⋅mol
-1
.
2.5.
Obliczyć ciepło topnienia srebra, jeżeli ciepło parowania srebra
wynosi 254,3 kJ
⋅
mol
-1
, a zależność prężności pary nad stałym srebrem od
temperatury dana jest równaniem:
ln
,
,
P
T
s
=
−
⋅
31952
3 225 10
4
2.6.
Obliczyć ciepło sublimacji srebra, jeżeli ciepło topnienia srebra
wynosi 13,83 kJ
⋅
mol
-1
, a zależność prężności par nad ciekłym srebrem od
temperatury dana jest równaniem:
lg
,
,
P
T
c
=
−
⋅
13 347
133 10
4
2.7.
Obliczyć ciepło parowania oraz normalną temperaturę wrzenia cyja-
nowodoru, jeżeli zależność prężności pary od temperatury nad ciekłym cyjano-
wodorem dana jest zależnością:
lg
,
P
T
=
−
916
1237
2.8.
Prężność par chloru nad ciekłym chlorem wynosi 1567 Pa w tem-
peraturze -100
o
C oraz 7841 Pa w temperaturze -80
o
C. Obliczyć ciepło
parowania i topnienia chloru, jeżeli ciepło sublimacji chloru wynosi
31,45kJ
⋅
mol
-1
.
2.9.
Normalna temperatura wrzenia acetonu wynosi 56,13
o
C. Obliczyć
temperaturę wrzenia acetonu pod ciśnieniem 1,0266
⋅
10
5
Pa, jeżeli ciepło
parowania acetonu wynosi 29,09 kJ
⋅
mol
-1
w normalnej temperaturze wrzenia.
2.10.
Normalna temperatura wrzenia roztworu doskonałego zawierającego
0,3 mola składnika A i 0,7 mola składnika B wynosi 70
o
C. W tej temperaturze

13
13
P
o
A
= 2 P
o
B
. Obliczyć P
o
A
i P
o
B
w temperaturze 70
o
C. Obliczyć także sumaryczne
ciśnienie nad roztworem zawierającym 0,8 mola składnika A i 1,2 mola
składnika B oraz skład par nad tym roztworem.
2.11.
Ciecze A i B tworzą roztwór doskonały. Zależność ciśnienia
całkowi-tego nad roztworem od ułamka molowego substancji B w temperaturze
300
K dana jest zależnością:
[ ]
P
X
Pa
B
= ⋅
+ ⋅
3 10
4 10
4
4
Obliczyć P
o
A
i P
o
B
w temperaturze 300 K oraz skład pary pozostającej w
równowadze z roztworem, w którym ułamek molowy składnika A wynosi 0,8.
2.12.
Prężności par czystych cieczy A i B w temperaturze 340 K są równe.
Obliczyć stosunek prężności par cieczy A i B w temperaturze 360 K, jeżeli
ciepło parowania wynosi 20 kJ
⋅
mol
-1
dla cieczy A i 30 kJ
⋅
mol
-1
dla cieczy B.
2.13.
Prężność par czystego etanolu wynosi 6,0
⋅
10
3
Pa, a metanolu
1,2
⋅
10
4
Pa w temperaturze 20
o
C. Wyznaczyć sumaryczną prężność par nad roz-
tworem zawierającym 60% wagowych etanolu oraz obliczyć skład fazy gazowej
w procentach wagowych. M(CH
3
OH) = 32 g
⋅
mol
-1
, M(C
2
H
5
OH)= 46 g
⋅
mol
-1
.
2.14.
Ciecze A i B tworzą roztwór doskonały. Roztwór zawierający 20%
molowych cieczy A pozostaje w równowadze z parami zawierającymi 40%
molowych cieczy A w temperaturze 60
o
C. Obliczyć stosunek prężności pary
czystej cieczy B do prężności pary czystej cieczy A w temperaturze 60
o
C.
2.15.
Stosunek prężności par czystych cieczy A i B wynosi 3 w tempe-
raturze 27
o
C. Ile wynosi ten stosunek w temperaturze 77
o
C, jeżeli ciepła paro-
wania wynoszą 30 kJ
⋅
mol
-1
dla cieczy A oraz 20 kJ
⋅
mol
-1
dla cieczy B?
2.16.
0,4 mola roztworu o składzie X
B
= 0,645 umieszczono w
zamkniętym naczyniu o pojemności 4
⋅
10
-3
m
3
w temperaturze 25
o
C. Ciecz
paruje do osiągnięcia stanu równowagi, w którym skład cieczy wynosi X'
B
=
0,600, natomiast ciśnienie w naczyniu wynosi 5
⋅
10
4
Pa. Obliczyć liczbę moli
pary oraz skład pary. Objętość cieczy w stanie równowagi można pominąć, a
parę potraktować jak gaz doskonały.
2.17.
W temperaturze 315 K prężności par dichloroetanu i benzenu
wynoszą odpowiednio: 2,066
⋅
10
4
oraz 2,433
⋅
10
4
Pa.
a) ZnaleYć skład mieszaniny, która będzie wrzeć pod ciśnieniem 2,267
⋅
10
4
Pa w
temperaturze 315 K.

14
14
b) Pod jakim ciśnieniem będzie wrzeć mieszanina zawierająca 50% molowych
benzenu?
2.18.
Mieszaninę zawierającą 1 mol alkoholu etylowego i 1 mol dichloro-
etanu destylowano do momentu, gdy normalna temperatura wrzenia osiągnęła
70
o
C. Przez cały czas destylacji pary skraplano i destylat gromadzono w
odbieralniku. Prężność par kondensatu w temperaturze 70
o
C wyniosła 1,30
⋅
10
5
Pa. Prężności par alkoholu etylowego i dichloroetanu wynoszą w tej
temperaturze odpowiednio: 7
⋅
10
4
Pa i 1,5
⋅
10
5
Pa. Zakładając, że roztwór jest
doskonały, obliczyć:
a) ułamek molowy dichloroetanu w cieczy pozostałej w kolbie destylacyjnej,
b) ułamek molowy dichloroetanu w destylacie,
c) liczbę moli dichloroetanu, która znajduje się w destylacie.
2.19
.
W stanie równowagi znajdują się 3 mole cieczy A oraz pewna ilość
cieczy B. Prężność równowagowa wynosi 7,321
⋅10
4
Pa w temperaturze 350 K.
Prężności par czystych cieczy A i B wynoszą odpowiednio: 4,666
⋅10
4
i 1,013
⋅10
5
Pa w temperaturze 350 K. Obliczyć ułamek molowy cieczy A w
roztworze, liczbę moli cieczy B w roztworze oraz ułamek molowy składnika B
w parze.
2.20
.
Obliczyć rozpuszczalność sacharozy w wodzie (w molach na 1000 g
H
2
O) w temperaturze 25
o
C, wiedząc, że temperatura topnienia sacharozy wynosi
200
o
C, a jej ciepło topnienia 15,1 kJ
⋅mol
-1
. Molowa masa cząsteczkowa sacharo-
zy wynosi 342 g. Zakładamy, że roztwór sacharozy w wodzie jest roztworem
doskonałym.
2.21
.
Obliczyć podwyższenie temperatury wrzenia wodnych roztworów
zawierających w 100 g H
2
O:
a) 1,20 g mocznika (nieelektrolit),
b) 0,7455 g chlorku potasowego (mocny elektrolit),
c) 1,20 g mocznika oraz 0,7455 g chlorku potasowego.
Stała ebulioskopowa wody wynosi 0,516 K
⋅kg⋅mol
-1
.
2.22
.
Prężność pary nad roztworem zawierającym 11,1 g CaCl
2
w 1000 g
H
2
O w temperaturze 20
o
C wynosi 2,328
⋅10
3
Pa. Czysta woda ma w tej tempe-
raturze prężność pary 2,338
⋅10
3
Pa. Obliczyć stopień dysocjacji CaCl
2
w tym
roz-tworze. Molowa masa cząsteczkowa CaCl
2
wynosi 111 g.

15
15
2.23
.
Pewna substancja rozpuszczona w 100 g benzenu powoduje
obniżenie temperatury krzepnięcia o 1,28
o
C, a ta sama ilość tej substancji
rozpuszczona w 100 g H
2
O powoduje obniżenie temperatury krzepnięcia o
1,395
o
C. Obliczyć, na ile jonów dysocjuje substancja w wodzie zakładając, że w
benzenie znajduje się ona w postaci cząsteczkowej, a w wodzie jest w pełni
zdysocjowana. Stałe krioskopowe dla wody i benzenu wynoszą odpowiednio:
1,86 i 5,12 K
⋅kg⋅mol
-1
.
2.24
.
Prężność pary CCl
4
w temperaturze 20
o
C wynosi 1,140
⋅10
4
Pa, a
prężność par nad roztworem zawierającym 0,550 g substancji A w 25 g CCl
4
w
tej samej temperaturze wynosi 1,105
⋅10
4
Pa. Obliczyć molową masę cząstecz-
kową substancji A.
2.25.
Prężność par nad roztworem zawierającym 5,48 g aniliny w 50 g ete-
ru etylowego wynosi 4,4255
⋅10
4
Pa w temperaturze 15,3
o
C. Normalna
temperatura wrzenia eteru etylowego wynosi 35
o
C, a jego ciepło parowania
27,82 kJ
⋅mol
-1
. Obliczyć molową masę cząsteczkową aniliny.
2.26.
Obliczyć stopień dysocjacji Ba(NO
3
)
2
w roztworze wodnym
zawierającym 9,261 g Ba(NO
3
)
2
w 100 g H
2
O. Temperatura wrzenia tego
roztworu pod ciśnieniem normalnym wynosi 100,381
o
C. Stała ebulioskopowa
wody wynosi 0,516 K
⋅kg⋅mol
-1
.
2.27.
Dla benzenu stała krioskopowa wynosi 5,16 K
⋅kg⋅mol
-1
, a stała
ebulioskopowa 2,61 K
⋅kg⋅mol
-1
. Obliczyć ciepło parowania i topnienia benzenu,
jeżeli ciepło sublimacji benzenu wynosi 41,14 kJ
⋅mol
-1
. Temperatury wrzenia i
topnienia benzenu wynoszą odpowiednio: 80
o
C i 5,5
o
C.
ODPOWIEDZI DO ZADAŃ
2.1.
Nie mo?na; V
c
= 1,431 dm
3
;
2.2.
d = 9,67 g
⋅cm
-3
.
2.3.
∆H = 1249 J.
2.4.
∆H
s
= 31,45 kJ
⋅mol
-1
;
∆H
p
= 22,35 kJ
⋅mol
-1
.
2.5.
∆H
t
= 13,83 kJ
⋅mol
-1
.
2.6.
∆H
s
= 268,13 kJ
⋅mol
-1
.
2.7.
T = 298 K;
∆H
p
= 23,65 kJ
⋅mol
-1
.
2.8.
H
t
= 9,10 kJ
⋅mol
-1
.
2.9.
t = 56,55
o
C.
2.10.
P
o
A
= 1,538
⋅10
5
Pa; P
o
B
= 7,69
⋅10
4
Pa; P
ca3k.
= 1,077
⋅10
5
Pa; Y
A
= 0,571.
2.11.
P
o
A
= 3
⋅10
4
Pa; P
o
B
= 7
⋅10
4
Pa; Y
A
= 0,631.

16
16
2.12.
P
B
/P
A
= 1,217.
2.13.
P = 8,93
⋅10
3
Pa; 57,13% wagowych metanolu.
2.14.
P
o
A
/P
o
B
= 2,67;
2.15.
P
A
/P
B
= 5,32.
2.16.
n
p
= 0,08 mola; Y
B
= 0,825.
2.17.
a) X(dichloroetanu) = 0,452;
b) P = 2,2495
⋅10
4
Pa.
2.18.
a) X'(dichloroetanu) = 0,375;
b) Y(dichloroetanu) = 0,75;
c) n = 0,5 mola.
2.19.
X
A
= 0,514; n
B
= 2,84 moli; Y
B
= 0,672.
2.20.
6,52 moli w 1000 g H
2
O.
2.21.
a)
∆T = 0,103 K:
b) 0,103 K;
c)
∆T = 0,206 K.
2.22.
α = 0,688.
2.23.
3 jony.
2.24.
M
A
= 107 g.
2.25.
M = 90 g.
2.26.
α = 0,54.
2.27.
∆H
p
= 31,29 kJ
⋅mol
-1
;
∆H
t
= 9,85 kJ
⋅mol
-1
.
Wyszukiwarka
Podobne podstrony:
chf im sem 1d
05 Konduktometria, naoh,nh3h2o,ch3cooh, Marek Mokrzycki IM sem
Polimery-IM sem.V-zagadnienia na zaliczenie, Studia, AiR, SEMESTR II, TSiIW
01 Pomiar stałych fizykochemicznych cieczy, stałe fizyko chemiczne, Marek Mokrzycki IM sem
06 Średnia Masa Cząsteczkowa Polimeru, wiskozymetria (glikol), Marek Mokrzycki IM sem
6 SEM IM Mdpsib
Chemia fizyczna - Loska, OŚ, sem II 1 SOWiG, Chemia Fizyczna, ChF laboratoria
ccs, Politechnika, Rok 2, sem 3, chf
CHF PYTANIA, OŚ, sem II 1 SOWiG, Chemia Fizyczna
Wyklad 1c, Sesja, Rok 2 sem 1, WYKŁAD Psychologia osobowości
Chemia fizyczna - kolokwium 1b, OŚ, sem II 1 SOWiG, Chemia Fizyczna, ChF laboratoria
tensometrosretroPOPRfinal, Politechnika, Rok 2, sem 3, chf
tensometrosretro, Politechnika, Rok 2, sem 3, chf
Chemia fizyczna - kolokwium 1a, OŚ, sem II 1 SOWiG, Chemia Fizyczna, ChF laboratoria
spis lab I sem 2010
Zastosowanie SEM
Mała chirurgia II Sem IV MOD
więcej podobnych podstron