Zestaw B1
Ciepło reakcji chemicznych:
Nie zależy od temperatury dla reakcji zerowego rzędu
Zależy od temperatury tylko dla reakcji egzotermicznych
Zależy od temperatury tylko dla reakcji egzotermicznych
Nie zależy od temperatury
Zależy od temperatury zgodnie z równaniami Kirchoffa ???
Cząstki fazy rozproszonej zawiesiny:
Nie są widoczne pod mikroskopem optycznym
Są widoczne pod mikroskopem optycznym
Zawsze tworzą duże aglomeraty
Ulegają sedymentacji w ziemskim polu grawitacyjnym
A. II,III B. III C. II, IV D. I E. II, III, IV
Wskaż prawidłowy wzór na stałą szybkości reakcji pierwszego rzędu (t- czas reakcji, Cx - chwilowe stężenie produktu, Co - początkowe stężenie substratu):
![]()
![]()
Wskaż równanie umożliwiające obliczenie rzędowości reakcji (n) (τ- okres połowicznej przemiany, A-stała, k- stała szybkości reakcji,
Co- początkowe stężenie substratu):
A. 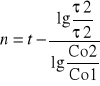
Rozpuszczalność gazu w cieczy:
Nie zależy od ciśnienia gazu nad powierzchnią cieczy
Rośnie ze wzrostem temperatury cieczy
Maleje ze wzrostem temperatury cieczy
Maleje ze wzrostem ciśnienia gazu nad powierzchnią cieczy
Nie zależy od temperatury cieczy
Parametry ekstensywne:
Zależą od masy układu
Charakteryzują każdą najmniejszą część układu
Są addytywne
Są to np. ciśnienie, temperatura
Są to np. objętość, funkcje termodynamiczne
A. II,V B. I, II, IV C. II, III,IV D. III, IV E. I, III, V
Standardowa entalpia molowa tworzenia związku chemicznego (H°) oznacza:
bezwzględną wartość entalpii związku chemicznego
wartość entalpii pierwiastka i substancji prostej
zmiane entalpii towarzysząca tworzeniu (syntezie) 1mola związku chemicznego z prostszych związków
zmiane entalpii towarzysząca tworzeniu (syntezie) 1mola związku chemicznego z pierwiastków
A. I, IV B. II C. I, III D. I, II E. III
rzędowość reakcji chemicznej jest to:
wartość stałej szybkości reakcji w równaniu kinetycznym
liczba cząsteczek uczestniczących jednocześnie w tworzeniu produktów reakcji chemicznej
wartość iloczynu stężeń substratów w równaniu kinetycznym na szybkość reakcji chemicznej
liczba cząsteczek produktów powstających jednocześnie w reakcji chemicznej
suma wykładników potęgowych w równaniu na szybkość reakcji chemicznej, do której należy podnieść stężenia substratów by doświadczalnie wyznaczona szybkość reakcji była zgodna z wyznaczoną z odpowiedniego równania kinetycznego
Stała równowagi reakcji odwracalnej wyraża
Iloczyn stężeń i substratów reakcji
Stosunek iloczynów stężeń produktów i substratów w odpowiednich potęgach
Zmianę stężeń produktów wraz ze zmianą temperatury
Iloczyn stężeń produktów reakcji
Stosunek zmian stężenia substratów lub produktów do czasu reakcji
Dializa:
jest procesem, w którym membrana przepuszcza cząstki koloidów, a zatrzymuje substancje małocząsteczkowe (zanieczyszczenia)
wykorzystuje ruch naładowanych cząsteczek koloidu w polu elektrycznym
jest wykorzystywana do otrzymywania koloidów liofilowych
wykorzystuje jako siłę napędową procesu ciśnienie przyłożone z jednej strony membrany
wykorzystuje różnice w przenikalności substancji przez membrany półprzepuszczalne
11. Wskaż prawidłowe założenie modelu adsorpcji wg Langmuira
występuje zjawisko kondensacji par adsorbatu
na powierzchni adsorbentu występują tzw. Miejsca aktywne, na których adsorbuje się jedna cząsteczka adsorbatu- adsorpcja monomolekularna
równowaga adsorpcji nie zależy od własności fizycznych układu
adsorpcja jest wielowarstwowa
powierzchnia ciała jest energetycznie niejednorodna
12. potencjał elektrokinetyczny (potencjał zeta) koloidu oznacza:
wartość potencjału między warstwą adsorpcyjną i dyzuzyjną w momencie koagulacji
różnicę potencjału między jądrem a warstwą jonogenną koloidu
wartość równą wielkości potencjału warstwy sztywnej
potencjał termodynamiczny Nernsta
różnicę potencjałów między warstwą adsorpcyjną i dyzfuzyjną jonogennej części koloidu
13. Analizując kinetykę reakcji enzymatycznych należy uwzględnić:
Kinetykę reakcji rodnikowych
Kinetykę reakcji równoległych
Kinetykę reakcji następczych
Kinetykę reakcji pierwszego rzędu i prawo działania mas
Kinetykę reakcji łańcuchowych
14. Zależność ![]()
dotyczy:
prawa podziału Nernsta
stosunek stężeń substancji w dwóch nie mieszających się cieczach w równowadze
stałej równowagi reakcji chemicznej
stałej równowagi rozpadu promieniotwórczego α
A. I, II B. II, III C. III D. IV E. I, III
15. W trakcie przebiegu procesów fizycznych i fizykochemicznych układu z otoczeniem może wymieniać energię:
tylko na sposób pracy
na sposób ciepła i pracy
tylko na sposób ciepła
kinetyczną
potencjalną
16. matematyczny warunek równowagi procesów chemicznych i fizykochemicznych jest następujący:
ΔH=0
ΔS= 0
ΔG=0
ΔT>0
A. I,II B. I, III C. III, IV D. II, III E. II, IV
17. Cechą procesów samorzutnych jest:
niemożliwość wykonywania pracy przez układ
osiąganie stanu równowagi
nieodwracalność
odwracalność
A. I, II B. I, III C. III, IV D. II,III E. II, IV
37. prawo rozcieńczeń Ostwalda wiążące stałą dysocjacji (K) ze stopniem dysocjacji (α)może przyjąć postać:
(Co- początkowe stężenie substratu):
I. ![]()
![]()
![]()
II. ![]()
III. pK= -lg K/C0
IV. pH=α *ln (K/C0)
A. I, II B. II,IV C. I, IV D. I, II, III E. IV
38. koloidami cząsteczkowymi nazywamy takie układy, w których:
cząsteczki fazy rozproszonej ulegają silnej solwatacji
czynnikiem stabilizującym trwałość jest ładunek elektryczny
faza rozproszona składa się z pojedynczych cząsteczek związku wielkocząsteczkowego
faza rozproszona składa się z agregatów takich samych cząsteczek związku chemicznego
A. I, IV B. I, II C. I, III D. II, III E. II, IV
39. wskaż równanie służące do obliczenia zmiany entropii (ΔS) procesu przebiegającego w warunkach izotermicznych
ΔS=
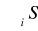
i(prod)-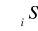
i(substr)ΔS= Cp-ln (T2/T1)
ΔS=Cv -ln(T2/T1)
ΔS=ΔH/T
ΔS= ΔH - pdV
40. Wskaż cechę, która charakteryzuje reakcje odwracalne:
reakcje odracalne nie osiągają stanu równowagi
W czasie przebiegu reakcji odwracalnych wytrącają się osady w postaci stałej
W czasie przebiegu reakcji odwracalnych uwalniają się gazy opuszczające środowisko reakcji
Równowaga ustalająca się w reakcji odwracalnej nie jest równowaga dynamiczną
W danych warunkach ciśnienia i temperatury stężenia produktów i nieprzereagowanych substratów osiągają stałe wartości
41. Wskaż równanie Gibbsa-Helmholtza, pozwalające na obliczenie zmiany entalpii swobodnej reakcji chemicznej:
ΔG= ΔU + pΔV
ΔG = Q+W
ΔH2- ΔH1 = ΔCp (T2-T1)
ΔG = ΔH- TΔS
ΔG= - RT lnK
42. Równanie Clausiusa-Clapeyrona w postaci:
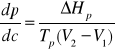
opisuje stan równowagi układów:
dwuskładnikowego-jednofazowego
dwuskładnikowego- dwufazowego
jednoskładnikowego-jednofazowego
jednoskładnikowego-dwufazowego
trójskładnikowego-dwufazowego
43. dla układu trójfazowego-jednoskładnikowego liczba stopni swobody, zgodnie z regułą faz Gibbsa, wynosi:
A. 0 B. 1 C.2 D.3 E.4
Wynika to ze wzoru f+s=n+2; f=3 ; n=1
Wyniki s=0
44. Hydrozole to układy koloidalne, w których:
fazą dyspersyjną jest woda, a fazą zdyspergowaną ciało stałe
fazą dyspersyjną organiczna ciecz, a faza zdyspersergowaną jest woda
fazą dyspersyjną jest ciecz, a fazą zdyspergowaną gaz
fazą dyspersyjną i zdyspergowaną jest ciało stałe
fazą dyspersyjną jest gaz, a fazą zdyspergowaną ciecz lub ciało stałe
45. Mgły charakteryzuje:
Stała faza rozproszona
Ciekła faza dyspergująca
Ciekła faza rozproszona
Stała lub ciekła faza rozproszona
Stała lub ciekła faza dyspergująca
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna - Loska, OŚ, sem II 1 SOWiG, Chemia Fizyczna, ChF laboratoria
Chemia fizyczna - kolokwium 1b, OŚ, sem II 1 SOWiG, Chemia Fizyczna, ChF laboratoria
Chemia fizyczna - kolokwium 1a, OŚ, sem II 1 SOWiG, Chemia Fizyczna, ChF laboratoria
Chemia fizyczna - wykad 5, OŚ, sem II 1 SOWiG, Chemia Fizyczna
Chemia fizyczna - wykład 3, OŚ, sem II 1 SOWiG, Chemia Fizyczna
Chemia fizyczna - wykład 2, OŚ, sem II 1 SOWiG, Chemia Fizyczna
Akwakompleksy metali, OŚ, sem II 2 SOWiG, Chemia Środowiska, Seminarium ChŚ
3. Zanieczyszczenia wody 2, OŚ, sem II 2 SOWiG, Chemia Środowiska, Seminarium ChŚ
3. Zanieczyszczenia wody 1, OŚ, sem II 2 SOWiG, Chemia Środowiska, Seminarium ChŚ
Klasy czystości wód, OŚ, sem II 2 SOWiG, Chemia Środowiska, Seminarium ChŚ
Akwakompleksy metali, OŚ, sem II 2 SOWiG, Chemia Środowiska, Seminarium ChŚ
test na inteligencję emocjonalną, OŚ, sem II 1 SOWiG, Negocjacje, testy
techniki sterowania przebiegiem, OŚ, sem II 1 SOWiG, Negocjacje
Załącznik A4-Oświadczenie Wnioskodawcy, OŚ, sem II 1 SOWiG, Systemy Finansowania Ochrony Środowiska
WNIOSEK C1 , OŚ, sem II 1 SOWiG, Systemy Finansowania Ochrony Środowiska w Polsce, Projekt SFOŚwP
cw zakres KMB, OŚ, sem II 1 SOWiG, Planowanie Przestrzenne
Wykaz załączników - B2 kanalizacja, OŚ, sem II 1 SOWiG, Systemy Finansowania Ochrony Środowiska w Po
Ćwiczenie semestr letni 2013 - 2014 2, OŚ, sem II 2 SOWiG, Systemy Finansowania Ochrony Środowiska w
Test kreatywności, OŚ, sem II 1 SOWiG, Negocjacje, testy
więcej podobnych podstron