
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

S + O
2
= SO
2
Zn + S = ZnS
4Al + 3O
2
= 2Al
2
O
3
A + B = AB
CaCO
3
= CaO + CO
2
2HgO = 2Hg + O
2
2Fe(OH)
2
= Fe
2
O
3
+ 3H
2
O
C = A + B
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

2KBr + Cl
2
= 2KCl + Br
2
AB + C = AC + B
AB + CD = AD + CB
2NaNO
3
+ CaCl
2
= 2NaCl + Ca(NO
3
)
2
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

AgNO
3
+ KCl = AgCl
o + KNO
3
AB + CD = AD
o + CB
KOH + HCl = KCl + H
2
O
AOH + HB = AB + H
2
O
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Jeżeli w trakcie reakcji chemicznej dochodzi do zmian
stopni utlenienia pierwiastków to mówimy, że reakcja jest
reakcją utleniania i redukcji lub reakcją redoks.
0
V
III
II
3
3
2
3
Fe 4H N O
Fe NO
N O 2H O
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

ZASADY OKREŚLANIA STOPNIA UTLENIENIA
1. Stopień utlenienia pierwiastka w stanie wolnym równy jest zero.
0
0
Fe
Ca
2. Fluor we wszystkich swych połączeniach występuje na -I stopniu
utlenienia.
I
F
3. Stopień utlenienia litowców równy jest I, a berylowców II,
(metale przyjmują dodatnie stopnie utlenienia).
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

4. Wodór przyjmuje w swych związkach stopień utlenienia równy I, z
wyjątkiem wodorków litowców i berylowców, gdzie stopień
utlenienia wynosi -I.
ZASADY OKREŚLANIA STOPNIA UTLENIENIA (c.d.)
5. Tlen w połączeniach ma stopień utlenienia -II. Wyjątki stanowią:
fluorek tlenu OF
2
, w którym tlen ma stopień utlenienia II, nadtlenki
np. H
2
O
2
, Na
2
O
2
, BaO
2
, w których stopień utlenienia tlenu wynosi –I i
ponadtlenki, gdzie stopień utlenienia tlenu wynosi -1/2.
1
2
II
II
I
2
2
2
2
2
H O
O F
H O
Na O
I
I
I
I
II
I
2
H Cl
Li H
Ca H
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

6. Suma stopni utlenienia wszystkich atomów wchodzących w
skład cząsteczki wynosi zero.
I
V
II
3
H N O
(+1) + (+5) + 3·(-2) = 0
7. Suma stopni utlenienia wszystkich atomów wchodzących w
skład jonu złożonego równa jest ładunkowi jonu.
ZASADY OKREŚLANIA STOPNIA UTLENIENIA (c.d.)
2
VI
II
4
S O
(+6) + 4·(-2) = -2
ładunek jonu
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

1. Prawidłowe zapisanie wzorów substancji
2. Prawidłowe przewidywanie produktów reakcji
3. Uzupełnienie współczynników reakcji
KOLEJNOŚĆ CZYNNOŚCI PRZY ZAPISYWANIU
RÓWNAŃ REAKCJI CHEMICZNYCH
Zapis reakcji może być cząsteczkowy, jonowo-cząsteczkowy
lub jonowy.
Równanie reakcji jest sumarycznym zapisem reakcji chemicznej
i określa jakie substancje wchodzą w reakcję i jakie są
produktami reakcji oraz stosunki ilościowe między substratami
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

..zapisując reakcje chemiczne w sposób uzgodniony
musimy pamiętać, że:
Liczba atomów danego pierwiastka po lewej stronie równania
musi być taka sama jak liczba atomów tego pierwiastka po
prawej stronie równania
PRAWO ZACHOWANIA
PIERWIASTKA
Liczba elektronów oddawanych przez atomy (jony) musi taka
sama jak liczba elektronów pobieranych przez inne atomy
(jony)
PRAWO ZACHOWANIA
ŁADUNKU
Dodatkowo, dla reakcji z wymianą elektronów (czyli redoks):
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
Uzgadnianie równań reakcji utleniania i redukcji
I
I
I
VI
II
0
IV
II
I
II
2
4
2
2
2
H Br
H S O
Br
S O
H O
bilans elektronów:
I
0
VI
IV
Br 1e
Br
S
2e
S
1
2
I
0
2
VI
IV
2Br 2e
Br
S
2e
S
2
4
2
2
2
2H Br
H SO
Br
SO
2H O
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
Uzgadnianie równań reakcji utleniania i redukcji
HBr + H
2
SO
4
Br
2
+ SO
2
+ H
2
O
I
I
I
VI
II
0
IV
II
I
II
2
4
2
2
2
H Br
H S O
Br
S O
H O
bilans elektronów:
I
0
VI
IV
Br 1e
Br
S
2e
S
1
2
I
0
2
VI
IV
2Br 2e
Br
S
2e
S
2
4
2
2
2
2H Br
H SO
Br
SO
2H O
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Uzgadnianie równań reakcji utleniania i redukcji
HClO
3
+ HCl
= Cl
2
+ H
2
O
I
V
II
I
I
0
I
II
3
2
2
H Cl O
H Cl
Cl
H O
0
0
5
V
I
Cl
e
Cl
Cl
e
Cl
I
V
II
I
I
0
I
II
3
2
2
H Cl O
5H Cl
3Cl
3H O
1
5
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

ciepło Q’
CaCO
3
= CaO + CO
2
ciepło Q”
reakcja egzotermiczna
reakcja endotermiczna
S + O
2
= SO
2
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
KINETYKA CHEMICZNA
Dział chemii fizycznej zajmujący się opisem wpływu różnych
czynników na szybkość reakcji chemicznych to...
KINETYKA REAKCJI
HOMOGENICZNYCH
KINETYKA REAKCJI
HETEROGENICZNYCH
układy jednofazowe
układy wielofazowe
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
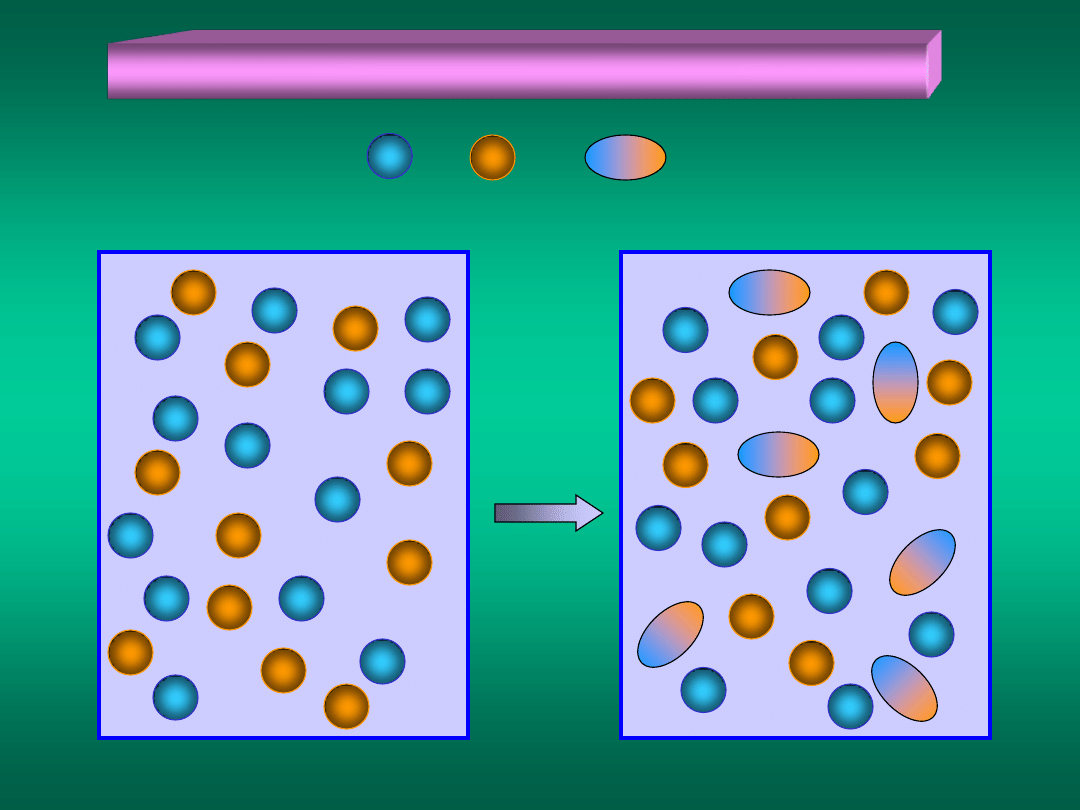
Reakcje chemiczne w układach homogenicznych
t = 0
t > 0
+
=
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
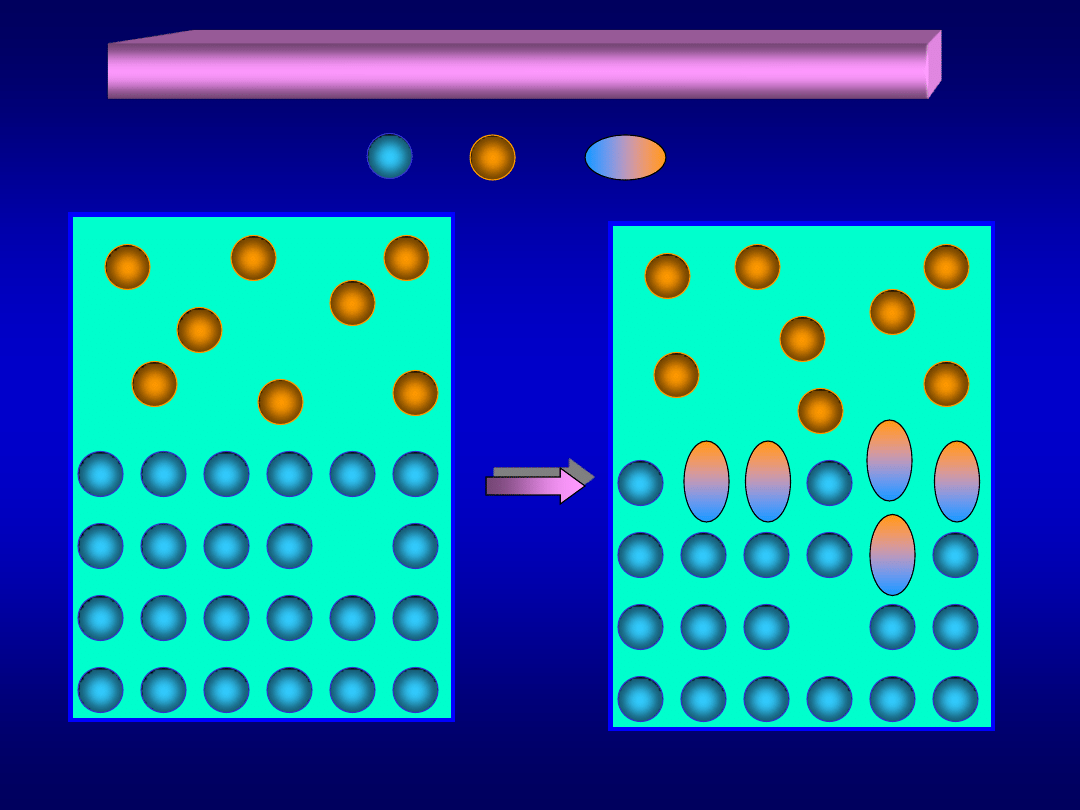
Reakcje chemiczne w układach heterogenicznych
+
=
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
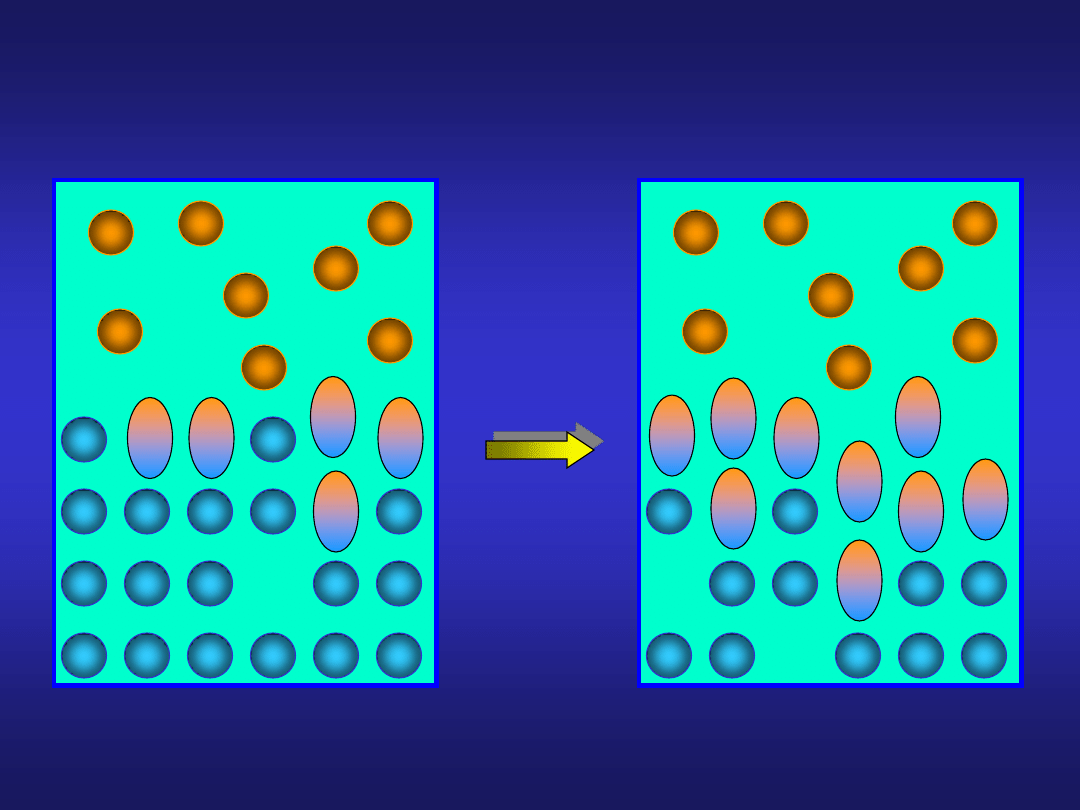
..kolejne fazy reakcji heterogenicznej...
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

O tym czy zaobserwujemy zachodzenie MOŻLIWEJ reakcji,
decyduje SZYBKOŚĆ z jaką reakcja zachodzi.
SZYBKOŚCIĄ
reakcji chemicznych zajmuje się dział
chemii ogólnej (fizycznej) nazywany
KINETYKĄ REAKCJI CHEMICZNYCH

Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
czas
li
cz
b
a
m
oli
O
2
H
2
H
2
O
t
k
DEFINICJA SZYBKOŚCI REAKCJI CHEMICZNEJ (2)
2H
2
+ O
2
= 2H
2
O
dt
dn
2
1
dt
dn
dt
dn
2
1
v
O
H
O
H
2
2
2
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
Szybkość reakcji chemicznych
Doświadczenie wykazało, że szybkość reakcji bardzo często
można przedstawić empirycznym równaniem kinetycznym:
1
2
3
S
S
S
r
kc c c ...
1 1
2
2
3
3
S
S
S
......
produkty
,
,
– rzędy reakcji względem substratów S
1
, S
2
, S
3
.....
n =
+
+
+ ......
całkowity rząd reakcji
k – stała szybkości reakcji
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
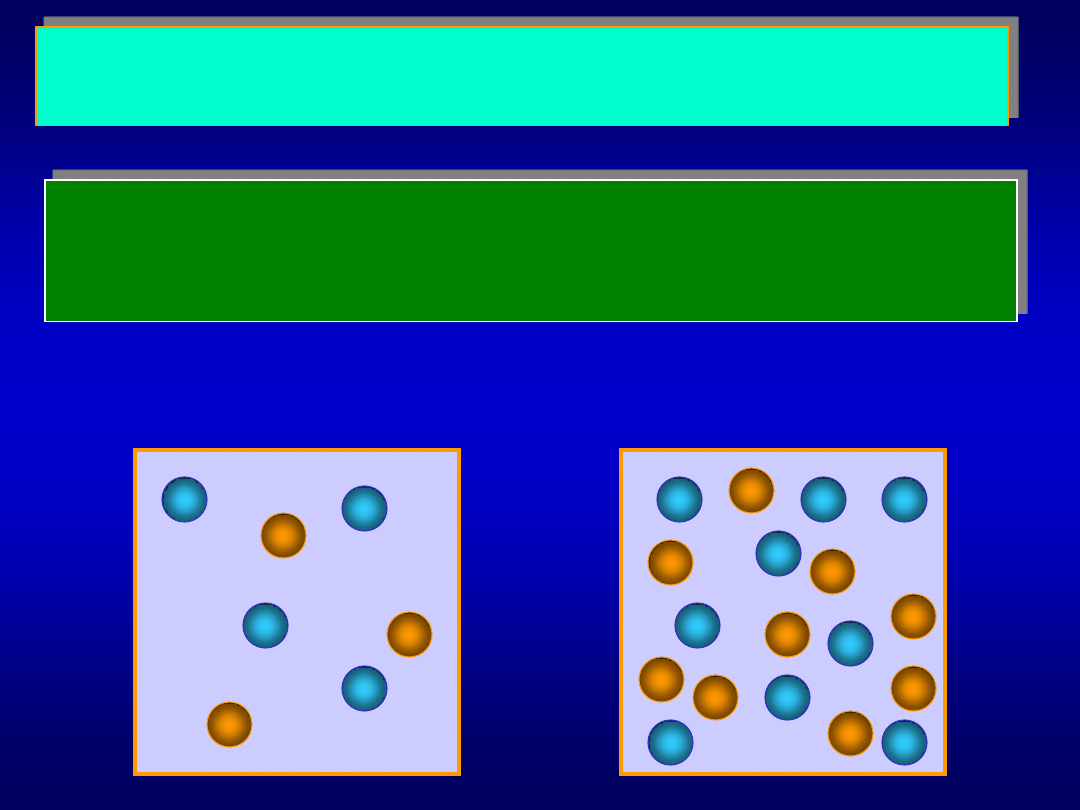
Dlaczego szybkość reakcji chemicznych jest proporcjonalna
do stężeń reagentów?
Aby reakcja A + B
d C mogła zajść, atomy (cząsteczki) A i B
muszą wejść w kontakt (zderzyć się). Czym więcej zderzeń w
jednostce czasu, tym reakcja powinna biec szybciej.
...w którym naczyniu będzie więcej zderzeń?
I
II
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

atom (cząsteczka) A
atom (cząsteczka) B
II
B
I
B
II
A
I
A
c
c
c
c
W II naczyniu zderzeń będzie więcej, zatem reakcja
przebiegnie szybciej. Jednocześnie w II naczyniu stężenia
substratów A i B są większe, zatem szybkość reakcji powinna
rosnąć ze wzrostem stężenia substratów
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Rzędy
reakcji
chemicznych
1
2
3
S
S
S
r
kc c c ...
n =
+
+
+ ......
całkowity rząd reakcji:
0
n 3
n = 0 – bardzo rzadko
n = 1,2
– często
n = 3
– rzadko
n = p/q - rzadko
0
,
,
3
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Rzędy
reakcji
chemicznych -
przykłady
rząd
reakcja
równanie kinetyczne
0
N
2
O = N
2
+ 0,5O
2
1
N
2
O
5
= 2NO
2
+ 0,5O
2
2
H
2
+ I
2
= 2HI
3
2NO + O
2
= 2NO
2
k
r
5
2
O
N
kc
r
2
2
I
H
c
kc
r
2
2
O
NO
c
kc
r
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Cząsteczkowość reakcji chemicznych
Liczbę cząsteczek biorących udział w elementarnym etapie
reakcji nazywamy CZĄSTECZKOWOŚCIĄ REAKCJI.
Dawniej
utożsamiano
pojecie
rzędu
reakcji
z
cząsteczkowością.
rozważmy reakcję:
2N
2
O
5
= 2N
2
O
4
+ O
2
Można oczekiwać, że na to by zaszła taka reakcja potrzeba
aby
zderzyły
się
dwie
cząsteczki
N
2
O
5
(reakcja
dwucząsteczkowa), a zatem jej szybkość powinna być opisana
równaniem kinetycznym II rzędu:
2
5
2
5
2
5
2
O
N
O
N
O
N
c
k
dt
dc
... dlaczego tak uważamy?
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

reakcję:
2N
2
O
5
= 2N
2
O
4
+ O
2
2
5
2
5
2
5
2
5
2
5
2
5
N O
2
N O
N O
N O
N O
N O
dc
k
c
c
k
c
dt
..można zapisać w formie:
N
2
O
5
+ N
2
O
5
= 2N
2
O
4
+ O
2
substraty
Szybkość reakcji jest wprost proporcjonalna do stężenia
substratów (nie widzimy powodów do podniesienia
stężeń do potęg innych niż 1)
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
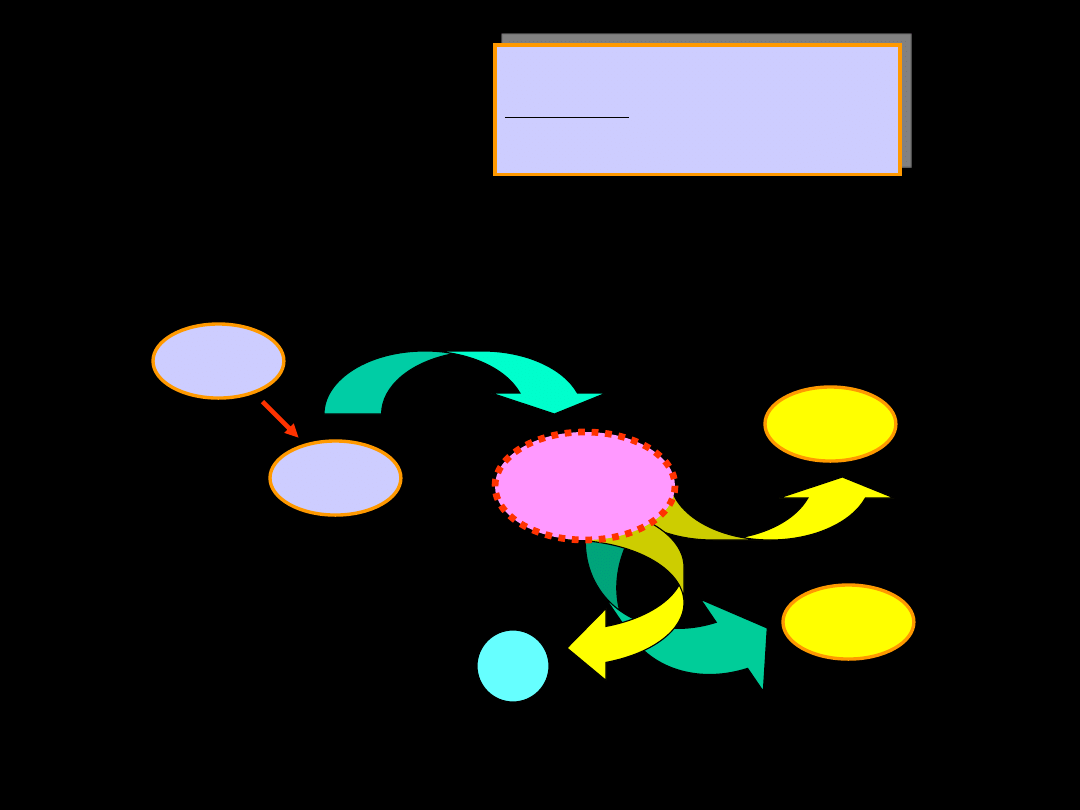
Równanie kinetyczne:
2
5
2
5
2
5
2
O
N
O
N
O
N
c
k
dt
dc
odpowiada mechanizmowi:
N
2
O
5
N
2
O
5
N
2
O
4
N
2
O
4
O
2
4N 10O
2N
2
O
5
= 2N
2
O
4
+ O
2
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
Doświadczenie wykazało, że szybkość tej reakcji odpowiada
równaniu I rzędu:
5
2
5
2
5
2
O
N
O
N
O
N
c
k
dt
dc
Jest to wynikiem złożonego mechanizmu tej reakcji:
N
2
O
5
= N
2
O
3
+ O
2
(reakcja wolna)
N
2
O
3
= NO + NO
2
(reakcja szybka)
NO + N
2
O
5
= 3NO
2
(reakcja szybka)
4NO
2
= 2N
2
O
4
(reakcja szybka)
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
I) N
2
O
5
= N
2
O
3
+ O
2
(reakcja wolna)
II) N
2
O
3
= NO + NO
2
(reakcja szybka)
III) NO + N
2
O
5
= 3NO
2
(reakcja szybka)
IV) 4NO
2
= 2N
2
O
4
(reakcja szybka)
I
II
IV
III
N
2
O
5
N
2
O
4
+ O
2
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
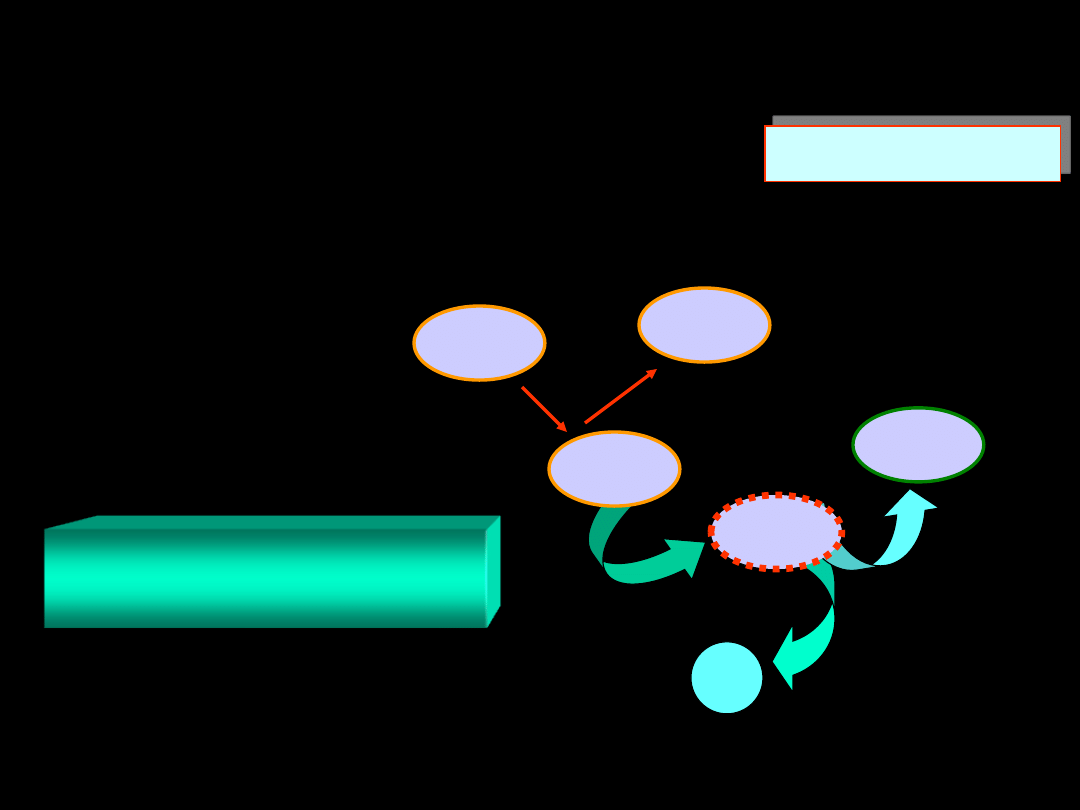
Jeżeli reakcja 2N
2
O
5
= 2N
2
O
4
+ O
2
przebiega etapami, które
następują po sobie (etapy następcze), to o obserwowanej
szybkości reakcji decyduje etap najwolniejszy:
N
2
O
5
= N
2
O
3
+ O
2
reakcja w tym etapie przebiega zgodnie z mechanizmem:
N
2
O
5
N
2
O
5
N
2
O
5
N
2
O
5
N
2
O
3
O
2
reakcja jednocząsteczkowa
I rzędu
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Zależność szybkości reakcji chemicznych od
temperatury (1)
Doświadczenia wskazały, że szybkość reakcji chemicznych
istotnie zależy od temperatury. Najczęściej szybkość reakcji
rośnie ze wzrostem temperatury.
Przy wzroście temperatury o 10 K
szybkość reakcji wzrasta przeciętnie
2 – 4 razy
reguła Van’t Hoffa
1852-1911
Jacobus Van’t Hoff
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
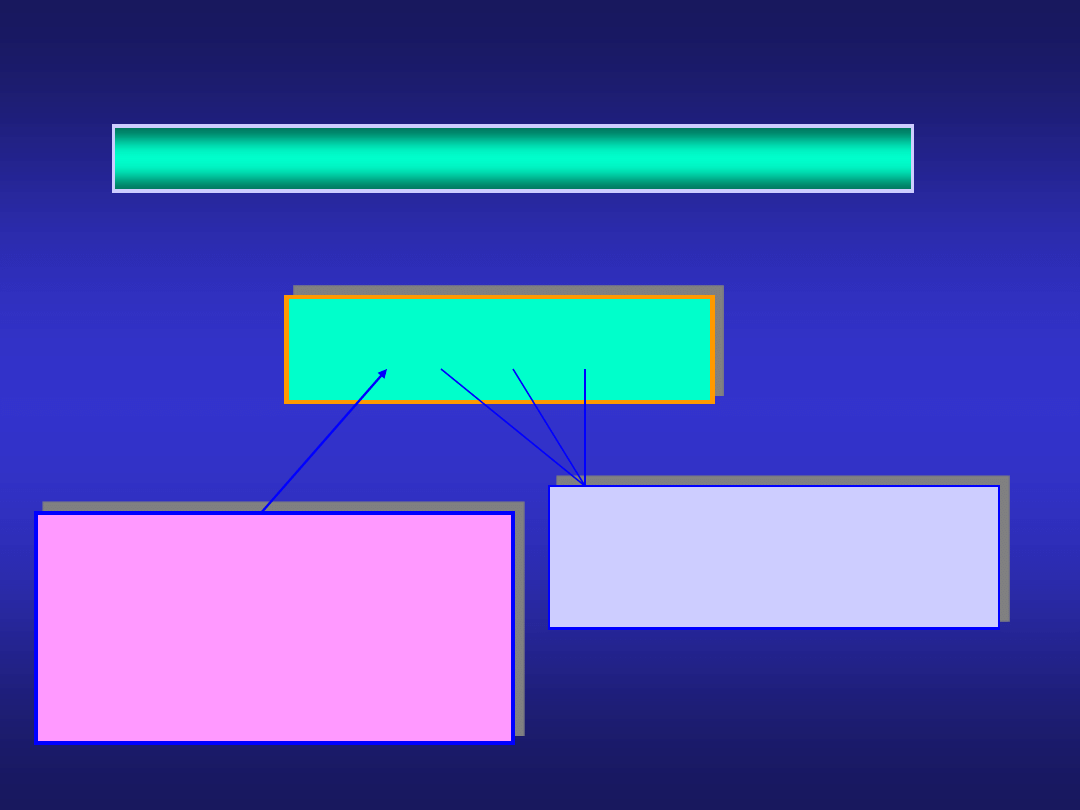
1
2
3
S
S
S
r
kc c c ...
1 1
2
2
3
3
S
S
S
......
produkty
..wiemy, że szybkość reakcji r :
można wyrazić jako:
stężenia
substratów
S
i
bardzo słabo lub w ogóle
nie zależą od temperatury
stała szybkości k musi
istotnie
zależeć
od
temperatury, skoro szybkość
reakcji r silnie zależy od
temperatury
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
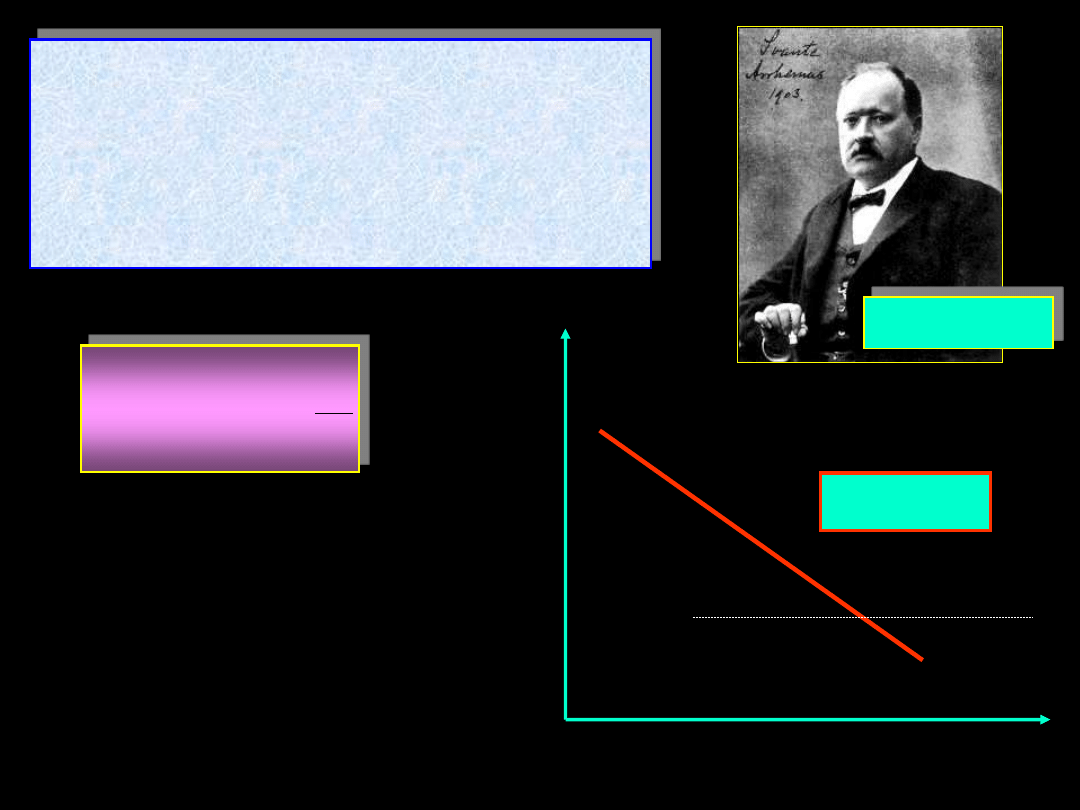
Svante Arrhenius (Szwecja) w 1889
ustalił,
że
z
bardzo
dobrym
przybliżeniem
zależność
stałej
szybkości k od temperatury T można
wyrazić równaniem:
1859-1927
A, B – dodatnie stałe
zależne od reagujących
substancji
T
B
A
)
k
ln(
T
-1
ln(k)
tg(
) = B
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
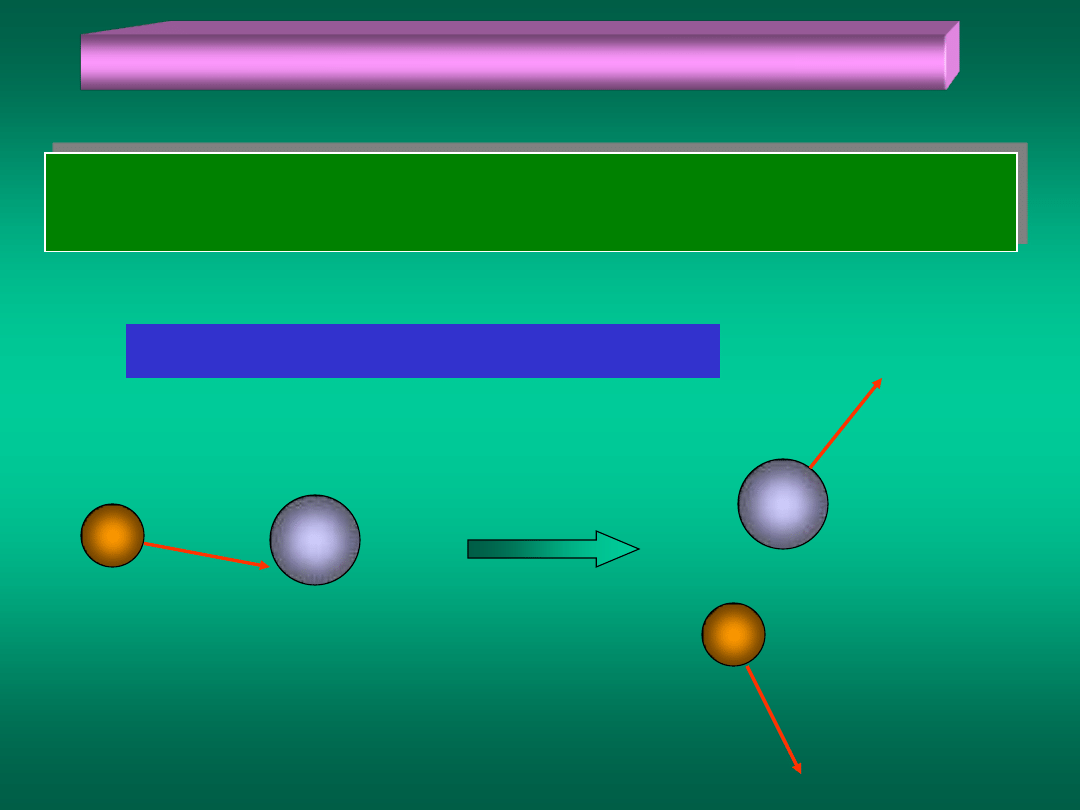
A
B
A
B
...możliwość I – zderzenie sprężyste
przed zderzeniem
po zderzeniu
Aby reakcja A + B
d C mogła zajść, atomy (cząsteczki) A i B
muszą wejść w kontakt (zderzyć się).
Zderzenia cząstek a szybkość reakcji chemicznej (1)
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
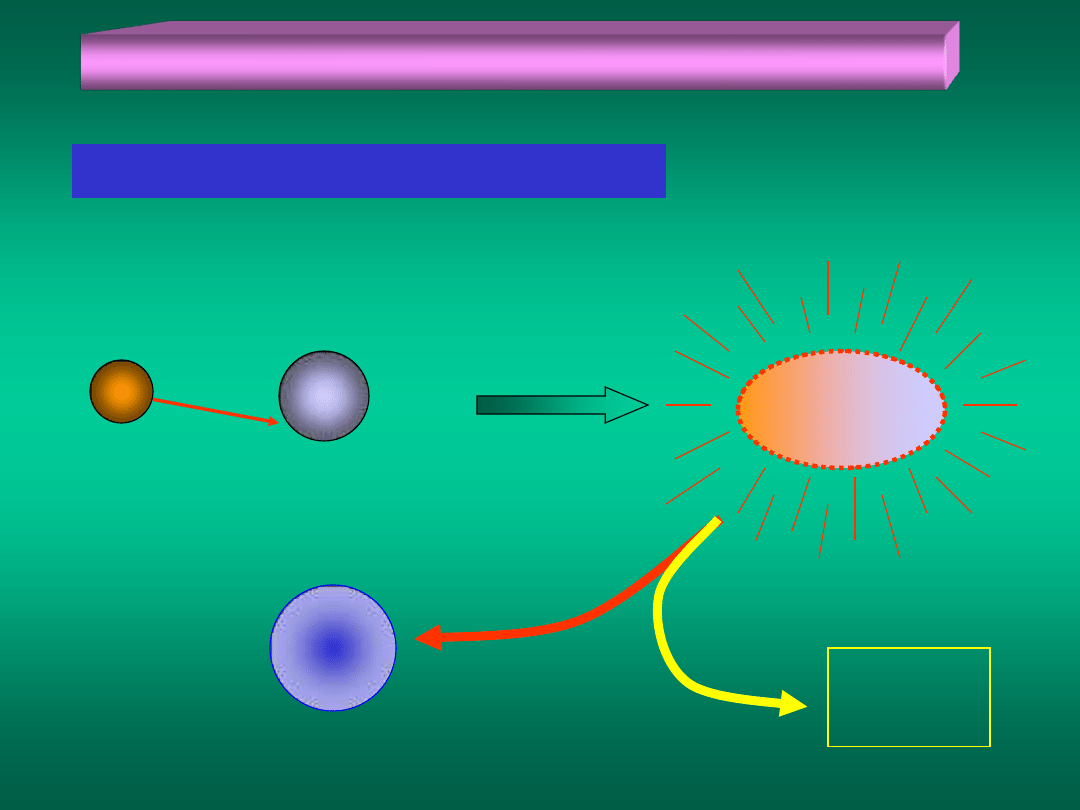
Zderzenia cząstek a szybkość reakcji chemicznej (2)
...możliwość II – zderzenie aktywne
A
B
przed zderzeniem
A B
C
nadmiar
energii
kompleks
aktywny
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Zderzenia cząstek a szybkość reakcji chemicznej (3)
Szybkość reakcji chemicznej powinna być proporcjonalna do
liczby zderzeń N
zd
między cząsteczkami (atomami) substratów
r = k’·N
zd
Ponieważ tylko ZDERZENIA AKTYWNE prowadzą do
reakcji, to dokładniej szybkość reakcji musi proporcjonalna do
liczby zderzeń aktywnych N
zd(akt)
zachodzących w jednostce
czasu i jednostce objętości reagującego układu:
r = k’’·N
zd(akt)
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
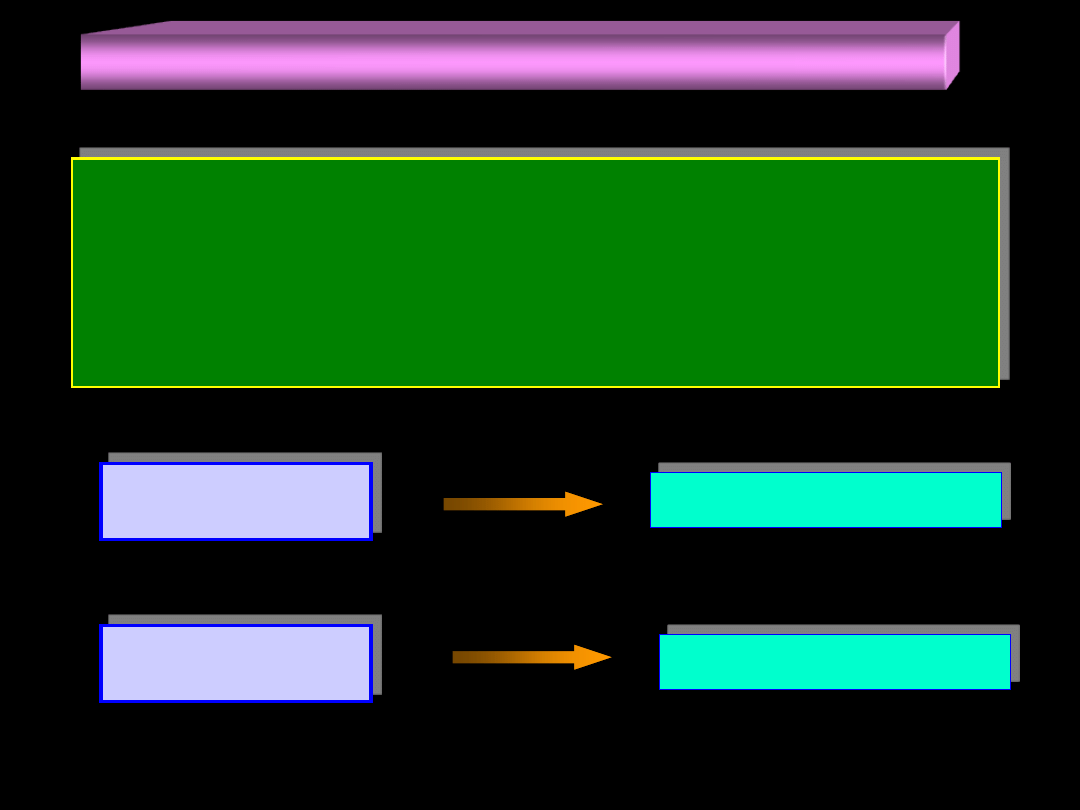
Zderzenia cząstek a szybkość reakcji chemicznej (5)
O tym czy zderzenie cząsteczek A i B jest aktywne
decyduje całkowita energia E
A
i E
B
wniesiona przez
cząsteczki do układu jaki tworzą one w chwili zderzenia.
Istnieje pewna progowa wartość tej energii zwana
ENERGIĄ AKTYWACJI E
a
, dla której spełnione jest:
a
B
A
E
E
E
a
B
A
E
E
E
zderzenie sprężyste
zderzenie aktywne
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
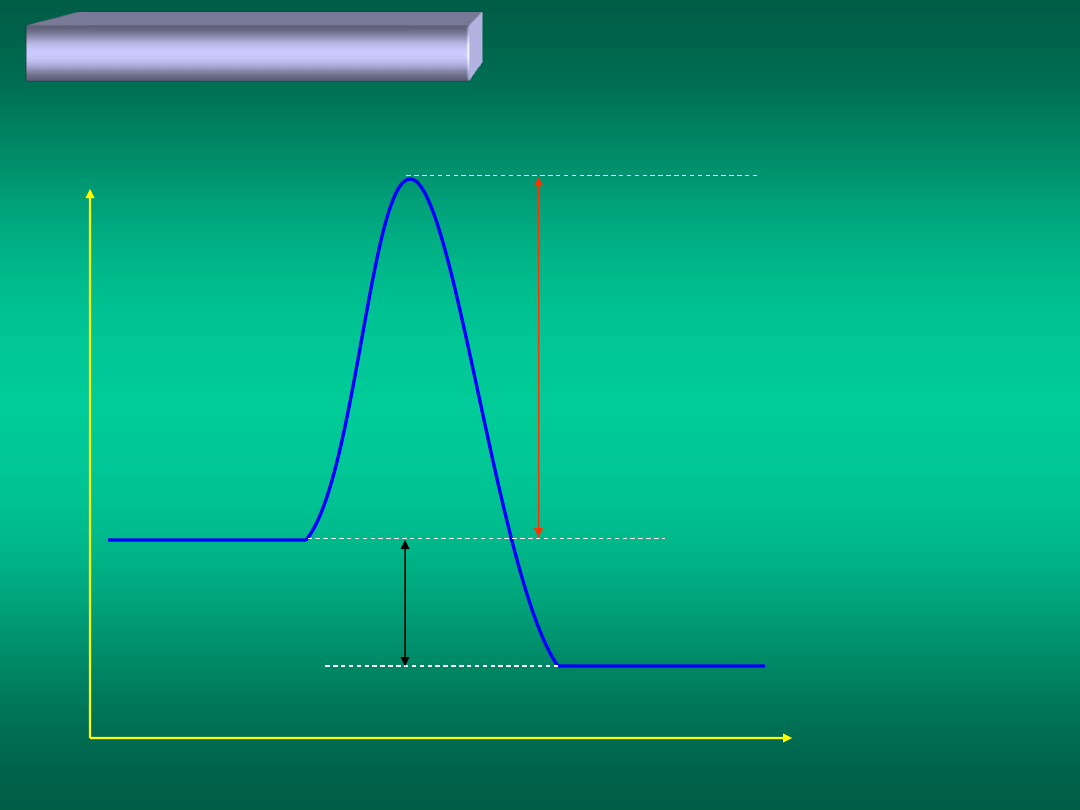
E
substr
E
prod
E
a
Q
ENERGIA AKTYWACJI
A + B = C
A + B
C
(A + B)
*
en
er
gia
droga reakcji
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
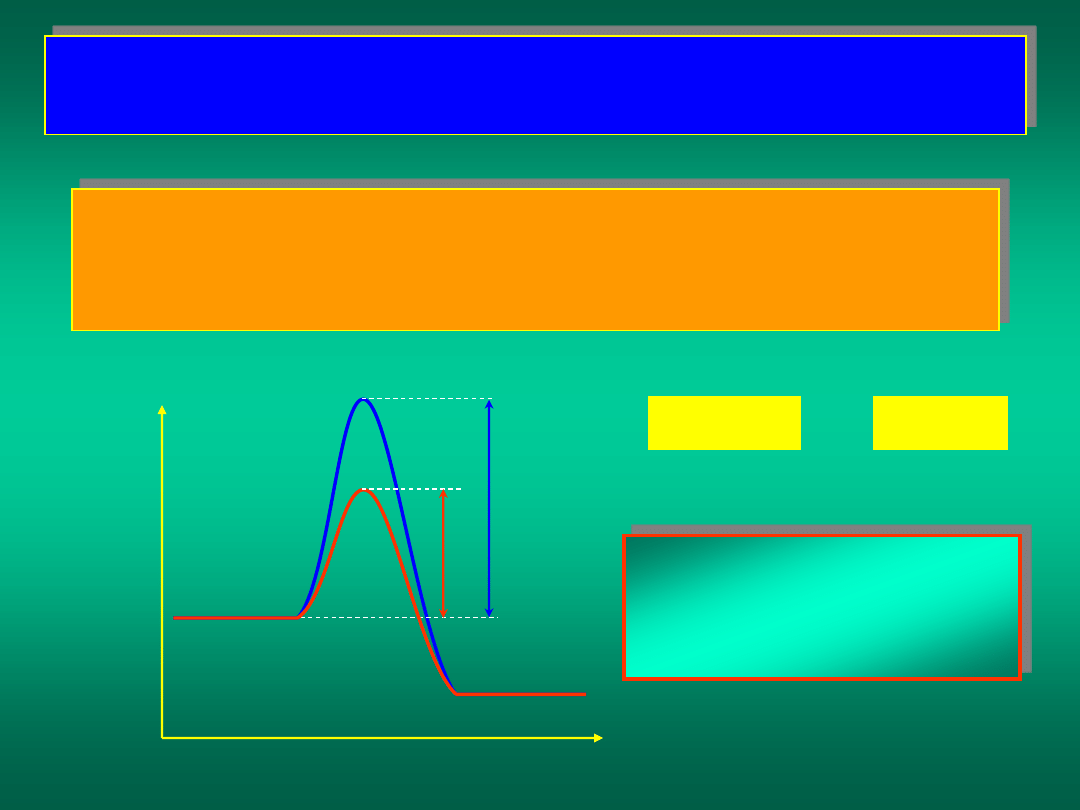
Energia aktywacji jest swoistą barierą, którą muszą pokonać
cząsteczki substratów aby utworzyć produkty.
Gdyby udało się obniżyć energię aktywacji, to przy tych
samych stężeniach substratów i w tej samej temperaturze
reakcja przebiegałaby szybciej.
A+B
C
E
1
E
2
E
2
<
E
1
r
2
>
r
1
Możemy ten cel
osiągnąć stosując tzw.
KATALIZATORY
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
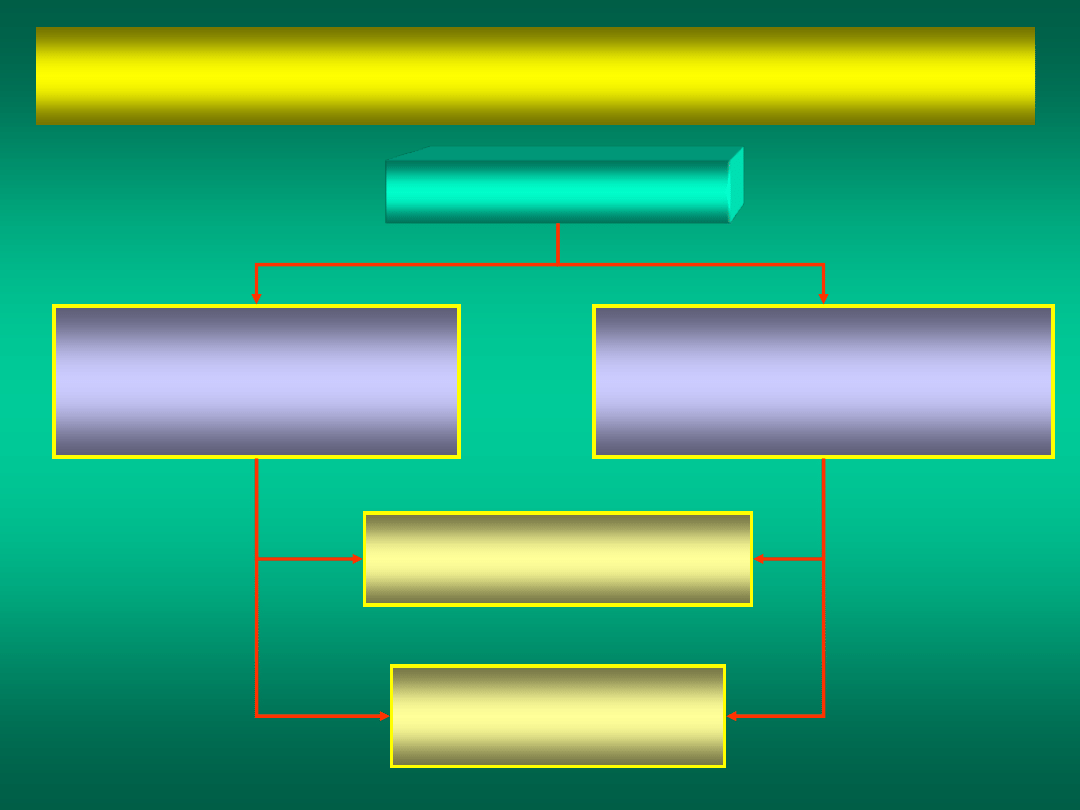
KATALIZA
KATALIZA
to zjawisko zmiany szybkości reakcji chemicznych
pod wpływem substancji zwanych
KATALIZATORAMI
HOMOGENICZNA
katalizator i substraty
tworzą jedną fazę
HETEROGENICZNA
katalizator i substraty
występują w różnych fazach
DODATNIA
szybkość
reakcji wzrasta
UJEMNA
szybkość
reakcji maleje
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
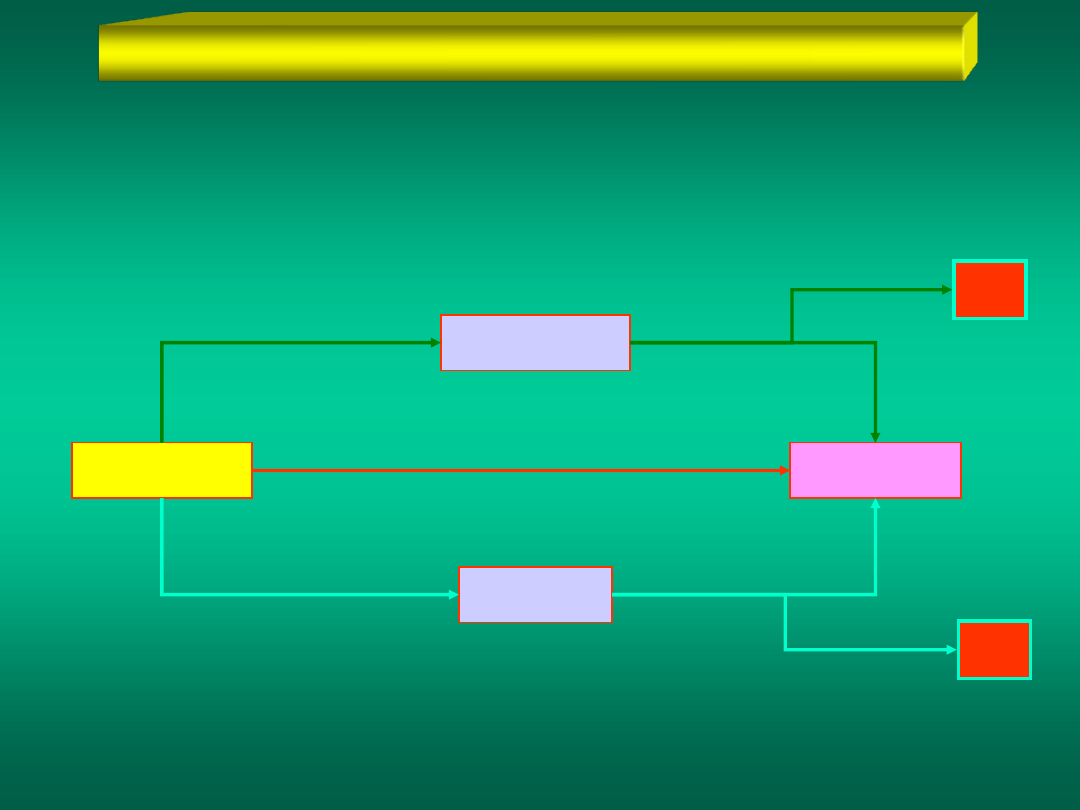
KATALIZA JEDNOFAZOWA (homogeniczna)
Wprowadźmy do reagującego układu A + B = C
Substancja K nie weszła w skład produktów reakcji
A + B
C
substancję K, która tworzy z A i B układ homogeniczny i ma
jedną z dwóch poniższych właściwości:
AK + B
+K
A + BK
+K
K
K
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
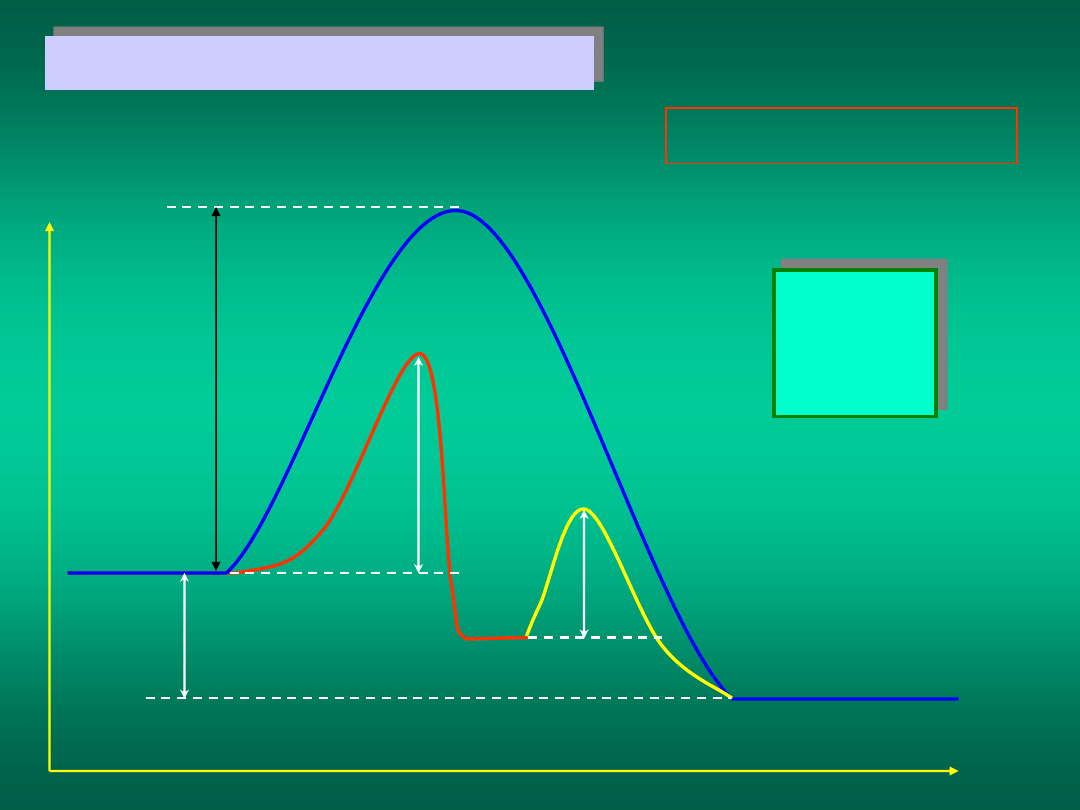
A+B
C
(A+B)
*
+K
+K
I
a
E
II
a
E
AK+B
Q
(A+K)
*
(AK+B)
*
Przykład działania katalizatora
A + B + K = C + K
E
E
a
II
a
a
I
a
a
E
E
E
E
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
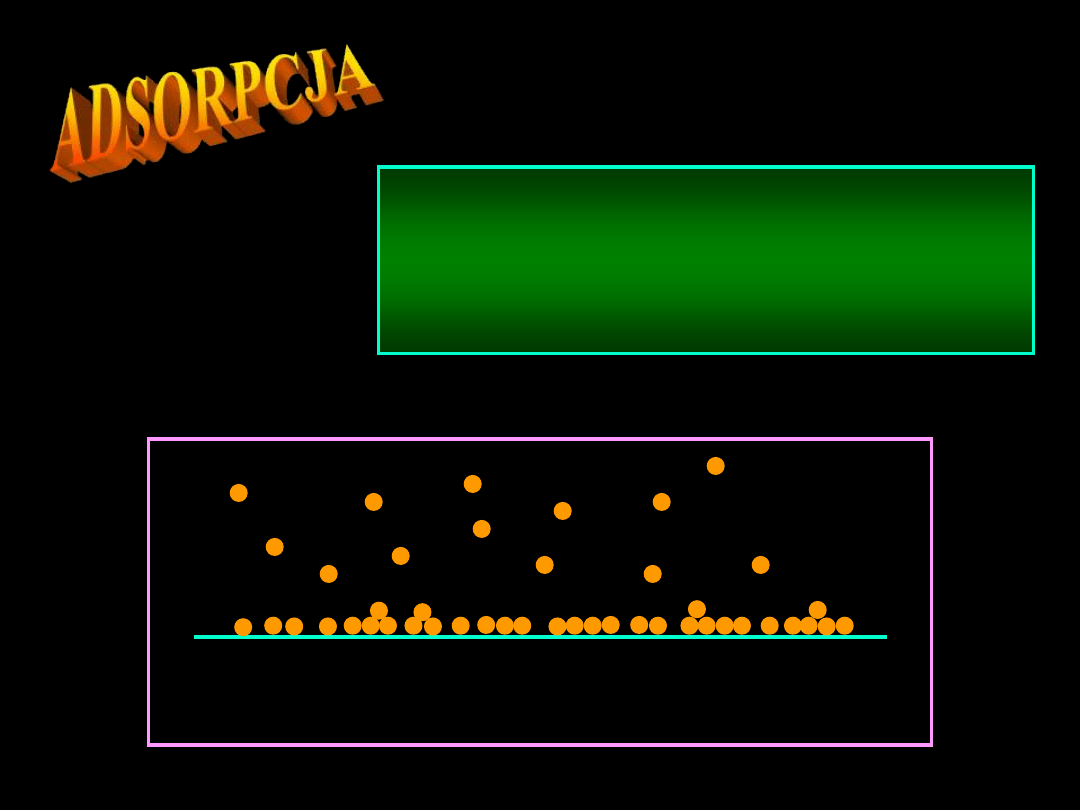
to zjawisko gromadzenia
się jakiejś
substancji
(adsorbatu)
na
powierzchni
ciała stałego lub cieczy
(adsorbentu).
faza stała
gaz
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
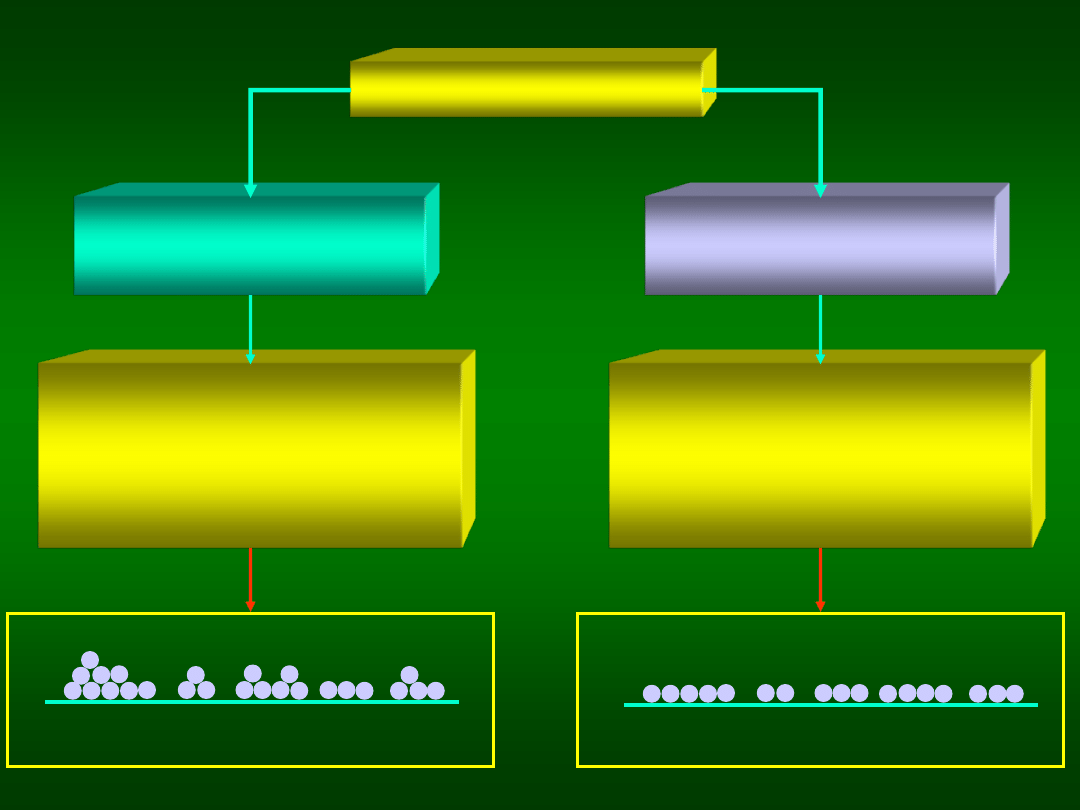
ADSORPCJA
FIZYCZNA
fizysorpcja
CHEMICZNA
chemisorpcja
pomiędzy
cząsteczkami
(atomami) adsorbatu i
adsorbenta
tworzą się
wiązania chemiczne
pomiędzy
cząsteczkami
(atomami) adsorbatu i
adsorbenta działają siły
Van der Waalsa
STOPIEŃ POKRYCIA POWIERZCHNI
Q
powierzchnia S
0
na
której zachodzi
adsorpcja
obszary zajęte przez
zaadsorbowane cząsteczki
o łącznej powierzchni S
a
stopień pokrycia
powierzchni:
0
a
S
S
Q
0
1
Q
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
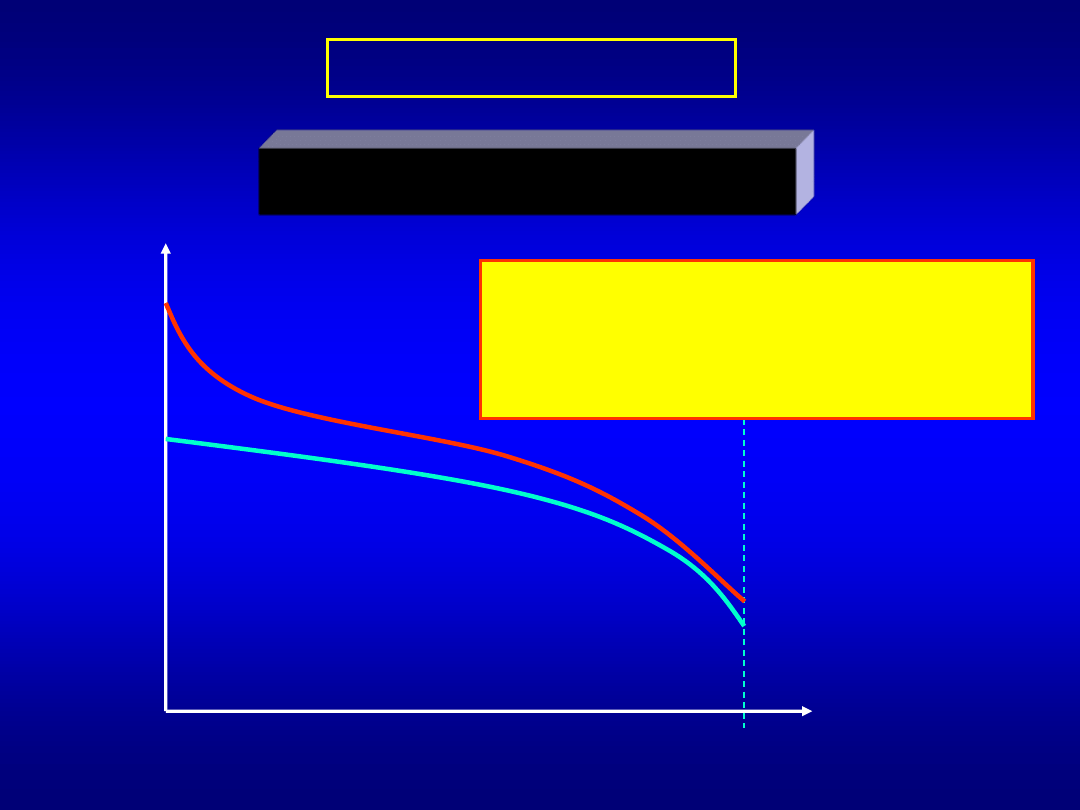
CIEPŁO ADSORPCJI
A
(g)
→ A
(ads)
D
H < 0
ciepło
w
ydzielo
ne
stopień pokrycia powierzchni
Q
1
Zmiana ciepła adsorpcji ze stopniem
pokrycia
Q
jest wynikiem oddziaływań
pomiędzy zaadsorbowanymi atomami
lub cząsteczkami
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
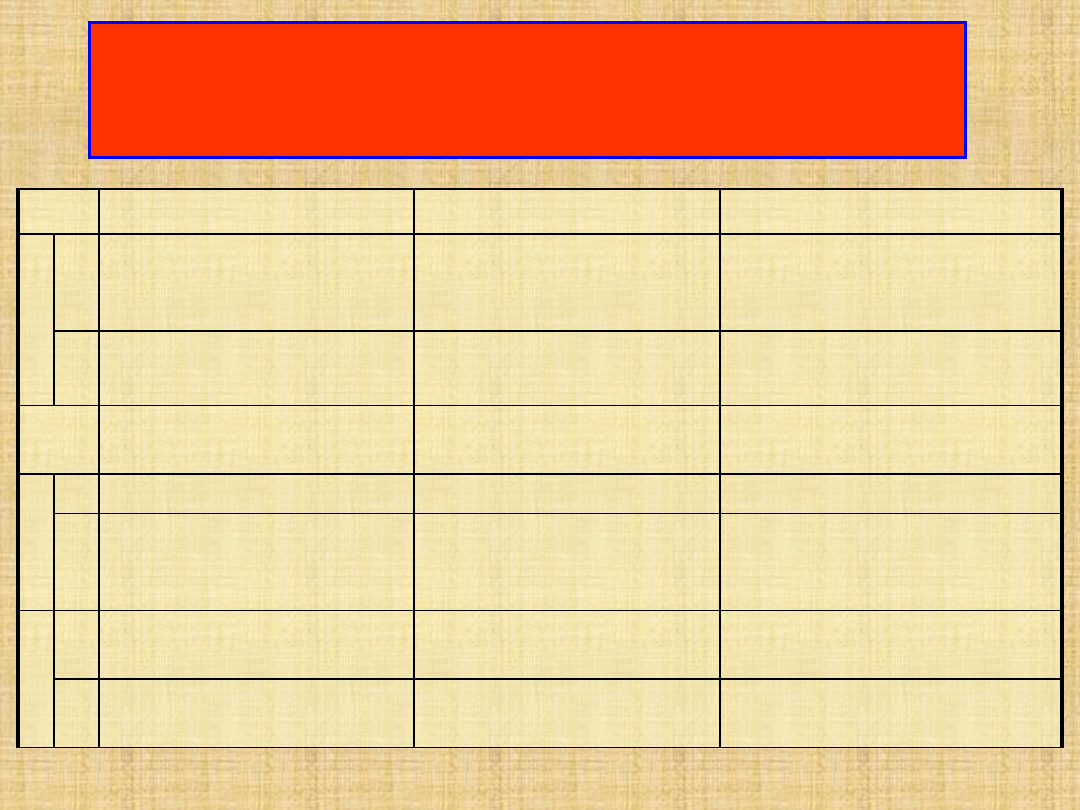
Porównanie cech charakterystycznych adsorpcji i
chemisorpcji
Lp.
Cecha charakterystyczna
Fizysorpcja
Chemisorpcja
1
a
Siły wiązań między
cząsteczkami adsorbatu i
adsorbenta
Słabe siły Van der Waalsa
Duże siły zbliżone do sił
wiązań chemicznych
b
Efekt cieplny zjawiska
Małe ciepła adsorpcji
10-30 kJ/mol
Duże ciepła adsorpcji
>70-100 kJ/mol
2
Równowaga adsorpcji i
desorpcji
Całkowita odwracalność
Częściowa nieodwracalność
3
a
Energia aktywacji
Nie występuje
Duża energia aktywacji
b
Przebieg zjawiska w funkcji
temperatury
Względnie duża szybkość
już przy niskich
temperaturach
Dopiero w wysokich
temperaturach nie jest silnie
hamowana
4
a
Zależność od rodzaju
substancji biorących udział
Brak istotnej specyfiki
Silna specyfika
b
Stopień pokrycia
powierzchni
Możliwe powstanie warstw
multimolekularnych
Zahamowanie procesu przy
monomolekularnym pokryciu
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

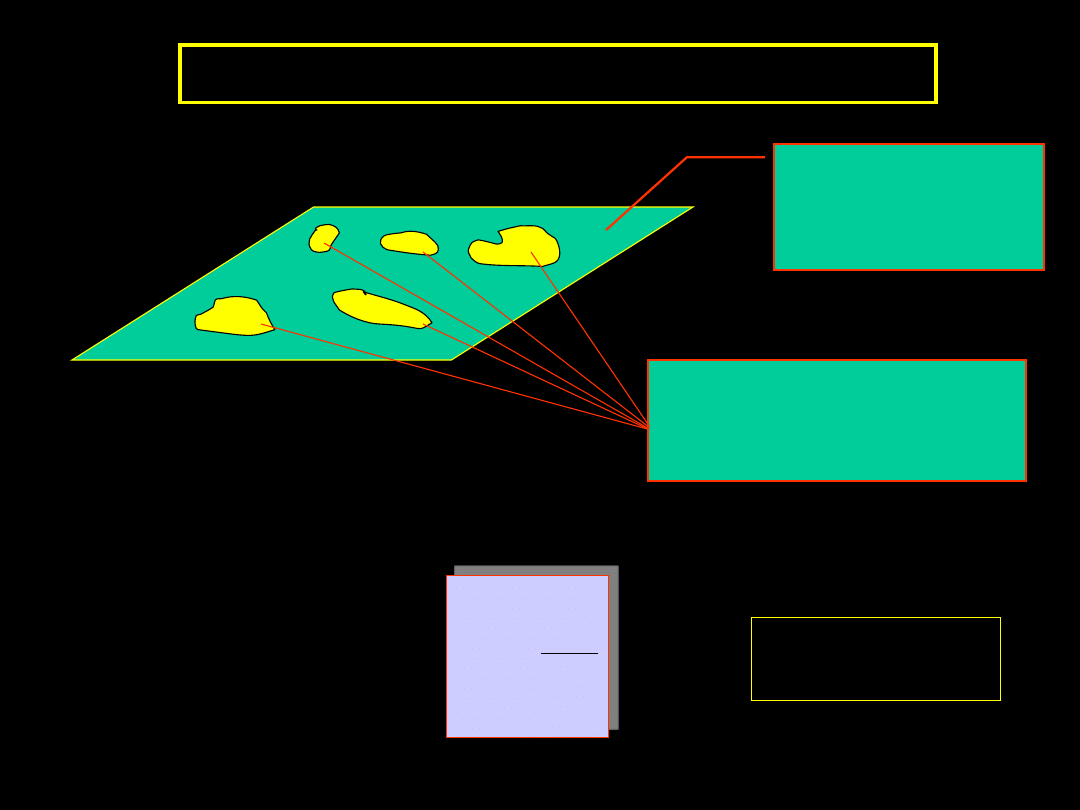
ADSORPCJA NA POWIERZCHNI CIAŁ STAŁYCH
CENTRA AKTYWNE
Granica faz ciało stałe – gaz czy ciało stałe – ciecz nie jest
abstrakcyjną powierzchnią geometryczną, tylko realnym
bytem fizycznym utworzonym przez atomy, jony lub
cząsteczki.
Adsorpcja cząsteczek (atomów) adsorbatu zachodzi tylko
na pewnych szczególnych miejscach tej granicy, które
nazywamy
CENTRAMI AKTYWNYMI
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
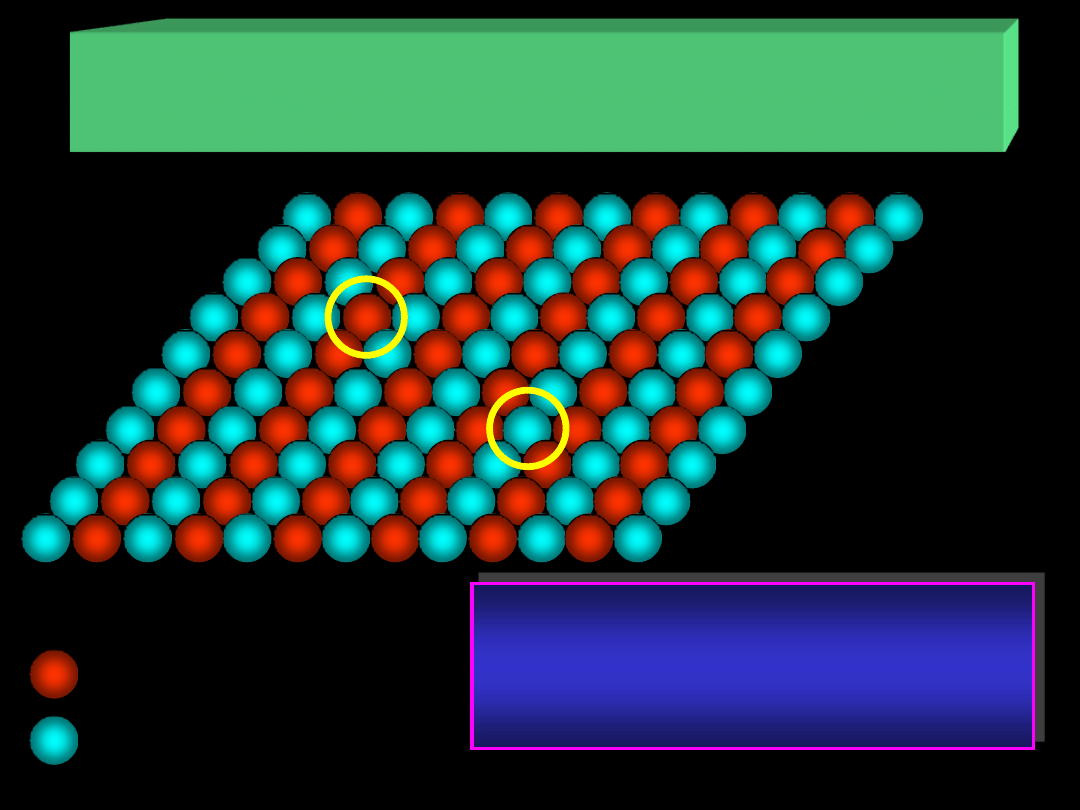
ADSORPCJA NA POWIERZCHNI CIAŁ STAŁYCH
I. Centra aktywne – atomy lub jony na powierzchni
atom (jon) A
atom (jon) B
I.
Każdy atom (jon) może stanowić
centrum aktywne
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
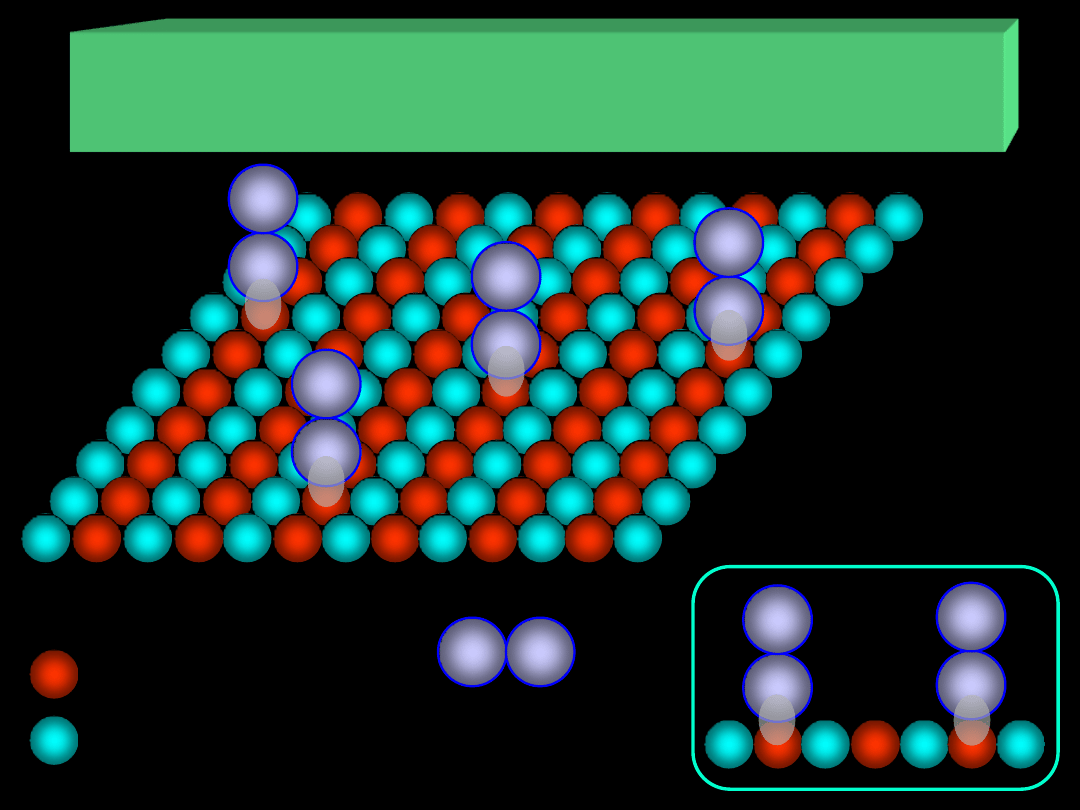
atom (jon) A
atom (jon) B
cząsteczka
adsorbatu
ADSORPCJA NA POWIERZCHNI CIAŁ STAŁYCH
I. Centra aktywne – atomy lub jony na powierzchni
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
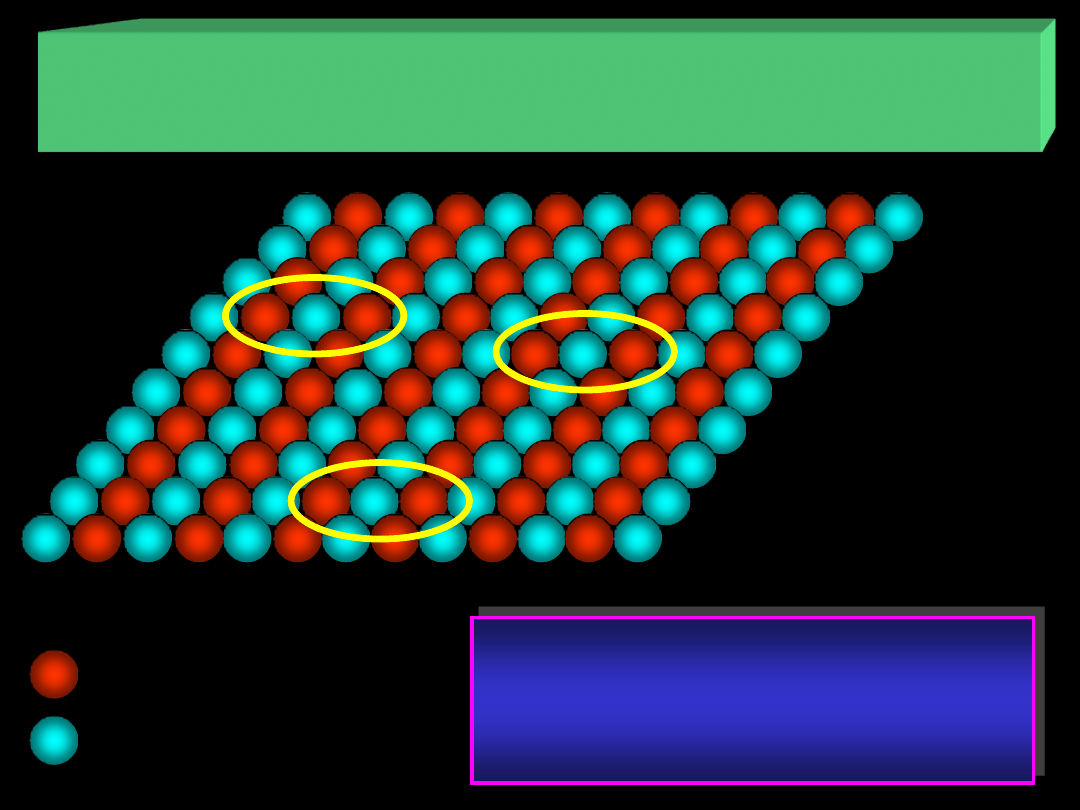
atom (jon) A
atom (jon) B
ADSORPCJA NA POWIERZCHNI CIAŁ STAŁYCH
II. Centra aktywne – grupy atomów lub jonów na powierzchni
II.
Grupy atomów (lub jonów) mogą
stanowić centra aktywne
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
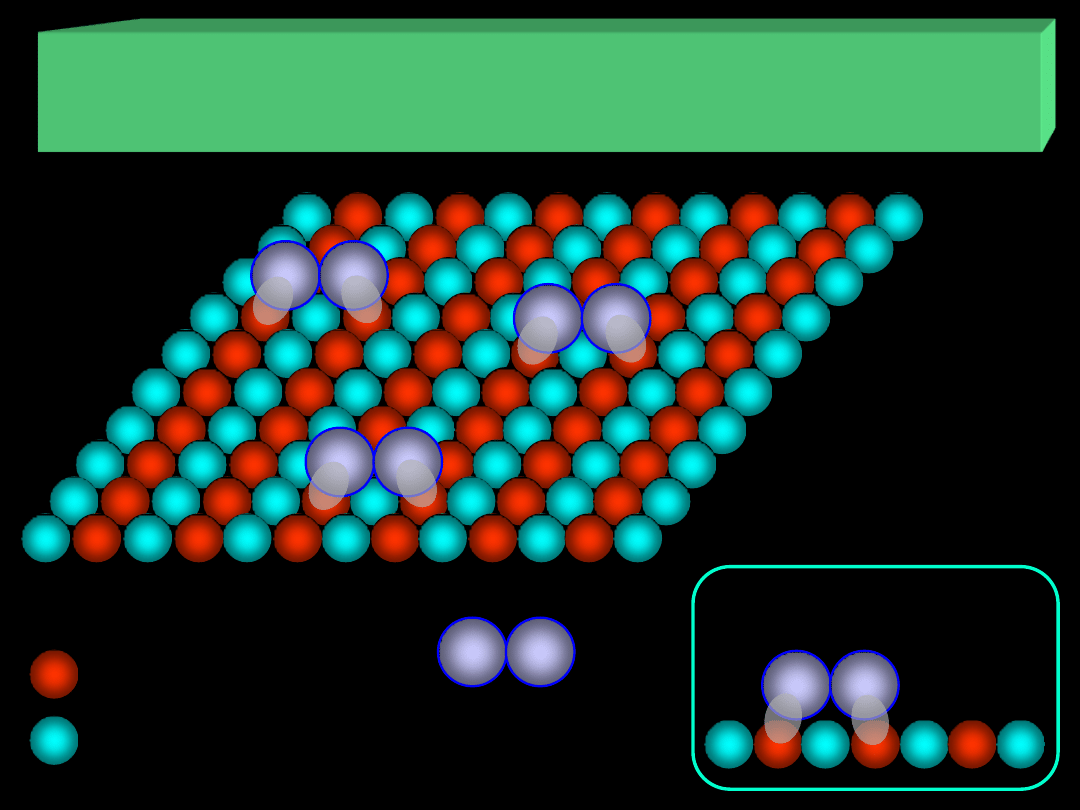
atom (jon) A
atom (jon) B
cząsteczka
adsorbatu
ADSORPCJA NA POWIERZCHNI CIAŁ STAŁYCH
II. Centra aktywne – grupy atomów lub jonów na powierzchni
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
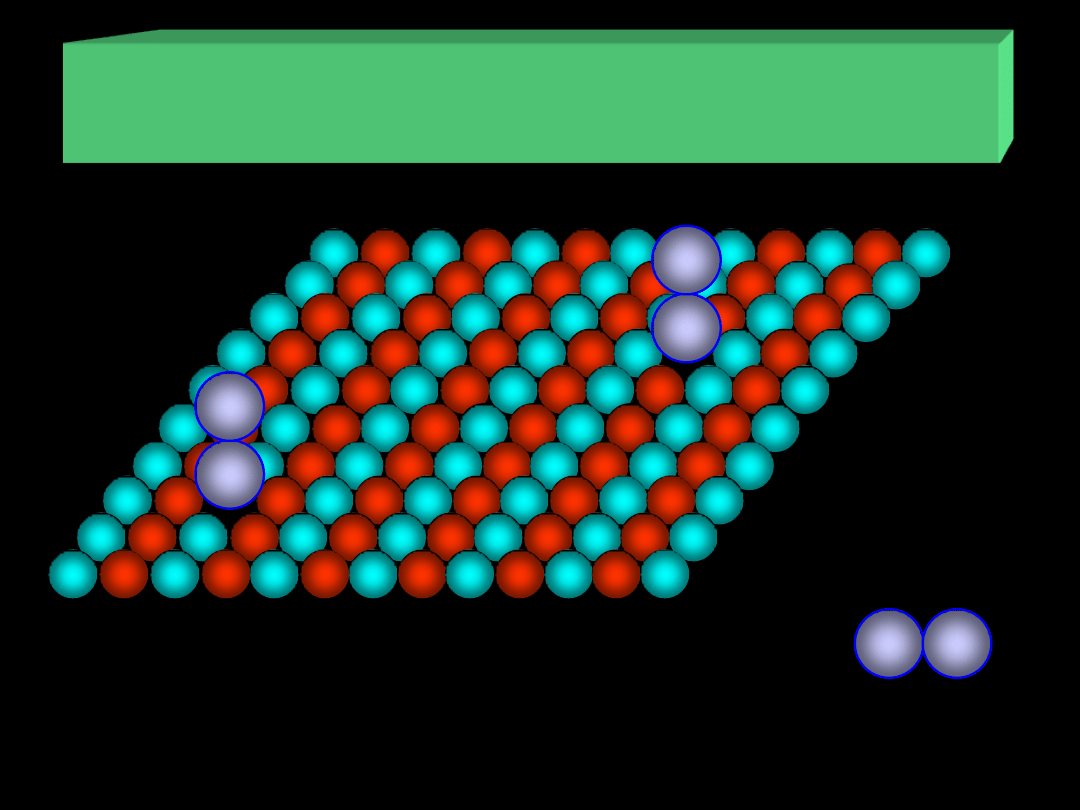
ADSORPCJA NA POWIERZCHNI CIAŁ STAŁYCH
III. Centra aktywne – defekty na powierzchni
cząsteczka
adsorbatu
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Etapem KAŻDEJ katalitycznej heterogenicznej reakcji
chemicznej są procesy ADSORPCJI
KATALIZA HETEROGENICZNA

KATALIZA HETEROGENICZNA
etapy reakcji
1. dyfuzja substratów A i B do powierzchni katalizatora
2. adsorpcja substratów A i B na powierzchni katalizatora
A
(g)
+ B
(g)
t A
(ads)
+ B
(ads)
3. reakcja na powierzchni katalizatora:
A
(ads)
+ B
(ads)
t C
(ads)
4. desorpcja produktu z powierzchni katalizatora:
C
(ads)
t C
(g)
5. dyfuzja produktu C od powierzchni katalizatora
A + B
K
C
Materiały dydaktyczne dla studentów i roku WGGiIŚ, kier. IŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
Wyszukiwarka
Podobne podstrony:
Ch WGGiIS Wyklad6
Ch WGGiIS Wyklad13
ch infekcyjne wyklad
Ch organiczna wykład 1d
Ch organiczna wykład 1g
ch zywnosci wyklad 4 lipidy low
CH klin wykład 2
Ch organiczna wykład 1e
CH klin wyklad 1ok id 110378 Nieznany
ch nieorg11 wyklady
CH Ż OD 9 wykłady
Ch organiczna wykład 1c
ch infekcyjne wyklad
Ch organiczna wykład 1d
Ch organiczna wykład 1g
ch zywnosci wyklad 4 lipidy low
więcej podobnych podstron