
1
Chemia kliniczna
Walidacja metody analitycznej: Weryfikacja danych dotyczących
charakterystyki metody wykonywanej w określonym laboratorium
Zakres roboczy: zakres zastosowania metody w którym precyzja metody,
poprawność i liniowość mieści się w przyjętych granicach
Liniowość: zakres metody gdzie wykres kalibracji określony poprzez
obliczanie współczynnika regresji liniowej metodą najmniejszych kwadratów r
> 0,999
Czu
łość analityczna: jest to najmniejsza ilość substancji, która może być
miarodajnie oznaczona za pomoc
ą wybranej metody w określonej ilości
materia
łu badanego. [ wz , 20%]
Specyficzno
ść / selektywność metody: specyficzność lub swoistość metody
to zdolno
ść metody do reagowania (oznaczania) tylko substancji badanej.
Zwykle oznaczenia prowadzimy u
żywając materiału o bardzo złożonym
sk
ładzie chemicznym (krew, mocz, PMR itp.)
Poprawność: stopień zgodności pomiędzy średnią wartością zmierzoną a
wartością oczekiwaną (nominalną).
Obciążenie (bias): różnica pomiędzy wartością oczekiwaną wyniku a przyjętą
wartością odniesienia (nominalną)
Chemia kliniczna
Strategia wyboru metody analitycznej
polega na uwzględnieniu jej:
użyteczności diagnostycznej = pomoc w określeniu
występowania i stopnia zaawansowania choroby
użyteczności praktycznej = dostępność aparatury, odczynników,
koszty, trwałość odczynników itp).
swoistość metody = analityczna specyficzność wobec
oznaczanego składnika. Mała swoistość to możliwość
inteferencji z innymi składnikami próbki.
dokładność metody = zgodność uzyskanego wyniku z wartością
rzeczywistą ( wartość rzeczywistą ustala się przez pomiar
bardzo dokładnymi metodami referencyjnymi = odniesienia).
Błąd dopuszczalny
Kryteria dopuszczalno
ści błędu metody:
B
łąd dopuszczalny - maksymalny błąd pomiaru
kt
óry nie zmienia w istotny sposób
analitycznego i klinicznego znaczenia wyniku.
2. Wed
ług klinicystow: błąd nie powinien
przekracza
ć klinicznie istotnej różnicy pomiędzy
grup
ą chorych i grupą odniesienia - nie
zalecane
3. Okre
ślenie błędu dopuszczalnego w oparciu
o informacje na temat zmienno
ści biologicznej
okre
ślonych parametrow.
• Zmienność wewnątrzosobnicza badanego
parametru wyraża różnice
wewnątrzosobnicze, występujące w czasie.
Są one spowodowane między innymi dietą,
wysiłkiem fizycznym, lekami, położeniem
ciała, godziną pobrania próbki.
• Zmienność zewnątrzosobnicza wyraża
różnice, występujące między badanymi
osobami. Wynikają one z wieku, płci, rasy,
uwarunkowania genetycznego i.t.d.
Błąd dopuszczalny
Błąd dopuszczalny
Przykłady zmienności wewnątrzosobniczej i międzyosobniczej
Parametr
Wewnątrz-(%)
Między-(%)
1.Aminotransferaza aspartylowa
24,3
41,6
2.Fosfataza alkaliczna
32,6
39,0
4.Dehydrogenaza mleczanowa
6,6
14,7
5.Bilirubina
25,6
30,5
7.Kreatynina
4,3
12,9
8.Albumina
3,1
4,2
9.Wapń
1,9
2,8
11.Potas
13,6
13,4
12.Sód
0,7
1,0
Dopuszczalny błąd precyzji
CV
A
≤ 0,5 x CV
1
CV
A
-
współczynnik zmienności określający
dopuszczalny błąd precyzji
CV
1
-
współczynnik zmienności określający
zmienność wewnątrzosobniczą
Współczynnik zmienności dopuszczalnego
błędu precyzji nie powinien przekraczać
połowy zmienności wewnątrzosobniczej
badanego parametru
.
Błąd dopuszczalny

2
Dopuszczalny błąd dokładności
B
A
=
%
A
≤ 0,25 x CV
1
2
+
CV
G
2
CV
1
-
współczynnik zmienności określający zmienność
wewnątrzosobniczą
CV
G
-
współczynnik zmienności określający zmienność
międzyosobniczą
B
A
=
%
A
– względna różnica określająca dopuszczalny błąd dokładności
Wyznaczanie dopuszczalnego błędu w oparciu o kryteria
zmienności biologicznej mogą być korygowane w zależności
od możliwości technicznych (precyzja analityczna) metody.
DBD - Powinien wyrażać się różnicą nie przekraczającą
jednej czwartej sumy zmienności wewnątrzosobniczej i
międzyosobniczej badanego parametru.
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Na podstawie pożądanej precyzji i dokładności wyliczyć można
dopuszczalny błąd całkowity: TE
A
TE
A
= (1,65xCV
A
) + B
A
CV
A
= współczynnik zmienności określający dopuszczalny błąd
precyzji, precyzja pożądana
B
A
= względna różnica określająca dopuszczalny błąd dokładności,
dokładność pożądana
Wyznaczanie dopuszczalnego błędu w oparciu o kryteria zmienności
biologicznej mogą być korygowane w zależności od możliwości
technicznych (precyzja analityczna) metody.
Błąd dopuszczalny
Przykłady proponowanego błędu
dopuszczalnego całkowitego TE
A
(%):
1.
Sód
0,3
2. Potas
2,4
3.
Wapń
0,9
4.
Żelazo
15,9
5. Cholesterol
2,7
6. glukoza -
2,2
7. bilirubina-
11,3
8. tr
ójglicerydy -
11,5
9. kinaza kreatyny -
20.9
Wartości Referencyjne
Wartości referencyjne
Wartości referencyjne - definicja : zakres wartości badanego parametru
obserwowane lub mierzone w zdefiniowanej grupie uczestników
badania.
1.
Statystycznie
wartości obserwowane w grupie badanie które mają zwykle rozkład
„normalny” wg Gausa
2. Epidemiologiczne
Wyniki badań wykonane na dużej grupie zdrowych ochotników.
Przykład – wykazano że 95% wyników TG zawarte jest w granicach
0.6
– 2.4 mmol/L. Wiadomo, że wartości te mogą zmieniać się w
zależności od składu demograficznego grupy.
3. Kliniczne
Wartości określonego parametru spotykane w grupie pacjentów u
których nie stwierdzono określonej choroby.
Wartość mierzona (obserwowana) - wartość uzyskana w celu porównania z
wartościami referencyjnymi w celu podjęcia decyzji medycznej
Wartości referencyjne
WARTOŚCI NORMALNE, ZAKRES REFERENCYJNY
Przyczyny ustalenia wartości normalnych:
1.
tworzenie układu odniesienia dla wyników laboratoryjnych,
2.
wskazówka do określenia błędu dopuszczalnego analizy,
3.
ocena wartości diagnostycznej testu analitycznego.
Warunki konieczne
do właściwego pomiaru wartości normalnych:
1.
dobór osób referencyjnych wg ustalonego kryterium zdrowia,
2.
odpowiednio duża liczebność grup o wyodrębnionych cechach
(wiek, płeć, rasa, itd.),
3.
określone warunki pobierania, z uwzględnieniem zmienności
okołodobowej,
4.
określone warunki transportowania, przechowywania,
postępowania analitycznego,
5.
kontrola jakości wyników: dokładności i precyzji wg ustalonego BD,
6. profesjonalne opracowanie statystyczne.

3
Wartości referencyjne
Warunki tworzenia grupy referencyjnej
:
1.
Precyzyjna definicja grupy badanej (wiek, płeć, rasa
itp.)
2.
Badana grupa referencyjna powinna charakteryzować
się podobnymi cechami demograficznymi jak
potencjalna grupa pacjentów
3. Standaryzowane metody pobierania, przechowywania i
transportu materiału
4.
Ten sam rodzaj materiału badanego
5.
Standaryzowane metody analizy materiału
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Triglicerydy – 95% CE
Na
+
= x
śr
± 2 OS
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Cel kontroli wewnątrz i zewnątrzlaboratoryjnej:.
-
wykrywa niezgodności w kalibracji metod
-
pomaga ustalić listę rekomendowanych metod
-
normy ustalone dla określonego laboratorium stają się
normami ogólnymi (identyczne dla każdego lab.)
- wzrasta zaufanie lekarza do pracy laboratorium
-
wzrasta prawdopodobieństwo otrzymania identycznych
wyników kiedy materiał od tego samego pacjenta
zostanie oznaczony w kilku laboratoriach
-
licencjonowanie laboratoriów
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Materiał kontrolny: liofilizowany, rozpuszczany przed oznaczaniem
przygotowywany przez firmy, biologicznie bezpieczny
Materiał kontrolny komercyjny - normalny oraz patologiczny (lipemiczne,
glikemiczne), m
ateriał kontrolny ma stabilny skład w seriach i między seriami.
Kontrola wewnątrzlaboratoryjna: kontrola metody przez personel laboratorium.
Kontrola międzylaboratoryjna: centralnie rozdzielane jest ten sam materiał
kontrolny do szeregu laboratoriów (laboratoria nie znają stężenia) - jednostka
centralna zbiera wyniki i porównuje je.
Metoda referencyjna (porównawcza) - ten sam materiał testowany identyczną
metodą w wyselekcjonowanych laboratoriach. Średnia wartość jest uważana za
wartość prawdziwą. Laboratorium referencyjne: laboratorium wykonujące testy
dla metody referencyjnej.
Wartość średnia grupy kontroli: wartość średnia danego parametru oznaczonego
w tym samym materiale w rutynowych lab. dysponujących tym samym
wyposażeniem technicznym. Zazwyczaj pośrednikiem I jednostką zbierającą
wyniki jest laboratorium naukowe firmy produkującej sprzęt laboratoryjny
.
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Warunkiem prawidłowego wyznaczenia powtarzalności a szczególnie
odtwarzalności metody jest używanie odpowiedniego materiału kontrolnego.
Materiałem (surowicą) kontrolną jest płynna lub stała (liofilizowana) surowica
ludzka lub bydlęca która zachowuje stały stężenie (aktywność) badanych
parametrów przez dłuższy okres czasu. Zwykle duża partia surowicy
podzielona jest na porcje o identycznym składzie. Stosuje się zwykle materiał
kontrolny zawierający stężenie składników spotykanych u osób zdrowych
(poziom N) oraz osób chorych (poziom P).
Preparaty krwi pełnej do kontroli jakości badań hematologicznych przygotowuje
się analogicznie - trzy poziomy stężenia poszczególnych komórek.
Surowica kontrola może być:
1. mianowana – laboratorium referencyjne fabrycznie oznaczyło stężenie
określonych składników w surowicy kontrolnej.
2. niemianowana – znane są jedynie przybliżone wartości stężenia badanych
składników.
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Kontrola jakości badań laboratoryjnych
1.
Kontrola precyzji metody – polega na wielokrotnym oznaczeniu
stężenia określonej substancji w tym samym materiale.
Kontrolujemy powtarzalność metody – zgodność wyników
oznaczania w tej samej próbce w jednej serii pomiarowej na tym
samym aparacie i stosując ten sam system kalibracji aparatu –
określamy najmniejszą możliwą zmienność analityczną jaką można
osiągnąć za pomocą określonej metody analitycznej, określonego
zestawu odczynników i określonego sprzętu.
Kontrolujemy odtwarzalność metody
– zgodność wyników oznaczeń
w poszczególnych dniach pracy aparatu.
Wyniki odtwarzalności oznaczeń określonego parametru przez 21-
30 dni pozwalają na wyliczenie średniej arytmetycznej i odchylenia
standardowego (rozproszenie wyników wokół wartości średniej).
Karty kontroli Levy-Jenningsa.

4
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Kontrola odtwarzalności (międzyseryjnej)
materiałem kontrolnym jest liofilizowana surowica bydlęca -
porcjowane, przechowywane w - 20
o
C . Materiał nie jest
metrykowany.
Metrykowanie materiału kontrolnego - oznaczanie parametrów
przez 21 dni, określenie WZ, powinna być < niż 0,5 DGB
Postępowanie z próbą kontrolną:
a. włączenie jej do każdej serii badań
b. włączenie do każdego wyniku badań - dyżur, cito
obliczanie błędu = Xi x 100 / Xśr = bł(%)
Materiał kontrolny
Matryca analityczna:
Materia
ł biologiczny o bardzo złożonym składzie
chemicznym np. krew, mocz, PMR, ka
ł itp. zawiera szereg
substancji chemicznych po
łączonych ze sobą w postaci
kompleks
ów, soli złożonych, miceli woda-lipid.
Wyst
ępowanie tego rodzaju połączeń może przeszkadzać w
reakcji chemicznej lub immunochemicznej.
Wyst
ępujący w materiale badanym określony układ
substancja badana - substancje towarzysz
ące nazywamy
matryc
ą analityczną.
Zmiany sk
ładu chemicznego podczas reakcji chemicznej
np. wytr
ącanie białka z surowicy przed oznaczaniem
niekt
órych leków mogą mieć wpływ na ostateczny wynik
badania.
Materiał kontrolny
Przykładem matrycy analitycznej jest surowica bydlęca
lub surowica ludzka osób zdrowych stosowana do
przygotowania „materiałów kontrolnych”
Materiał kontrolny
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Kontrola dokładności:
metrykowany materiał kontrolny: Serostandard N i
P, Europe Control Serum Hyland itp.
cel: określenie błędu dokładności:
% bł. = [X(śr z 3 ozn) - Xrz] x 100 / Xrz
Kontrolę prowadzi się na karcie kontroli odkładając
% bł - data bad.
Materiał nie służy jako wzorzec lub kalibrator.
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
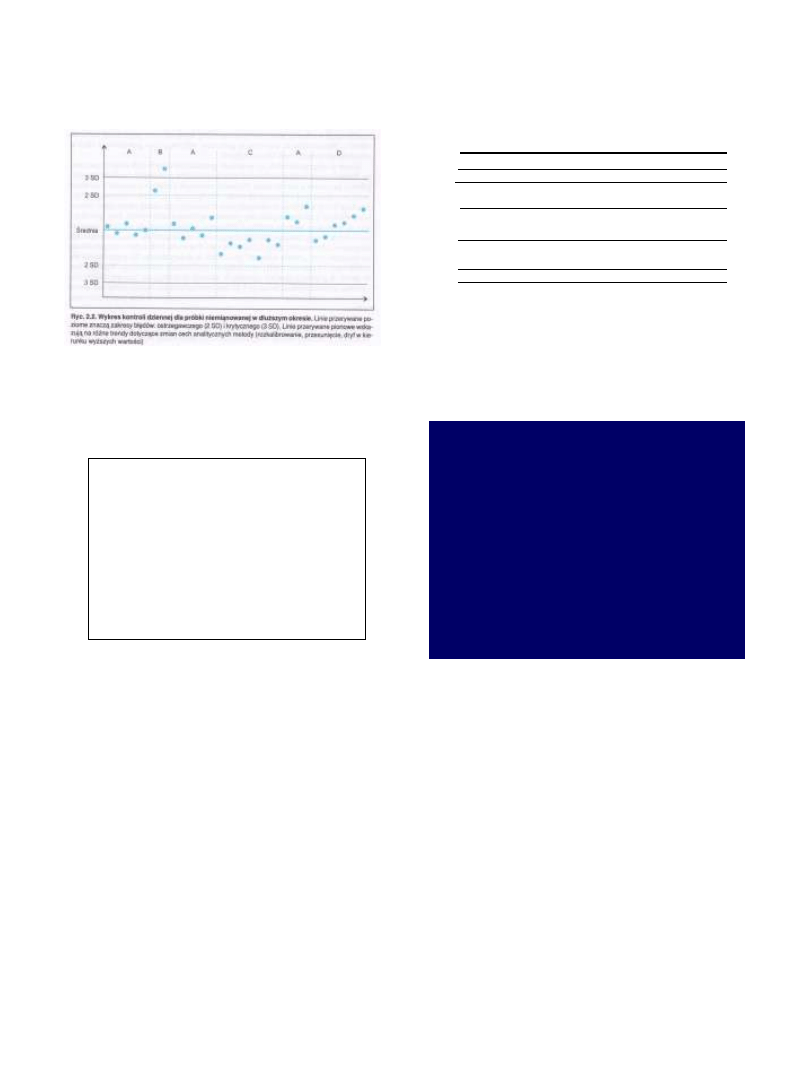
5
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Reguły Westegarda:
reakcja
1
2S
- > X + 2 OS
(ostrzeżenie)
1
3 S
- > X + 3 OS
(odrzucenie)
(RE)
2
2S
- dwukrotnie > X + 2 OS
(odrzucenie)
(SE)
lub > X - 2 OS
R
4S
- jedna
> X + 2 OS
(odrzucenie)
(RE)
następnie jedna > X - 2 OS
4
1S
- czterokrotnie
> X + 1 OS
lub czterokrotnie
> X - 1 OS
10
X
-
dziesięciokrotnie wynik będzie powyżej lub poniżej średniej
Karta kontrolna -
nanosi się wynik jako % odchylenia od wartości
nominalnej.
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Kontrola powtarzalności - stosowana gdy są trudności w uzyskaniu
trwałego materiału kontrolnego np. pełna krew
„metoda nieznanego dubletu”
-
oznacza się dwukrotnie, niezależnie badany składnik
-
oblicza różnicę w wyniku
-
przygotowuje zbiór 21 dubletów, oblicza 21 różnic, wylicza średnią
2.5 x R(średnie) = 95% oznaczeń = 2S
-
oblicza odsetkową wartość wsp. R
[2.5 x R(średnie)] x 100
--------------------------------
= błąd oznaczenia < DGB
X(średnie)
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Przykład:
Oznaczanie hematokrytu:
X 1
X 2
R 1
1
46,5
47,3
0,8
...
...
...
21
43,0
43,5
0,5
----------------------------------------------------------
n=21
Xśr=46,0
Rśr=0,64
2.5 x Rśr = 2.5 x 0,64 = 1,6
1,6 x 100 / 46 =
3,5 %
( DGB dla Ht = 10%)
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Zapobieganie błędom w medycznym laboratorium
diagnostycznym to QA (Quality Assurance) „system
zapewniania jakości” w laboratorium.
Definicja QA = Zespół działań powodujących że wynik
badania jest wiarygodny i może spełnić określone
zadania diagnostyczne umożliwiającą
podejmowanie decyzji związanych z praktyką
medyczną.
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Funkcjonowanie procedur zapewnienia jakości QA
polega na identyfikacji i wyeliminowaniu tych
czynności w postępowaniu przedanalitycznym które
mogą zmienić własności fizyko-chemiczne próbki.
Rozwiązaniem jest standaryzacja wszystkich procedur.
Przygotować należy instrukcję zapewnienia jakości
badań QAM – SOP która opisuje sposób
postępowania z:
a. Pacjentem
b. Próbką materiału pobraną od pacjenta
c. Wynikiem badania

6
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Wymagania stawiane procedurom badawczym (np. w formie SOP
– standard
operational procedure)
- minimum informacji:
1.
cel badania;
2.
zasada wykorzystywanej procedury;
3.
analityczne cechy metody:
liniowość,
precyzja,
dokładność wyrażona jako standardowa niepewność pomiaru,
próg wykrywalności,
zakres pomiarowy,
błąd systematyczny,
czułość
swoistość analityczna);
4.
rodzaj próbki pierwotnej (z uwzględnieniem rodzaju pojemnika i
substancji dodatkowych);
KONTROLA JAKOŚCI BADAŃ LABORATORYJNYCH
Wymagania stawiane procedurom badawczym (np. w formie SOP)
- minimum informacji:
1.
wymagane wyposażenie i odczynniki lub system badań;
2.
procedury kalibracyjne
3.
etapy postępowania;
4.
procedury kontroli jakości;
5.
interferencje (np. lipemia, hemoliza, bilirubinemia) i reakcje krzyżowe;
6.
podstawy procedury obliczania wyników,
7.
zakres biologicznych wartości referencyjnych;
8.
zakres wartości wydawanych wyników,
9.
wartości alarmowe/krytyczne, gdzie ma to zastosowanie;
10. interpretacja laboratoryjna;
11.
środki ostrożności;
12.
potencjalne źródła zmienności
Wyszukiwarka
Podobne podstrony:
CH klin wyklad 1ok id 110378 Nieznany
ch infekcyjne wyklad
Ch organiczna wykład 1d
Ch organiczna wykład 1g
ch zywnosci wyklad 4 lipidy low
Ch WGGiIS Wyklad12
Ch WGGiIS Wyklad6
Ch WGGiIS Wyklad13
Ch organiczna wykład 1e
ch nieorg11 wyklady
CH Ż OD 9 wykłady
Ch organiczna wykład 1c
ch infekcyjne wyklad
Ch organiczna wykład 1d
Ch organiczna wykład 1g
ch zywnosci wyklad 4 lipidy low
więcej podobnych podstron