Chemia żywności cz.2 2010/2011
1
Wykład 9 10.05.11
AGAR:
Jest substancją żelującą otrzymaną z czerwonych glonów Rhodopyceae przez ekstrakcje gorącą wodą.
Zbudowany jest z silnie żelującej agarozy i agaropektyny która daje lepkie roztwory, ale nie tworzące żeli.
Agaroza zbudowana jest z cząsteczek β-D-galaktopiranozy i 3,6-anhydro-α-L-galaktobiranozy połączonych
wiązaniem β-(1,4)-glikozydowymi.
Agaropektyna ma łańcuch zbudowany z cząsteczek D-galaktobiranozy połączonych wiązaniami β-(1,3)-
glikozydowymi. Część grup hydroksylowych przy węglu szóstym jest zestryfikowana kwasem siarkowym.
Stwierdzono również w agaropektynie obecność kwasu galakturonowego i pirogronowego.
Agar jest bardzo wydajnym środkiem żelującym. Utworzone żele są stabilne w podwyższonej temperaturze co
decyduje o jego zastosowaniach w laboratoriach mikrobiologicznych.
O
O
O
OH
HO
CH
2
OH
O
OH
O
O
agaroza
Fragment czasteczki agaru
W technologii żywności agar wykorzystywany jest jako środek żelujący lub stabilizujący koloidy przy produkcji:
Soków owocowych
Lodów
Niektórych wyrobów cukierniczych
Jogurtów
KARAGENY:
Karageny podobnie jak agar otrzymywane są z czerwonych glonów. Zbudowane są z cząsteczek D-galaktozy i
3,6-anhydro-galaktozy połączonych wiązaniami β-(1,3) lub β-(1,4) glikozydowymi.
Są w dużym stopniu zestryfikowane kwasem siarkowym (zawartość siarczanów wynosi średnio 21%). Wraz ze
stopniem estryfikacji rośnie rozpuszczalność karagenów.
W preparatach handlowych karagen występuje w postaci soli sodowych, potasowych lub wapniowych.
W technologii żywności karageny stosowane są jako substancje zwiększające lepkość i stabilizujące zawiesiny
np.
w celu zapobiegania sedymentacji skondensowanego:
o Mleka
o Kakao
o Innych napojów
W obecności jonów potasu stosowane są jako odczynnik żelujący przy produkcji deserów i dżemów
małej zawartości cukru.

Chemia żywności cz.2 2010/2011
2
Podobnym heterocukrem jest farcelan nazywany duńskim agarem, a produkowany jest z czerwonych
wodorostów
GUMY ROŚLINNE:
Gumy roślinne są to lepkie, gęste masy wydzielane przez pnie drzew w miejscu skaleczenia. Na ogół są dobrze
rozpuszczalne w wodzie
Guma arabska – wydzielona przez drzewa akacji mieszanina hetero polisacharydów w skład, których wchodzą
np. w gumie z akacji senegalskiej:
l-arabinoza
L-ramnoza
D-galaktoza
Kwas glukuronowy
W produkcji żywności ma zastosowanie jako:
Emulgator
Stabilizator
Jako czynnik opóźniający krystalizację cukru, zapobiegając powstawaniu dużych kryształów np. w
lodach
Jako czynnik stabilizujący pianę w napojach
Guma ta jest również wykorzystywana jako nośnik przy otrzymywaniu trwałych mikrokapsułkowanych
preparatów olejów zapachowych.
Guma tragantowa (tragant) – otrzymywana jest z drzew gatunku Astragalus rosnących w środkowym
wschodzie (Turcja, Iran, Syria). Główny łańcuch zbudowany jest z cząsteczek kwasu galakturonowego. W
łańcuchach występuje:
D-galaktoza
D-ksyloza
L-fruktoza
L-arabinoza
Guma guarowo-mączna otrzymywana z bielma nasion rośliny Cyamopsis teragonoloae uprawianej na paszę w
Indiach, Pekistanie i Teksasie.
Guma locust Bean – otrzymywana z nasion rośliny Ceratonina slliqua. Nazywanej również chlebem
świętojańskim. Mąka ta w przemyśle spożywczym stosowana jest:
Jako dodatek wiążący wodę i stabilizujący przy produkcji kiełbas, konserw mięsnych.
W celu poprawienia struktury ciasta, szczególnie w przypadku użycia mąki nisko glutenowej.
Guma Karaya – produkt w postaci „łezek” drzewa Sterculia areus. Zbudowana jest głównie z połączonych
aldoheksoz:
D-galakturozy
L-ramnozy
Kwasu D-galakturonowego.
Poddawana jest modyfikacjom – po reakcji acetylowania zmienia się charakter gumy…..

Chemia żywności cz.2 2010/2011
3
POLISACHARYDY PRODUKOWANE PRZEZ DROBNOUSTROJE:
Ksantan – wytwarzany z glukozy przez bakterie Vanthomonas campestris nazywany również gumą ksantanową.
Główny łańcuch zbudowany jest z cząsteczek glukozy połączonych wiązaniami β-(1,4)glikozydowymi, w
bocznych łańcuchach znajduje się mannoza, kwas glukuronowy, połączone wiązaniami (1-2) i (1-3)
glikozydowymi. W roztworach wodnych guma ksantanowa tworzy ugrupowania helikoidalne (spiralne)
związane ze sobą oddziaływaniami wodorowymi, a zatem powstają roztwory o charakterze pseudoplastycznym
i posiadające granicę odkształcalności.
Guma ksantanowa jest stosowana w przemyśle spożywczym jako zagęstnik do produktów poddawanych
ogrzewaniu (konserw), a także jako stabilizator emulsji koloidalnych, zawiesin w napojach, sosach itp.
Dekstran – wytwarzany z sacharozy przez Leconostac mesenteroides, streptobacterium dextranicum.
Zbudowany jest z reszt glukozy, połączonych wiązaniem β-(1,6)glikozydowymi. W słabo rozgałęzionym łańcuchu
bocznym występują wiązania (1-3), (1,4) i (1,2) glikozydowe.
W medycynie dekstran stosowany jest jako środek zastępujący krew (dekstran o masie cząsteczkowej 40kD)
W przemyśle spożywczym jako zagęstnik i stabilizator
Cyklodekstryny – (omówione przy skrobi)
Żelan jest egzopolisacharydem pochodzenia bakteryjnego produkowany przez bakterię z rodzaju
Sphingomonas.
Pod względem struktury chemicznej jest to polimer, którego podstawową jednostką jest tetrasacharyd, w
którego skład wchodzą:
β-D-glukoza
L-ramnoza
D-glukuronian
Żelan posiadać może nawet 50000 takich reszt. Dodatkowo w obrębie struktury tego polimeru znaleźć można
liczne związki niecukrowe, czy jony wapniowe, które stabilizują helikalną strukturę przestrzenną żelanu.
Zastosowanie żelanu w przemyśle spożywczym polega na wykorzystaniu go jako substancji solidyfikującej,
zagęszczającej i pęczniejącej w różnego rodzaju produktach spożywczych, takich jak budynie, lody, jedzenie dla
psów itp.
WŁAŚCIWOŚCI FUNKCJONALNE SAHCARYDÓW:
Słodki smak
Reakcja smakowa jest procesem złożonym i niedostatecznie zbadanym. Jej pojawienie się jest wynikiem
interakcji cząsteczek substancji wywołującej smak z odpowiednimi recepotami.

Chemia żywności cz.2 2010/2011
4
Układ sensoryczny zawiera kilka rodzajów receptorów smakowych znajdujących się w poszczególnych strefach
języka. Reagują one na różne rodzaje substancji wywołujących cztery podstawowe smaki:
Słodki
Kwaśny
Gorzki
Słony
Umami (glutaminian sodu)
Receptory reagujące na smak słodki znajdują się w kubeczkach smakowych w przedniej części języka. Jak
wykazały badania, struktura chemiczna substancji ma istotny wpływ na słodki smak. Okazało się, że sacharydy
różnią się od siebie intensywnością słodkiego smaku. Smak słodki acyklicznych polioli, takich jak glikol
etylenowy czy gliceryna, które mają fragmenty strukturalne podobne jak cukry, początkowo wiązano z ogólną
liczbą grup hydroksylowych znajdujących się w ich cząsteczkach.
Takie przypuszczenie okazało się niesłuszne. Stwierdzono, że takie cukry jak glukoza i galaktoza zawierające
taką samą liczbę grup hydroksylowych róznią się intensywnością słodkości. Również poliole z pięcioma grupami
hydroksylowymi np. ksylitol są słodsze od tych, które mają tych grup sześć, np. sorbitol. Gdy ustalono
pierścieniową strukturę sacharydów okazało się, że różnica w słodkości diastereoizomerów może być
-D-glukopiranozy, która jest
-D-
-D-
-D-mannopiranozy, z których
pierwsza jest słodka a druga gorzka.
Shallenberger opracował hipotezę, która wiąże się w zaeżnosci między strukturą substancji a odczuciem
słodkości (w 1969r. zmodyfikowaną w 1977). Wrażenie słodkości jest wynikiem specyficznych oddziaływań
pomiędzy substancją, a białkami receptorów smakowych na języku. Kontakt między substancją smakową i
receptorem powstaje poprzez utworzenie wiązania wodorowego między odpowiednimi strukturami substancji
słodkiej i aktywnymi centrami receptora, który charakteryzuje się zdolnością do wiązania cząsteczki o właściwej
konfiguracji.
Tworzenie się międzycząsteczkowego wiązania wodorowego jest możliwe dzięki obecności ugrupowań
protonodonorowych (typu AH) i elektronodonorowych (typu B) w strukturach substancji słodkiej, jak również i
w odpowiednich receptorach. Powstający dwurdzeniowy kompleks wodorowy wywołuje odczucie słodkiego
smaku, a trwałość tego wiązania decyduje o jego intensywności. Zarówno białka receptorów jak i substancje
muszą mieć po jednym osrodku kwasowym i zasadowym reakcji w równych odległościach (ok. 0,30 nm).
Układ protonodawca – protonobiorca (AH/B) warunkujących komplementarność z receptoru w kubkach
smakowych języka. Stwierdzono, że geometria układów protonodonorowych (AH) oraz elektronodonorowych
(B) cząsteczek sacharydów i aktywnego centrum w receptorze stwarza pewność powstania kompleksu.
Odczucie słodkości wywołane przez cukry trwa krótko wskutek tego, że trwałość wiązań wodorowych, które
powstały, jest niewielka. Natomiast syntetyczne środki słodzące, które są kilkaset razy słodsze od cukrów,
tworzą trwałe wiązania wodorowe z receptorami i to z dużą szybkością. Stwierdzono, że gdy słodka cząsteczka
pasuje stereochemicznie do aktywnego centrum receptora, szybkość z jaką centra wzajemnie reagują, może
być czynnikiem bardziej decydującym niż trwałość samego kompleksu.
Mechanizm wzajemnej orientacji pary; receptor-związek słodki, został ustalony na podstawie danych
uzyskanych w badaniach słodkiego smaku stereoizomerycznych aminokwasów. Fakt, że wiele D-aminokwasów
ma słodki smak, podczas gdy ich izomery L-aminokwasów są gorzkie lub bez smaku, świadczy o
stereospecyficzności receptora i wskazuje, że istnieje jeszcze trzecie miejsce kontaktu związku słodkiego z
receptorem. To trzecie miejsce słodkiego jest uważane za centrum wiązania dyspersyjnego lub kombinowanej
funkcji lipofilowej i hydrofilowej. Obecny więc model to układ trójpunktowy z obecnością….
Chemia żywności cz.2 2010/2011
5
Duże znaczenie ma też część hydrofobowa, która oddziaływuje ze smakowymi centrami receptora. Ten etap
zależy od interakcji grup hydroksylowych, stopnia polarności, odległości poszczególnych ładunków w
cząsteczce, gęstości elektronowej, stałej Hammetta i efektów sterycznych. Badano wpływ stopnia
hydrofobowości i geometrii podstawników w bocznym łańcuchu dipeptydów na intensywność ich słodkiego
smaku. Stwierdzono, że centrum rozgałęzionego łańcucha bocznego w aspartamie jest w środku pierścienia
benzenowego. Przypuszcza się, że im dokładniej zewnętrzny obrys związku słodkiego odpowiada powierzchni
receptora, tym łatwiej osiąga się odpowiedni kontakt między nimi i tym intensywniej objawi się słodki smak
związku.
Nie ma żadnych metod fizykochemicznych do pomiaru słodkości. Intensywność smaku słodkiego określana jest
poprzez wyznaczenie wartości progowej, czyli najmniejszego stężenia przy którym smak słodki jest jeszcze
wyczuwalny lub określenie względnej słodkości wobec wzorca, którym najczęściej jest sacharoza.
WZGLĘDNA SŁODKOŚĆ 10% WODNYCH ROZTWORÓW W PORÓWNANIU Z SACHAROZĄ (SŁODKOŚĆ =1)
Wszystkie mono i oligosacharydy są dobrze rozpuszczalne w wodzie i słabo w alkoholu, a nierozpuszczalne w
niepolarnych rozpuszczalnikach organizmu
Sacharydy różnią się właściwościami hydrofilowymi w zależności od struktury. Higroskopijność cukrów ma duże
znaczenie w technologii żywności. Do produkcji wyrobów, które powinny być lepkie (np. cukru, proszki,
granulaty) korzystne jest stosowanie cukrów o małej higroskopijności(sacharoza, maltoza czy laktoza)natomiast
do produktów które powinny zachować wilgotność (np. ciasto) – cukrów o dużej zdolności wiązania wody
(syropy skrobiowe).
Wykład 10 17.05.2011
Inne reakcje powodujące obniżenie wartości pokarmowej białka
Ograniczenie przyswajalności biologicznej białek powodują produkty reakcji grupy ε-aminowej głównie lizyny z
cukrami redukującymi (najczęściej glukozą).
Produkt pierwszego etapu reakcji Maillarda, glukozyloamina, ulega
przegrupowaniu Amadori do ε-N-deoksy-fruktozylo-1-lizyny, z której po
β-D-fruktoza
1,8
Cukier chlebowy
1,3
α-D-glukoza
0,7
β-D-glukoza
0,8
α-D-mannoza
0,3
β-D-mannoza
Gorzka
D-galaktoza
0,32
Maltoza
0,32
Rafinoza
0,01
Stachioza
0,1
Ksylitol
0,85-1,2
Mannitol
0,4
Sorbitol
0,6
Miód
0,97
Melasa
0,74
Sacharyna
200-700
Cykloaminiany
30-140
Aspartam
200

Chemia żywności cz.2 2010/2011
6
hydrolizie powstaje niebiałkowy aminokwas pirydozyna.
Związki powstające w pierwszym etapie reakcji nieenzymatycznego
brązowienia ulegają deaminacji, reakcji Streckera, cyklizacji.
Powstałe niskocząsteczkowe związki są bezbarwne, ale nadające produktom charakterystyczny zapach.
W wyniku dalszych przemian i polikondensacji otrzymujemy wysokocząsteczkowe związki o brunatnym
zabarwieniu. Produkty tego procesu obok redukowania przyswajalności lizyny mogą mieć korzystne
oddziaływania dla organizmu człowieka, wykazują bowiem właściwości antyoksydacyne.
Promieniowanie
Pod wpływem promieniowania następuje sieciowanie białek, powstawanie produktów sieciowania białek,
utleniania tyrozyny, a ostateczny efekt radiolizy metioniny to metanotiol posiadający charakterystyczny zapach,
typowy dla napromieniowanej żywności.
Inne procesy zachodzące pod wpływem promieniowania, takie jak:
modyfikacja reszt aminokwasowych
zmiana całkowitego ładunku
agregacja
fragmentacja
Procesy te powodują zmiany w strukturze trzecio- i drugorzędowej białek. Te indukowane radiacyjnie zmiany
strukturalne mogą być przyczyna utraty aktywności enzymatycznej białek i zmian ich funkcji fizjologicznych.
Funkcjonalne właściwości białek są wynikiem ich oddziaływań z innymi składnikami żywności - wodą, lipidami,
sacharydami. jonami czy innymi białka.
Funkcjonalne właściwości białek to:
zdolność zwilżania,
pęcznienia,
rehydratacji,
utrzymywania wody, pienienia
lepkość
tworzenie włókien, błon, ciasta, emulsji i jej stabilizowanie rozpuszczalność
Metody modyfikacji właściwości funkcjonalnych białek
Modyfikacja białek jest to szereg zabiegów chemicznych, fizycznych i enzymatycznych mających na celu zmianę
właściwości funkcjonalnych białek, redukcję poziomu substancji szkodliwych i związków anty żywieniowych, a
jednocześnie zachowanie lub podwyższenie wartości odżywczej. Zabiegi te poprawiają reologiczne właściwości
wyrobów zawierających białko oraz wytwarzają pożądane cechy smakowo-zapachowe.
Białka to liniowe polikondensaty aminokwasów, połączonych wiązaniami peptydowymi (wiązanie kowalencyjne
pomiędzy grupą α-aminową jednego aminokwasu i α-karboksylową, z wydzieleniem cząsteczki wody) jest
teoretycznie nieskończona.
Białka zbudowane są z ok. 20 aminokwasów łączących się w bardzo różnorodnej kolejności, ponieważ
cząsteczka jest białkiem wówczas, gdy składa się co najmniej ze 100 aminokwasów (Ich liczba może przekroczyć
nawet tysiąc, a masa cząsteczkowa od 6000 do ponad miliona).
Kombinacja jednostek aminokwasowych jest teoretycznie nieskończona, praktycznie jednak w organizmach
żywych różnorodność budowy białek jest ograniczona i podporządkowana ich funkcjom fizjologicznym.
Białka zbudowane wyłącznie z aminokwasów to białka proste (proteiny):
protaminy
histony
albuminy
globuliny
gluteiny
prolaminy
skleroproteiny
Białka zawierające w swoim składzie obok aminokwasów inne związki to białka złożone (proteidy):
fosfoproteidy — kwas ortofosforowy (kazeina mleka, witelina w żółtku jaj)

Chemia żywności cz.2 2010/2011
7
chromoproteidy - substancja barwna (hemoglobina krwi, białka roślinne - chloroplasty, leukoplasty,
chromoplasty)
metaloproteidy - metale (ferrytyna -żelazo; hemocyjanina - miedź)
glikoproteidy - węglowodany lub ich pochodne (mucyna w ślinie)
nukleoproteidy - kwasy nukleinowe
lipoproteidy - lipidy
Białka przyjmują określoną strukturę przestrzenną - konformację
Struktura przestrzenna cząsteczek białkowych tradycyjnie jest dzielona na strukturę:
pierwszorzędową czyli pierwotną i
struktury wtórne (inaczej nazywane wyższego rzędu) drugo-, trzecio- i czwartorzędowe
O pierwszorzędowej strukturze białka decyduje kolejność, w jakiej są połączone aminokwasy w łańcuchy
polipeptydowe. Aminokwasy łączą się wiązaniem peptydowym i to wiązanie stabilizuje strukturę
pierwszorzędową białek, która jest uwarunkowana genetycznie.
Ukształtowanie przestrzenne łańcuchów polipeptydowych decyduje o drugorzędowej strukturze białka.
Stabilizowana jest ona głównie poprzez wiązania wodorowe utworzone pomiędzy grupami -CO i -NH lub
pomiędzy grupami funkcyjnymi aminokwasów w bocznych łańcuchach.
Rozróżniamy dwa rodzaje struktury drugorzędowej:
strukturę śrubową
strukturę fałdową
Zmiany konformacji białek zachodzą pod wpływem czynników zewnętrznych takich jak:
działanie promieniowania jonizującego
ultradźwięków
temperatury
zmian odczynu środowiska
obecności związków chemicznych - jonów metali, detergentów, czy kwasów tłuszczowych
W zależności od intensywności i czasu oddziaływania następują różne zmiany konformacji cząsteczek białka -
począwszy od rozluźnienia struktury bez naruszenia konformacji łańcuchów polipeptydowych aż do zniszczenia
wiązań niekonwalencyjnych i denaturacji białka.
Wskutek denaturacji zmieniają się właściwości funkcjonalne białek, co często jest zjawiskiem niepożądanym. Z
punktu widzenia technologicznego w przypadku badanych białek takie zmiany są konieczne np. częściowa
hydroliza kolagenu do żelatyny jest możliwa po zniszczeniu jego pierwotnej struktury czwartorzędowej.
Występujące w białkach aminokwasy możemy podzielić na:
aminokwasy egzogenne (niezbędne), które muszą być dostarczane wraz z pożywieniem, ponieważ
organizmy zwierzęce nie są zdolne do ich syntezy dla człowieka to:
o izoleucyna
o leucyna
o lizyna
o metionina
o fenyloalanina
o treonina
o tryptofan
o walina
o histydyna
aminokwasy endogenne, które organizm może syntetyzować z nadmiaru innych aminokwasów bądź z
innych organicznych źródeł azotu
Niektóre aminokwasy noszą nazwę seminiezbędnych ponieważ mogą być wytwarzane w obecności innych
aminokwasów egzogennych np.
cysteina powstaje z niezbędnej metioniny
tyrozyna z fenyloalaniny

Chemia żywności cz.2 2010/2011
8
Z punktu widzenia żywieniowego skład aminokwasowy białka decyduje o jego wartości odżywczej gdyż białko
dopiero po strawieniu i wchłonięciu jest wykorzystywane przez organizm człowieka.
Skład aminokwasowy danego białka porównujemy ze składem białka przyjętego jako wzorzec, którym
najczęściej jest białko mleka krowiego lub całego jaja. Aminokwasem ograniczającym dane białko jest ten z
występujących w niedoborze, dla którego wartość wskaźnika CS (chemical score — czyli zawartości danego
aminokwasu w badanym białku w stosunku do zawartości tego aminokwasu w białku wzorcowym - najczęściej
jaja białko + żółtko) jest najniższa.
CS = A/A
w
x 100 (chemical score)
gdzie: A — zawartość aminokwasu w badanym białku A
w
— zawartość aminokwasu wzorca
Wskaźnik aminokwasów niezbędnych (essential amino acid index) - EAAI
Obliczany jest jako 100 krotny pierwiastek n-tego stopnia z iloczynu ilorazów:
A
1
/A
1w
x A
2
/A
2w
x ............. A
n
/A
nw
Czyli jest to średnia geometryczna stosunków zawartości aminokwasów w danym białku do zawartości
aminokwasów w białku wzorcowym.
Natomiast szybkość hydrolizy białka pod wpływem działalności enzymów proteolitycznych jest uzależniona w
znacznym stopniu od konformacji jego cząsteczki.
Podatność białka na hydrolizę w przewodzie pokarmowym określa się metodami biologicznymi przez
oznaczenie strawności.
Strawność pozorna D
x
:
D
x
= (N
d
- N
k
/ N
d
) x 100
gdzie: N
d
- ilość azotu w diecie
N
k
- ilość azotu w kale
Strawność rzeczywista:
D
n
=( N
d
- N
k
+ N
k'
/ N
d
) x 100
N
k'
- ilość azotu metabolicznego w kale, tzn. opuszczającego organizm przy diecie bezbiałkowej.
Chemiczne reakcje białek w żywności
Produkty żywnościowe są złożonym środowiskiem wielu składników, które mogą reagować ze sobą.
Przebiegającym procesom sprzyjają warunki zewnętrzne często zmieniające w trakcie przechowywania i
przetwarzania surowców. Białka żywności narażone są na działanie:
endogennych enzymów
drobnoustrojów
wody
tlenu
światła
W trakcie obróbki dodatkowo na działanie temperatury i zmian kwasowości środowiska.
Wpływ temperatury:
Podczas ogrzewania produktów zasobnych w białko powstają międzycząsteczkowe wiązania sieciujące
wytwarzane pomiędzy wolną grupą karboksylową i aminową aminokwasów będących składnikami białka.
Wpływ czynników utleniających
Czynnikami utleniającymi białka mogą być:
nadtlenki celowo wprowadzane w trakcie procesów technologicznych
aktywne rodniki powstające wskutek działania światła lub enzymów
aktywne produkty utleniania lipidów i polifenoli.
Te utleniające czynniki powodują polimeryzację białek lub utlenianie aminokwasów.
Najbardziej wrażliwe na ich działanie są metionina, cysteina, tryptofan i tyrozyna. I tak:

Chemia żywności cz.2 2010/2011
9
metionina utleniana jest do sulfotlenku, następnie do sulfonu a w niektórych przypadkach do kwasu
homocysteinowego:
Wpływ środowiska zasadowego
Surowce w procesach technologicznych są często poddawane obróbce w środowisku zasadowym:
obieranie owoców i warzyw
otrzymywanie preparatów białkowych ze źródeł niekonwencjonalnych i usuwanie z nich kwasów
nukleinowych
hamowanie działalności enzymów i ich inhibitorów
W środowisku zasadowym podczas ogrzewania białek następuje ich sieciowanie poprzez reakcję
dehydroalaniny albo 3-metylodehydroalaniny z grupą aminową lizyny, ornityny lub tiolową cysteiny.
Dehydroalanina powstaje w wyniku hydrolizy karboanionu otrzymanego poprzez B-eliminację rodnika
aminokwasowego cysteiny, seryny lub treoniny. Karboaniony mogą przyłączać proton dając enacjomery L i D
aminokwasów. Rezultatem tych przemian jest powstawanie aminokwasów niebiałkowych takich jak
iizynoalanina, ornitynoalanina czy lantionina.
Zawartość lizynoalaniny w żywności pochodzenia roślinnego
Rodzaj żywności
Lizynoalanina (mg/kg białka)
Izolat białka sojowego (produkt
handlowy)
Izolat białka sojowego
0 - 370
1
370 —1300
2
Hydrolizat białka warzyw
40 - 500
1
Kakao w proszku (produkt handlowy)
130-190
1
Produkty zbożowa
200 - 390
2
Makaron
480
2
1
cytowane za Food Chemiftry 1999
2
cytowane za Friedman N. 1999

Chemia żywności cz.2 2010/2011
10
Obok sieciowania ważnym bowiem procesem, któremu ulegają białka w środowisku alkalicznym, potęgowanym
przez długotrwałe ogrzewanie jest racemizacja aminokwasów.
Powstające D-enacjomery aminokwasów są wolniej wchłaniane i nie wszystkie metabolizowane przez organizm
człowieka. Szybkość racemizacji uzależniona jest od budowy łańcucha bocznego aminokwasu (alifatyczne
najwolniej ulegają tej przemianie) i od właściwości białka (te same reszty aminokwasowe ale w innych białkach
w różnym stopniu ulegają racemizacji) niemniej jednak racemizacja aminokwasów w białkach przebiega
szybciej, niż tych samych aminokwasów w stanie wolnym.
Oddziaływanie środowiska zasadowego w podwyższonej temperaturze
przez dłuższy okres czasu powoduje
obniżenie strawności i przyswajalności białek.
Wykład 11 24.05.11
Modyfikacja fizyczna
Modyfikacja fizyczna ma na celu kształtowanie właściwości reologicznych w produktach spożywczych a także
zapobieganie niekorzystnym zmianom w czasie przetwarzania i magazynowania.
Metody fizycznego teksturowania żywności możemy podzielić na:
Metody kompozycyjne – laminowanie, nadziewanie, mieszanie surowców o zróżnicowanych właściwościach
fizycznych oraz wprowadzenie dodatków (ksantyny, galaktomanóww, karboksylom etylocelulozy)
Metody operacyjne – mechaniczna tendaryzacja, płatkowanie, prasowanie mrożonego surowca w bloki,
ogrzewanie prasowanego mięsa, tempera, formowanie i utrwalanie w ciekłych czynnikach chłodniczych,
powierzchniowe obsuszanie gazem, magazynowanie, rozdmuchiwanie wybuchowe, przędzenie, kierunkowe
zamrażanie, ciepła i gorąca ekstruzja, stosowanie bardzo wysokich ciśnień.
Modyfikacja enzymatyczna:
Modyfikacja enzymatyczna ma ba celu poprawę właściwości reologicznych smaku i zapachu białek żywności.
Pozwala także zapobiegać niepożądanym zmianom w produkcie, wzbogacić do w niezbędne aminokwasy a te,
które uchronić przed niekorzystnymi zmianami.
Reakcje enzymatyczne obejmują:
fosforyzowanie
metylowanie
hydroksylowanie
acetylowanie
hydrolizę
tworzenie wiązań sieciujących śród- i międzycząsteczkowych
Wymienione reakcje zachodzą w organizmie żywym i określane tą jako posttranslacyjne. W warunkach in vitro
można przeprowadzić tylko nieliczne z nich. Łagodne warunki procesów przeprowadzonych z udziałem
enzymów są dodatkowym czynnikiem zapobiegającym powstawaniu niekorzystnych zmian w powstałych
produktach.
Dla technologii produkcji żywności najistotniejszymi i najczęściej stosowanymi są modyfikacje enzymami
proteolitycznymi, foslorylowanie i tworzenie wiązań różujących z udziałem enzymu jako katalizatora.
Stosowane są enzymy proteolityczne pochodzenia
zwierzęcego (trypsyna, pepsyna, chymotrypsyna) roślinnego (papaina, licyna, bromelaina) bakteryjnego i
pleśniowego
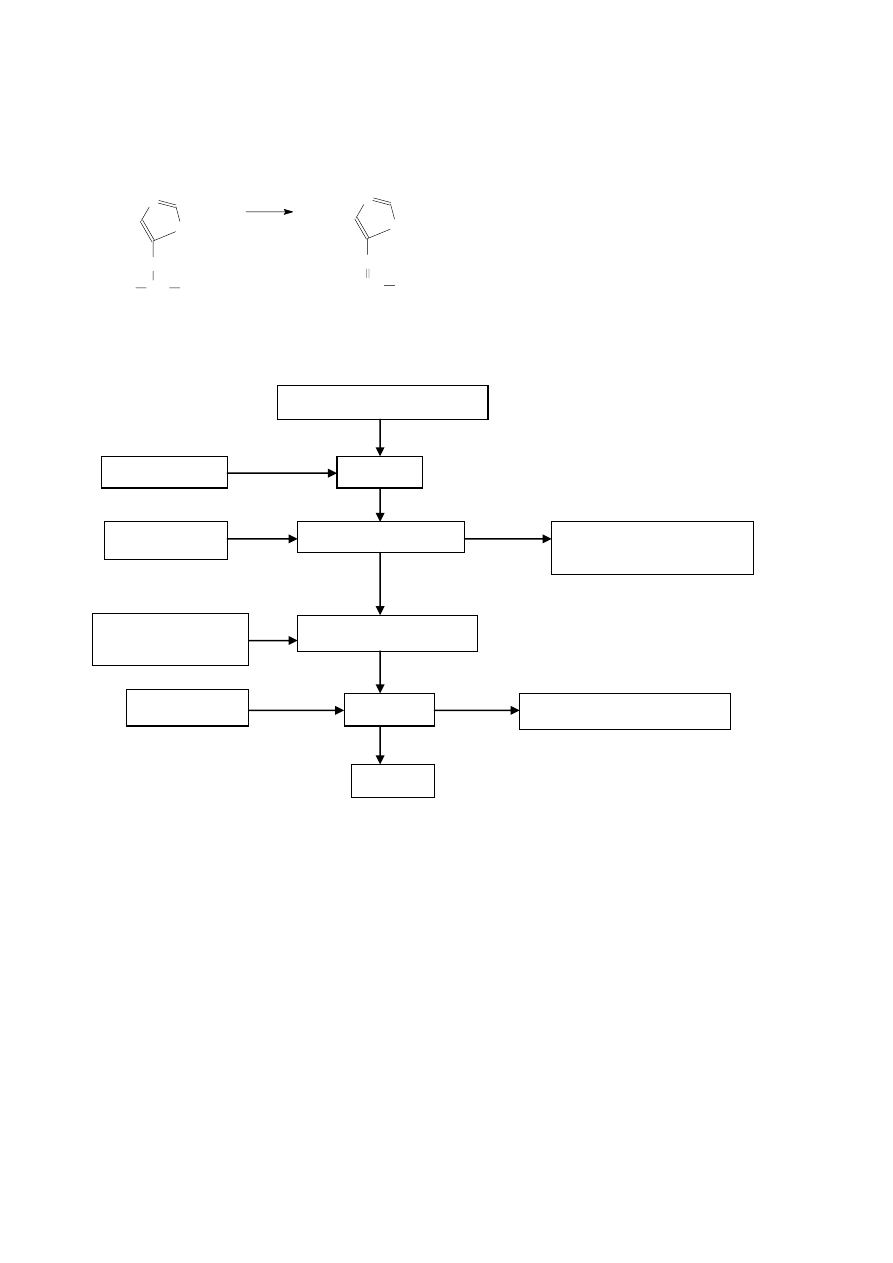
Chemia żywności cz.2 2010/2011
11
W procesie tendaryzacji i kruszenia mięsa, w przemyśle rybnym, przy soleniu i produkowaniu tusz rybnych, w
piwowarstwie (zapobieganie mętniu osadów), w piekarnictwie do rozluźnienia glutenu i poprawy jakości
wypiekowej mąki.
N
NH
CH
2
CH
COOH
H
2
N
L-histydyna
amoniakoliza
N
NH
CH
CH
COOH
kwas urokaninowy
Reakcja plasteinowania daje olbrzymie możliwości do sterowania składem substancji białkopodobnej - z
hydrolizatów można usunąć gorzkie peptydy, estry trypsyny, polepszać jego właściwości funkcjonalne czy
podnosić poprzez włączenie limitujących aminokwasów.
Modyfikacja chemiczna:
Generalnie modyfikacje chemiczne opierają się na reakcjach acytacji i ich pochodnych, reakcjach podstawienia
pierścienia aromatycznego. Typowymi przykładami chemicznej modyfikacji białek są miedzy innymi takie
reakcje jak:
a) acylacja — podstawienie bezwodnikami kwasowymi (np. kwasu octowego, bursztynowego, maleinowego,
metylomaleinowego, dimetytoglutarowego); karbamylacja kwasem cyjanowym; guadynacja acetimidem alkilu;
b) alkilacja - alkilacja kilku grup kwasem jodooctowym; reduktykurna
alkilacja formaldehydem;
c) estryfikacja metanolem;
d)sulfonoliza;
e) amidacja aminowa i czynnikiem kondesującym;
Koncentrat lub izobat białka
Hydroliza
Modyfikowane białka
Endopeptydazy
Egzopeptydazy
Niepożądane aminokwasy,
zanieczyszczenia
Reakcja plasteinowania
Endopeptydazy,
estry aminokwasów
Ekstrakcja
Roztwór Et-OH
Aminokwasy i małe peptydy
Plasteiny

Chemia żywności cz.2 2010/2011
12
f) fosforylacja — przy użyciu cyklicznego trimetafosforanu sodu, przy użyciu tlenochlorku fosforu POCl
3
lub
POCl
5
; g) oksydacja (po uprzedniej redukcji np. Na
2
SO
3
) - kwasem czterotionianem sodowym, jonami
miedzianowymi, tlenem cząsteczkowym.
O
O
O
O
O
O
O
Bezwodnik tetrahydro-
furano-tetrakarbonylowy
O
HOOC C
C
H
H
CH
2
CH
3
CH
3
C
O
C
O
CH
2
C
C
HOOC
H
H
CH
3
CH
3
Bezwodnik dimetyglutonowy
O
O
O
HOOC
Bezwodnik benzonotri-
karboksylowy
C
C
C
H
H
3
C
C
O
O
O
Bezwodnik cytrakonowy
Modyfikacja bezwodnikami kwasowymi:
C
O
O
C
H
3
C
O
H
3
C
H
2
N
bialko
C
O
H
3
C
NH
bialko
C
O
O
C
O
H
2
C
H
2
C
H
2
N
bialko
-
OOC
(CH
2
)
2
C
O
NH
bialko
Fosforylacja tlenochlorkiem fosforu:
P
O
Cl
Cl
Cl
H
2
O
P
O
O
-
Cl
Cl
P
O
O
-
Cl
Cl
P
O
O
-
Cl
O
-
P
O
O
-
Cl
O
-
P
O
O
-
O
-
O
-
H
2
O
H
2
O
Cl
-
2 H
+
Cl
-
2 H
+
Cl
-
2 H
+
Zwiazek posredni
Zwiazek posredni
Zwiazek posredni
Chemia żywności cz.2 2010/2011
13
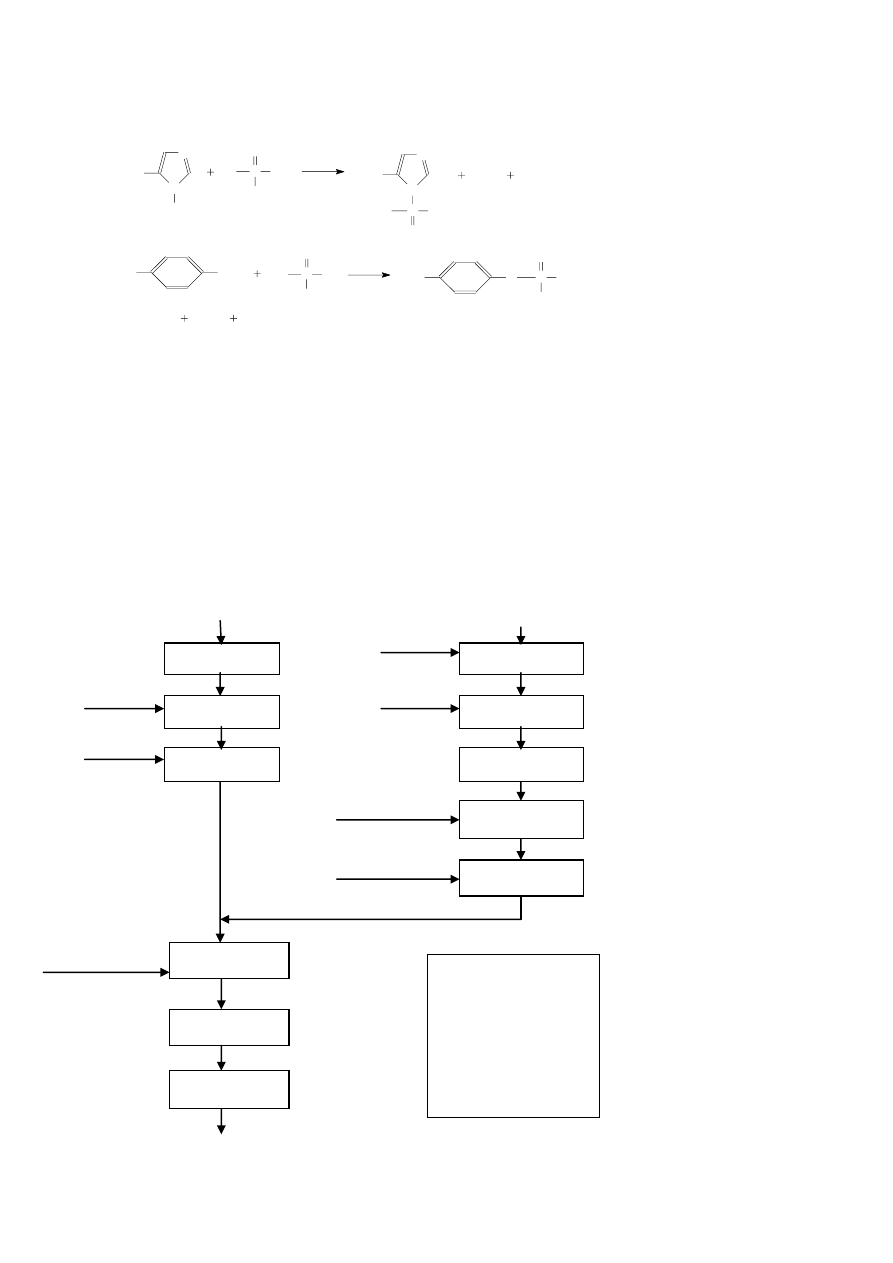
Mechanizm fosforylacji reszt różnych aminokwasów
N
N
PRO
H
P
O
O
-
Cl
O
-
N
N
PRO
P
O
-
O
-
O
Cl
-
H
+
histydyny
PRO
OH
P
O
O
-
Cl
O
-
PRO
O
P
O
O
-
O
-
Cl
-
H
+
tyrozyny
Powyższe reakcje i stosowane odczynniki ze względu na ich charakter oraz możliwość powstawania różnych
zmian w uzyskanym produkcie (np. związków toksycznych) nie zawsze mogą być zastosowane do modyfikacji
białek przeznaczonych do celów żywieniowych.
Chemiczne modyfikacje białek bez względu na pochodzenie i przeznaczenie tych białek mają na celu:
a) zablokowanie reaktywnych grup biorących udział w niepożądanych reakcjach chemicznych;
b) polepszenie właściwości funkcjonalnych i żywieniowych;
c) umożliwienie wyizolowania i oczyszczania białek, a także oddzielenie ich od innych substancji;
d) ułatwienie badań strukturalno-funkcjonalnych.
Schemat technologiczny otrzymywania miso:
Soja, 100kg
Łuszczenie
Moczenie
Gotownie
Ryż, 600 kg
Moczenie
Parowanie
Oziębianie
Fermentacja
Solenie
Mieszanie
Fermentacja
Dojrzewanie
Drożdże,
bakterie
kwasu
mlekowego
Woda
Para
Woda
Para
powietrze
NaCl, 430 kg
Skład, %
Woda 48-52
białka 8-24
tłuszcz 1-10
cukry 3-10
skrobia i dekatryny 3-10
sól 4-13
„miso”, 2700 kg

Chemia żywności cz.2 2010/2011
14
Charakterystyka białek obecnych w żywności:
Białka mięsa
Ogólna zawartość białka w mięsie waha się w granicach od 12-22% w zależności od gatunku i wieku zwierzęcia.
Białka mięsa zarówno zwierząt rzeźnych jak i ryb posiadają bardzo wysoką wartość odżywczą. Ich skład jest
zróżnicowany, a właściwości dostosowane do spełnianych funkcji - niemal połowa wszystkich zachodzących
przemian metabolicznych zlokalizowana jest w mięśniach.
Białka mięsni szkieletowych można podzielić na dwie grupy:
białka sarkoplazmy
białka miofibryli
Białka sarkoplazmy rozpuszczalne w zimnej wodzie nazywane miogenami mają charakter enzymatyczny i
stanowią ok. 30% białek mięśni.
Należą do nich enzymy z klasy:
hydrolaz, oksydoreduktaz i transferaz - głównie enzymy szlaku glikolitycznego, kinaza kreatynowa.
Wśród hydrolaz najpowszechniej występują protemazy w których dominują katepsyny, hydrolizujące głównie
miofibrylarne białka mięsa. Rozpuszczalnym w wodzie białkiem jest barwnik mięśniowy - mioglobina, która w
procesie utleniania i pod wpływem temperatury przechodzi w brązową metmioglobinę. Z tym procesem
spotykamy się podczas gotowania mięsa.
Głównymi białkami strukturalnymi miofybryli są należąca do glublulin miozyna i aktyna występująca w postaci
globularnej (aktyna G) i fibrylarnej (aktyna F ) .
Miozyna w połączeniu z aktyną daje kompleks nazywany aktimiozyną. Głównym składnikiem fibrylarnym tkanki
łącznej jest kolagen, który spełnia bardzo istotną rolę w kształtowaniu właściwości reologicznych mięsa.
Natomiast głównym składnikiem ścięgien i wiązadeł mięśniowych jest elastyna - białko odporne na działanie
temperatury do 100°C i gorących roztworów wodorotlenku sodu.
Białka mleka
Zawartość białek w mleku wynosi od 3-4% i zależy od rasy zwierzęcia i sposobu jego odżywiania.
Białka mleka dzielimy na trzy grupy:
kazeiny
białka serwatki
białka otoczki kuleczek tłuszczowych Największy udział w mleku stanowią, kazeiny, w skład których
wchodzą trzy frakcje - alfa, beta i kappa kazeiny.
Z chemicznego punktu widzenia są to fosfoproteiny, różniące się składem aminokwasowym, stopniem
ufosforylowania i właściwościami fizykochemicznymi. Właściwości hydrofilne κ-kazeiny wynikają z obecności w
jej składzie obok fosforanowych reszt cukrowych (galaktozy, galaktozaminy). W stabilizowaniu struktury miceli
istotną rolę odgrywają jony wapnia tworząc wiązania śród- i międzycząsteczkowe.
Podczas zakwaszania mleka jony wapnia są z micelli uwalniane i po osiągnięciu punktu izoelektrycznego (pH-
ok. 4,6) kazeina ulega wytrąceniu. Proces wytrącania kazeiny z mleka może zachodzić bez zmiany kwasowości
pod wpływem enzymów proteolitycznych - chymozyny (podpuszczki) i trypsyny.
Po oddzieleniu z mleka kazein pozostaje serwatka, w której skład wchodzą trzy główne frakcje:
β-laktoglobulina nie zawierająca reszt kwasu fosforowego i występująca w czterech odmianach
genetycznych
α-laktoalbumina zawierająca różne fragmenty sacharydowe i występująca w dwóch odmianach
genetycznych
immunoglobuliny - mieszanina białek o dużej masie cząsteczkowej i właściwościach substancji
odpornościowych
Pozostałe białka serwatki to:
albumina osocza

Chemia żywności cz.2 2010/2011
15
metaloproteiny - wiążące żelazo laktoferyna i laktotransferyna o właściwościach bakterio statycznych
oraz ceruloplazmina wiążąca miedź.
W niskich stężeniach są białka enzymatyczne:
alkaliczna fosfataza
przeciwna kteryjna peroksydaza
powodujące gorzknienie mleka lipazy
proteinazy
oksydaza tiolowa (wiązania disulfitowe)
proteozy
peptony
Białka otoczki kuleczek tłuszczowych to złożona mieszanina glikoprotein, lipoprotein i fosfoprotein pełniących
funkcję strukturalną i enzymatyczną.
Schemat technologiczny otrzymywania sosu sojowego:
Wykład 11 31.05.11
Białka jaja
Białka jaja dzieli się ze względu na występowanie na:
białka części białkowej (o zawartości białka surowego ok. 11%)
białka żółtka (posiadające 17,5% białka surowego)
białka skorupy 1 błon, w których ilość białka surowego wynosi 5,7%

Chemia żywności cz.2 2010/2011
16
Białka części białkowej jaja spełniają głównie funkcje enzymatyczne i odpornościowe. W ich skład wchodzą
włókna owomucynowe otoczone białkami globularnymi, z których najważniejsze to:
owoalbumina - odporna na termiczną denaturację fosfoglikoproteina owotransferyna - glikoproteina o
właściwościach bakteriostatycznych owomukoid - giikoproteina o działaniu przeciwbakteryjnym
owomucyna - glikoproteina odporna na denaturację cieplną, posiadająca zdolność kompletowania
lizozymu
lizozym - pojedynczy łańuch polipeptydowy, aktywny w działaniu przeciwko drobnoustojom
powodującym zatrucia i zakażenia pokarmowe
owoinhibitor - glikoproteina posiadająca właściwości inhibitowania
trypsyny, a-chymotrypsyny, elastazy i licznych serynowych proteinaz pochodzenia bakteryjnego i
pleśniowego.
Ilość pozostałych składników nie przekracza 1% w zawartości białek części białkowej jaja. Możemy tu wyróżnić:
owoglikoproteinę
owoflawoproteinę
owomakrogiobulinę (glikoproteina o największej aktywności antygenowej spośród wszystkich białek
jaja)
awidyna (glikoproteina wiążąca biotynę, odporna na działanie takich enzymów proteolitycznych jak:
trypsyna, chymotrypsyna, pankreatyna i pronaza)
inhibitor ficyny wykazujący aktywność wobec ficyny i papainy a takie bromelainy i niektórych katepsyn
Białka żółtka jaja stanowią materiał zapasowy. Jest to mieszanina wielu:
glikoprotein
fosfoglikoprotein
lipopromin
fofoglikolipoprotein
które można rozdzielić poprzez wirowanie na dwie główne frakcje:
plazmę
granule
I następnie na dalsze frakcje różniące się gęstością w zależności od ilości lipidów w ich składzie.
Białka plazmy to rozpuszczalne w wodzie kwaśne glikoproteiny - liwetyny i białko wiążące ryboflawinę oraz
frakcja lipoprotein o małej gęstości.
W skład granul wchodzi frakcja o małej gęstości oraz frakcja lipowitelinowa w formie kompleksów z foswityną -
kwaśnym białkiem zasobnym w fosfor. Białka skorupy i błony pełnią wytrzymałościowe i barierowe.
Są to glikoproteiny, w których część białkowa ma charakter kolagenu.
Białka roślinne
białka ziarniaków zbóż
Zboża są to najpowszechniejsze uprawy na świecie i są ona podstawowym źródłem białka roślinnego w diecie,
pomimo, że zawierają go mniej niż nasiona roślin oleistych. Największe znaczenie ma pszenica, ryż i żyto
wykorzystywane głównie do celów żywnościowych, natomiast kukurydza, jęczmień, owies, sorgo uprawiane są
głownie do celów paszowych. Ilość białka w ziarniakach zbóż waha się od 5 do 17% suchej masy.
Najzasobniejsze w białko jest ziarno pszenicy, najuboższe ziarno ryżu i kukurydzy.
Chociaż zawartość białka w ziarniakach zbóż jest cechą dziedziczną, można ją modyfikować poprzez zmiany
warunków uprawy. Tradycyjny podział białek zbóż opiera się na podstawie różnicy ich rozpuszczalności.
Albuminy i globuliny to frakcje białek rozpuszczalnych w obojętnych roztworach soli stanowiące ok. 30%
ogólnej zawartości białek. Pełnią w ziarniakach głownie funkcje enzymatyczne i strukturalne.
Występują tu takie enzymy jak: α- i β-amylaza, kwaśne proteinazy, lipazy, lipooksygenaza, peroksydaza,
katalaza i fitaza. Albuminy zawierają w swoim składzie sacharydy- najczęściej glukozę, ksylozę, arabinozę.

Chemia żywności cz.2 2010/2011
17
Globuliny charakteryzują się wyższą od albumin masą cząsteczkową i dużą zawartością grup tiolowych i
disulfitowych w swoim składzie.
Prolaminy to białka rozpuszczalne w 60-80% roztworach niższych alkoholi alifatycznych. Są to białka zapasowe,
które mogą być przyczyną (szczególnie u małych dzieci) schorzeń przewodu pokarmowego. Dla różnych
gatunków zbóż ta frakcja nosi specyficzne nazwy.
I tak:
gliadyna pszenicy
hordeina jęczmienia
zeina kukurydzy
kafiryna sorga
panicyna prosa
awenina owsa
Prolaminy mają małą wartość odżywczą z uwagi na niski poziom aminokwasów egzogennych, a w szczególności
charakteryzuje je niska zawartość lizyny.
Gluteliny to frakcja białek również zapasowych, rozpuszczalnych w 0,2% roztworze NaOH.
Zawartość tych jest bardzo zmienna w zależności od gatunku zboża waha się od 5% w ziarnie owsa, do 80% w
ziarnie ryżu. Gluteliny pszenicy i żyta noszą nazwę glutenin. Gluteniny i gliadyny w połączeniu z innymi
składnikami tworzą wielkocząsteczkowy kompleks zwany glutenem. Jest on nierozpuszczalny w wodzie i
decyduje o reologicznych właściwościach ciasta, otrzymywanego poprzez miesienie mąki pszennej z wodą.
Białka nasion roślin strączkowych i oleistych
W nasionach roślin strączkowych zawartość białka waha się w szerokich granicach od 14% w niektórych
odmianach fasoli do 40% w nasionach soi i łubinu.
Główną frakcję stanowią globuliny, białka o charakterze zapasowym, których ilość sięga 60-90%.
Wyróżnia my dwa zasadnicze typy globulin - wicyliny o masie cząsteczkowej ok 180 000 i leguminy o masie
cząsteczkowej dwukrotnie większej.
Globuliny nasion roślin strączkowych charakteryzuje złożona struktura czwartorzędowa. W obecności
substancji takich jak mocznik czy chlorowodorek guanidyny, bądź w niskich wartościach pH ulegają one
dysocjacji na mniejsze podjednostki o masie cząsteczkowej ok. 30 000.
Drugą frakcję białek stanowią albuminy, których zawartość waha się w granicach od 10-40% ilości białka
ogólnego w zależności od gatunku rośliny strączkowej.
Największe znaczenie zarówno żywieniowe jak i technologiczne mają nasiona soi - zasobne obok białka o
korzystnym składzie aminokwasowym również w tłuszcze.
80% białek soi jest rozpuszczalnych w wodzie, a metodą ultrafiltracji wyodrębniono z nich cztery frakcje o
stałych sedymentacji 2, 7, 11 i 15S. Najlepiej poznanym białkiem soi jest frakcja 11S która stanowi 31 % białka
soi. Frakcją występującą w największej ilości (37%) jest glikoproteina 7S w której skład wchodzą hemaglutyniny,
lipooksygenaza, β-amylaza. Natomiast we frakcji 2S występują inhibitory trypsyny.
Spośród dziesięciu występujących w nasionach soi białek o aktywności antyproteolitycznej szczególnie dobrze
poznane są dwa:
wydzielony przez Kunitza w 1947 roku taw. STI (soybean trypsin inhibitor), który może być
inaktywowany termicznie i przez soki żolądkowe;
i dominujący w roślinach strączkowych inhibitor trypsyny i chymotrypsyny Bowmana-Birk (BBl).
Cząsteczka BBI jest termostabilna i odporna na proteolizę, gdyż posiada sztywną strukturę trzeciorzędową.
Inhibitory proteaz wiążą się z centrum aktywnym enzymu tworząc nieaktywny kompleks enzym-inhibitor.
Związki te postrzegane są jako czynniki antyżywieniowe, gdyż powodują częściową inaktywację proteaz
przewodu pokarmowego. Inhibitory trypsyny i chymotrypsyny w największych ilościach występują w nasionach
roślin strączkowych, również w ziarniakach zbóż, bulwach ziemniaków i korzeniach buraków.
W Polsce spośród roślin strączkowych najbardziej wykorzystywana w żywieniu jest fasola i groch. Na cele
paszowe uprawiany jest również łubin i bobik. Natomiast rosliny oleiste 9rzepak, len, słonecznik) pomimo
znacznej zawartości białka (od 15-30%) służą głównie do produkcji tłuszczów z ich nasion. Główną frakcję białek

Chemia żywności cz.2 2010/2011
18
nasion roślin oleistych stanowią globuliny (do 70%), zawartość albumin waha się w granicach 22-28%, a białka
nierozpuszczalne stanowią ok. 10%.
Niekonwencjonalne źródła białka
Stałe zwiększająca się liczba ludności na świecie zmusza do poszukiwania dodatkowych źródeł białka wobec
istniejącej obawy, iż produkcja rolnicza i rybołówstwo nie będą w stanie pokryć zapotrzebowania na ten
niezbędny składnik żywności. Do niekonwencjonalnych źródeł białka zaliczamy:
Białko organizmów jednokomórkowych takich jak: drożdży, pleśni, bakterii lub glonów.
Zaletą tych syntez jest
wykorzystanie jako pożywki surowców odpadowych z przemysłu spożywczego lub drzewnego (ługi
posulfitowe z produkcji celulozy, ścieki z zakładów przemysłu ziemniaczanego, melas, hydrolizaty
odpadów z przemysłu drzewnego, n-paraflny, metanol),
duża wydajność syntezy,
niezależność produkcji od warunków atmosferynych,
niska wartość nakładów materiałowych i energetycznych na jednostkę produktu.
Wadą natomiast jest
zbyt wysoki poziom kwasów nukleinowych w otrzymanej biomasie (są one źródłem kwasu
moczowego, którego nadmiar jest odkładany w nerkach lub stawach i przyczynia się do powstawania
zmian chorobowych),
konieczność oddzielenia biomasy od podłoża (w przypadku bakteri i glonów),
niska strawność białek uwięzionych w komórkach,
możliwość występowania w biomasie składników szkodliwych dla zdrowia pochodzących z podłoża.
Naturalne substancje toksyczne (c.d):
Czynniki wolotwórcze - niskocząsteczkowe peptydy, zawierające resztę cukrową lub związki o budowie 5-
winylooksazolidynotion-2 (WOT, tzw. goitryna). Występuje ona w roślinach w postaci progoitryny, która jest
glukozydem 2-hydroksybutyl-3en-izotiocyjanianu, nierozpuszczalnym w tłuszczach. Z progoitryny pod wpływem
działania enzymów tioglukozydazy i sulfatazy i w wyniku cyklizacji wytwarza się goitryna.
O CH
CH
CH
2
CS
NH
CH
2
Niskocząsteczkowe peptydy występują w nasionach strączkowych (groch,soja), WOT w roślinach krzyżowych
(kapusta, rzepak).
Hemaglutyniny – białka, najczęściej glikoproteidy (z mannozą lub glukozoaminą), posiadające zdolność
aglutynacji czerwonych ciałek krwi. Występują w grzybach trujących, w nasionach roślin strączkowych (fasola,
groch soczewica).
Antywitaminy – związki o budowie podobnej do witamin, nie posiadające aktywności biologicznej np. linotyna
w nasionach lnu – antagonistyczna do witaminy B
6
(pirydoksyny).
Kwas szczawiowy – COOH-COOH – powstaje w trakcje katabolizmu niektórych aminokwasów, kwasu
askorbinowego, puryn.
Nadmierne ilości kwasu szczawiowego mogą być przyczyną kamicy nerkowej.
Warzywa zasobne w kwas szczawiowy to: szpinak, rabarbar, szczaw, buraki, ryż.
Kwas fitynowy – (inozytoheksafosforowy) jest sześciofosforanową pochodną mezo-inozytolu, jednego z
dziewięciu izomerów pochodnych heksahydroksycykloheksanu.

Chemia żywności cz.2 2010/2011
19
Kwas ten tworzy nierozpuszczalne związki z wapniem i magnezem, a także z żelazem, cynkiem oraz związki
kompleksowe z białkami. Fityniany są formą magazynowania fosforu w roślinach i występują w zbożach,
orzechach, nasionach strączkowych, warzywach, owocach, a także w korzeniach i liściach roslin. Ich zawartość
waha się od 0,1 do 6%.
W zdolności wiązania cynku i żelaza przez kwas fitynowy znaleziono pozytywne aspekty. Uważa się, że kwas
fitynowy pośrednio zapobiega rozrostowi komórek poprzez wiązanie cynku potrzebnego do syntezy DNA, lub
wiązanie żelaza, katalizatora utleniania tłuszczów.
Sugeruje się również, że kwas fitynowy pełni rolę w zapobieganiu próchnicy zębów, w leczeniu nadwapnienia
kamieni nerkowych, oraz antidotum przeciwko ostrym zatruciom ołowiem.
W mięczakach, małżach i ostrygach występuje saksytoksyna - C
10
H
1
-O
4
N
7
x 2HCl - działa neurotoksycznie,
wytwarzana jest przez plankton i przypuszcza się, że toksyczność niektórych ostryg czy mięczaków wynika z
tego, że żywią się one glonami. Sezonowe zatrucia mięczakami (w okresie tarła) związane są z wysoką
zawartością choliny.
Ryby: Cyguaterotoksyna - prawdopodobnie IV-rzędowa zasada amonowa działa na układ krążenia oraz
nerwowo-mięśniowy. I tetrodoksyna -
obie znaleziona w rybach jadalnych.
W białku jaja:
awidyna – wiąże biotynę
owotransferyna – wiąże metale
owomukoid – czynnik antytryptyczny
owoinhibitor – inhibitor aktywności trypsyny i α-chymotrypsyny bydlęcej –wywołuje alergie.
Lizozym – działa litycznie w stosunku do ścian bakteryjnych i chityny, wywołuje odczyny alergiczne.
Audyt 3 17.03.11
NIEBIAŁKOWE ZWIĄZKI AZOTOWE:
Aminokwasy:
Glutaminian sodu – występuje w stanie wolnym w wielu artykułach żywnościowych, zazwyczaj w ilości
mniejszych niż 0,1% z wyjątkiem serów (0,6%) i pomidorów (0,25%). Należy do potencjałów smakowych,
wzmaga smakowitość produktów, a sam wywołuje wrażenie smakowe określone umami. W celu wzbogacenia
smaku dodawany jest do potraw w ilości 0,2-0,8%.
Histydyna, alanina, glicyna, lizyna, prolina i tauryna (produkt dekarboksylacji kwasu cysteinowego) – w mięsie
zwierząt rzeźnych, ryb i skorupiaków. Szczególnie w mięsie ryb występują histydyny, które ulegają dalszym
przemianom do amin biogennych
Prolina – stanowi 50-80% wolnych amin w miodzie
Aminokwasy niebiałkowe – kilkadziesiąt w owocach i warzywach, np. kwas γ-aminomasłowy – w soku buraka
ćwikłowego, pochodne aminokwasów zawierające siarkę – sulfotlenek S-(prop-1-enylo) cysteiny występujące w
cebuli, a S-(prop-1-enylo)cysteina w czosnku są prekursorem charakterystycznego dla nich związków
zapachowych uwalnianych w skutek enzymatycznych przemian.
Kwas 2,4-diaminomasłowy i β-aminopropylonitryl (wywołujący osteolatyryzm) zawierają niektóre nasiona roślin
strączkowych.

Chemia żywności cz.2 2010/2011
20
Trimetyloglicyna –w korzeniu buraka cukrowego.
Homobetaina – pochodna β-alaniny występuje w mięsie
Karnityna – pochodna kwasu β-hydroksy-γ-aminomasłowego – występuje w mięsie, rybach, drożdżach, kiełkach
pszenicy.
Stachydryna – pochodna proliny – w skórze cytryny i w lucernie.
Pod wpływem działania enzymów , mikroflory czy w trakcie obróbki w procesach technologicznych ulegają
deaminacji z wydzieleniem amoniaku; dekarboksylacji – z aminokwasów siarkowych uwalniany jest
siarkowodór.
Bakteryjny rozkład tryptofanu prowadzi do powstania indolu i stanowi o odrażającej woni kału.
Peptydy
W mięsie wołowym, drobiowym, w mięsie zwierząt morskich występują 3 cykliczne di peptydy
Kornozyna (β-alanylo-L-histydyna)
Jest to dipeptyd złożony z 2 aminokwasów β-alaniny i histydyny. Występuje głównie w mięśniach
H
2
N
NH
O
N
O
HO
NH
Balenina
H
2
N CH
2
CH
2
C
NH
O
CH
C
O
OH
CH
2
N
N
H
3
C
Anseryna
H
2
N
N
OH
O
O
H
N
N
Anseryna (β-anylo-N-metylo-L-histydyna) – składający się z 2 aminokwasów: β-alaniny i L-histydyny
rozbudowanej o grupę metylową (-CH
3
) biegnącą z atomu azotu grupy aminowej (-NH
2
). Występuje
głównie w mięśniach szkieletowych i mózgu. Pełni w organizmie ssaków rolę antyoksydantu.
W ostatnich latach wyizolowano z żywności również pochodzenia roślinnego i scharakteryzowano szereg
peptydów, wskazujących aktywność biologiczną, wśród nich znalazły się fizjologicznie czynne peptydy o
aktywności:
Antywirusowej
Immunologicznej
Antybakteryjnej
Peptydy neuroaktywne
Peptydy regulujące działanie enzymów i hormonów.

Chemia żywności cz.2 2010/2011
21
Substancje te posiadają zróżnicowaną budowę – zaliczamy do nich zarówno proste dipeptydy jak i liniowe lub
cykliczne digo- lub polipeptydy, których reszty aminokwasowe są często dodatkowo zmodyfikowane w procesie
glikozylacji, fosforylacji czy acylacji.
Od dawna jest znane znaczenie produktów częściowej proteolizy białek głównie występujących w serze, w
odbiorze wrażeń smakowych.
Peptydy różnorodnego pochodzenia o różnej sekwencji aminokwasowej mogą być źródłem wszystkich
podstawowych smaków:
Słodkiego
Gorzkiego
Kwaśnego
Słonego
Umami
Peptydy o smaku gorzkim wyizolowano w kakao, sake, hydrolizatorów białkowych.
Peptydy charakteryzuje się właściwościami antyoksydacyjnymi. Posiadają one zdolności neutralizowania
rodników nadtlenowych, powstających w żywności głównie w procesie utleniania kwasów tłuszczowych, jak
również są akceptorami jonów metali ciężkich, dzięki czemu mogą zapobiegać powstaniu wolnych rodników.
Żywność pochodzenia roślinnego jest bezpośrednim źródłem bioaktywnych peptydów.
W nasionach roślin strączkowych (groch, fasola, soja, soczewica) powszechnie występują inhibitory proteaz,
które ograniczają działanie enzymów proteolitycznych, obniżają więc przyswajanie białka. Z drugiej strony
mogą wykazywać korzystne działania w walce z rakiem, poprzez ograniczenie dostępności aminokwasów
potrzebnych do budowy komórek rakowych czy odwrócenie zmian, spowodowanych ekspresją onkodenów.
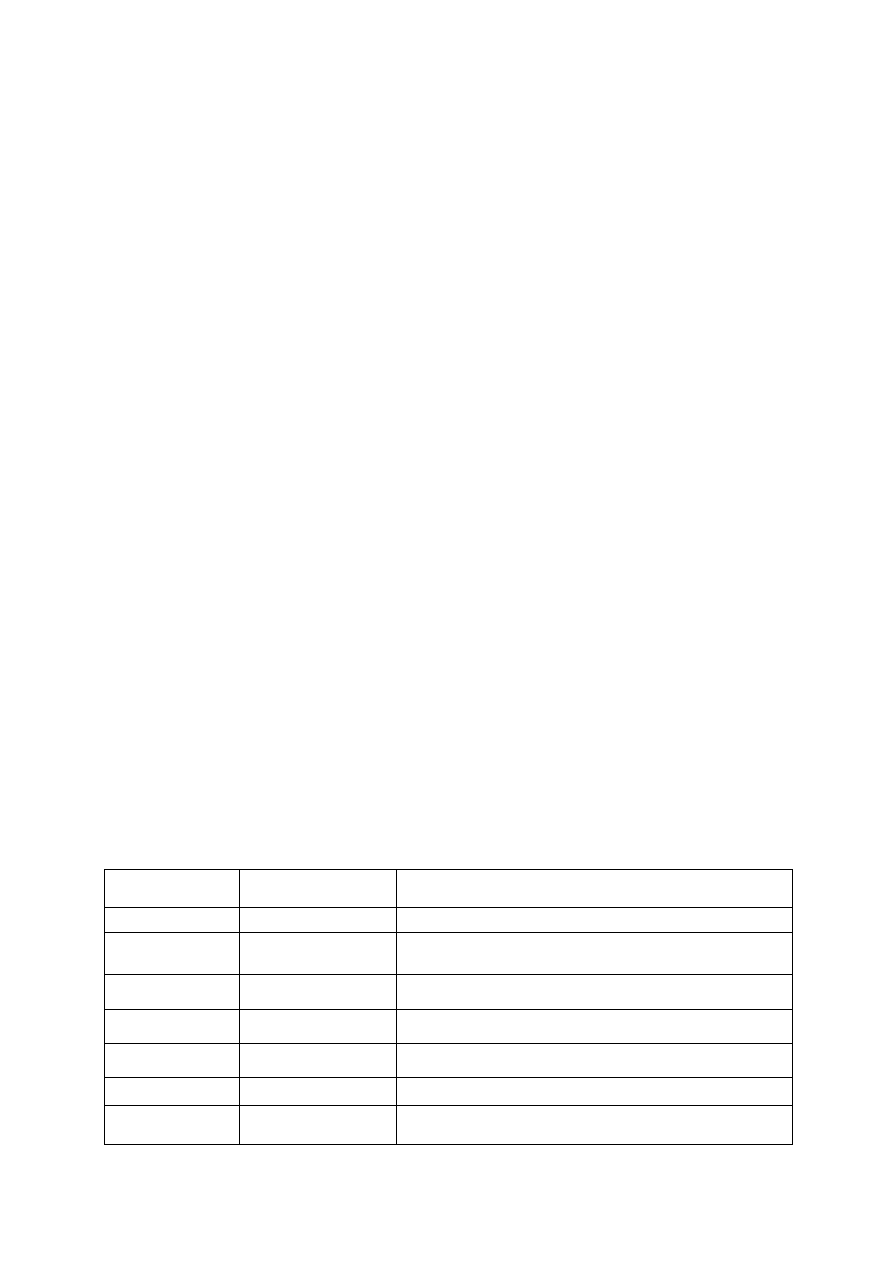
Inhibitory enzymów proteolitycznych:
W roślinach obok białek zapasowych, enzymatycznych i strukturalnych, występują białka, charakteryzujące się
zdolnością do hamowania aktywności enzymów proteolitycznych.
Inhibitory proteaz w największych ilościach spotykane są w nasionach roślin motylkowych w ziarnach zbóż oraz
w bulwach ziemniaków i korzeniach buraków. Ich zawartość stanowi od 0,1 do 1% ilości białka. Inhibitory
proteaz tworzą kompleksy z enzymami, w skutek czego te ostatnie tracą swoją aktywność pod względem
budowy chemicznej są to drobnocząsteczkowe białka lub polipeptydy, których masy cząsteczkowe nie
przekraczają zwykle 20 000 daltonów.
Większość z nich zbudowana jest z 70-90 reszt aminokwasowych i bardzo rzadko zawierają komponentę
cukrową. Roślinne inhibitory proteaz zostały przez Y. Birk podzielone na siedem grup wg podobnej sekwencji i
położenia centrum aktywnego:
Inhibitor trypsyny z soi (kurnitz)
Inhibitor trypsyny z soi (Bowman-Birk)
Inhibitor I z ziemniaków
Inhibitor II z ziemniaków
Inhibitor z dyniowatych
Inhibitor z trypsyny z jęczmienia
Inne Inhibitory.
Chemia żywności cz.2 2010/2011
22
Podstawowym badaniem pozwalającym wyjaśnić mechanizm inhibicji jest poznanie sekwencji
aminokwasowych oraz struktury inhibitorów. Do najlepiej poznanych należą Inhibitory sojowe. Spośród
dziesięciu występujących w tych nasionach białek o aktywności antyproteolitycznej, szczególnie dobrze
poznane są dwie:
Wydzielony przez Kunitza w 1947 tzw. STI. Może być on inhibitowany termicznie, przez soki
żołądkowe. Tylko kilka jego homologów zostało wyodrębnionych z innych źródeł roślinnych.
Inhibitor trypsyny i chymotrypsyny Browman-Birk (BB) dominujących w roślinach strączkowych
W ziemniakach, grzybach i jabłkach występują peptydowe inhibitory polifenolooksydazy. Obok ograniczenia
aktywności tego enzymu zmniejszają one również proces enzymatycznego ciemnienia żywności.
W wielu roślinach występują lektyny (fitoalaglutaniany), białka często z komponentą cukrową, posiadające
zdolność aglutynacji - poprzez łączenie się z erytrocytami powodują ich aglomerację lektyny, mogą wywoływać
stany zapalne komórek nabłonka, hemofilię w tkankach limfatycznych i uszkodzenia wątroby. Z drugiej strony
prowadzone są prace nad ich wykorzystaniem w terapii chorób nowotworowych.
Kolejną grupą aktywnych peptydów pochodzenia roślinnego są fitochelatyny – funkcjonalne analogi
zwierzęcych metalotionein. Fitochelatyny zawierają w swoim składzie kwas glutaminowy, cysteinę, glicynę.
Posiadają one zdolność chelatowania jonów metali, zwłaszcza ciężkich, takich jak Cu, Zn, Ni, Cd, Pb czy Hg.
Odgrywają one ważną rolę jako detoksydanty, przypisuje się im również udział w gospodarce mikroelementami,
w której są donorami metali w procesie biosyntezy metaloenzymów.
Audyt 4 31.03.11
Aminy
Lotne aminy - metyloamina, dimetyloamina, propyloamina, butyloamina, izobutyloamina, izoamyloamina są
składnikami związków zapachowych wina, piwa, herbaty i czekolady.
W mięsie zwierząt morskich prekursorem lotnych amin jest tlenek trimetyloaminy -TMAO. Pod wpływem
enzymów endogennych lub bakteryjnych ulega on redukcji do trimetyloaminy(T1\/IA), który to związek jest
przyczyną charakterystycznego zapachu śniętych ryb.
W procesie dekarboksylacji aminokwasów powstają aminy, które z uwagi na swoją aktywność biologiczną
zwane są aminami biogennymi. Cysteamina, składnik koenzymu A powstaje z cysteiny; histamina, tyramina,
tryptamina - hormony tkankowe odpowiednio z histydyny, tyrozyny, tryptofanu; putrescyna należąca do
poliamin bezpośrednio z ornityny lub w procesie hydrolizy agmatyny, powstałej w wyniku dekarboksylacji
argininy; metionina natomiast jest prekursorem spermidyny i sperminy.
Putrescyna i spermidyna występują w komórkach roślinnych, dodatkowo putrescyna jest nagromadzana w
owocach cytrusowych, przechowywanych W niskich temperaturach.
Najważniejsze aminy biogenne w organizmie ludzkim
Aminokwas
Produkt
dekarboksylacji
Działanie i występowanie
Histydyna
Histamina
Hormon tkankowy obniżający ciśnienie
Lizyna
Kadaweryna
Stabilizator rybosomów; produkt metabolizmu bakterii
Arginina
Agmatyna
Produkt metabolizmu bakterii przewodu pokarmowego
Kwas asparginowy
ß-alanina
Składnik koenzymu A
Kwas glutaminowy
Kwas χ-aminomasłowy
Produkt przemiany metabolicznej w mózgu neuroprzekaźnik
Seryna
Etanoloamlna
Składnik fosfatydów i choliny
Treonina
Propanoloamlna
Składnik witaminy B
12
Chemia żywności cz.2 2010/2011
23
Cysteina
Cysteamlna
Składnik koenzymu A
Tyrozyna
Tyramina
Hormon tkankowy
Tryptofan
Tryptamina
Hormon tkankowy
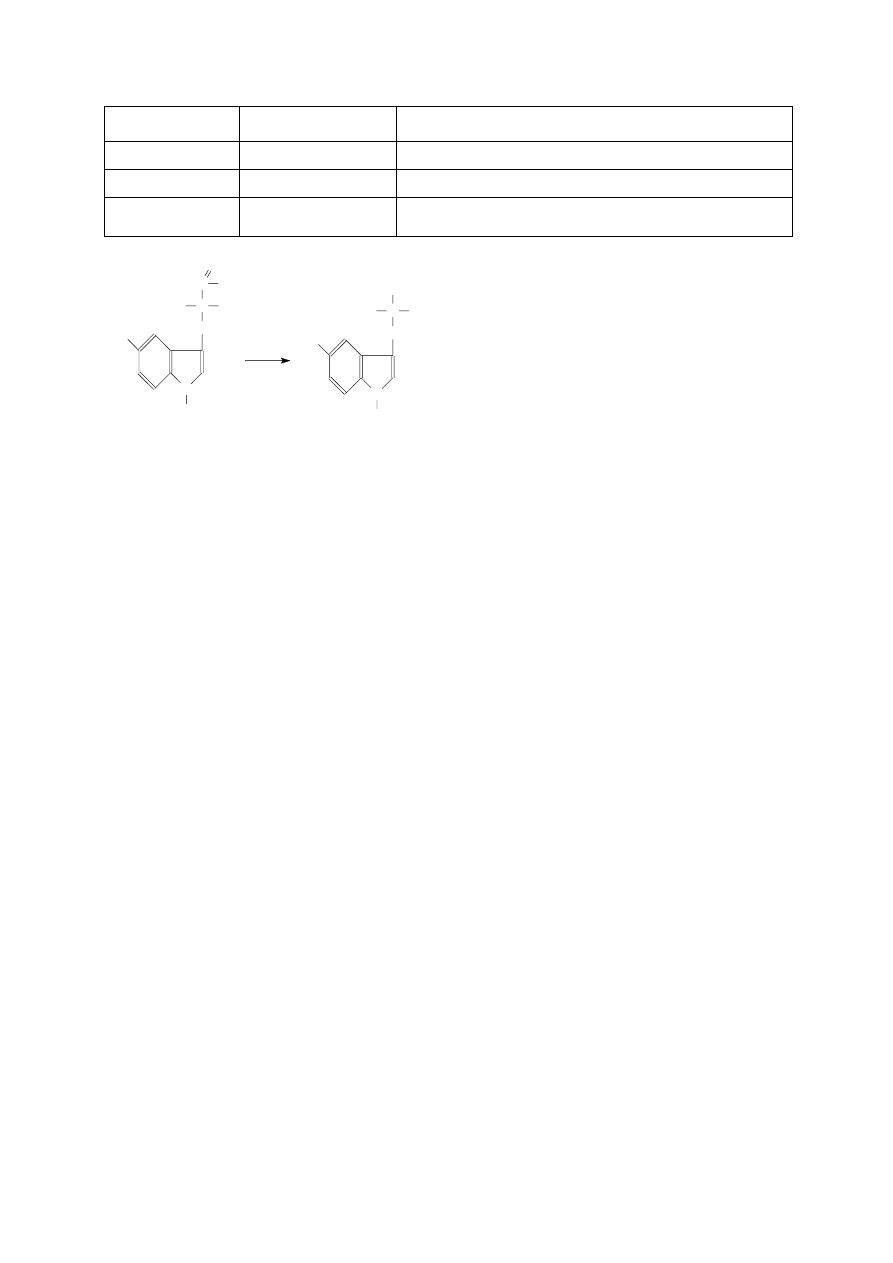
5-hydroksy-
tryptofan
Serotonina
Hormon tkankowy podwyższający ciśnienie we krwi,
neuroprzekaźnik
N
HO
CH
2
C
H
H
2
N
C
OH
O
H
5-hydroksytryptofan
N
HO
CH
2
C
H
H
2
N
H
H
+
Serotonina
CO
2
Tryptoamina i serotonina występują w kawie, winie, piwie, owocach, warzywach, mięsie i rybach, duże
tyraminy (powyżej 0,1g/100g) zawierają niektóre sery.
Histamina występuje powszechnie w mięsie ryb i niewłaściwe przechowywanie surowca może
doprowadzić do zbytniego jej nagromadzenia, będącego przyczyną zatruć pokarmowych.
Aminy drugo- i trzeciorzędowe ulegają reakcji nitrozowania pod wpływem azotanów (III), panującego z nich
bezwodnika N
2
O
3
, jego protonowej formy i kationu nitrozoniowego.
W wyniku reakcji powstają N-nitrozoaminy (NNA), związki posiadające działanie rakotwórcze.
Powstawaniu takich szkodliwych związków sprzyja obróbka cieplna (smażenie, wędzenie). W trakcie procesów
cieplnych w produktach zasobnych w białko powstają heterocykliczne aminy aromatyczne (HAA), które również
wykazują działanie mutagenne i kancerogenne.
Kwasy nukleinowe i nukleotydy:
Produkty żywnościowe nie są bogatym źródłem kwasów nukleinowych. Kwas rybonukleinowy (RNA) występuje
głównie w rybosomach, natomiast kwas deoksyrybonukleinowy (DNA) przede wszystkim w jądrze
komórkowym. Obydwa kwasy występują w połączeniach z zasadowymi białkami jako nukleoproteiny.
Największe ilości kwasów nukleinowych zawiera mlecz ryb (nawet do ok. 50%); wątroba zwierząt rzeźnych i
biomasa drobnoustrojów - od kilku do kilkunastu procent. Z punktu widzenia żywieniowego są to zbyt wysokie
ilości. Również kawior jest zasobny w kwasy nukleinowe.
W artykułach żywnościowych występują również nukleotydy i produkty ich biochemicznych przemian - z
adenozynotrifosforanu (ATP) powstaje inozynomonofosforan (IMP), następnie inozyna (Ino) i hipoksantyna
(Hx). Są one potencjatorami smaku - hipoksantyna gorzkiego, a IMP i inne nukleozydo-5’-monofosforany
działają kilkunastokrotnie efektywniej od glutaminianu sodu (smak umami).
Zawartość nukleotydów i produktów ich degradacji jest bardzo czułym wskaźnikiem świeżości ryb w pierwszym
okresie po ich śnięciu.

Chemia żywności cz.2 2010/2011
24
N
NH
CH
2
CH
COOH
H
2
N
histydyna
N
NH
CH
2
CH
2
NH
2
histamina
(CH
2
)
4
NH
2
CH
COOH
H
2
N
lizyna
(CH
2
)
5
NH
2
NH
2
kadaweryna
(CH
2
)
2
C
CH
NH
2
O
COOH
H
2
N
(CH
2
)
3
NH
2
CH
COOH
H
2
N
(CH
2
)
4
NH
2
NH
2
(CH
2
)
4
NH
NH
2
(CH
2
)
3
NH
2
(CH
2
)
3
NH
C
NH
H
2
N
CH
COOH
H
2
N
(CH
2
)
4
NH
C
NH
H
2
N
NH
2
(CH
2
)
3
NH
2
NH
(CH
2
)
4
NH
(CH
2
)
3
NH
2
spermina
agmatyna
putrescyna
arginina
ornityna
glutamina
spermidyna
Barwniki:
W produktach zwierzęcych występują dwa naturalne czerwone barwniki: hemoglobina w czerwonych ciałkach
krwi i mioglobina w mięśniach. Obydwa należą do chromoprotein, zawierają układ por fitynowy w którego
centrum jest jon żelaza dwuwartościowego.
N
N
N
O
-
O
N
O
-
O
Fe
2+
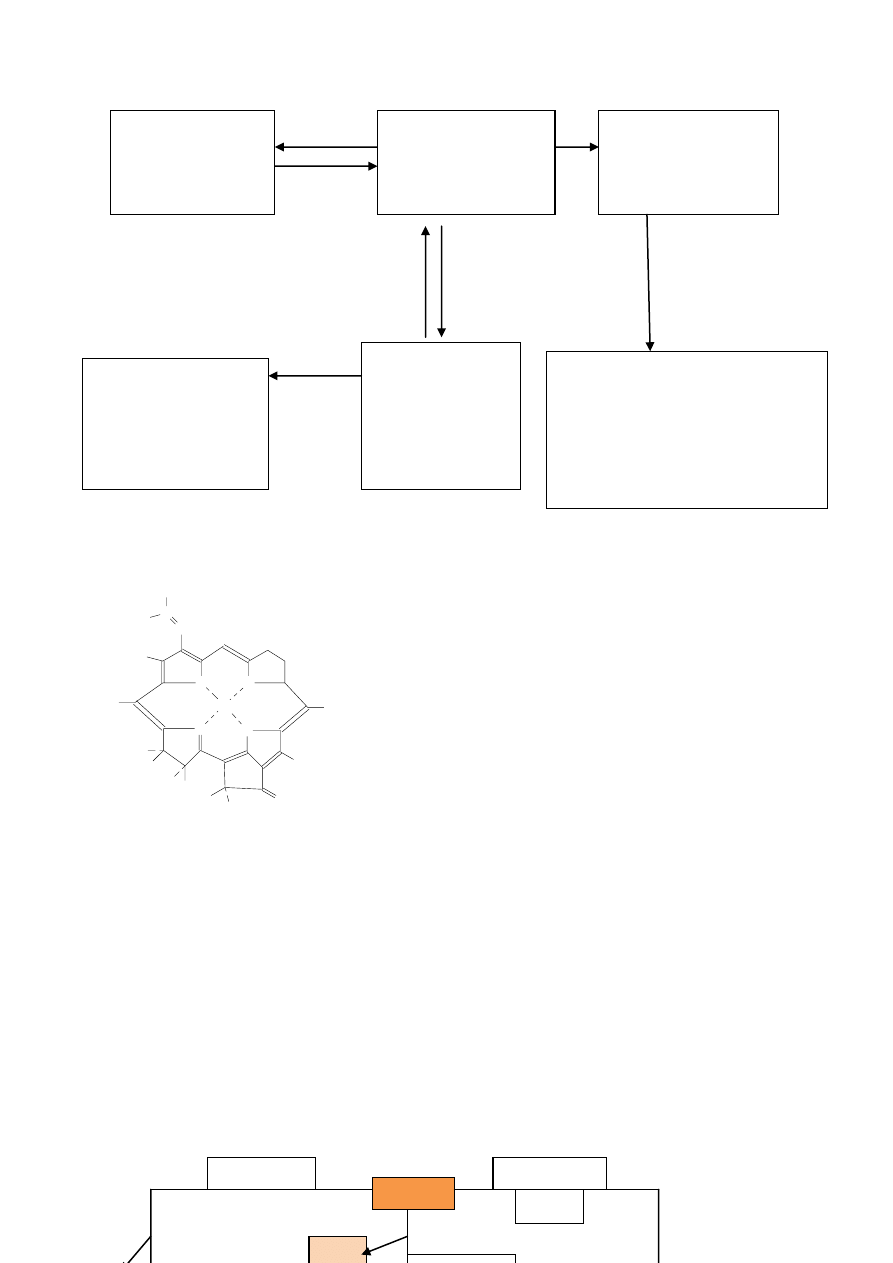
W mięsie po ubojowym głównym barwnikiem jest mioglobina. Pod wpływem tlenu mioglobina ulega utlenieniu
do oksymioglobiny o barwie jasnoczerwonej. Obecność tego związku powoduje widoczne rozjaśnienie barwy
świeżo przekrojonego mięsa.
ZMIANY BAWNIKÓW MIĘSA
NO
Chemia żywności cz.2 2010/2011
25
Barwnikami najbardziej rozpowszechnionymi w świecie roślinnym są chlorofile, zielone barwniki odgrywają
główną rolę w procesie fotosyntezy. Zbudowane są one z układu porfirynowego, zawierającego w centrum
dwuwartościowy jon magnezu i łańcucha fitowego, który umożliwia rozpuszczanie w tłuszczach.
N
N
N
N
Mg
H
CH
3
O
H
CH
2
H
H
C
H
3
C
C
H
H
H
3
C
H
CO
2
CH
3
Barwniki chlorofilowe są bardzo nietrwałe, ulegają rozpadowi zarówno w środowisku kwaśnym jak i
zasadowym. W słabo kwaśnym środowisku następuje usuniecie magnezu i powstaje oliwkowo zielona
feofityna, w środowisku mocno kwasowym obok fitolu usuwany jest również magnez - powstały brunatny
feoforbid rozpuszcza sie w wodzie. W środowisku zasadowym usuwany jest metanol i fitol, a otrzymane
chlorofiliny są nadal zielone, natomiast pod wpływem działania chlorofiliazy powstają zielone chlorofilidy
pozbawione łańcucha fitolowego.
Oksymioglobina
MbFe(II)O
2
Jasno czerwona
Mioglobina
MbFe(II)
Purpurowo czerwona
Nitrozylomioglobina
MbFe(II)NO
Jasno czerwona
O
2
Nitrozylohomochromogen
+ Globina-NO
2
HemFe(II)NO
różowy
Metmioglobina
MbFe(II)OH
brązowa
Zdenaturowana
metmioglobina
MbFe(III)OH
brązowa
ogrzewanie
+
e
-
e
NO
2
-
ogrzewanie
Słabe kwasy
Chlorofil
Chlorofiliaza
zasada
Silne kwasy
Mg
2+
Chemia żywności cz.2 2010/2011
26
Pozostałe barwniki roślinne rozpuszczalne w tłuszczach
Żółte karotenoidy należą do związków polienowych, zbudowanych z ośmiu jednostek izoprenowych,
posiadających w swoim składzie pierścień β-jononu.
Związki te dzielimy na dwie grupy:
1. karoteny do których zaliczamy m.in. decydujący o barwie pomidorów likopen
i ß-karoten związek najpowszechniej występujący w świecie roślinnym, prowitamina A
2. ksantofile – pochodne hydroksylowe, epoksydowe, karboksylowe
Żywność pochodzenia roślinnego zawdzięcza swoja czerwona barwę obecności antocjanów, czerwonych
barwników rozpuszczalnych w wodzie, należących do flawonoidów. Są one pochodnymi kationu flawyliowego:
HO
O
+
OH
R
3
OH
R
5
A
C
B
Aglikony najczęściej występują w barwnikach antocyjanowych:
Chemia żywności cz.2 2010/2011
27
R
3
R
5
Pelargonidyna (Pg)
-H
-H
Cyjanidyna (Cy)
-OH
-H
Delfinidyna (Dp)
-OH
-OH
Peonidyna (Pn)
-OCH
3
-H
Petunidyna (Pt)
-OCH
3
-OH
Malwidyna (Mv)
-OCH
3
-OCH
3
Cyjanonidyna występuje prawie we wszystkich owocach, nie zawierają tego aglikonu bakłażany, w których
występują pochodne delfinidyny.
Antocyjany przyjmują barwę od pomarańczowej do niebieskiej, poprzez odcienie czerwieni i fioletu. Pomimo,
że w owocach i warzywach może występować nawet kilkanaście barwników antocyjanowych, to zazwyczaj
jeden jest dominujący i od jego zawartości jeden jest dominujący i od jego zawartości zależy barwa danego
produktu. Antocyjany są wrażliwe na działanie temperatury, czynników utleniających. Są nietrwałe w
środowisku wodnym, zmieniają swoją barwę w zależności od pH środowiska.
Wzrost trwałości barwy powoduje utworzenie kompleksów z jonami metali lub z takimi składnikami żywności
jak polifenole, alkaloidy czy aminy.
Reakcjom tym sprzyja słabo kwaśne środowisko.
Zachowanie barwy antocyjanów można też osiągnąć poprzez obniżenie zawartości wody:
Suszenie
Zagęszczanie
Wprowadzanie związków wiążących
N
COOH
N
COOH
H
HOOC
+
Betaksantyna
CH
(CH
2
)
2
COOH
HOOC
N
N
COOH
HOOC
H
Wulgaksantyna
Skład barwników antocyjanowych występujących w niektórych owocach:
Owoce
Barwniki
Truskawki
Cy 3-glukozyd, Pg 3-glukozyd
Śliwki
Cy 3-glukozyd, Cy 3-rutynozyd, Pn 3-glukozyd, Pn 3-rutynozyd
Aronia
Cy 3-glukozyd, Cy 3-galaktozyd, Cy 3-arabinozyd, Cy 3-ksylozyd
Porzeczka
czarna
Cy 3-glukozyd, Cy 3-rutynozyd, Dp 3-glukozyd, Dp 3-rutynozyd
Porzeczka
czerwona
Cy 3-glukozyd, Cy 3-rutynozyd, Cy 3-sambubiozyd, Cy 3-soforozyd,
Cy 3-(2-ksylozylorutynozyd), Cy 3-(2-glukozylorutynozyd)
Maliny
Cy i Pg 3-glukozyd, Cy iPg 3-soforozyd, Cy i Pg 3-rutynozyd,
Cy i Pg 3(2-glukozylorutynozyd), Cy 3,5-diglukozyd
Jabłka
Cy 3-glukozyd, Cy 3-galaktozyd, Cy 3-arabinozyd, Cy 3-ksylozyd
Winogrona
Cy 3-glukozyd, Mv 3-glukozyd, Dp, Pn, Pt 3-glukozydy, Cy, Dp, Mv, Pn, Pt 3-acetyloglukozydy
i 3-p-kumaroiloglikozydy, Mv 3-kawoiloglukozydy
Wyszukiwarka
Podobne podstrony:
ch infekcyjne wyklad
Ch organiczna wykład 1d
MN energetyka zadania od wykładowcy 09-05-14, STARE, Metody Numeryczne, Część wykładowa Sem IV
Ch organiczna wykład 1g
ch zywnosci wyklad 4 lipidy low
Filozofia karta przedm, semestr VIII, Semestr VIII, VIII semestr, Filozofia, Materiały od wykładowcy
5 LIDDELL HART, semestr II, Strategia Bezpieczeństwa Narodowego, Materiały od wykładowcy
Karta Narodów Zjednoczony ch (od mgr O.Łachacz), Studia, Prawo, prawo międzynarodowe publiczne
OGÓLNA TEORIA STRATEGII, semestr II, Strategia Bezpieczeństwa Narodowego, Materiały od wykładowcy
KLIMAT14, Zasady dzia˙ania urz˙dze˙ ch˙odniczych
Fluidyzacja, Technologia Żywności i Żywienie Człowieka, IV semestr, Obróbka cieplna produktów spożyw
14 MOLTKE Star, semestr II, Strategia Bezpieczeństwa Narodowego, Materiały od wykładowcy
MAT-OB~2 dobre cieplnaa, Obr˙bka cieplna jest zabiegiem technologicznym , umo˙liwiaj˙cym dzi˙ki grza
Makroekonomia prezentacja od wykładowcy
Ch WGGiIS Wyklad12
Ch WGGiIS Wyklad6
CH klin wykład 2
Finanse Przedsiębiortsw wykład 22 09 2012 materiały od wykładowcy
10 MAO TSE TUNG, semestr II, Strategia Bezpieczeństwa Narodowego, Materiały od wykładowcy
więcej podobnych podstron