
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
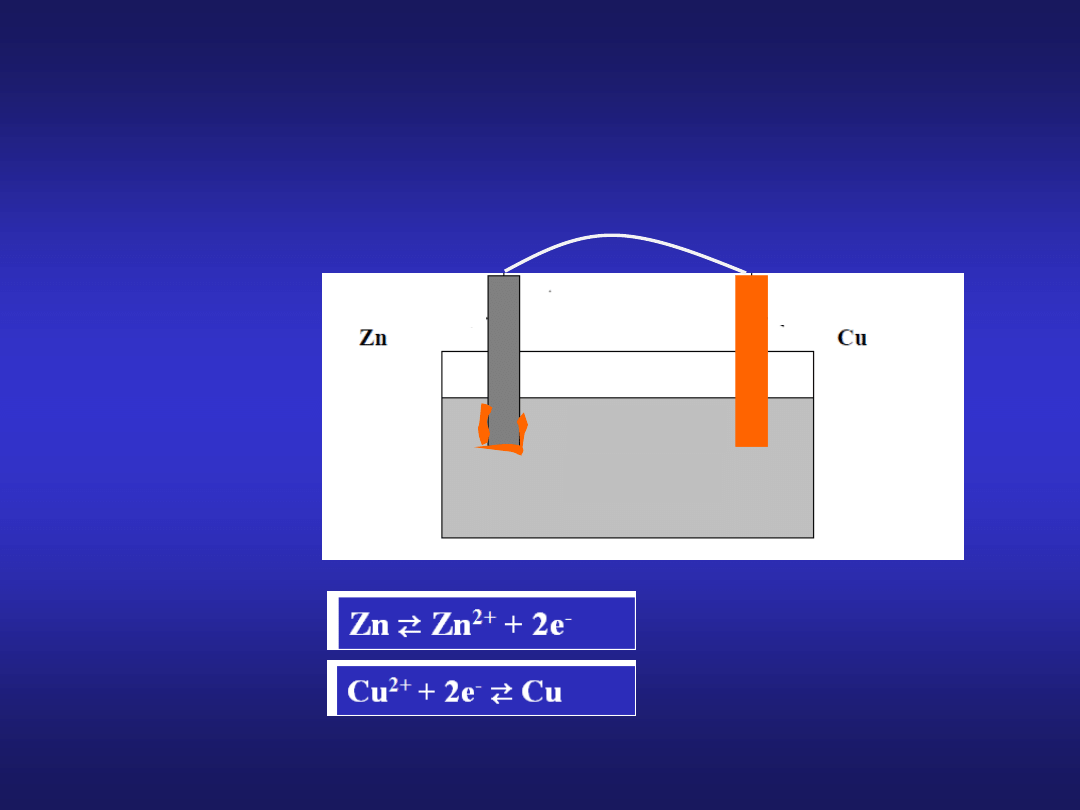
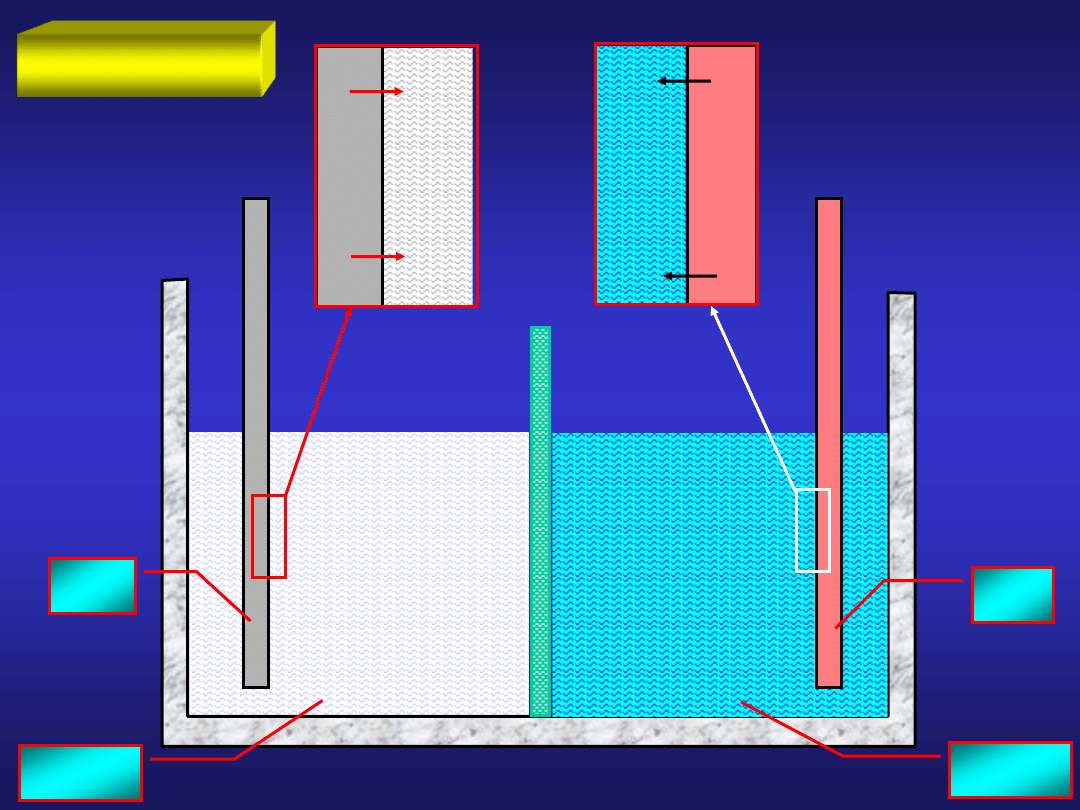
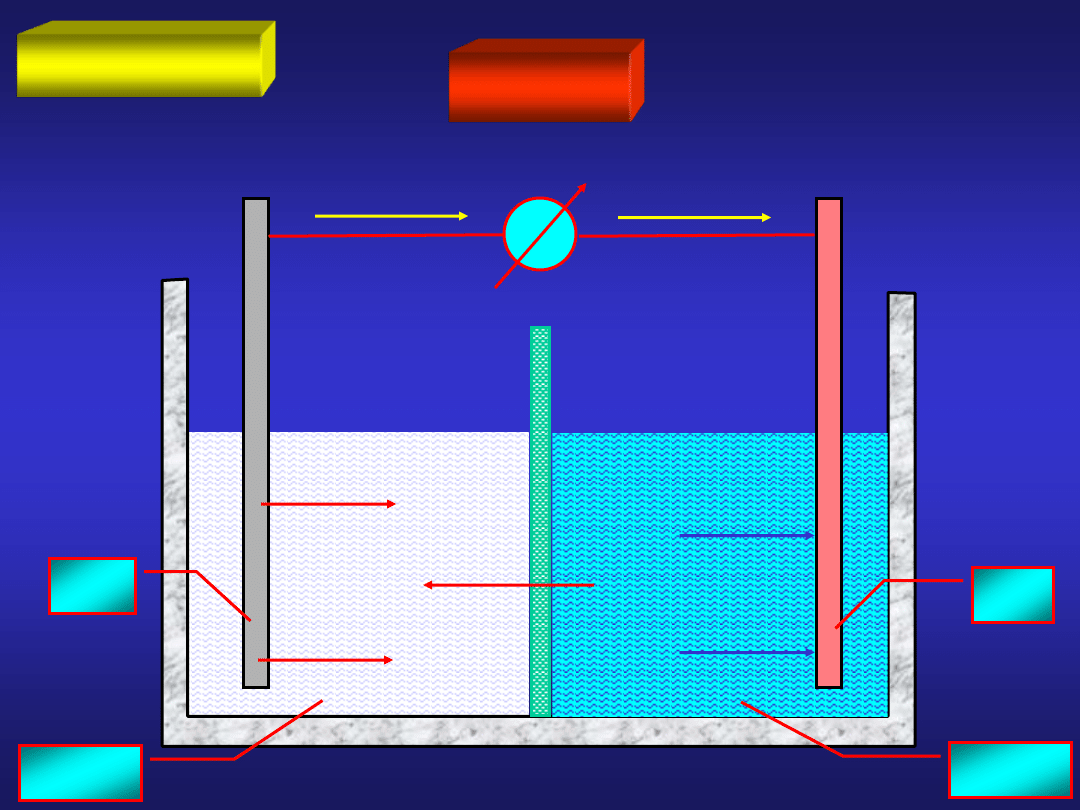
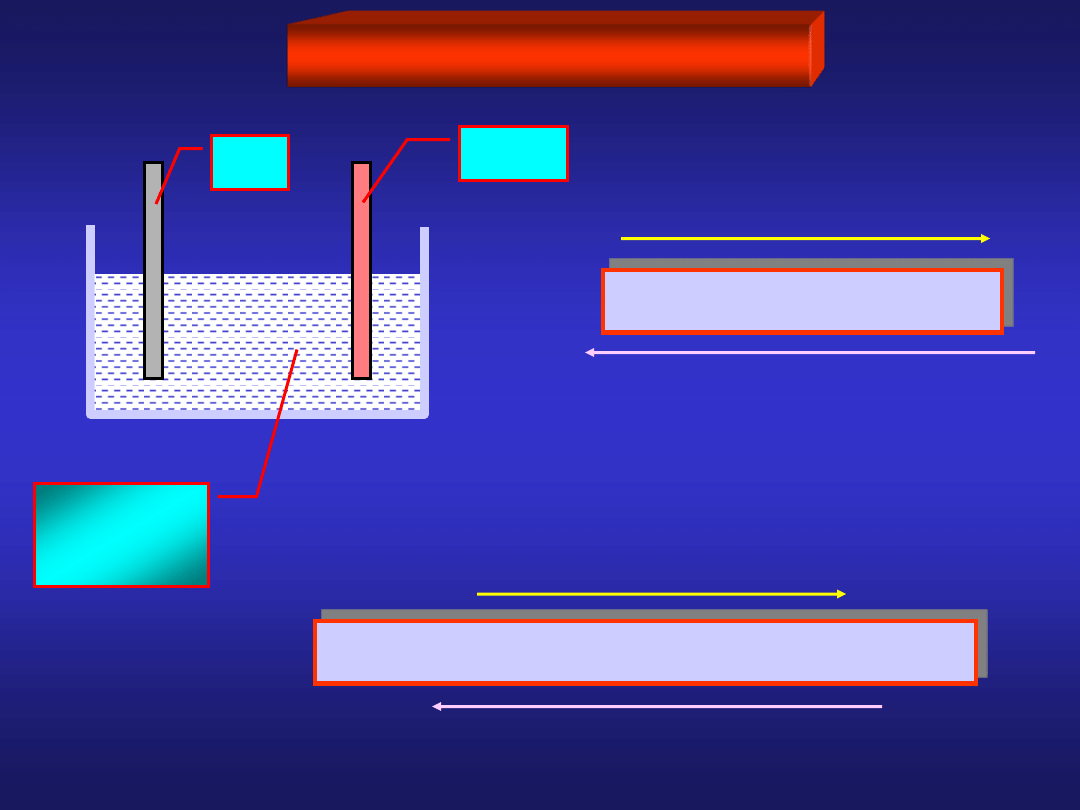
Rozpatrzmy układ dwóch blaszek: cynkowej i miedzianej zanurzonych
w roztworze CuSO
4
:
CuSO
4
po pewnym czasie:
To można wykorzystać!
ZnSO
4
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
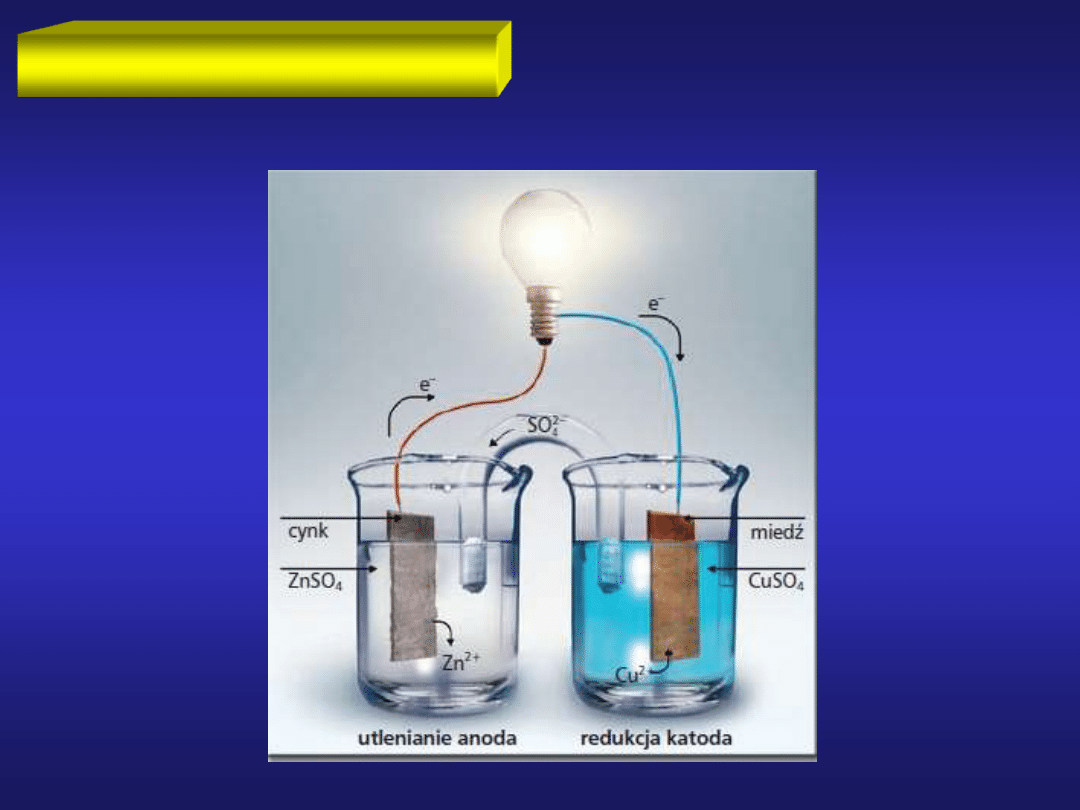
OGNIWO DANIELLA
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

W ogniwie reakcje utleniania i redukcji są
przestrzennie rozdzielone.
OGNIWO składa się z:
- dwóch elektrod (przewodniki elektryczne)
- elektrolitu (przewodnik jonowy)
OGNIWO
to urządzenie, w którym wytwarzany jest prąd elektryczny
dzięki przebiegowi samorzutnej reakcji chemicznej redoks.
Aby wystąpił przepływ prądu elektrycznego, elektrody muszą
zostać połączone przewodnikiem metalicznym (przepływ
elektronów) a obwód musi być zamknięty przez np. klucz
elektrolityczny.
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
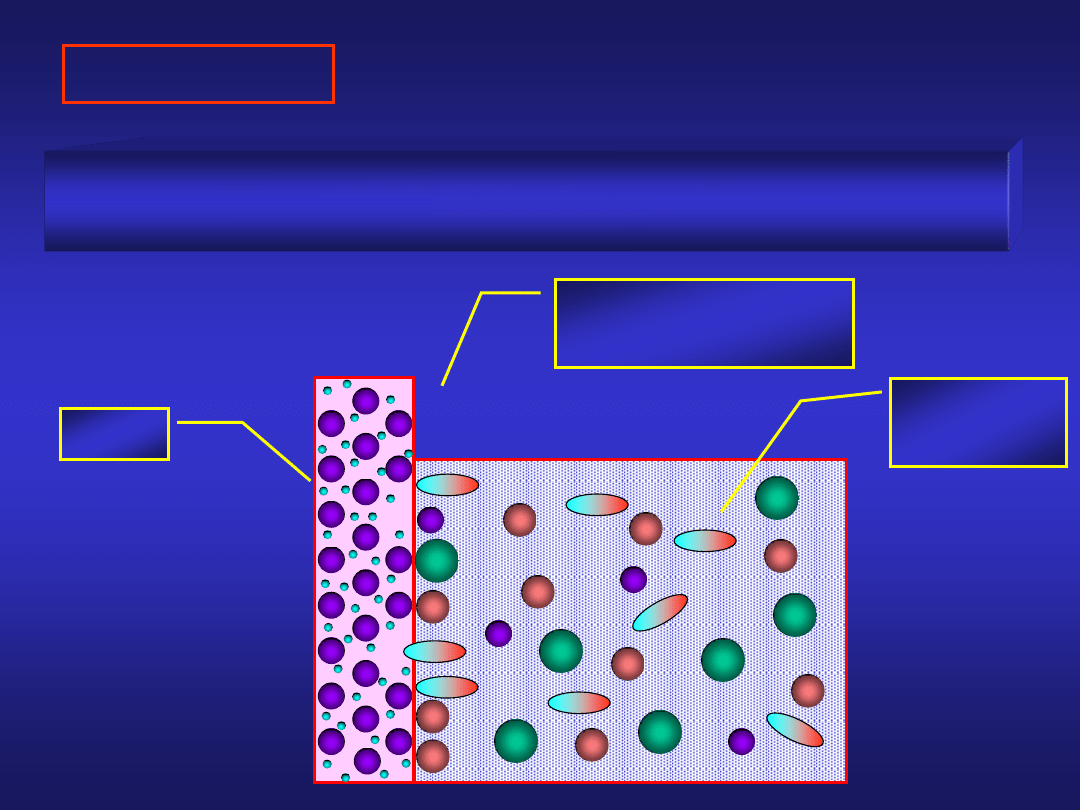
ELEKTRODA
Układ, w którym zapewniono kontakt przewodnika
metalicznego i jonowego nosi nazwę
ELEKTRODY
metal
roztwór
elektrolitu
- - -
+ + +
podwójna warstwa
elektryczna
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

ZJAWISKA ELEKTRYCZNE NA GRANICY FAZ
Zetknięcie dwóch faz powoduje zmianę w rozkładzie
ładunków elektrycznych w każdej z nich, w warstwach
przylegających do obu stron granicy faz.
Wynikiem tego jest powstanie różnicy potencjałów
między fazami nazywanej...
POTENCJAŁEM
MIĘDZYFAZOWYM
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
- kationy
- aniony
- - -
+ + +
POCHODZENIE POTENCJAŁU MIĘDZYFAZOWEGO
Ia. Dyfuzja jonów przez granicę faz – potencjał dyfuzyjny
D
V
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
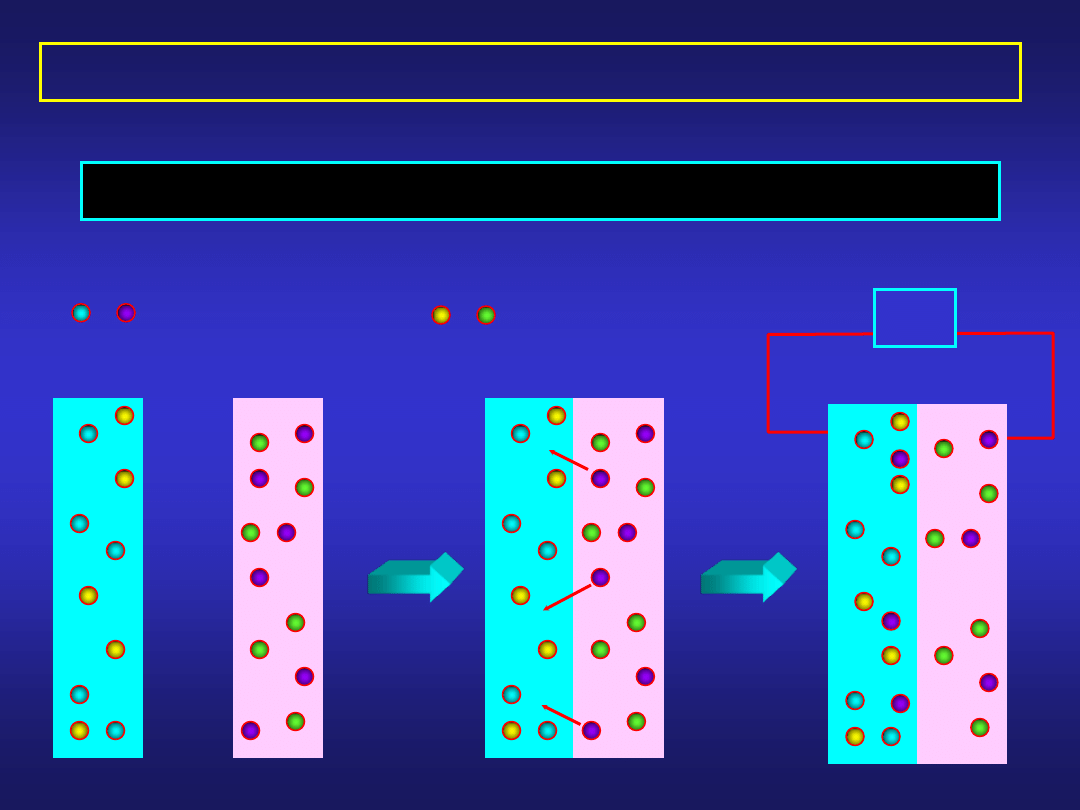
- kationy
- aniony
- - -
+ + +
POCHODZENIE POTENCJAŁU MIĘDZYFAZOWEGO
Ib. Dyfuzja jonów przez granicę faz – potencjał elektrody
D
V
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
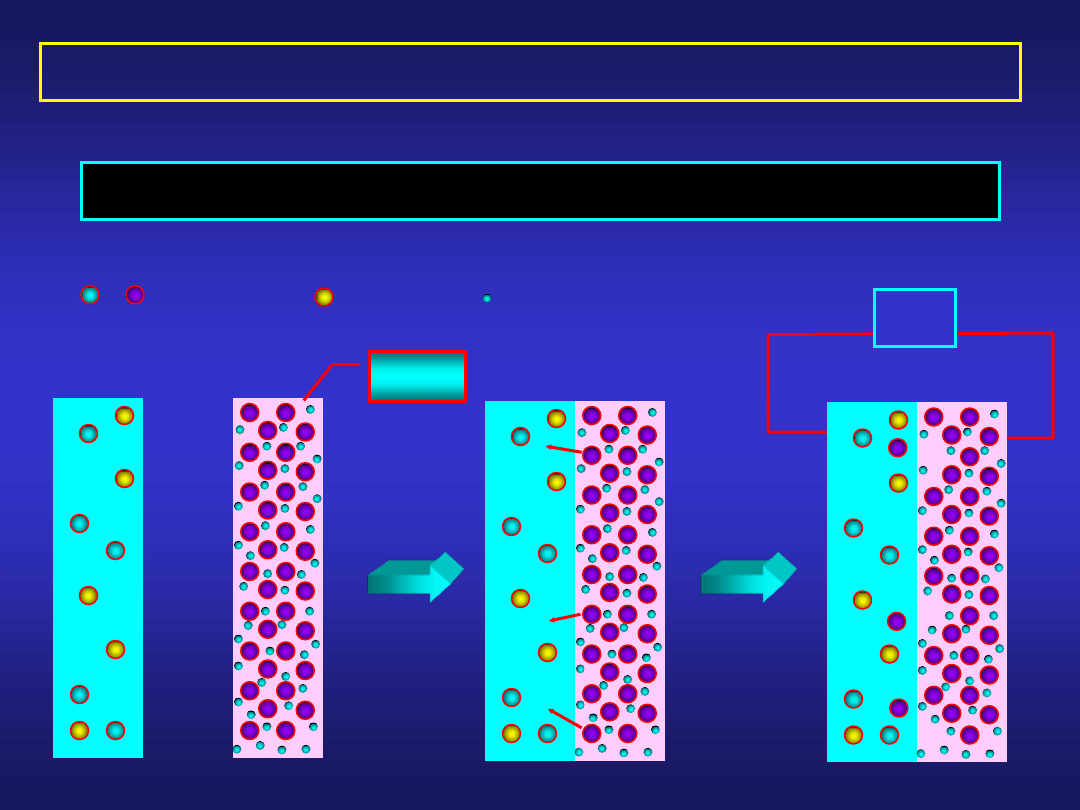
- - -
+ + +
POCHODZENIE POTENCJAŁU MIĘDZYFAZOWEGO
Ic. Dyfuzja jonów przez granicę faz – potencjał elektrody
D
V
- kationy
- aniony
- elektrony
metal
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
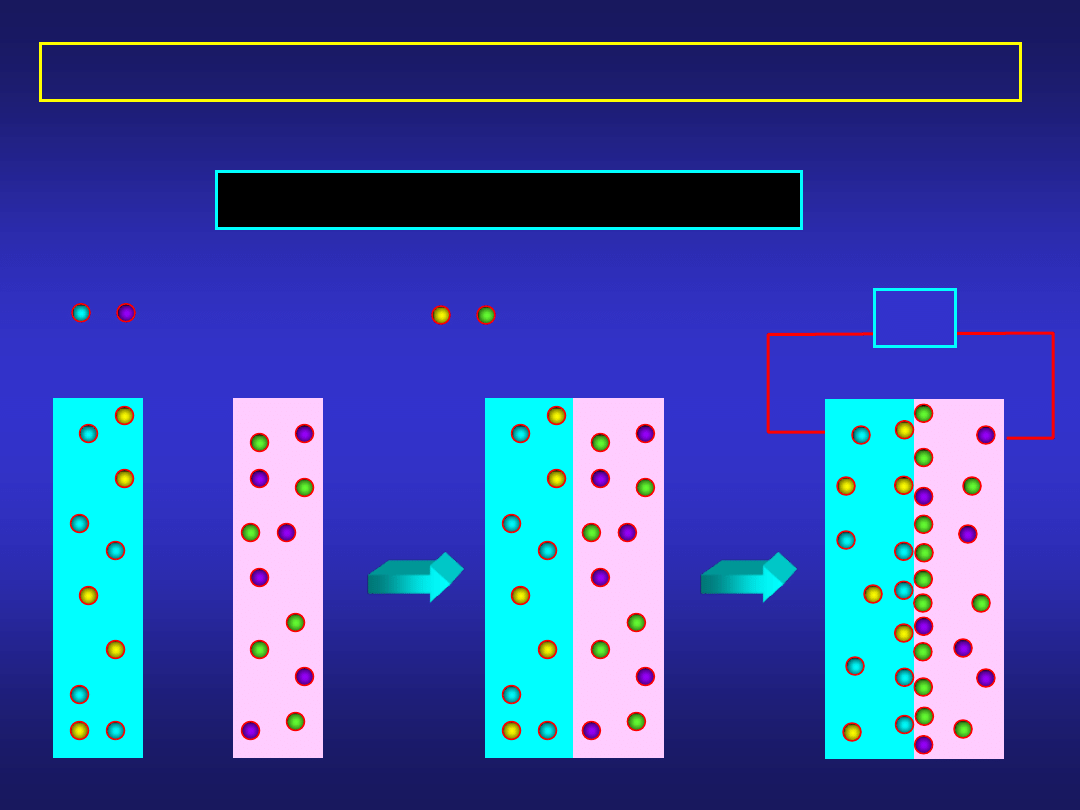
- kationy
- aniony
- - -
+ + +
POCHODZENIE POTENCJAŁU MIĘDZYFAZOWEGO
II. Adsorpcja jonów na granicy faz.
D
V
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
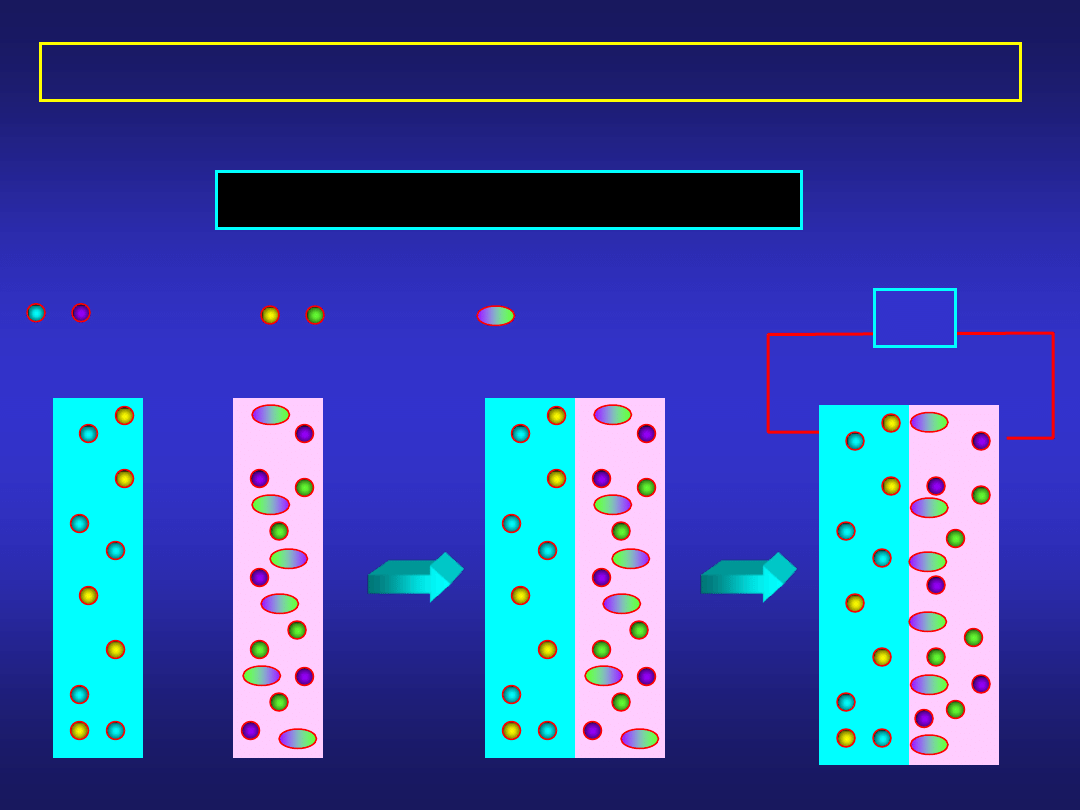
- - -
+ + +
POCHODZENIE POTENCJAŁU MIĘDZYFAZOWEGO
III. Adsorpcja dipoli na granicy faz.
D
V
- kationy
- aniony
- dipol
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
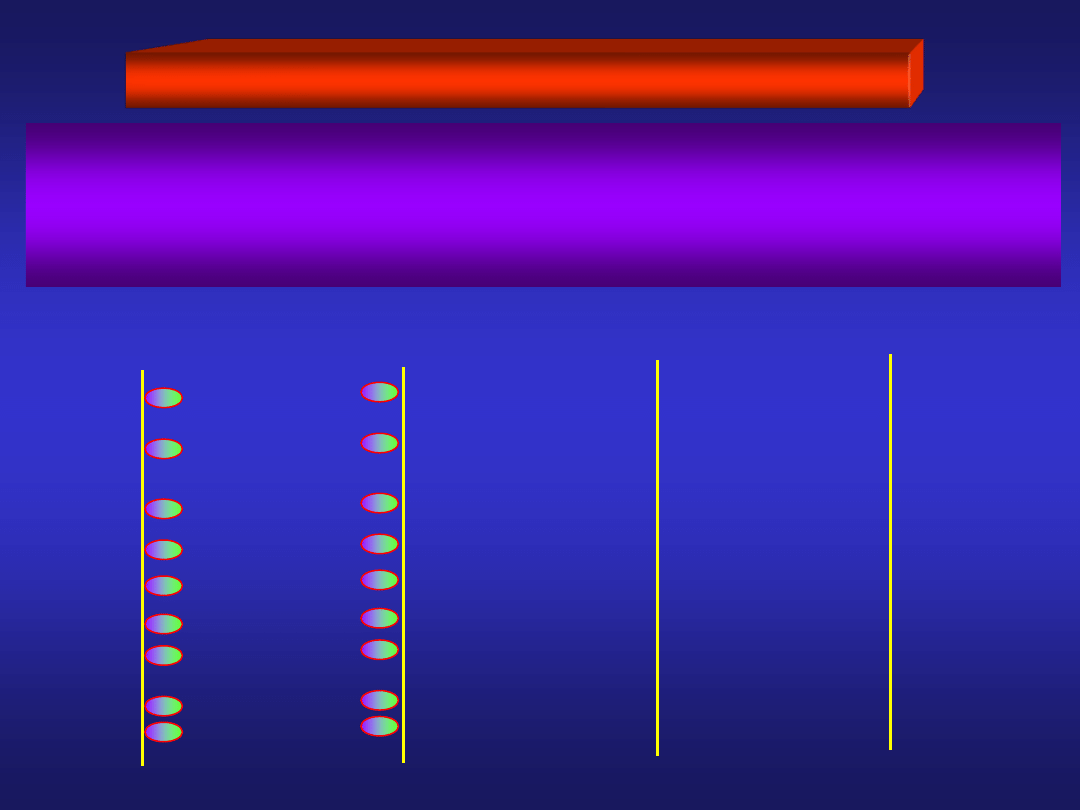
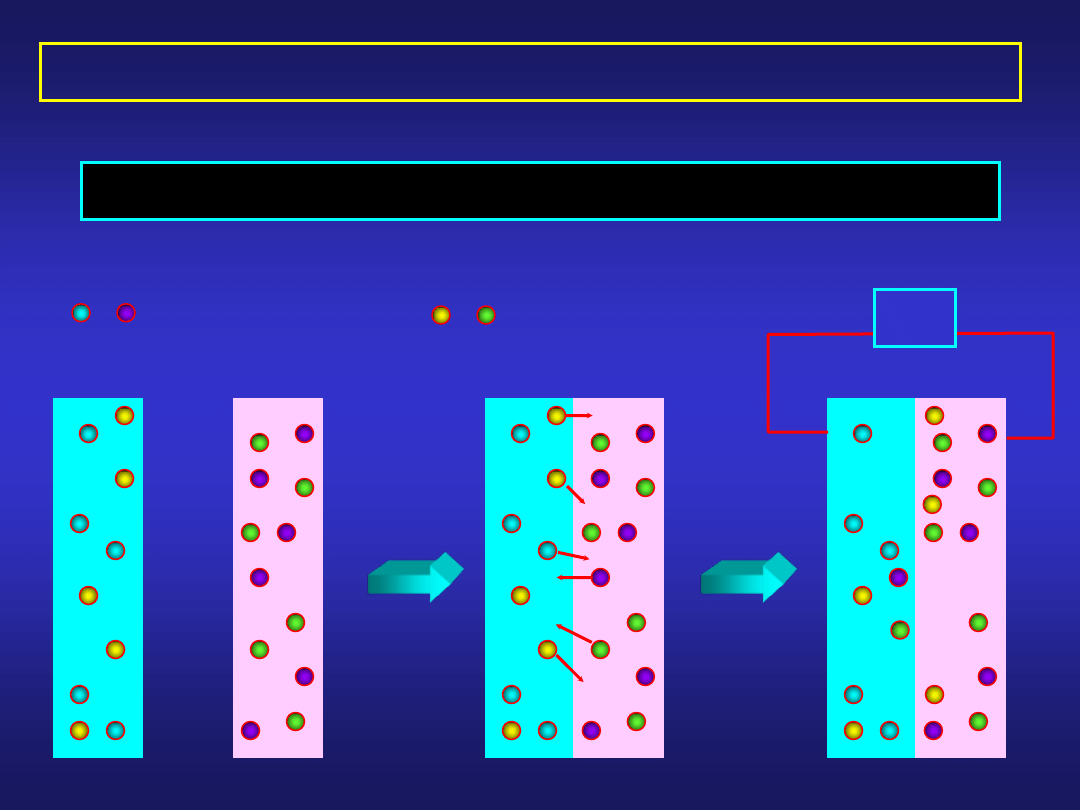
PODWÓJNA WARSTWA ELEKTRYCZNA
Charakterystyczny układ ładunków elektrycznych w obszarze
przy granicy faz elektroda/elektrolit nosi nazwę
PODWÓJNEJ WARSTWY ELEKTRYCZNEJ
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+
-
+
-
+
-
+
-
+
-
+
-
+
-
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
ZnSO
4
CuSO
4
Zn
Cu
Zn
2+
Zn
2+
- +
- +
- +
- +
- +
- +
- +
- +
Cu
2+
Cu
2+
E
2
E
1
OGNIWO
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
ZnSO
4
CuSO
4
Zn
Cu
E
2
E
1
OGNIWO
E
1
g E
2
e
-
e
-
Zn
2+
Zn
2+
Cu
2+
Cu
2+
2
4
SO
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

OGNIWO Daniella - zapis umowny
Zn|Zn
2+
||Cu
2+
|Cu
Zn|ZnSO
4
(c = .....)||CuSO
4
(c = .....)|Cu
Zn|Zn
2+
(c = ....)||Cu
2+
(c = ....)|Cu
Zn + CuSO
4
= ZnSO
4
+ Cu
samorzutnie
lub
lub
W ogniwie samorzutna reakcja utleniania powoduje
uwalnianie elektronów na anodzie i ich przepływ do katody
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Ogniwa – konwencje dotyczące znaków elektrod
Siła elektromotoryczna ogniwa (SEM)
E
, jest bezwzględną
wartością różnicy potencjałów elektrod, w sytuacji, gdy prąd
elektryczny nie płynie przez ogniwo. Znak SEM przyjmujemy
za dodatni, dla ogniwa zestawionego tak, że elektrony płyną od
strony lewej ku prawej .
E =
!|E
1
– E
2
|
2
)
(
2
)
(
1
1
M
|
M
||
M
|
M
elektrony (E > 0)
elektrony (E < 0)
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Dodatnia siła elektromotoryczna ogniwa wskazuje na
przepływ elektronów w kierunku, któremu odpowiada
samorzutny przebieg reakcji
W ogniwie Daniella:
na lewej elektrodzie:
Zn
Zn
2+
+ 2e
-
na prawej elektrodzie:
Cu
2+
+ 2e
-
Cu
Zn + Cu
2+
+ 2e
-
Zn
2+
+ Cu + 2e
-
Zn|ZnSO
4
(c = .....)||CuSO
4
(c = .....)|Cu
elektrony
Zn + Cu
2+
Zn
2+
+ Cu
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

red
u tl
n
red
n
utl
a
a
ln
nF
RT
0
E
E
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
Potencjał elektrody - równanie NERNSTA:
POTENCJAŁY ELEKTROD W OGNIWIE DANIELLA
Zn + Cu
2+
Zn
2+
+ Cu
red
u tl
n
red
n
utl
a
a
ln
nF
RT
0
E
E
Zn
Zn
2+
+ 2e
-
Cu
2+
+ 2e
-
Cu
Zn
Zn
a
a
ln
F
2
RT
2
Zn
0
Zn
E
E
Cu
Cu
a
a
ln
F
2
RT
2
Cu
0
Cu
E
E
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
red
2
red
2
utl
1
utl
1
utl
2
utl
2
red
1
red
1
R
n
R
n
R
n
R
n
u tl
2
u tl
2
red
1
red
1
red
2
red
2
u tl
1
u tl
1
n
R
n
R
n
R
n
R
1
0
2
0
1
2
a
a
a
a
ln
nF
RT
)
E
E
(
E
E
W przypadku ogólnym reakcji w ogniwie:
aktywnościowa „stała równowagi”
dla reakcji zachodzącej w ogniwie
a – aktywności (stężenia) formy utlenionej i zredukowanej jonu R,
F – stała Faradaya, n – liczba elektronów w jednostkowej reakcji redoks
SIŁA ELEKTROMOTORYCZNA OGNIWA
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
Aby skorzystać z równania Nernsta i obliczyć potencjał
elektrody potrzebna jest znajomość wartości E
0
Zastosujmy to równanie do jednej z elektrod w ogniwie Daniella:
Zn
Zn
a
a
ln
F
2
RT
2
Zn
0
Zn
E
E
2
Zn
a
ln
F
2
RT
Zn
0
Zn
E
E
Zn
0
Zn
E
E
Skąd wziąć wartość E
0
Zn
?
Zn
2+
a
=1
1
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
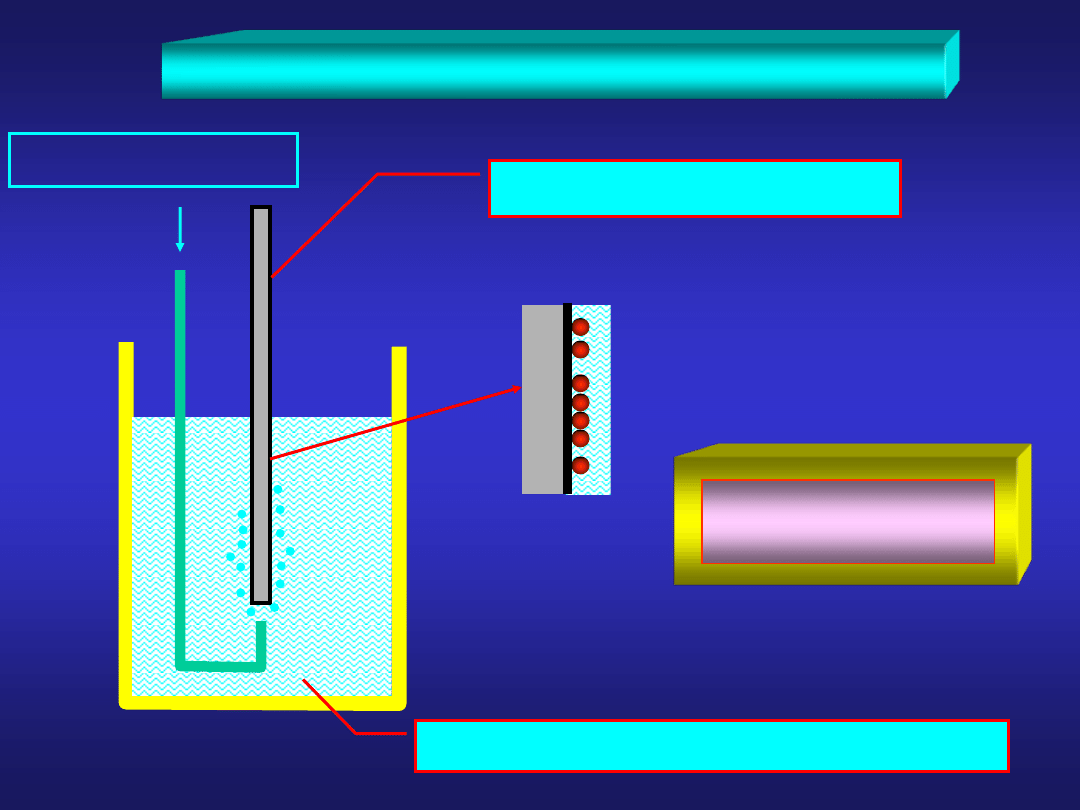
WZORCOWA ELEKTRODA WODOROWA
Pt pokryta czernią platynową
roztwór kwasu o aktywności jonów H
+
= 1
H
2
p=101,32 kPa
25°C
0
2
2
H
0
H
E
E
z definicji:
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
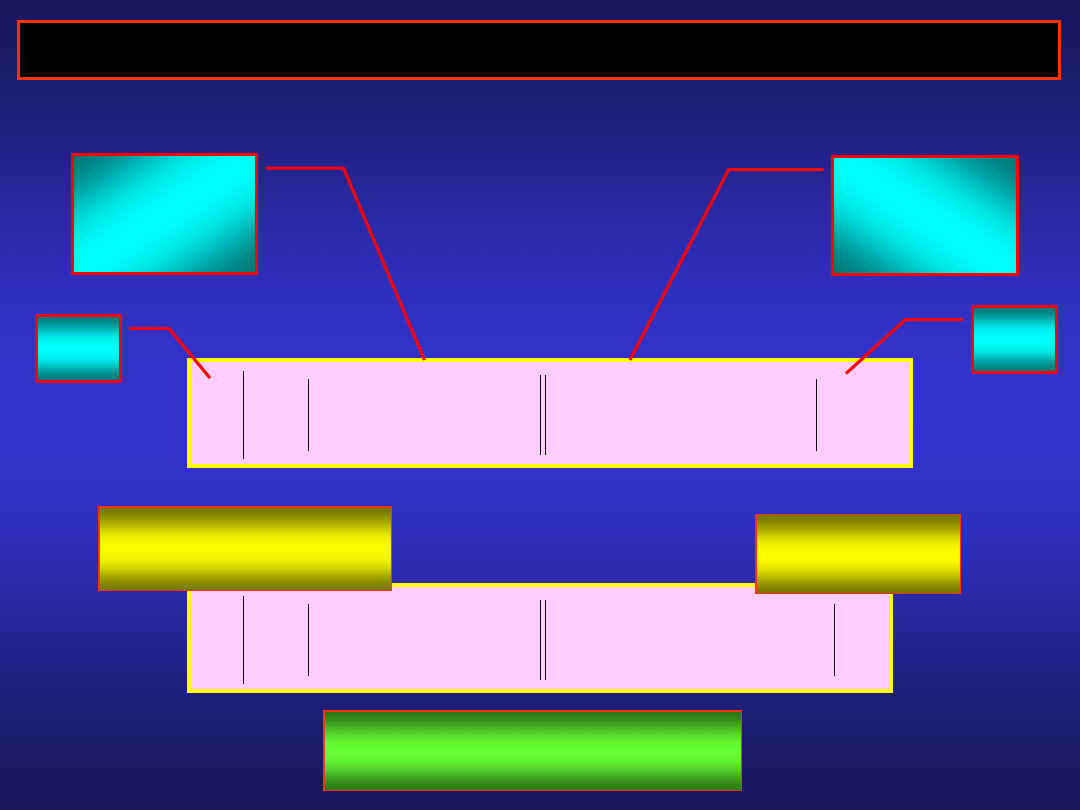
POTENCJAŁY NORMALNE ELEKTROD METALICZNYCH
Zestawiamy ogniwo:
red
utl
M
H
2
M
M
1
a
1
a
H
H
Pt
utl
M
M
1
a
1
a
H
H
Pt
)
(
M
H
2
)
(
normalna
elektroda
wodorowa
normalna
elektroda
metaliczna
E
2
E
1
0
2
2
H
0
H
E
E
M
0
M
E
E
M
0
H
0
M
0
E
E
E
E
2
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
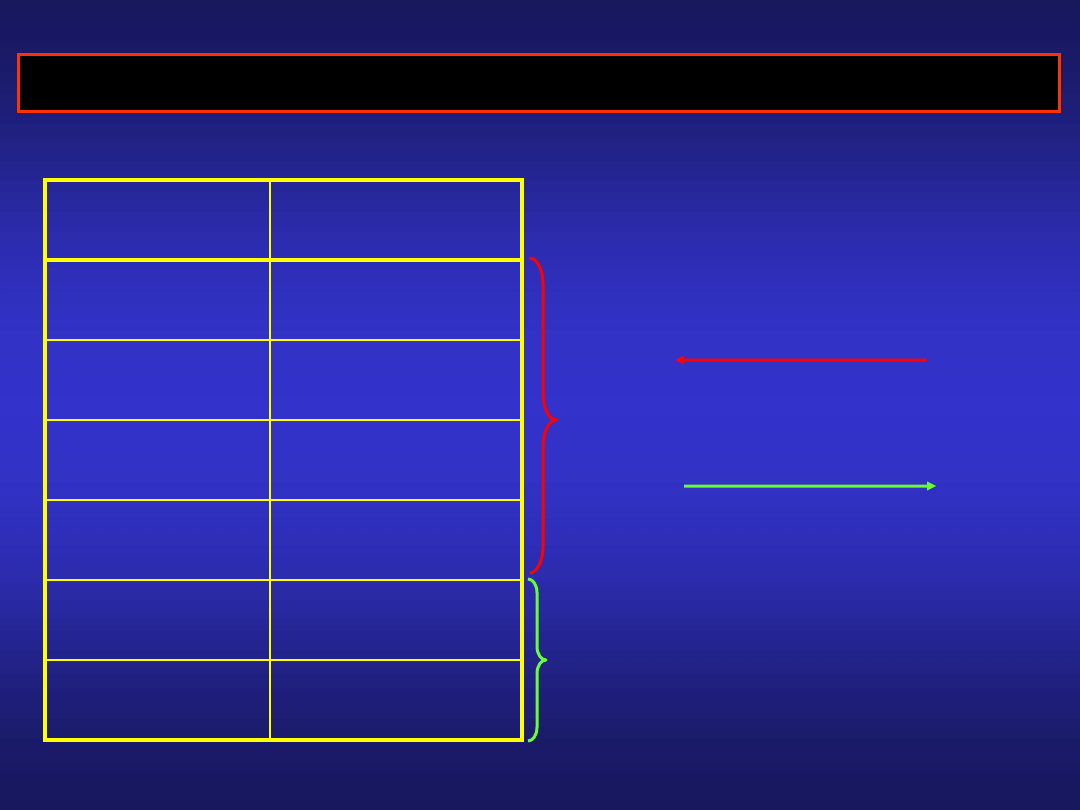
POTENCJAŁY NORMALNE ELEKTROD METALICZNYCH
elektroda
E
0
Li|Li
+
- 3,045 V
Al|Al
3+
- 1,662 V
Zn|Zn
2+
- 0,763 V
Pb|Pb
2+
- 0,126 V
Cu|Cu
2+
+ 0,337 V
Ag|Ag
+
+ 0,799 V
Pt|H
2
|H
+
||M
(+)
|M
e
-
e
-
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
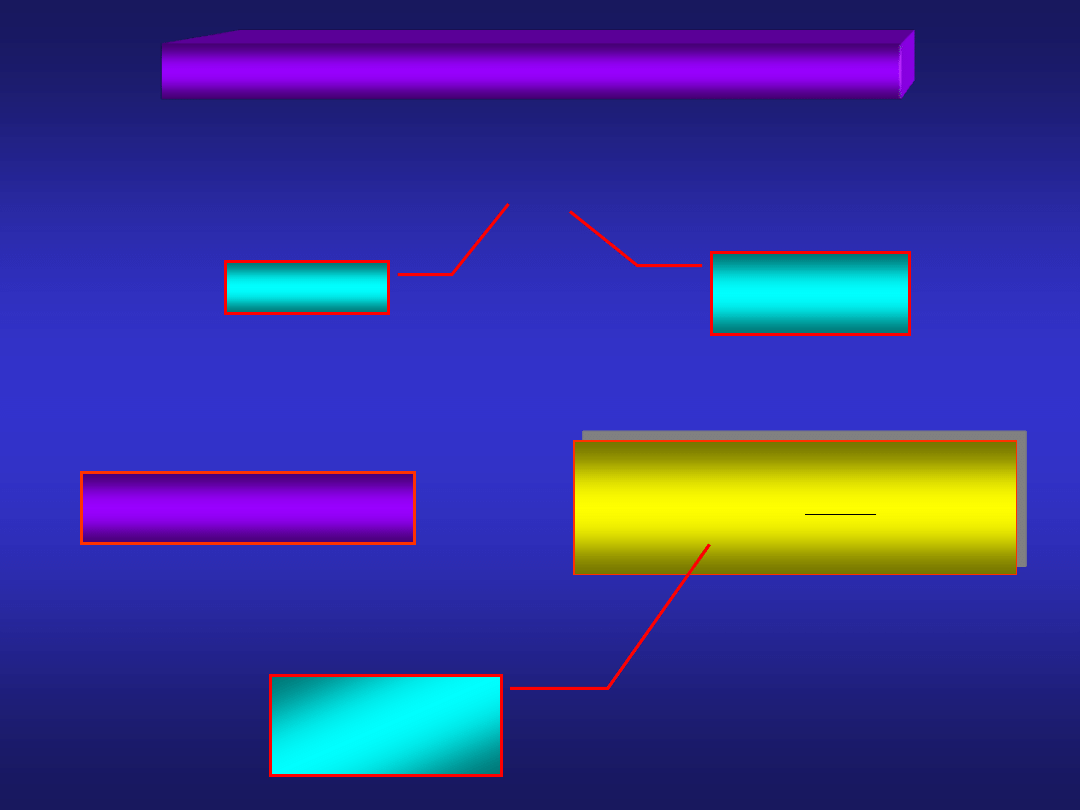
ELEKTRODY PIERWSZEGO RODZAJU
1. Elektrody metalowe M|M
n+
metal M
roztwór soli
metalu M
n
M
a
ln
nF
RT
M
0
M
E
E
potencjał
normalny
M
M
n+
+ ne
-
proces elektrodowy:
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
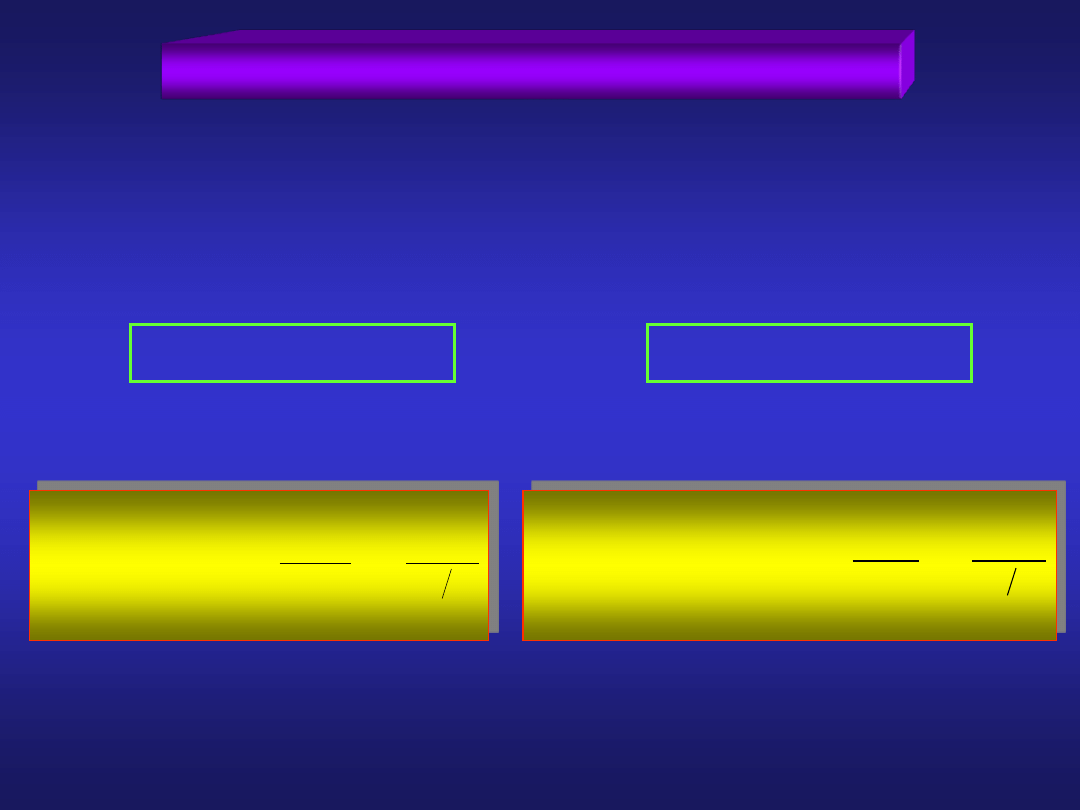
ELEKTRODY PIERWSZEGO RODZAJU
2. Elektrody gazowe (M)X
2
|X
n(-,+)
2
1
H
H
2
a
a
ln
F
RT
2
2
H
0
H
E
E
½H
2(gaz)
H
+
+ e
-
½Cl
2(gaz)
+ e
-
Cl
-
2
Cl
1 2
Cl
a
RT
ln
F
a
2
2
Cl
Cl
0
E
E
elektroda wodorowa
elektroda chlorowa
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
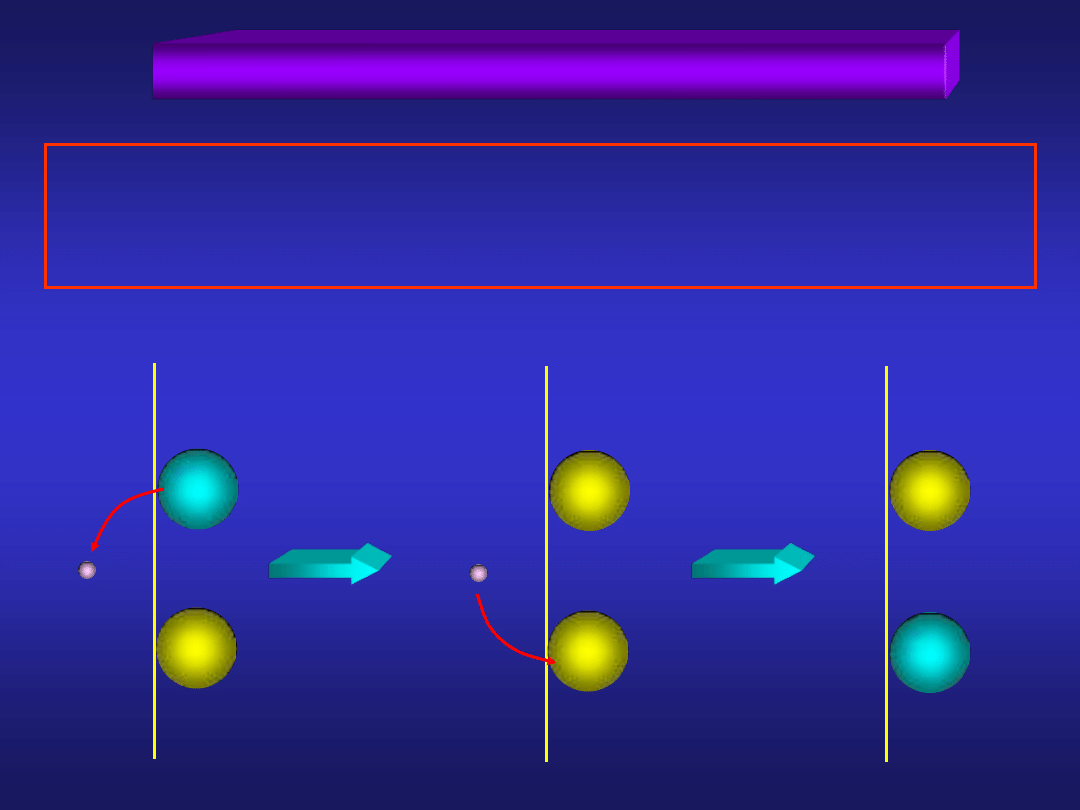
ELEKTRODY UTLENIAJĄCO-REDUKUJĄCE
... to elektrody, w których reakcja utleniania i redukcji
zachodzi przy udziale elektronów dostarczanych przez fazę
metaliczną, która bezpośrednio nie bierze udziału w reakcji
metal
roztwór
Fe
2+
Fe
3+
e
-
metal
roztwór
Fe
3+
Fe
3+
e
-
metal
roztwór
Fe
2+
Fe
3+
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
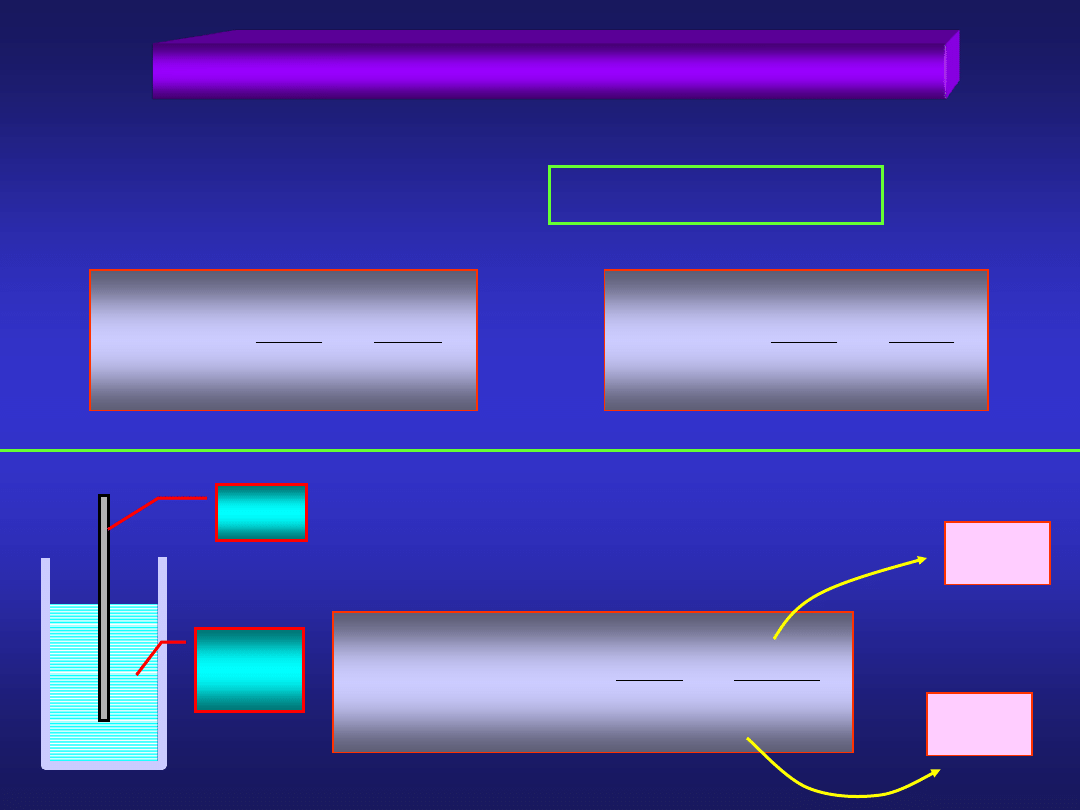
ELEKTRODY UTLENIAJĄCO-REDUKUJĄCE
reakcja elektrodowa:
red
utl + ne
-
red
utl
a
a
ln
nF
RT
0
E
E
red
utl
c
c
ln
nF
RT
0
E
E
Fe
2+
Fe
3+
+ e
-
2
3
Fe
Fe
/
a
a
ln
F
RT
2
3
Fe
Fe
0
E
E
3
Fe
c
2
Fe
c
Pt
Fe
2+
Fe
3+
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
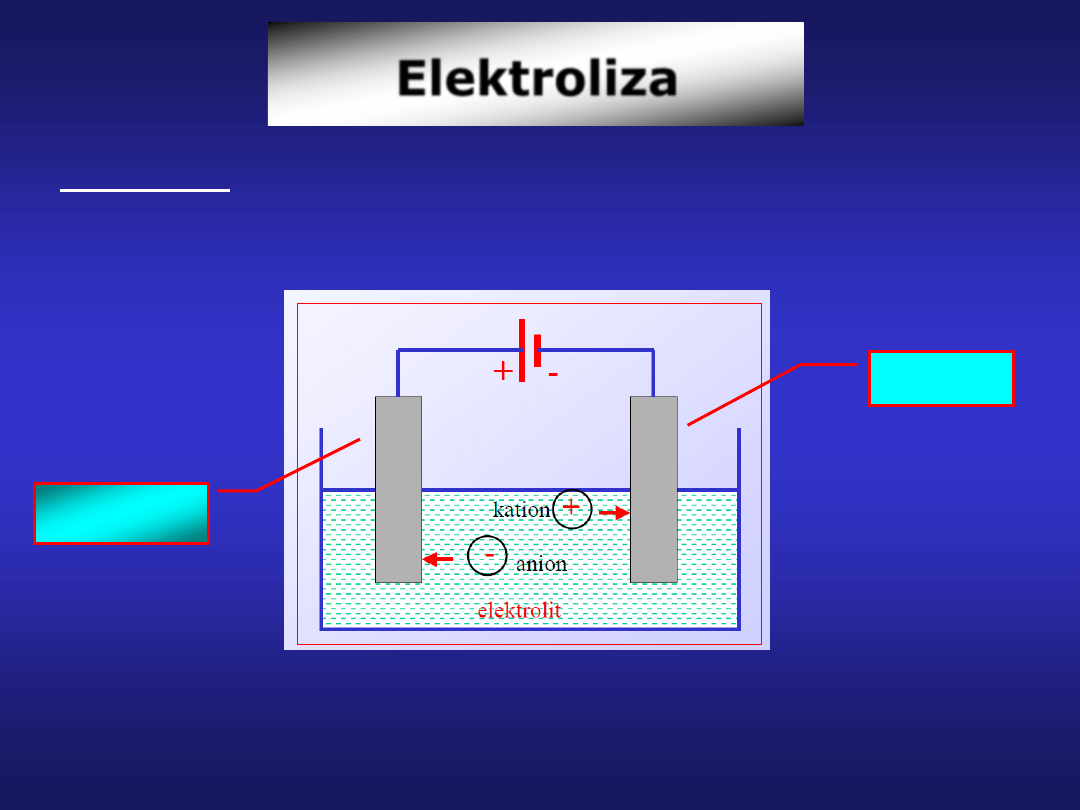
Elektroliza
Elektroliza – proces, podczas którego prąd elektryczny, z
zewnętrznego źródła zasilania, powoduje zachodzenie na
elektrodach reakcji utleniania i redukcji.
Elektrolizę przeprowadzimy, przykładając do elektrod ogniwa
napięcie nie mniejsze niż SEM, ale przeciwnie do niej skierowane.
anoda
katoda
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
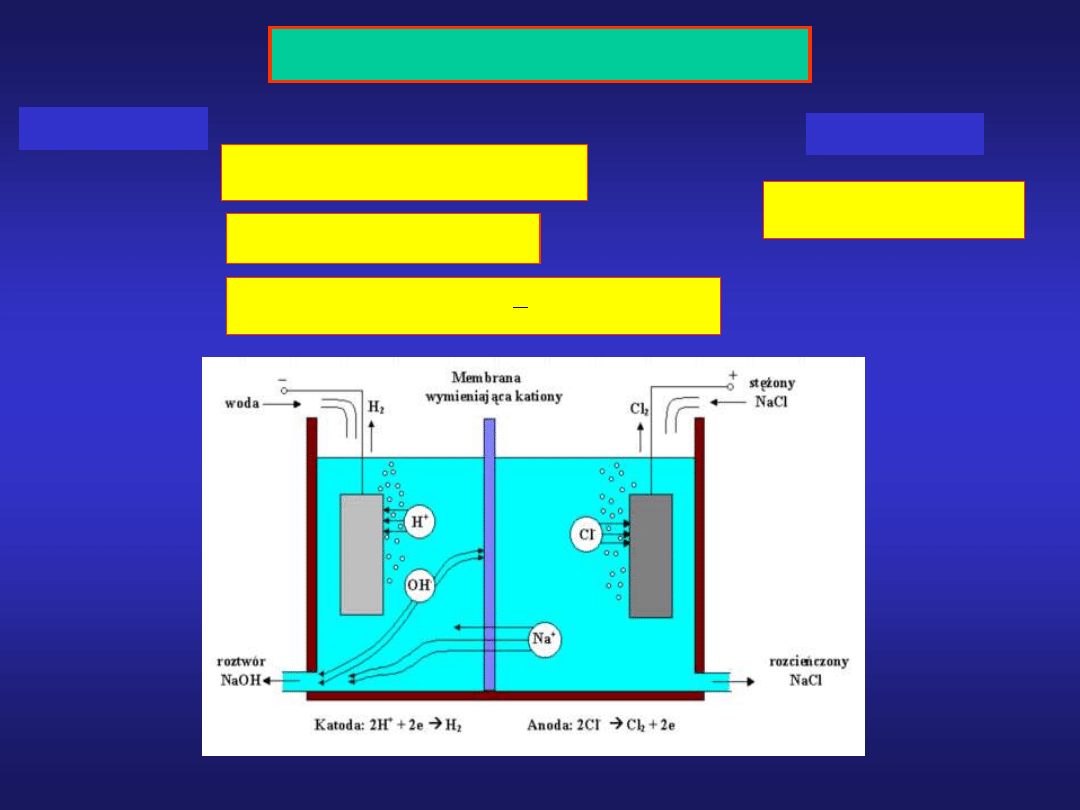
Elektroliza roztworu wodnego NaCl
1
2
2
2
Na
e
H O
H
NaOH
na katodzie:
0
2
2Cl
2e
Cl
na anodzie:
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
2
2
2H O 2e
H
2OH
Na
OH
NaOH
sumarycznie:

PRAWO ELEKTROLIZY FARADAYA
prąd o natężeniu I w czasie t przenosi ładunek Q:
Q = I·t
1 mol jonów A
n(
!)
posiada bezwzględny ładunek:
Q
M
= n·|e|·N
A
zatem jeżeli przez elektrolit przepłynie ładunek Q
M
to na
elektrodzie wydzieli się 1 mol produktu A o masie M
A
Q
M
M
A
Q
m
A
A
M
A
M
M
m
Q
Q
Q
n | e | N
F = |e|·N
A
l 96500 C
stała Faradaya:
nF
M
k
A
równoważnik
elektrochemiczny
m = k·I·t
Masa substancji wydzielonej podczas elektrolizy jest
proporcjonalna do ładunku, który przepłynął przez elektrolit
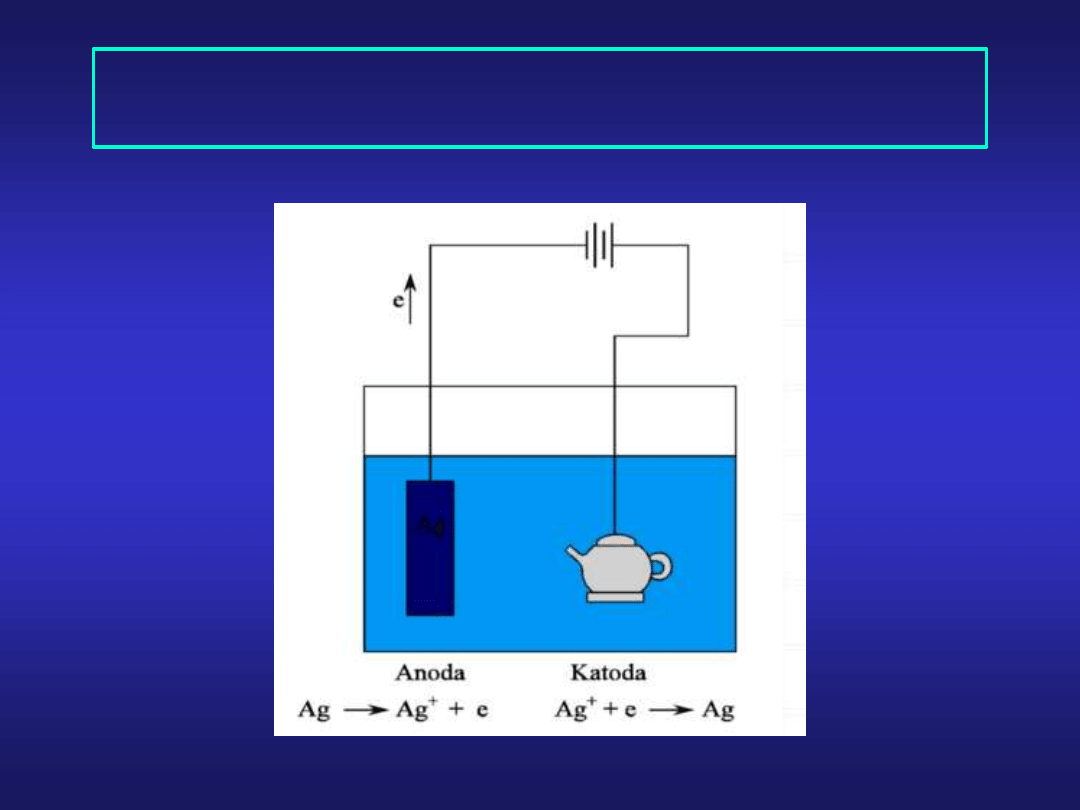
Ag
Galwanotechnika - pokrywanie przedmiotów
powłokami metalicznymi przy wykorzystaniu elektrolizy
AgNO
3
+NH
3
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
Akumulator ołowiowy
30%
H
2
SO
4
Pb
PbO
2
-
+
na elektrodzie ujemnej:
e
2
PbSO
SO
Pb
)
s
(
4
2
4
na elektrodzie dodatniej:
O
H
2
PbSO
e
2
SO
H
4
PbO
2
)
s
(
4
2
4
2
praca
praca
ładowanie
ładowanie
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Akumulatory niklowo–kadmowe
Anoda: Cd+2OH
-
Cd(OH)
2
+2e
-
Katoda: 2NiOOH+2H
2
O+2e
-
2Ni(OH)
2
+2OH
-
Cd|Cd(OH)
2
|KOH, H
2
O|NiOOH|Ni
Akumulatory niklowo–wodorkowe
Anoda: Ni(OH)
2
+ OH
-
→ NiOOH + H
2
O + e
-
Katoda: H
2
O + M + e
-
→ OH
-
+ MH
gdzie M to metal ziem rzadkich – najczęściej używa się
mieszaniny lantanu, ceru, neodymu, prazeodymu i in.
Ni|Ni(OH)
2
|KOH, H
2
O|MH|M
Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH

Materiały dydaktyczne dla studentów I roku IŚ, WGGiIŚ - Dr hab. inż. Barbara Małecka, prof. nadzw. WIMiC AGH
Zalecana literatura:
Do wykładu 9-10:
1.
L. Jones, P. Atkins - Chemia ogólna, PWN Warszawa 2004 – str. 890-
1000 (wydanie 1-tomowe)
2.
A. Bielański, Podstawy chemii nieorganicznej, tom 1, 452-458; tom 2
Do wykładu 11 i 12:
1.
L. Jones, P. Atkins - Chemia ogólna, PWN Warszawa 2004 – str. 599-
610, 618-630, 653-665 (wydanie 1-tomowe)
2.
A. Bielański, Podstawy chemii nieorganicznej, tom 1, 286-290, 410-
418, 446-450
Do wykładu 13:
1.
L. Jones, P. Atkins - Chemia ogólna, PWN Warszawa 2004 – str. 833-
842, 868-875 (wydanie 1-tomowe)
2.
A. Bielański, Podstawy chemii nieorganicznej, tom 1, 367-382
Wyszukiwarka
Podobne podstrony:
Ch WGGiIS Wyklad12
Ch WGGiIS Wyklad6
ch infekcyjne wyklad
Ch organiczna wykład 1d
Ch organiczna wykład 1g
ch zywnosci wyklad 4 lipidy low
CH klin wykład 2
Ch organiczna wykład 1e
CH klin wyklad 1ok id 110378 Nieznany
ch nieorg11 wyklady
CH Ż OD 9 wykłady
Ch organiczna wykład 1c
ch infekcyjne wyklad
Ch organiczna wykład 1d
Ch organiczna wykład 1g
ch zywnosci wyklad 4 lipidy low
więcej podobnych podstron