UKŁAD OKRESOWY PIERWIASTKÓW
CHEMICZNYCH
grupa
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
konfig.
elektr.
ns
1
ns
2
(n-1)
d
1
ns
2
(n-1)
d
2
ns
2
(n-1)
d
3
ns
2
(n-1)
d
4
ns
2
(n-1)
d
5
ns
2
(n-1)
d
6
ns
2
(n-1)
d
7
ns
2
(n-1)
d
8
ns
2
(n-1)
d
9
ns
2
(n-1)
d
10
ns
2
s
2
p
1
s
2
p
2
s
2
p
3
s
2
p
4
s
2
p
5
s
2
p
6
okres
blok s
pierwiastki zewnętrznoprzejściowe (blok d)
pierwiastki bloku p
I
H
II
Li Be
III
Na Mg
IV
K
Ca
V
Rb Sr
VI
Cs Ba
VII Fr Ra
He
B
C
N
O
F
Ne
Al
Si
P
S
Cl Ar
Ga Ge As Se Br Kr
In
Sn Sb Te
I
Xe
Tl
Pb Bi Po At Rn
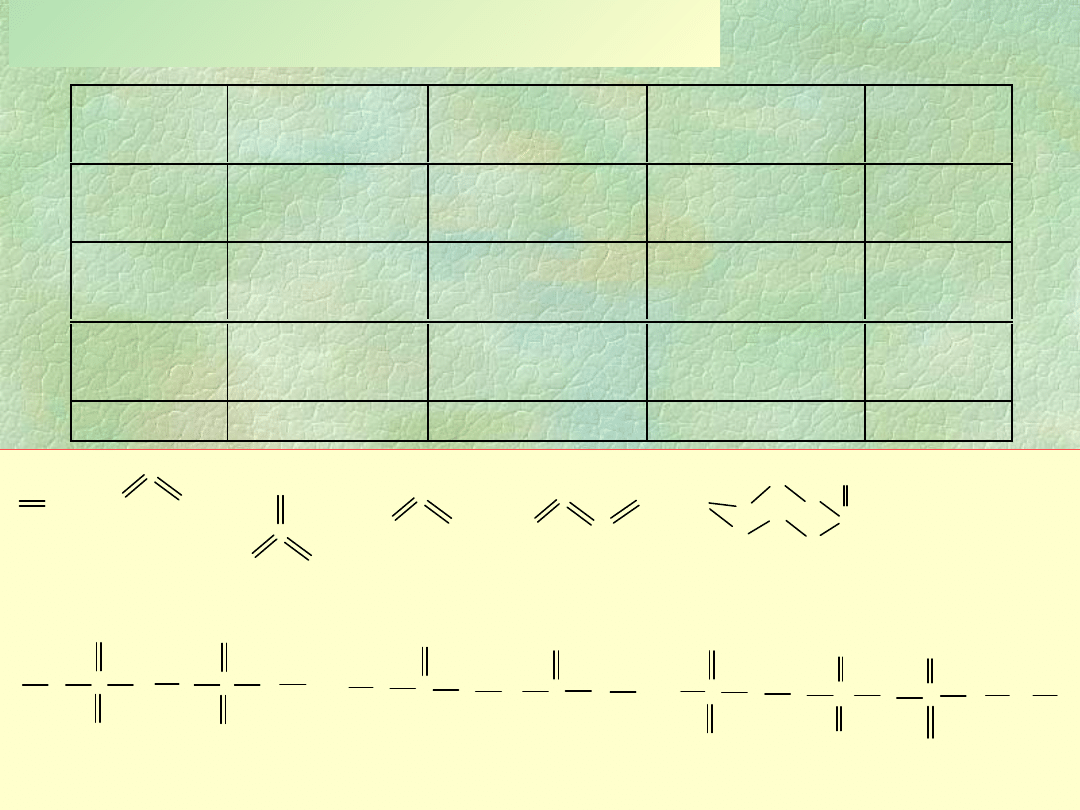
Kwasy tlenowe fosforu
O
OH
H
H
O P
OH
H
H
O P
OH
HO
O
P
OH
HO
O
P
OH
OH
OH
O P
O
OH
OH
O P
OH
HO
O
P
O
O
OH
O P
OH
HO
O
P
O
OH
OH
P
O
O
O
O
P
HO
O
P
O
OH
HO
P
H
3
PO
2
(HPH
2
O
2
) kwas
fosfinowy
(dihydrydodioksofosforowy
)
H
3
PO
3
(H
2
PHO
3
) kwas
fosfonowy
(hydrydotrioksofosforowy)
H
4
P
2
O
6
[(HO)
2
OPP(HO)
2
]
(kwas
heksaoksodifosforowy)
H
3
PO
4
kwas
ortofosforowy
(tetraoksofosforowy)
H
4
P
2
O
7
kwas difosforowy
(-
oksoheksaoksodifosforowy
)
H
5
P
3
O
10
kwas di--
oksooktaoksodifosforowy
(HPO
3
)
3
kwas
metafosforowy
(politrioksofosforowy)
P
O

Tlenowce
Tlenowce
Właściwości fizyczne tlenowców
Pierwiastek
Tlen
Siarka
Selen
Tellur
Polon
Symbol
O
S
Se
Te
Po
Konfiguracja elektronowa
2 s
2
p
4
3 s
2
p
4
4 s
2
p
4
5 s
2
p
4
6 s
2
p
4
Masa atomowa, u
15,9994 32,066
78,96
127,60
(209)
Temperatura topnienia, K
54,36
388,36
494
722,7
527
Temperatura wrzenia, K
90,15
717,8
958
1261
1235
Energia jonizacji, kJ · mol
1
1314
999,6
941,1
869,3
812
Elektroujemność(
Allred Rochow)
3,50
2,44
2,48
2,01
1,76
Promień atomowy, pm
66
104
117
143,2
153
Promień jonowy X
2
(LK = 6),
pm
140
184
198
221
230
niemetale półmetale
metal
Tlenowce
wykazują tendencję do przyjęcia 2
elektronów i przejścia na stopień utlenienia
II
z
utworzeniem anionu
X
2
. Jon tlenkowy
O
2
jest bardzo
silną zasadą, mocniejszą niż OH
, i z tego powodu nie
występuje nigdy jako samodzielny jon w roztworach. W
czasie działania wody na tlenek o budowie jonowej
następuje reakcja
O
2
+ H
2
O 2OH

Tlenowce - otrzymywanie i
zastosowanie
Tlen
Tlen
otrzymuje się głównie z powietrza (po skropleniu w
temp. 90,15 K i oddzieleniu w wyniku destylacji
frakcjonowanej, zawiera 3% Ar). Bardzo czysty
tlen otrzymuje się z wody w wyniku elektrolizy.
Na dużą skalę znajduje zastosowanie w
hutnictwie do świeżenia stali w piecach martenowskich
oraz w palnikach acetyleno-tlenowych.
Ozon
tworzy się pod wpływem wyładowań elektrycznych
w atmosferze powietrza lub czystego tlenu, a także pod
wpływem naświetlania promieniami ultrafioletowymi.
Siarkę
elementarną otrzymuje się za pomocą rafinacji
siarki rodzimej. Bardzo czystą siarkę otrzymuje się
metodą Frasha polegającą na wytapianiu siarki pod
ziemią przy użyciu przegrzanej pary wodnej i wypieraniu
cieczy na powierzchnię za pomocą sprzężonego
powietrza. Siarkę przerabia się na SO
2
a następnie na
H
2
SO
4
, wykorzystuje się w procesie wulkanizowania
kauczuku, do dezynfekcji i do zwalczania pasożytów
roślinnych.
Selen
stanowi zanieczyszczenie rud siarkowych i siarki.
Surowiec , z którego otrzymuje się selen stanowią pyły z
prażalni rud siarkowych. Znajduje zastosowanie do
produkcji fotokomórek i prostowników, w kserografii i do
barwienia szkła na kolor rubinowoczerwony
.
Polon
, pierwiastek promieniotwórczy, obecny w
śladowych ilościach w rudach uranu, został odkryty w
1898 r. przez Marię i Piotra Curie. Można go uzyskać w
wyniku bombardowania bizmutu neutronami.
Odmiany alotropowe tlenu: O
2
,
O
3
i O
4
E
O
2
O
O
2s
2s
2p
y
2p
x
2p
x
2p
z
2p
z
2p
2s
2s
2p
2p
Cząsteczka O
2
, stan podstawowy
trypletowy
3
3
,
, stany wzbudzone
singletowe -
1
1
(92 kJ ·mol
-1
) i
1
1
(155 kJ ·mol
-1
)
Ozon -
O
3
Dimer O
4
(w ciekłym
tlenie)
116,8
o
O
O
O
O
4
2O
2
H
dysocjacji
= 0,54
kJ ·mol
-1
O=O
O=O

Odmiany alotropowe S,
Se, Te
Siarka rombowa
-
złożona z cząsteczek
ośmioatomowych S
8
, w których atomy ułożone są w
zygzakowaty pierścień (cyklo-oktasiarka), jasnożółta,
trwała w temperaturze pokojowej, zwana
siarką
. Po
ogrzaniu do temperatury 368,8 K ulega przemianie w
siarkę jednoskośną
zwan
ę
siarką
będącą mieszaniną
cyklo-oktasiarki i katena-oktasiarki (siarki
ośmioatomowej łańcuchowej). Dalsze ogrzewanie
prowadzi do katenacji, tworzenia
katena-polisiarki
zawierającej długie łańcuchy atomów siarki (10
5
)
zwanej
siarką
. Ogrzewanie w temp. wrzenia (717,8 K)
i wyższej powoduje dysocjację do cząsteczek S
2
. Do
nietrwałych odmian siarki zaliczają si
ę
odmiany
zawieraj
ą
ce cz
ą
steczki pier
ś
cieniowe S
6
(cyklo-
heksasiarka), S
7
(cyklo-heptasiarka), S
10
(cyklo-
dekasiarka), S
12
(cyklo-dodekasiarka), S
18
(cyklo-
oktadekasiarka), i S
20
(cyklo-ikozasiarka).
Selen tworzy cząsteczki pierścieniowe Se
8
(
selen
i
selen
) i łańcuchowe o znacznej długości (
selen
).
Najtrwalsza odmiana to
selen szary
, zwany także
selenem metalicznym
. Selen szary wykazuje w ciemności
bardzo małe przewodnictwo elektryczne, które znacznie
wzrasta pod wpływem naświetlania (fotoprzewodnictwo).
Zjawisko to stanowi podstawę działania
fotokomórek
selenowych
.
Najtrwalsza odmiana telluru to
tellur metaliczny
wykazujący łańcuchową budowę sieci przestrzennej.

Właściwości chemiczne
Właściwości chemiczne
tlenowców
tlenowców
Tlen - O
2
jest najbardziej aktywnym chemicznie
tlenowcem. Z fosforem białym i metalami alkalicznymi
łączy się już w temperaturze pokojowej. Po podgrzaniu
łączy się niemal ze wszystkimi pierwiastkami (
do
wyjątków należą fluor i platyna
), a także z ogromną
liczbą związków organicznych i nieorganicznych.
Spalanie różnych substancji polega na łączeniu się ich z
tlenem
. Spalanie, któremu towarzyszy wydzielanie się
ciepła, rozpoczyna się po ogrzaniu substancji do
temperatury zwanej
temperaturą zapłonu
.
Procesy utleniania zachodzące w organizmach żywych i
stanowiące źródło energii dla procesów biologicznych
są w swojej istocie procesami powolnego spalania.
Procesy zachodzące w żywych organizmach z udziałem
tlenu są katalizowane przez hemoproteiny, złożone z
białka zawierającego w swoim składzie żelazo, np.
hemoglobina.
Żelazo z hemoproteiny wiąże tlen w
sposób odwracalny, aktywuje go i przekazuje cząsteczce
utlenianej
.
Ozon O
3
jest energiczniejszym utleniaczem od O
2
, już w
temperaturze pokojowej łączy się ze srebrem, utlenia
rtęć do HgO, PbS do PbSO
4
.
Jonowe formy cząsteczki ditlenu:
O
2
2
- jon nadtlenkowy,
perokso (BaO
2
),
O
2
- jon ponadtlenkowy, superokso
(KO
2
),
O
2
+
- jon oksygenylowy
(O
2
PtF
6
).

Właściwości chemiczne
tlenowców
Siarka, selen i tellur
są mniej reaktywne od tlenu. Po
ogrzaniu spalają się tworząc
ditlenki
:
SO
2
, SeO
2
i TeO
2
. Z
fluorem (przy jego nadmiarze) tworzą
heksafluorki: SF
6
,
SeF
6
, TeF
6
. Z chlorem łączą się dając związki typu
X
2
Cl
2
i
XCl
4
.
Reagują łatwo z metalami alkalicznymi
.
Siarka
reaguje powoli z niektórymi metalami szlachetnymi: Cu,
Hg, i Ag.
Wiele metali ogrzewanych w parach siarki
spala się podobnie jak w atmosferze tlenu.
Związki tlenowców z wodorem typu H
2
X
H
2
O - oksydan (woda), H
2
S - sulfan (siarkowodór), H
2
Se
- selan (selenowodór), H
2
Te - tellan (tellurowodór), H
2
Po
- polan (polonowodór).
H
H
2
2
S
S
i H
i H
2
2
Se są związkami
Se są związkami
toksycznymi !!!
toksycznymi !!!
H
2
S, H
2
Se i H
2
Te otrzymuje się działając kwasem
solnym na siarczki, selenki lub tellurki metali.
FeS + 2HCl FeCl
2
+ H
2
S
H
2
S, H
2
Se i H
2
Te spalają się przy dużym dostępie
powietrza dając ditlenki i parę wodną
H
2
X + 3/2O
2
H
2
O + XO
2
H
2
S, H
2
Se i H
2
Te rozpuszczają się w wodzie dając
roztwory o odczynie kwasowym.
H
2
X + H
2
O H
3
O
+
+
HX
HX
+ H
2
O H
3
O
+
+ X
2
Nadtlenek wodoru H
2
O
2
OH
C
2
H
5
H
2
O
2
OH
C
2
H
5
+O
2
+H
2
+
O
O
katalizator palladowy
Otrzymywanie H
2
O
2
metodą
antrachinonową
2-etyloantraceno-9,10-
diol
2-
etyloantrachin
on
Otrzymywanie H
2
O
2
w wyniku działania kwasem
na nadtlenki
BaO
2
+ H
2
SO
4
BaSO
4
+
H
2
O
2
W wodzie H
2
O
2
ulega dysocjacji wykazując słabe
właściwości kwasowe.
H
2
O
2
+ H
2
O H
3
O
+
+ HO
2
Woda utleniona - 3% H
2
O
2
,
perhydrol - 30% H
2
O
2
,
80% H
2
O
2
- stosowana do napędu
torped, w technice rakietowej
H
2
O
2
jest związkiem silnie endotermicznym -
nietrwałym w temperaturze pokojowej:
2H
2
O
2
2H
2
O + O
2
Związki siarki, selenu, telluru i
polonu z tlenem
S
SO
O
S
O
SO
2
O
O
S
O
SO
3
O
S
S
O
S
2
O
O
S
S
O
S
2
O
2
S
8
O
O
S
S
S
S
S
S
S
S
O
S
(S
2
O
3
)
n
O
S
S
O
O
O
S
O
O
S
S
S
S
S
S
O
(S
m
O)
n
m>2
S
O
O
O
O
O
O
O
S
S
O
(SO
m
)
n
3<m<4
O
O
O
Stopień
utlenienia
Siarka
Selen
Tellur
Polon
I i <I
S
2
O, S
n
O,
(S
m
O)
n
II
SO, S
2
O
2
,
(S
2
O
3
)
n
PoO
IV
SO
2
SeO
2
,
Se
2
O
5
(IV i VI)
TeO
2
,
Te
2
O
5
(IV i VI)
PoO
2
VI
SO
3
, (SO
m
)
n
SeO
3
TeO
3
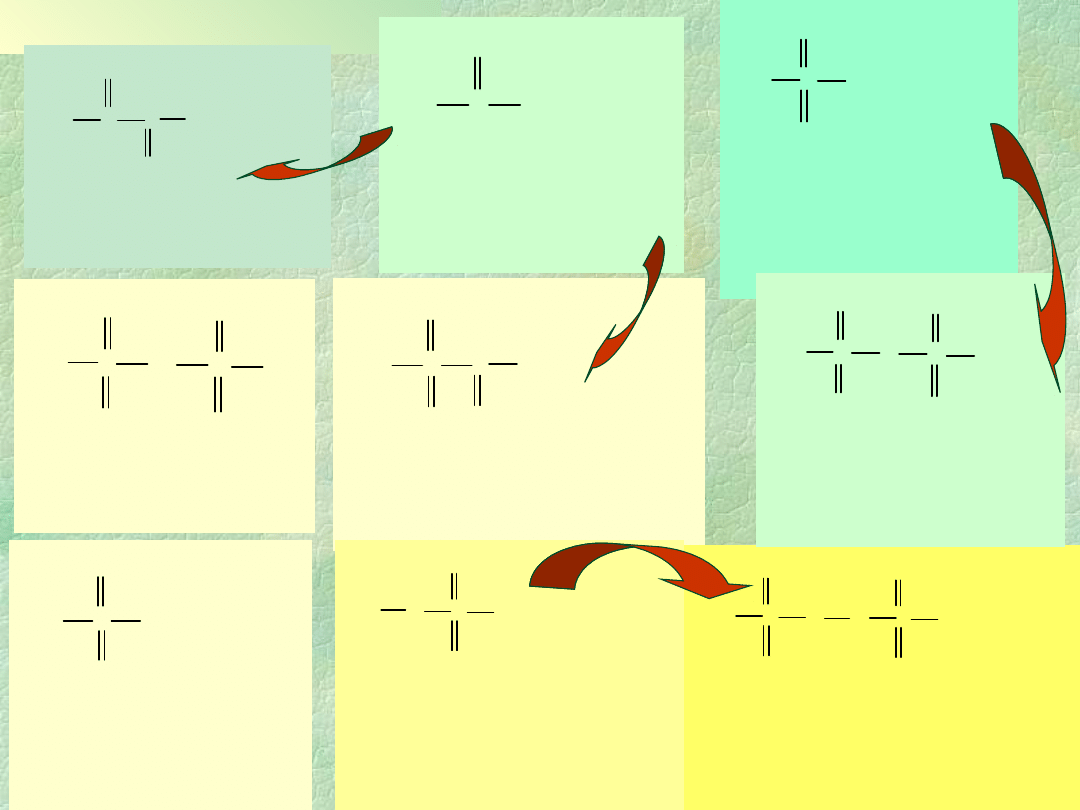
Kwasy tlenowe
siarki
H
2
S
2
O
4
kwas tetraoksodisiarkowy
[ditionowy(III)]
O
S
H
S OH
O
O
H
2
SO
3
kwas trioksosiarkowy
[siarkowy(IV)]
O
S
HO
OH
H
2
S
2
O
5
kwas pentaoksodisiarkowy
[disiarkowy(IV)]
O
S
HO
S OH
O
O
O
S
S
HO
OH
H
2
S
2
O
3
kwas trioksotiosiarkowy
[tiosiarkowy]
H
2
SO
5
kwas trioksoperoksosiarkowy
[peroksosiarkowy]
O
OH
HO
O
S
O
H
2
S
2
O
8
kwas heksaoksoperoksodisiarkowy
[peroksodisiarkowy]
OH
O
O
HO S O
O
O
S
O
H
2
SO
4
kwas tetraoksosiarkowy
[siarkowy(VI)]
OH
O
HO
O
S
SO
3
H
2
S
n
O
6
n = 2-6
kwasy politionowe
O
S OH
HO
O
S
(n-2)
O
S
O
SO
SO
2
H
2
S
2
O
7
kwas heptaoksodisiarkowy
[pirosiarkowy]
O
S OH
HO
O
O
O
S
O
SO
3

Kwas siarkowy(VI)
OH
O
HO
O
S
H
2
SO
4
Kwas siarkowy(VI) w skali technicznej
otrzymuje się z SO
2
, który uzyskuje się przez
prażenie pirytu FeS
2
lub blendy cynkowej ZnS w
strumieniu powietrza.
SO
2
+ 1/2O
2
SO
3
temp. 650-850 K, katalizator
V
2
O
5
SO
3
przepuszcza się przez kwas siarkowy(VI)
otrzymując kwas disiarkowy H
2
S
2
O
7
, który po
rozcieńczeniu wodą daje kwas siarkowy(VI).
Kwas siarkowy(VI) jest bezbarwną oleistą cieczą bez
zapachu. W wodzie rozpuszcza się z wydzieleniem
dużej ilości ciepła.
Kwas siarkowy rozcieńczamy wlewając go
Kwas siarkowy rozcieńczamy wlewając go
do wody (nigdy odwrotnie !!!)
do wody (nigdy odwrotnie !!!)
Stężony kwas siarkowy jest substancją silnie
higroskopijną. Powoduje rozkład różnych
substancji organicznych w wyniku odszczepienia
od nich cząsteczek wody. W tych warunkach
węglowodany (cukry) ulegają zwęgleniu.
Zastosowanie:
do produkcji nawozów sztucznych
(superfosfatu i siarczanu amonu); do
otrzymywania HCl z soli kamiennej; do
napełniania akumulatorów ołowiowych; do
osuszania gazów

Fluorowce (halogeny,
chlorowce)
Właściwości fizyczne fluorowców
Pierwiastek
Fluor
Chlor
Brom
Jod
Astat
Symbol
F
Cl
Br
I
At
Konfiguracja elektronowa
2 s
2
p
5
3 s
2
p
5
4 s
2
p
5
5 s
2
p
5
6 s
2
p
5
Masa atomowa, u
18,9984032 35,4527
79,904
126,90447
(210)
Temperatura topnienia, K
53,53
171,7
266,0
386,9
575
Temperatura wrzenia, K
85,03
235,11
332,0
457,6
Energia jonizacji, kJ · mol
1
1681,0
1251,1
1139,9
1008,4
Elektroujemność(
Allred Rochow)
4,10
2,83
2,74
2,21
1,90
Energia dysocjacji cząsteczek X
2
,
kJ · mol
1
159
243
193
151
Potencjal standardowy X
2
/X
, V
2,866
1,35827
1,0873
0.5355
0,3
Promień kowalencyjny, pm
70,9
99
114.2
133,3
Promień jonowy X
(LK = 6),
pm
133
181
196
220
Wysokie wartości potencjałów standardowych elektrod
halogenowych świadczą o silnych właściwościach
utleniających flurowców.
Fluor jest
najsilniejszym utleniaczem spośród wszystkich
pierwiastków!!
Najtrwalszy stopień utlenienia fluorowców i jedyny dla
fluoru to I. Pozostałe pierwiastki występują także na
dodatnich stopniach utlenienia: I, III, V i VII
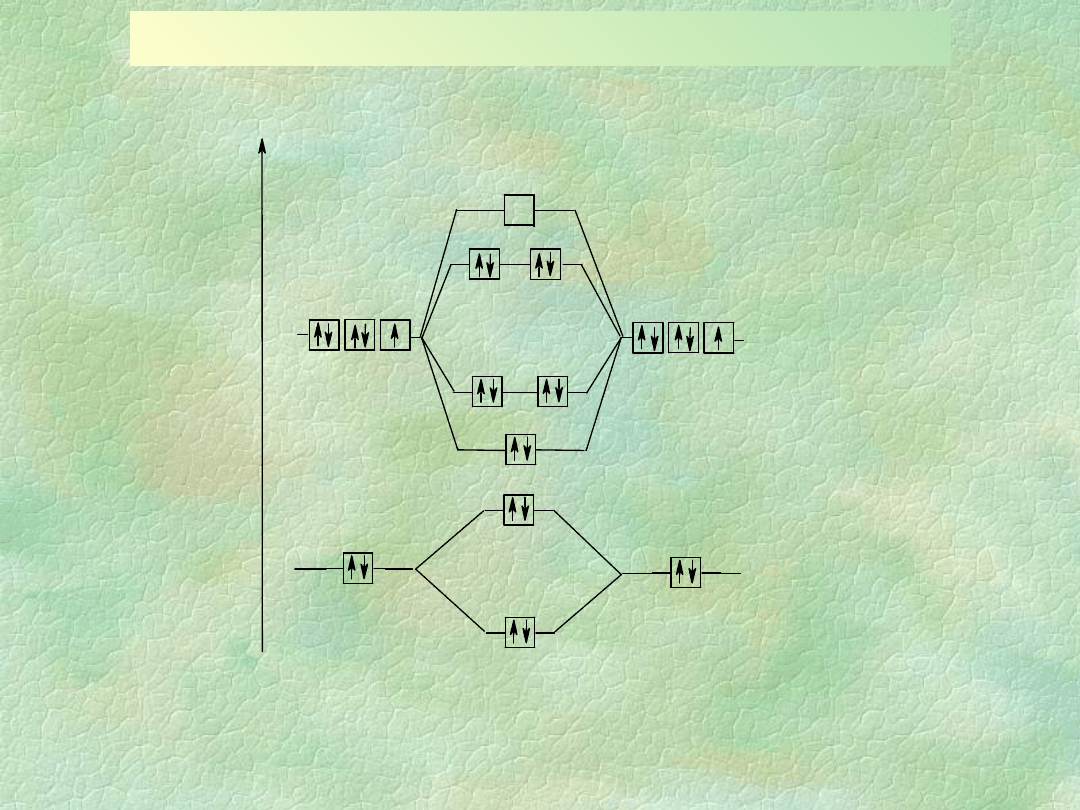
CZĄSTECZKA DIFLUORU - F
2
Schemat orbitali molekularnych cząsteczki F
2
KK(σ2s)
2
(σ*2s)
2
(σ2p
x
)
2
(π2p
y
)
2
(π2p
z
)
2
(π*2p
y
)
2
(π*2p
z
)
2
RW = ½(8e – 6e) = 1
F F E
d
= 155 kJ/mol
E
F
2
F
F
2s
2s
2p
y
2p
x
2p
x
2p
z
2p
z
2p
y
2s
2s
2p
2p

Fluorowce - występowanie i
otrzymywanie
Flurowce nie występują w przyrodzie w stanie
wolnym !!
Fluor
występuje w postaci
fluorytu CaF
2
,
apatytu
Ca
5
(PO
4
)
3
F
oraz
kriolitu Na
3
AlF
6
. Surowcem do
otrzymywania F
2
jest CaF
2
.
CaF
2
+ H
2
SO
4
CaSO
4
+ 2HF HF + KF KHF
2
Bezwodny HF w stopionym KHF
2
(380 K)
poddaje się elektrolizie w wannie z Cu i Ni. Na
węglowej anodzie wydziela się fluor a na katodzie ze
stali wydziela się wodór.
2F
F
2
+ 2e
2H
+
+ 2e
H
2
Chlor
otrzymuje się na drodze elektrolizy
stopionego, bezwodnego
NaCl
lub jego roztworu
wodnego. Chlor wydziela się na anodzie a na
katodzie Na (w warunkach bezwodnych) lub H
2
(w
H
2
O).
Brom
otrzymuje się elektrolitycznie lub w reakcji
bromków z chlorem:
2Br
+ Cl
2
Br
2
+ 2Cl
Jod
wydziela się z jodków działaniem chloru:
2I
+ Cl
2
I
2
+ 2Cl
Wyst
ę
puje w z
łoż
ach saletry sodowej w postaci
jodanów(V) i (VII), które redukuj
ąc
przerabia si
ę na I
2
.
Związki jodu wyst
ępują w organizmie człowieka w gruczole
tarczycowym. Brak jodu wywołuje objawy chorobowe.
Astat
otrzymuje się wyłącznie w sposób
sztuczny. Jeden z jego najtrwalszych
izotopów otrzymuje się przez
bombardowanie jąder Bi cząsteczkami
209
Bi
n
At
+
=
+
83
0
1
211
85
2
He
4
2

Właściwości
fluorowców
W normalnych warunkach fluor i chlor są gazami, brom
- cieczą o znacznej prężności par i
jod
- ciałem stałym o
tak znacznej prężności par, że już poniżej temperatury
topnienia
ulega
sublimacji
,
czyli przejściu ze stanu
stałego w gazowy.
W stanie gazowym F
W stanie gazowym F
2
2
, Cl
, Cl
2
2
, Br
, Br
2
2
i I
i I
2
2
silnie
silnie
drażnią drogi oddechowe - są toksyczne!!!!
drażnią drogi oddechowe - są toksyczne!!!!
Chlor i brom
rozpuszczają się dobrze w wodzie dając
odpowiednio
wodę chlorową i bromową
, używane jako
środki utleniające. W czasie krzepnięcia tych roztworów
wydzielają się kryształy
hydratów Cl
2
·8H
2
O
i
Br
2
·10H
2
O
. Słabą rozpuszczalność I
2
w wodzie można
zwiększyć przez dodatek KI, z którym tworzy jony
trijodkowe:
I
2
+ I
I
3
Flurowce wchodzą w reakcję z wodą ! F
2
- reaguje
gwałtownie a Cl
2
i Br
2
(X
2
) powoli.
F
2
+ H
2
O 2HF +
1/2O
2
X
2
+ H
2
O HX + HXO
pod wpływem
światła -
2HXO 2HX + O
2
Fluor
najbardziej aktywny pierwiastek łączy się ze
wszystkimi innymi pierwiastkami, nawet z gazami
szlachetnymi (z wyjątkiem helu i neonu). Z wodorem
elementarnym reaguje wybuchowo. Odbiera wodór z
jego związków. Niektóre metale np. Ni i Cu, pokrywają
się cienką warstwą fluorków, chroniącą je przed
dalszym działaniem tego gazu.

Związki fluorowców z wodorem HX -
Związki fluorowców z wodorem HX -
fluorowcowodory
fluorowcowodory
HF i HCl otrzymuje się działaniem kwasu siarkowego na
odpowiednie sole
CaF
2
+ H
2
SO
4
CaSO
4
+ 2HF
NaCl + H
2
SO
4
NaHSO
4
+ HCl
W roztworach wodnych fluorowcowodory
ulegają dysocjacji elektrolitycznej:
HX
+ H
2
O H
3
O
+
+ X
Ciekły bezwodny HF jest doskonałym rozpuszczalnikiem.
Ulega
autodysocjacji:
2HF H
2
F
+
+ F
HF używany jest głównie do trawienia szkła.
SiO
2
+ 4HF
SiF
4
+ 2H
2
O
HF i HCl są silnie toksyczne!!
St
ężone roztwory HF wywołują przykre i trudno
gojące się oparzenia ciała. Jednocześnie HF ma
właściwości bakteriobójcze. Rozcieńczone roztwory
stosuje się do dezynfekcji w przemyśle drożdżowym.
Fluorki stosuje się do impregnacji drewna.
HBr i HI otrzymuje się w wyniku hydrolizy PBr
3
lub PI
3
(H
2
SO
4
utlenia HBr i HI)
3P
(czerwony)
+ 3Br
2
2PBr
3
PBr
3
+ 3H
2
O H
3
PO
3
+ 3HBr
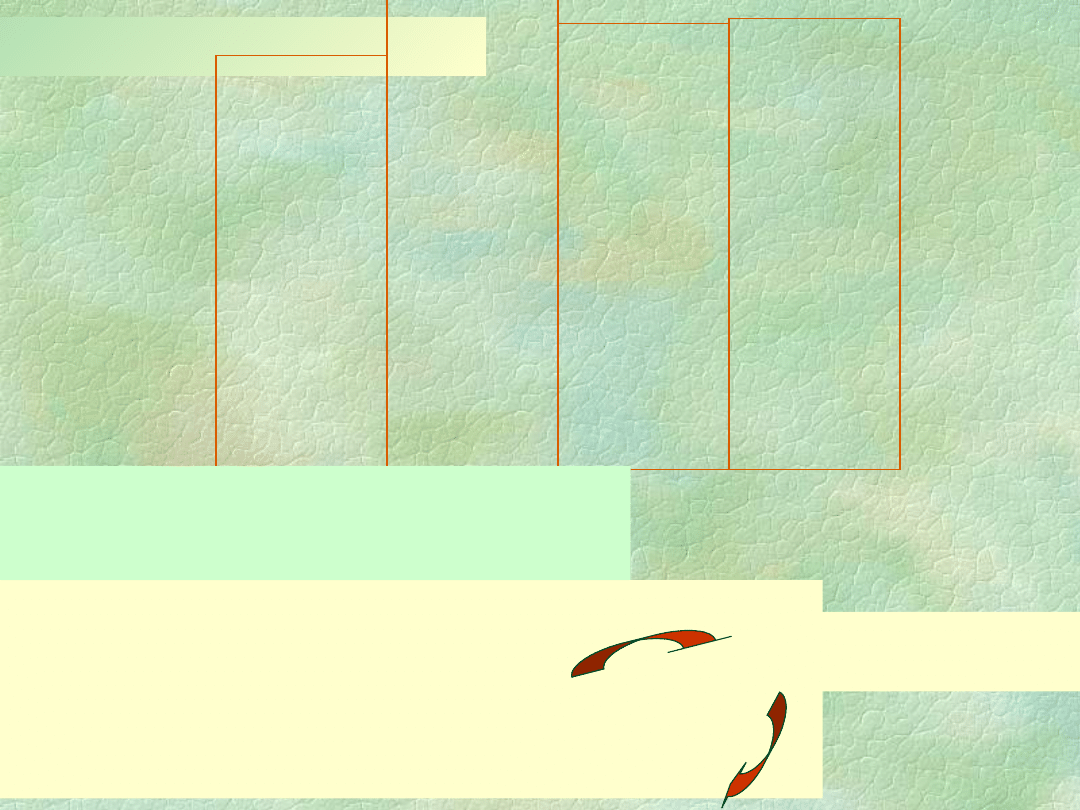
Związki fluorowców z
tlenem
Fluor
OF
2
(I)
O
2
F
2
( I)
Chlor
Cl
2
O (I)
Cl
2
O
3
( III)
ClO
2
(IV)
Cl
2
O
4
(IV)
Cl
2
O
6
(VI)
Cl
2
O
7
(VII)
Brom
Br
2
O (I)
BrO
2
(IV)
Jod
I
2
O
4
(IV)
I
2
O
5
(V)
I
2
O
7
(VII)
2F
2
+ 2NaOH 2NaF + H
2
O + OF
2
2Cl
2
+ 2HgO HgCl
2
·HgO + Cl
2
O
2Br
2
+ 2HgO HgBr
2
·HgO + Br
2
O
Cl
2
O + 2NaOH 2NaClO + H
2
O
Br
2
O + 2NaOH 2NaBrO + H
2
O
3KClO
3
+ 3H
2
SO
4
3HClO
3
+ 3KHSO
4
3HClO
3
2ClO
2
+ [H
3
O
+
][ClO
4
]
2Cl
IV
O
2
+ 2NaOH NaCl
III
O
2
+ NaCl
V
O
3
+ H
2
O
2ClO
2
+ O
3
Cl
2
O
6
+ 1/2O
2
Cl
2
VI
O
6
+ 2NaOH NaCl
V
O
3
+ NaCl
VII
O
4
+ H
2
O
P
2
O
5
2HClO
4
Cl
2
O
7
+
H
2
O
Bezwodniki kwasowe
Bezwodniki kwasowe
Reakcja
dysproporcjonowania
Oksokwasy
Oksokwasy
fluorowców
fluorowców
HClO
HClO
chlorowy(I)
HClO
HClO
2
2
chlorowy(II
I)
HClO
HClO
3
3
chlorowy(V)
HClO
HClO
4
4
chlorowy(VI
I)
HBrO
HBrO
bromowy(I)
HBrO
HBrO
2
2
bromowy(II
I)
HBrO
HBrO
3
3
bromowy(V
)
HBrO
HBrO
4
4
bromowy(V
II)
HIO
HIO
jodowy(I)
HIO
HIO
3
3
jodowy(V)
H
H
5
5
IO
IO
6
6
jodowy(VII)
HIO
HIO
4
4
H
H
3
3
IO
IO
5
5
H
H
4
4
I
I
2
2
O
O
9
9
H
H
7
7
I
I
3
3
O
O
11
11
HOF
HOF
fluorowy(I)
O H
..
..
O H
Cl
.. ..
..
..
:
HClO
kwas
monooksochlorowy(I)
[chlorowy(I)]
HClO
2
kwas dioksochlorowy(III)
[chlorowy(III)]
O Cl
.. ..
..
..
HClO
3
kwas trioksochlorowy(V)
[chlorowy(V)]
HClO
4
kwas
tetraoksochlorowy(VII)
[chlorowy(VII)]
O H
Cl
..
..
..
..
:
O
O
..
:
O
: :
O H
Cl
..
..
..
:
O
O
..
:
Związki międzyhalogenowe AX
n
, n = 1, 3,
5, 7; A F
AX
AX
2
2
BrCl
BrCl
2
2
AX
AX
3
3
ClF
ClF
3
3
BrF
BrF
3
3
IF
IF
3
3
(ICl
(ICl
3
3
)
)
2
2
AX
AX
5
5
ClF
ClF
5
5
BrF
BrF
5
5
IF
IF
5
5
AX
AX
ClF
ClF
BrF
BrF
IF
IF
BrCl
BrCl
ICl
ICl
IBr
IBr
AX
AX
7
7
IF
IF
7
7
..
..
I
F
F
F
:
F
F
:
:
: :
:
..
..
..
..
..
..
.. ..
..
..
F
..
F
Cl
.. ..
..
..
:
..
F
:
:
F F
:
: :
..
I
F
:
:
: :
:..
..
..
..
..
..
..
..
F
:
F
F
..
F
:..
Polihalogenki: I
Polihalogenki: I
3
3
, I
, I
5
5
, I
, I
7
7
, I
, I
9
9
, ICl
, ICl
2
2
, ICl
, ICl
4
4
I
I
+ I
+ I
2
2
I
I
3
3

Helowce (gazy
Helowce (gazy
szlachetne)
szlachetne)
Właściwości fizyczne helowców
Pierwiastek
Hel
Neon
Argon
Krypton
Ksenon
Radon
Symbol
He
Ne
Ar
Kr
Xe
Rn
Konfiguracja elektronowa
1 s
2
2 s
2
p
6
3 s
2
p
6
4 s
2
p
6
5 s
2
p
6
6 s
2
p
6
Masa atomowa, u
4,002602
20,1797
39,948
83,80
131,29
(222)
Temperatura topnienia, K
1,05
(ciśn. 2,5 MPa)
24,56
83,8
115,79
161,41
202,1
Temperatura wrzenia, K
4,22
27,02
87,30
119,93
165,11
211,4
Entalpia parowania, kJ · mol
1
0.0829
1,71
6,43
9,08
12,627
Temperatura krytyczna, K
5,19
44,4
150,87
209,41
289,73
377
Energia jonizacji, MJ · mol
1
2,372
2,081
1,521
1,35
1,170
1,037
Promień atomowy, pm
128
160
174
189
190
Hel jest drugim pierwiastkiem po wodorze (H -
Hel jest drugim pierwiastkiem po wodorze (H -
91% wszystkich atomów) pod względem
91% wszystkich atomów) pod względem
rozpowszechnienia we Wszechświecie!
rozpowszechnienia we Wszechświecie!
Zawartość w powietrzu, % obj. 5,2 ·10
4
1,8 ·10
3
0,934
0,934 1,14
·10
3
8,7 ·10
6
Rozpowszechnie
nie (liczba
atomów /1000
atomów
krzemu)
we
Wszechwiecie
na Ziemi
3.08
3.08
·10
·10
7
7
8,6
·10
4
1,5
·10
3
0.513
0,04
4,1 ·10
5
8 ·10
6
1,7 ·10
1,7 ·10
3
3
4 ·10
8
4
·10
9
~10
16

Helowce - otrzymywanie
Helowce - otrzymywanie
Wszystkie helowce (z wyjątkiem radonu) można
otrzymać z powietrza metodą destylacji frakcjonowanej,
tzn. wykorzystując różnice w temperaturach wrzenia
poszczególnych gazów.
He Ne N
2
Ar O
2
Kr Xe
Temperatura wrzenia, K: 4,22
27,02
77,36
87,30
90,15
119,93 166,11
Hel pozyskuje się głównie z gazu ziemnego, w którym
zawartość helu może dochodzić do 1%. Hel powstaje w
reakcji rozpadu promieniotwórczego w minerałach
uranowych.
Klatraty gazów szlachetnych
- połączenia, w których
atomy helowca (z wyjątkiem helu) zamykane są we
wnękach (klatkach) obecnych w sieci przestrzennej
tworzącej się podczas krzepnięcia związków
chemicznych, których cząsteczki zdolne są do asocjacji w
wyniku tworzenia wiązań wodorowych, np.
[C
6
H
4
(OH)
2
]
3
·0,8Ar
,
[C
6
H
4
(OH)
2
]
3
·
0,88Xe
,
[H
2
O]
5,75
·Y
(Y = atom
helowca).
Pierwszy związek chemiczny helowca został
otrzymany w 1960r. przez Bartletta w reakcji
utleniania Xe za pomocą PtF
6
.
Xe +
PtF
6
XePtF
6
(heksafluoroplatynian ksenonu).
Ulega on
gwałtownej hydrolizie:
2XePtF
6
+ 6H
2
O 2Xe + O
2
+12HF + 2PtO
2

Związki chemiczne
helowców
W 1960r został otrzymany pierwszy fluorek ksenonu
XeF
4
w wyniku ogrzewania Xe z F
2
w temp. 670 K, a
następnie gwałtownego ochłodzenia do temperatury
pokojowej. Obecnie znane są fluorki: XeF
2
, XeF
4
i
XeF
6
. W ciekłym fluorowodorze XeF
6
ulega
dysocjacji elektrolitycznej.
XeF
6
+ HF XeF
5
+
+
HF
2
XeF
6
ulega hydrolizie wobec małej ilości wody do
XeOF
4
i XeO
2
F
2
a użycie większej ilości wody daje
XeO
3
XeF
6
+ H
2
O XeOF
4
+
2HF XeF
6
+ 2H
2
O
XeO
2
F
2
XeF
6
+ 3H
2
O
XeO
3
XeF
6
reaguje z fluorkami litowców (M = Na, K, Rb,
Cs) tworząc aniony heptafluoroksenianów
XeF
7
.
XeF
6
+ MF M[XeF
7
]
XeO
3
działa silnie utleniająco. Utlenia Mn
2+
do
MnO
4
.
Po dodaniu do roztworu Ba(OH)
2
wydziela si
ę
osad heksaoksoksenianu dibaru, Ba
2
XeO
6
, w którym
ksenon wyst
ę
puje na stopniu utlenienia VIII.
2XeO
3
+ 4OH
+ 2Ba
2+
Ba
2
XeO
6
+ Xe + O
2
+ 2H
2
O

Zastosowania
helowców
Hel służy do napełniania balonów.
Mieszanina helu i tlenu używana jest jako gaz,
którym oddychają nurkowie (hel rozpuszcza się we
krwi w znacznie mniejszym stopniu niż azot, który
w przypadku zbyt szybkiej zmiany ciśnienia
wydziela się w postaci pęcherzyków zamykających
naczynia krwionośne).
Hel, jako gaz skraplający się w najniższej
temperaturze spośród wszystkich gazów, używany
jest w laboratoriach naukowych do otrzymywania
najniższych temperatur.
Gazy szlachetne (krypton i ksenon) używane są do
napełniania żarówek.
Rozrzedzone gazy szlachetne podczas przepuszczania
przez nie wyładowań elektrycznych emitują
charakterystyczne barwne światło:
neon - czerwone
,
hel - żółte,
mieszanina helu z parami rtęci -
niebieskie
itp. Zjawisko to wykorzystuje się w
technice oświetleniowej (neony).
Kwasy i
Kwasy i
zasady
zasady
Zgodnie z definicją Bronsteda kwas jest to
Zgodnie z definicją Bronsteda kwas jest to
substancja zawierająca cząsteczki zdolne do
substancja zawierająca cząsteczki zdolne do
oddawania protonów, zasada jest to substancja
oddawania protonów, zasada jest to substancja
zawierająca cząsteczki zdolne do pobierania
zawierająca cząsteczki zdolne do pobierania
protonów.
protonów.
Kwas A, oddając proton H
Kwas A, oddając proton H
+
+
,
,
staje się zasadą B.
staje się zasadą B.
Zasada B, łącząc
Zasada B, łącząc
się z protonem, przechodzi z powrotem w kwas A.
się z protonem, przechodzi z powrotem w kwas A.
Zasada B jest sprzężona z kwasem A.
Zasada B jest sprzężona z kwasem A.
A B + H
A B + H
+
+
A
A
1
1
+ B
+ B
2
2
B
B
1
1
+
+
A
A
2
2
HCl + H
HCl + H
2
2
O Cl
O Cl
-
-
+
+
H
H
3
3
O
O
+
+
Cząsteczka wody, pobierając proton od cząsteczki
Cząsteczka wody, pobierając proton od cząsteczki
HCl, będącej kwasem A
HCl, będącej kwasem A
1
1
, odgrywa rolę zasady B
, odgrywa rolę zasady B
2
2
.
.
Jon chlorkowy, stanowi zasadę B
Jon chlorkowy, stanowi zasadę B
1
1
sprzężoną z
sprzężoną z
kwasem HCl. Jon H
kwasem HCl. Jon H
3
3
O
O
+
+
stanowi kwas A
stanowi kwas A
2
2
sprzężony z
sprzężony z
zasadą B
zasadą B
2
2
, tj. z H
, tj. z H
2
2
O
O

Kwasy i zasady
Kwasy i zasady
Lewisa
Lewisa
Kwasy (A) i zasady (B) Lewisa
Oddziaływanie kwasu (
A) z zasadą Lewisa (B) i
tworzenie kompleksu (adduktu)
A
B
A + :B A:B
Podstawowe rodzaje kwasów Lewisa
1 Kationy metali
M
n+
+ m H
2
O [M(H
2
O)
m
]
n+
2 Cząsteczki z niepełnym oktetem elektronów
B(CH
3
)
3
+ :NH
3
B(CH
3
)
3
: NH
3
3
Cząsteczki z niepełnym oktetem elektronów
SiF
4
+ 2 F
[SiF
6
]
2
sp
3
d
2
sp
3
Si (3s
2
3p
2
) (4e) + 4 F
(4e) = 8e (hybrydyzacja sp
3
)
CO
2
+ OH
HCO
3
sp
sp
2
(przegrupowanie elektronów walencyjnych)
4 Cząsteczki o zapełnionej powłoce walencyjnej
I
2
+ :OC(CH
3
)
2
I
2
: OC(CH
3
)
2
Kwasy Lewisa typu ( akceptory) przyjmują elektrony od
metalu na puste orbitale typu
CO, H
2
C=CH
2
, HCCH, CN
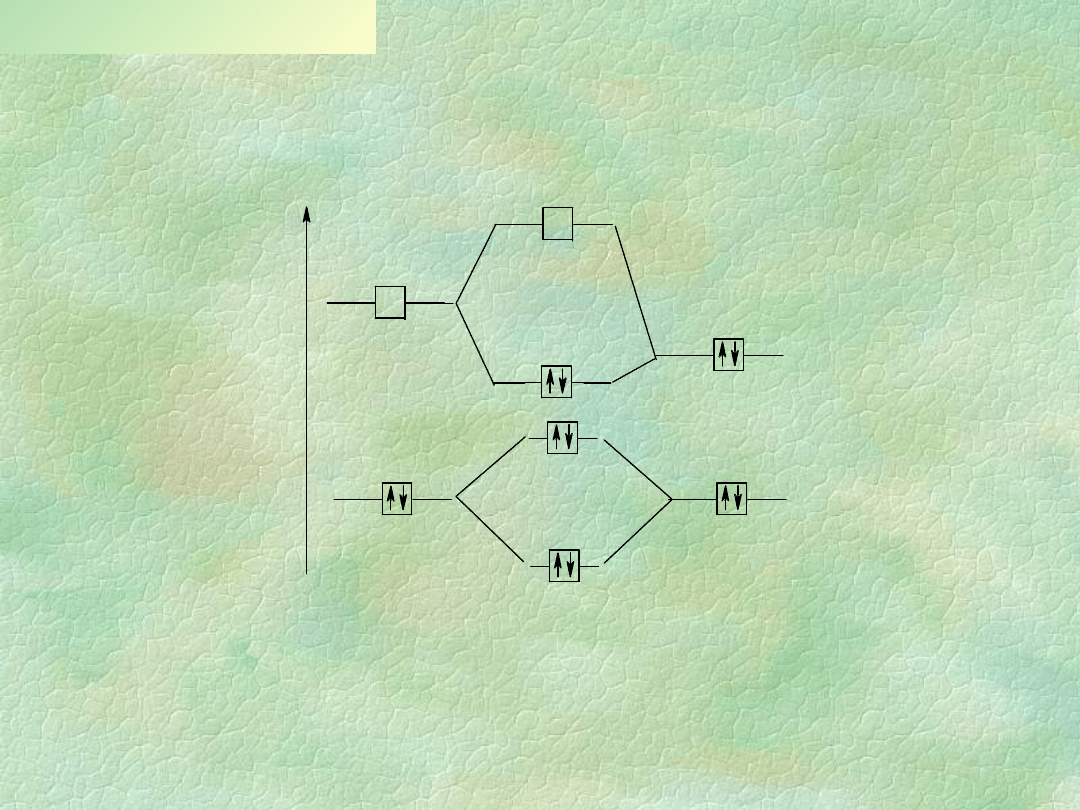
O d d z iały w a n ia k w a só w i za sa d L ew isa
A + : B A B
A
A B
B
k w as
k o m ple k s
z asad a
E
L U M O
H O M O
Kwasy i zasady
Lewisa

BF
3
+ :NH
3
F
3
B NH
3
SO
3
+ :OEt
2
O
3
S OEt
2
SnCl
2
+ :NH
3
Cl
2
Sn NH
3
(reakcje wymiany)
A B + :B A B + :B
F
3
B OEt
2
+ :NC
5
H
5
BF
3
NC
5
H
5
+ :OEt
2
(rozpuszczanie w H
2
O zasad Lewisa)
H
+
OH
+ :NH
3
:OH
+ NH
4
+
(rozpuszczanie w H
2
O kompleksów)
H B + :OH
2
B
+ H
3
O
+
H Cl + :OH
2
Cl
+ H
3
O
+
(reakcje wymiany)
A B + A A + A B
Cl
2
Sn NH
3
+ BF
3
SnCl
2
+ F
3
B NH
3
(rozpuszczanie w BrF
3
)
BrF
2
+
F
+ SbF
5
[BrF
2
]
+
+ [SbF
5
F]
(reakcje podwójnej wymiany)
A B + A B A B + A B
Et
3
Si I + Ag Br Et
3
Si Br + Ag I
Kwasy i zasady
Lewisa

Moc kwasów i zasad
Moc kwasów i zasad
Lewisa
Lewisa
M o c k w a s ó w L e w i sa za leż y n i e tyl k o o d jeg o i n d y w i d u a ln y ch
wł a ś ci w o ś ci a l e r ó w n i eż o d w ł a ś ci w o ś c i z a sa d y, z któ r ą te n
k w a s r e a g u je
Δ G = R T ln K
a
( r ó w n a n i e G i b b sa n a e n e r g ię sw o b o d n ą r e a k c j i )
S tała ró w n o w a gi K
a
ja k i e n e rgia sw o b o d n a Δ G rea k c ji z a l eż y
o d wł a śc iw o śc i k w a su A ja k i z a sa d y :B .
T w a r d e i m ięk k ie k w a sy i za sa d y L ew isa
w e dłu g k l a sy fi k a c j i P e a rso n a z 1 9 6 3 r.
a n g . H S A B ( H a r d a n d S o ft A ci d s a n d B a se s )
N a I + A g O H N a O H + A g I
T M M T T T M M
C F
3
H + C H
3
F C F
4
+ C H
4
T M M T T T M M
B F
3
:H
+ B H
3
:F
B F
4
+ B H
4
T M M T T T M M
A + : B A : B
c
A : B
K
a
= c
A
c
: B
.

Kwasy i
Kwasy i
zasady
zasady
Lewisa w
Lewisa w
przyrodzie
przyrodzie
Przykłady funkcjonowania zasady twardych i miękkich kwasów i
zasad Lewisa w przyrodzie
Twarde kwasy
Ca
2+
i
Mg
2+
występują w przyrodzie w połączeniach z
twardą zasadą CO
3
2
tzn. w postaci węglanów CaCO
3
i MgCO
3
.
Twarde kwasy
Li
+
, Na
+
, Tl
3+
i
Al
3+
występują w przyrodzie w
połączeniach z twardą zasadą
SiO
3
2
tzn. w postaci krzemianów
Li
2
SiO
3
i
Na
2
SiO
3
.
Miękkie kwasy Cd
2+
, Ag
+
i Hg
+
występują w przyrodzie w
połączeniach z miękkimi zasadami:
S
2
,
Se
2
i
Te
2
np.
CdS, Ag
2
S, Hg
2
Se.
Twarde zasady
F
i
O
2
stabilizują wyższe stopnie utlenienia metali
np. Ag
2+
w [AgF
4
]
2
, Fe
6+
w [FeO
4
]
2
i Os
8+
w OsO
4
.
Miękkie zasady
CO, C
6
H
6
i
H
stabilizują niższe stopnie utlenienia
metali np. Mo
0
w [Mo(CO)
6
], Cr
0
w [Cr(C
6
H
6
)
2
].
grupa
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
konfig.
elektr.
ns
1
ns
2
(n-1)
d
1
ns
2
(n-1)
d
2
ns
2
(n-1)
d
3
ns
2
(n-1)
d
4
ns
2
(n-1)
d
5
ns
2
(n-1)
d
6
ns
2
(n-1)
d
7
ns
2
(n-1)
d
8
ns
2
(n-1)
d
9
ns
2
(n-1)
d
10
ns
2
s
2
p
1
s
2
p
2
s
2
p
3
s
2
p
4
s
2
p
5
s
2
p
6
okres
blok s
pierwiastki zewnętrznoprzejściowe (blok d)
pierwiastki bloku p
I
H
II
Li Be
III
Na Mg
IV
K
Ca
V
Rb Sr
VI
Cs Ba
VII Fr Ra
He
B
C
N
O
F
Ne
Al
Si
P
S
Cl Ar
Ga Ge As Se Br Kr
In
Sn Sb Te
I
Xe
Tl
Pb Bi Po At Rn
Sc Ti
V Cr Mn Fe Co Ni Cu Zn
Y
Zr Nb Mo Tc Ru Rh Pd Ag Cd
La-Lu
Hf Ta W Re Os Ir Pt Au Hg
Ac-Lr
Rf Db Sg Bh Hs Mt
pierwiastki
wewnętrznoprzejściowe (blok f)
4f (57 – 71)
La Ce Pr Nd Pm Sm Eu Gd Tbo Dy Ho Er Tm Yb Lu
5f (92 – 103)
Ac Th Pa
U Np Pu Am Cm Bk Cf Es Fm Md No Lr
103
Lr – lorens;
104
Rf - rutherford;
105
Db - dubn;
106
Sg - seaborg;
107
Bh – bohr;
108
Hs – has;
109
Mt – meitner
UKŁAD OKRESOWY PIERWIASTKÓW CHEMICZNYCH

3
4
5
6
7
8
9
10 11 12
Sc
Ti
V
Cr Mn Fe Co Ni Cu Zn
Y
Zr Nb Mo Tc Ru Rh Pd Ag Cd
La-Lu
Hf Ta W Re Os Ir
Pt Au Hg
Ac-Lr
Rf Db Sg Bh Hs Mt
Pierwiastki
bloku d
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
ch infekcyjne wyklad
Ch organiczna wykład 1d
Ch organiczna wykład 1g
ch zywnosci wyklad 4 lipidy low
4 spr ch nieorg r id 37978 Nieznany (2)
terzykZestaw B, I semestr, Chemia, nieorganiczna, wyklad
Ch WGGiIS Wyklad12
chemia nieorganiczna wykłady cz II
Ch WGGiIS Wyklad6
CH klin wykład 2
chemia nieorganiczna wykłady cz 1
heisenberg, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Ch WGGiIS Wyklad13
3 spr ch nieorg p id 34094 Nieznany
Redox, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Regula Hunda, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Ch organiczna wykład 1e
Pierwiastki o liczbach atomowych 104-111, WAT chemia zaocznie, chemia nieorganiczna wyklady
więcej podobnych podstron