
ZESZYTY PROBLEMOWE POSTĘPÓW NAUK ROLNICZYCH 2009 z. 534: 83-94
WPŁYW RÓśNYCH WĘGLOWODANÓW NA WZROST
I ROZWÓJ LILIOWCA in vitro
1
Ludwika
Kawa-Miszczak
,
Elżbieta
Węgrzynowicz-Lesiak
,
Eleonora
Gabryszewska
, Justyna
Góraj
, Marian
Saniewski
Instytut Sadownictwa i Kwiaciarstwa im. Szczepana Pieniążka w Skierniewicach
Wstęp
W kulturach tkankowych węglowodany dodawane do pożywek są niezbędnym
czynnikiem odżywczym dla rosnących i różnicujących się tkanek. Ponadto działają jako
induktory bądź represory genów i tym samym regulują wzrost i rozwój tkanek oraz
zachodzące w nich procesy metaboliczne
[K
OCH
1996].
Odgrywają ważną rolę w
przekazywaniu sygnałów indukujących morfogenezę, wzrost komórek i odpowiedź na
stres
[H
O
i in. 2001].
Cukry, a zwłaszcza alkohole cukrowe (sorbitol, mannitol),
oddziałują na procesy wzrostu i rozwoju tkanek również poprzez wpływ na
osmolarność pożywki
[N
ETO
,
O
TONI
2003; S
TAIKIDOU
i in. 2005]
. Poszczególne
węglowodany mogą mieć różny wpływ na morfogenezę in vitro. Na przykład glukoza i
sacharoza są najlepszymi źródłami węgla w rozmnażaniu odmian i klonów Vaccinium
[D
EBNATH
2005]
, glukoza dla roślin z rodzaju Prunus
[B
ORKOWSKA
,
S
ZCZERBA
1991]
,
sorbitol dla gatunków z rodzaju Rosaceae
[C
OFFIN
i in. 1976]
, a maltoza w indukcji
somatycznej embriogenezy i androgenezy
[J
EANNIN
i in. 1995]
. Jednakże najczęściej
stosowanym w pożywkach węglowodanem jest sacharoza, która pod wpływem
inwertazy wydzielanej przez tkanki do pożywki, jest rozkładana do glukozy i fruktozy
[U
EDA
i in. 1974; T
REMBLAY
,
T
REMBLAY
1995]
. Z tego względu eksplantaty rosnące na
pożywce mają możliwość korzystania z mieszaniny różnych cukrów: sacharozy,
glukozy i fruktozy. W wielu przypadkach dla optymalnego wzrostu i rozwoju roślin
danego gatunku czy odmiany w warunkach in vitro niezwykle istotny jest nie tylko
rodzaj, ale i stężenie użytego cukru.
Celem badań było poznanie wpływu różnych cukrów na wzrost i rozwój liliowca
in vitro oraz na akumulację chlorofilu i węglowodanów w pędach.
Materiał i metody
1
Badania były finansowane przez MNiI, Grant Nr 2 P06R 034 29.
Materiał roślinny stanowiły pędy przybyszowe wybranego klonu hodowlanego
Hemerocallis
×
hybrida, pochodzące z rozmnażania in vitro. Eksplantaty umieszczano
na pożywce podstawowej MS
[M
URASHIGE
,
S
KOOG
1962]
zestalonej agarem, o pH 5,6
ustalonym przed sterylizacją. Pożywkę uzupełniano regulatorami wzrostu: 6-
benzyloaminopuryną (BAP) – 2 mg
⋅
dm
-3
, kinetyną – 2 mg
⋅
dm
-3
, 2-izopentyloadeniną
(2iP) – 2 mg
⋅
dm
-3
, tidiazuronem (TDZ) – 0,03 mg
⋅
dm
-3
[L
EMAŃSKA
,
G
ABRYSZEWSKA
2000]
. Do pożywki dodawano sacharozę, glukozę, fruktozę, maltozę i alkoholowe

L. Kawa-Miszczak i inni
84
pochodne cukrów – sorbitol i mannitol. Sacharozę i glukozę stosowano w stężeniach
10, 30 i 60 g
⋅
dm
-3
, a pozostałe cukry w stężeniach 10 i 30 g
⋅
dm
-3
. Po 6 tygodniach
prowadzenia kultur w fitotronie w temperaturze 20
°
C i przy 16-godzinnym oświetleniu,
mierzono liczbę i długość nowych pędów, liczbę liści, świeżą masę pędów i kalusa oraz
analizowano zawartość węglowodanów i chlorofilu w pędach. W każdej kombinacji
było po 5 powtórzeń, powtórzeniem był słoik z 5 eksplantatami. Pędy z 1 słoika
przeznaczono do oznaczania zawartości chlorofilu w świeżym materiale, a pozostałe
pędy liofilizowano (po uprzednim odcięciu kalusa). Zawartość glukozy, fruktozy,
sacharozy i skrobi w liofilizowanym materiale oznaczano metodami enzymatycznymi,
stosując zestawy testów (Boehringer Mannheim GmbH Biochemicals, Niemcy).
Zawartość chlorofilu oznaczano metodą Bruinsma
[B
RUINSMA
1963].
Analizy wykonano
w 4 powtórzeniach. Wyniki doświadczenia opracowano statystycznie metodą analizy
wariancji. Do oceny istotności różnic pomiędzy średnimi zastosowano test t-Duncana
przy poziomie istotności 5%.
Wyniki i dyskusja
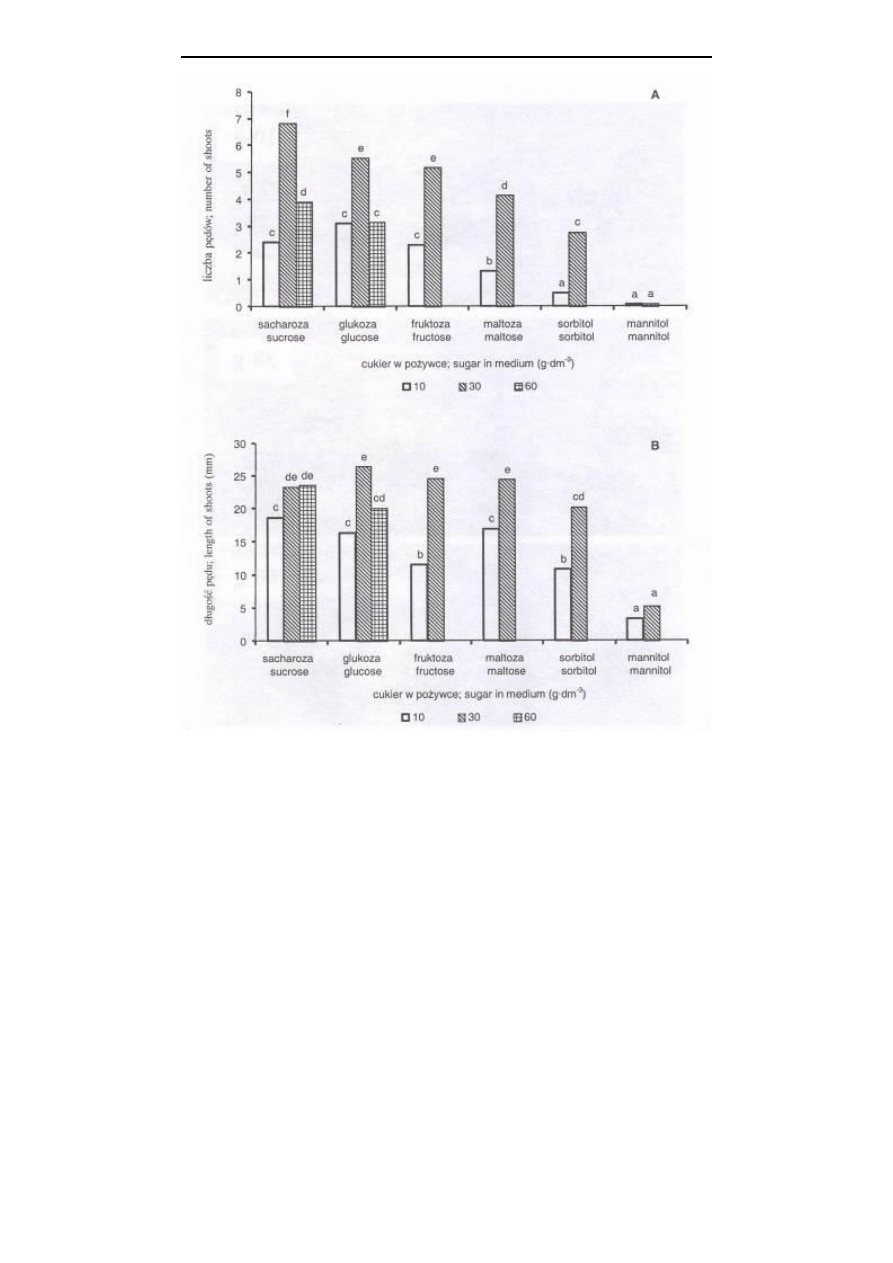
Wzrost i namnażanie pędów liliowca in vitro było uzależnione nie tylko od
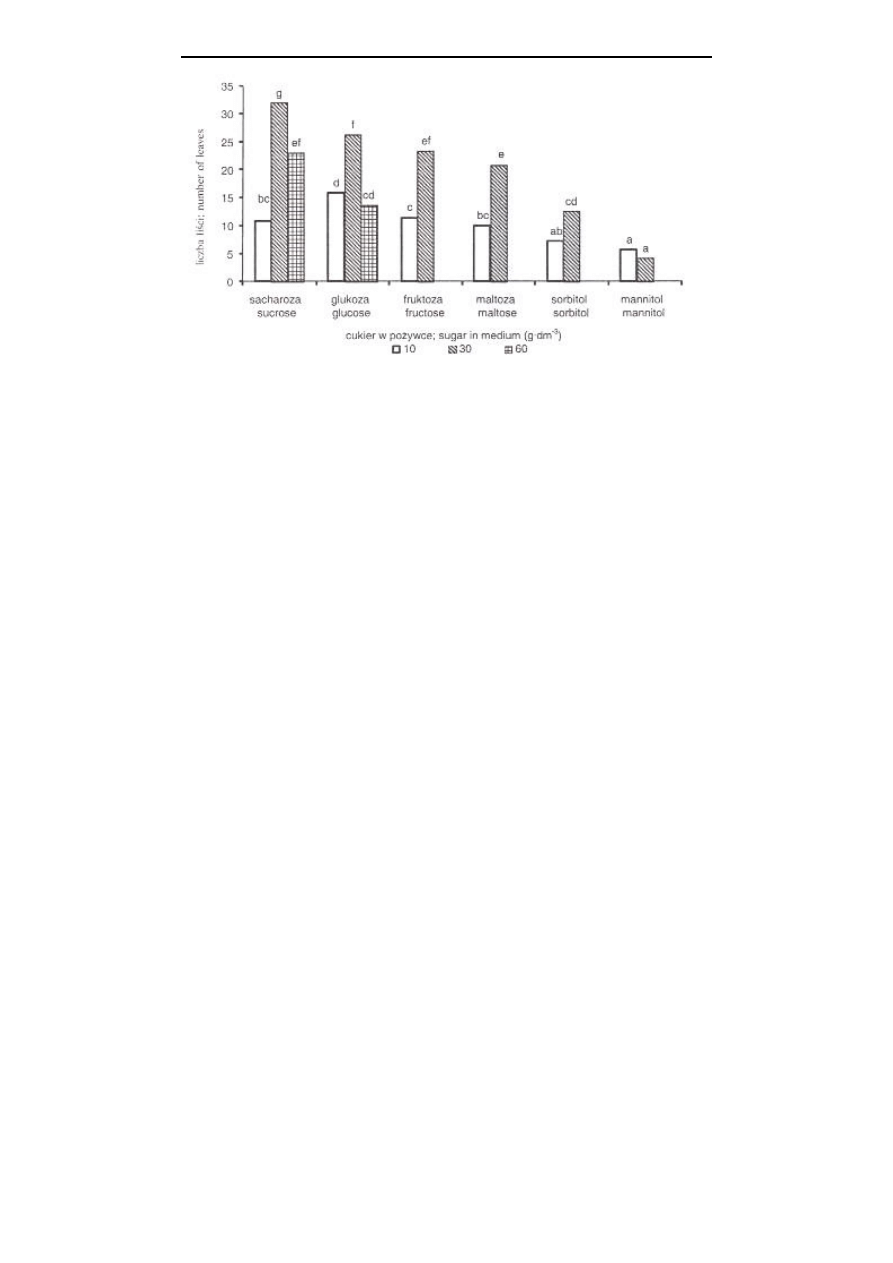
rodzaju, ale również od stężenia cukru dodanego do pożywki. Najwięcej nowych pędów
formowało się na pożywce zawierającej sacharozę (rys. 1A i 2, fot. 1). Przy czym na
pożywce z 30 g
⋅
dm
-3
sacharozy formowało się więcej nowych pędów, z większą liczbą
liści, niż na pożywce z 10 i 60 g
⋅
dm
-3
sacharozy. W traktowaniu tym, większa była
również świeża masa pędów (rys. 3A). Natomiast masa kalusa (rys. 3B) i sucha masa
pędów (dane nieprzedstawione) była wyższa przy 60 g
⋅
dm
-3
sacharozy. Wszystkie
badane cukry zastosowane w stężeniu 30 g
⋅
dm
-3
w większym stopniu oddziaływały na
wzrost i namnażanie się pędów liliowca, niż w pozostałych stężeniach. Jednakże na
pożywkach zawierających glukozę, fruktozę czy maltozę w stężeniu 30 g
⋅
dm
-3
formowało się mniej pędów, z mniejszą liczbą liści i o niższej świeżej masie, niż przy
30 g
⋅
dm
-3
sacharozy, ale długość pojedynczych pędów była podobna (rys. 1, 2 i 3).
Natomiast dodanie sorbitolu do pożywki w mniejszym stopniu wpływało na wzrost
pędów, a na pożywce zawierającej mannitol obserwowano brak wzrostu pędów liliowca
(rys. 1, 2 i 3).
Wpływ stężenia sacharozy w pożywce na wzrost roślin in vitro wykazano
w prowadzonych wcześniej doświadczeniach nad namnażaniem pędów Clematis
pitcheri. Stwierdzono, że zastosowanie niskiego stężenia sacharozy (10 g
⋅
dm
-3
)
zwiększało współczynnik namnażania oraz stymulowało wzrost wydłużeniowy pędów
powojnika, przy czym wpływ stężenia sacharozy był uzależniony od temperatury
prowadzenia kultur. Wyższe stężenie sacharozy w pożywce (30 g
⋅
dm
-3
) ograniczało
powstawanie i wzrost elongacyjny pędów bocznych, w mniejszym stopniu wpływając
na wzrost pędu głównego
[G
ABRYSZEWSKA
i in. 2008].
Również w przypadku Nicotiana
plumbaginifolia wysokie stężenia heksoz hamowały proces regeneracji pędów
[C
ABOCHE
1987].
Natomiast u kilku odmian Vaccinium corymbosum obserwowano, że wzrost
stężenia sacharozy w pożywce silnie stymulował powstawanie pędów bocznych, jednak
optymalne stężenie było różne dla poszczególnych odmian
[C
AO
i in. 2003].
WPŁYW RÓśNYCH WĘGLOWODANÓW NA WZROST ...
85
Rys. 1. Wpływ rodzaju i stężenia cukru w pożywce MS na liczbę pędów/eksplantat (A) oraz
długość pojedynczego pędu (B) liliowca; średnie oznaczone tą samą literą nie różnią
się istotnie według testu t-Duncana przy p=0,05
Fig. 1.
Effect of the type and concentration of sugar in the MS medium on the number of
shoots/explant (A) and the length of single shoot (B) of Hemerocallis; means with
the same letters are not different according to t-Duncan’s test at p=0.05

L. Kawa-Miszczak i inni
86
Fot. 1.
Wzrost pędów liliowca na pożywce zawierajacej sacharozę w stężeniu 10, 30 i 60
g
⋅
dm
-3
Photo 1.
The growth of Hemerocallis shoots on the medium containing sucrose at 10, 30 i 60
g
⋅
dm
-3
10 g
30 g
60 g
WPŁYW RÓśNYCH WĘGLOWODANÓW NA WZROST ...
87
Rys. 2. Wpływ rodzaju i stężenia cukru w pożywce MS na liczbę liści/eksplantat liliowca; średnie
oznaczone tą samą literą nie różnią się istotnie według testu t-Duncana przy p=0,05
Fig. 2.
Effect of the type and concentration of sugar in the MS medium on the number of
leaves/explant of Hemerocallis; means with the same letters are not different
according to t-Duncan’s test at p=0.05
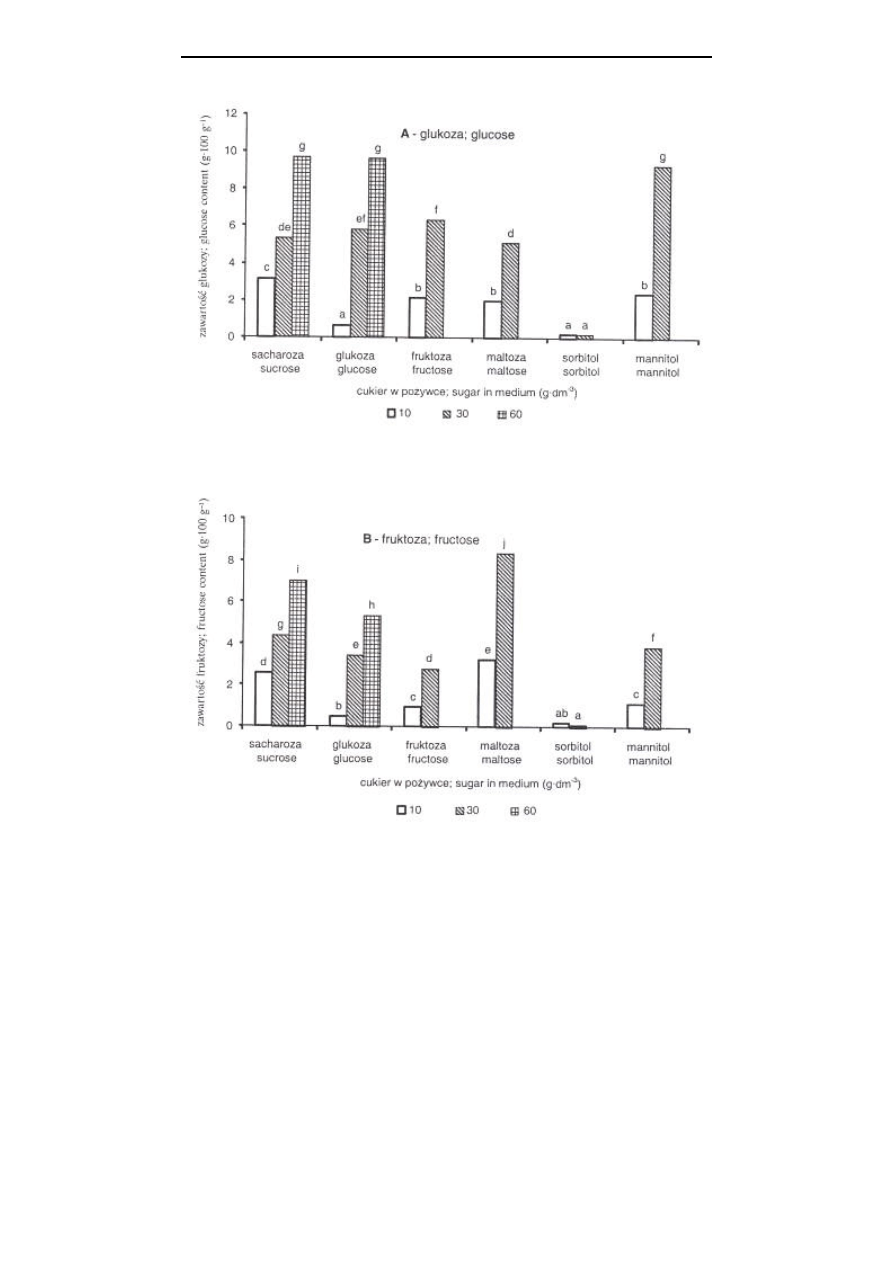
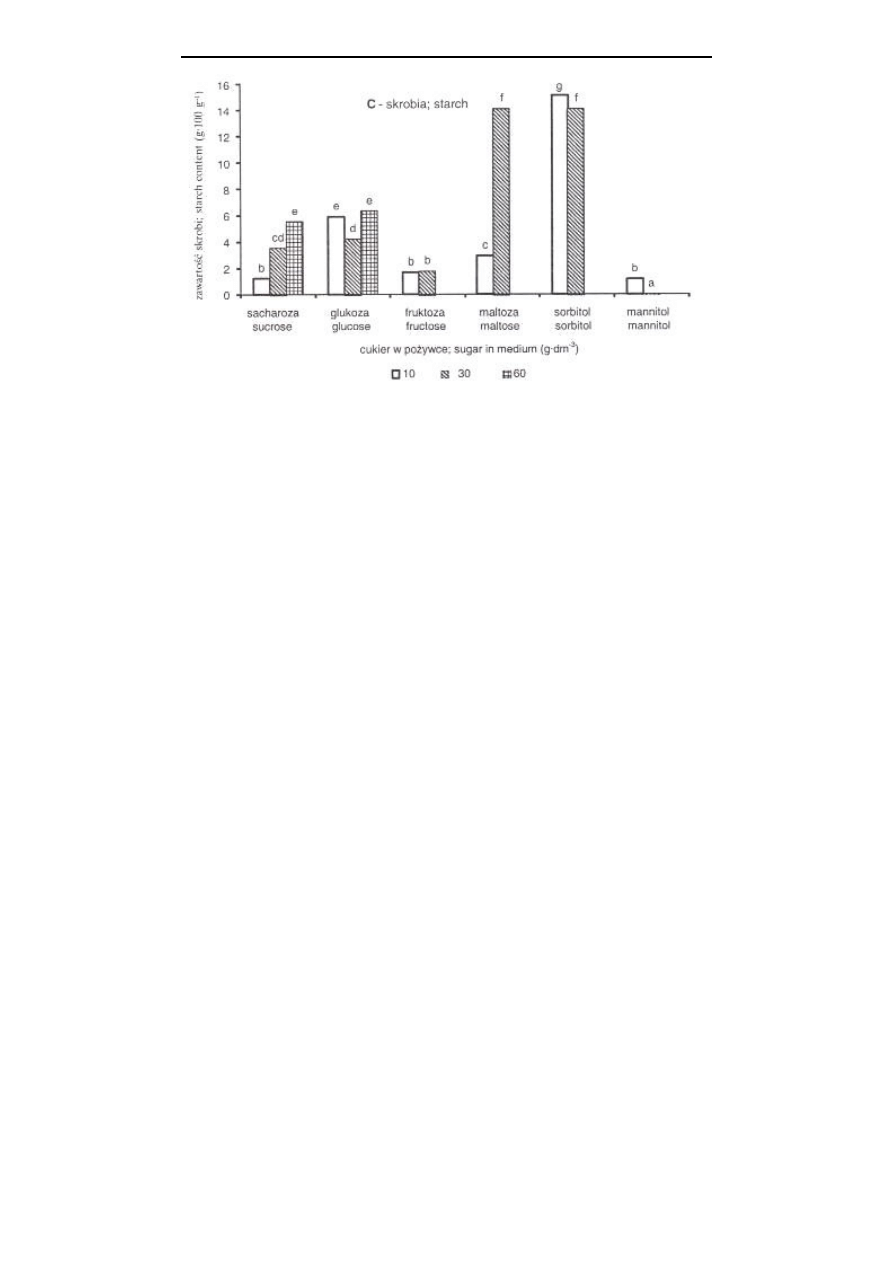
Porównując zawartość węglowodanów w pędach Clematis pitcheri rosnących in
vitro na pożywce z 10 i 30 g
⋅
dm
-3
sacharozy stwierdzono, że pędy akumulowały więcej
glukozy, fruktozy i skrobi na pożywce z wyższym stężeniem sacharozy, nie
stwierdzono natomiast obecności sacharozy w pędach
[K
AWA
-M
ISZCZAK
i in. 2008].
Podobne zależności obserwowano w prezentowanych badaniach. Niezależnie od
rodzaju cukru w pożywce, pędy liliowca nie zawierały sacharozy. W kulturach pro-
wadzonych na pożywce z sacharozą, akumulacja glukozy, fruktozy i skrobi w pędach
była tym wyższa, im wyższe było stężenie sacharozy w pożywce, a pędy zawierały
więcej glukozy i fruktozy niż skrobi (rys. 4). W przypadku kultur Clematis pitcheri,
zwłaszcza rosnących na pożywce z 30 g
⋅
dm
-3
sacharozy, najwyższa była w pędach
zawartość skrobi
[K
AWA
-M
ISZCZAK
i in. 2008].
Również w pędach Clematis ‘The
President’ rosnących in vitro wykazano wysoki poziom skrobi
[L
EES
i in. 1991].
Skrobia
była także głównym węglowodanem w pędach piwonii zielnej ‘Jadwiga’ w fazie
namnażania
[G
ABRYSZEWSKA
,
K
AWA
-M
ISZCZAK
2006].
W prezentowanych badaniach
stwierdzono, że zwiększenie stężenia maltozy w pożywce z 10 do 30 g
⋅
dm
-3
znacznie
nasilało akumulację węglowodanów w pędach (rys. 4). Natomiast wzrost stężenia
glukozy czy fruktozy w pożywce nie wpływał na zawartość skrobi w pędach,
stymulując równocześnie akumulację glukozy i fruktozy. Najwięcej skrobi
akumulowały pędy rosnące na pożywce z sorbitolem, przy czym pędy te zawierały
ś
ladowe ilości glukozy i fruktozy. Odwrotnie w przypadku pędów rosnących na
pożywce z mannitolem. Przy wyższym stężeniu mannitolu (30 g
⋅
dm
-3
) pędy
akumulowały glukozę i fruktozę, a nie zawierały skrobi (rys. 4).
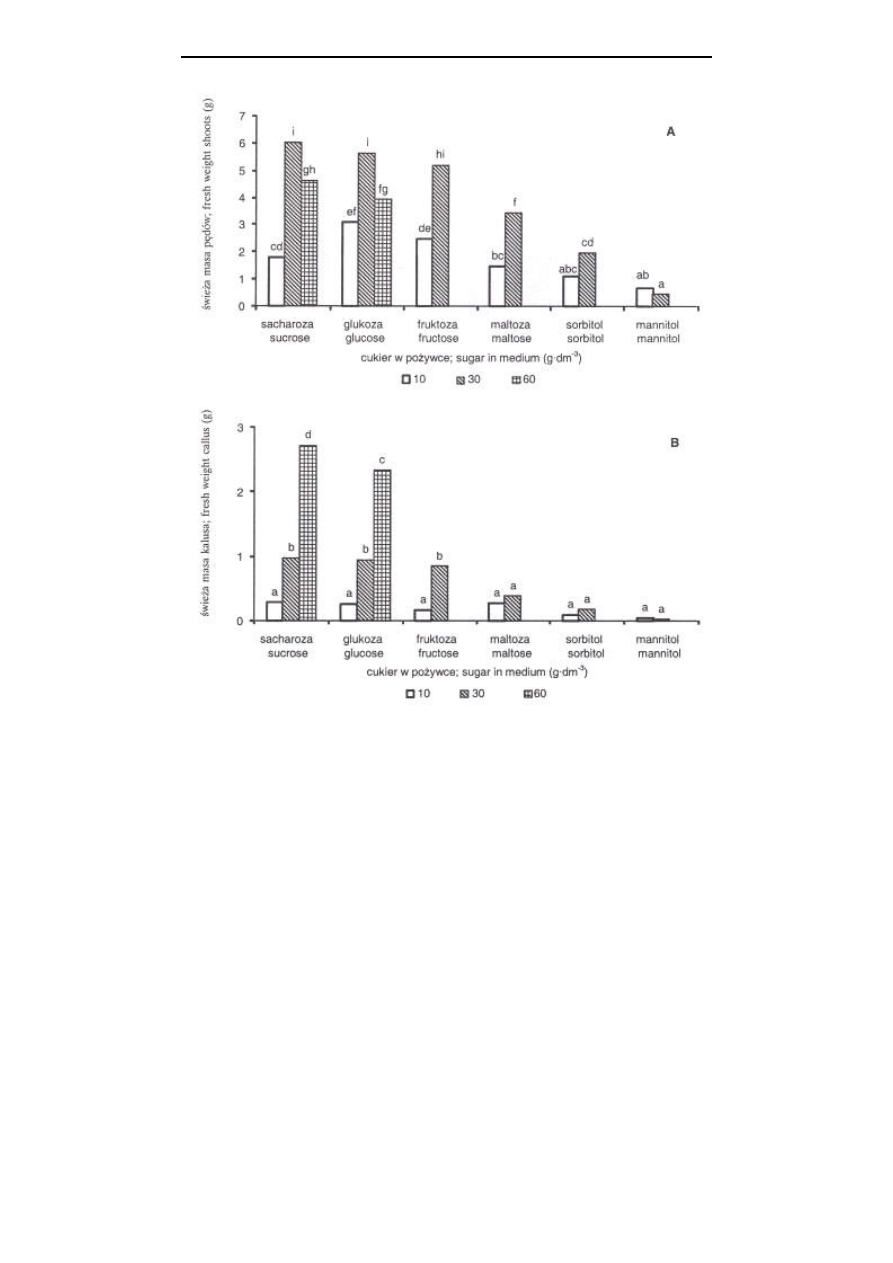
L. Kawa-Miszczak i inni
88
Rys. 3. Wpływ rodzaju i stężenia cukru w pożywce MS na świeżą masę pędów liliowca (bez
kalusa) (A) oraz świeżą masę kalusa (B) z 1 powtórzenia; średnie oznaczone tą samą
literą nie różnią się istotnie według testu t-Duncana przy p=0,05
Fig. 3.
Effect of the type and concentration of sugar in the MS medium on the fresh weight
of shoots of Hemerocallis (without callus) (A) and fresh weight of callus (B) from 1
replicate; means with the same letters are not different according to t-Duncan’s test at
p=0.05
Tabela 1; Table 1
Zawartość chlorofilu (
µ
g
⋅
100 mg
-1
świeżej masy) w pędach liliowca z zależności
od rodzaju i stężenia cukru w pożywce MS
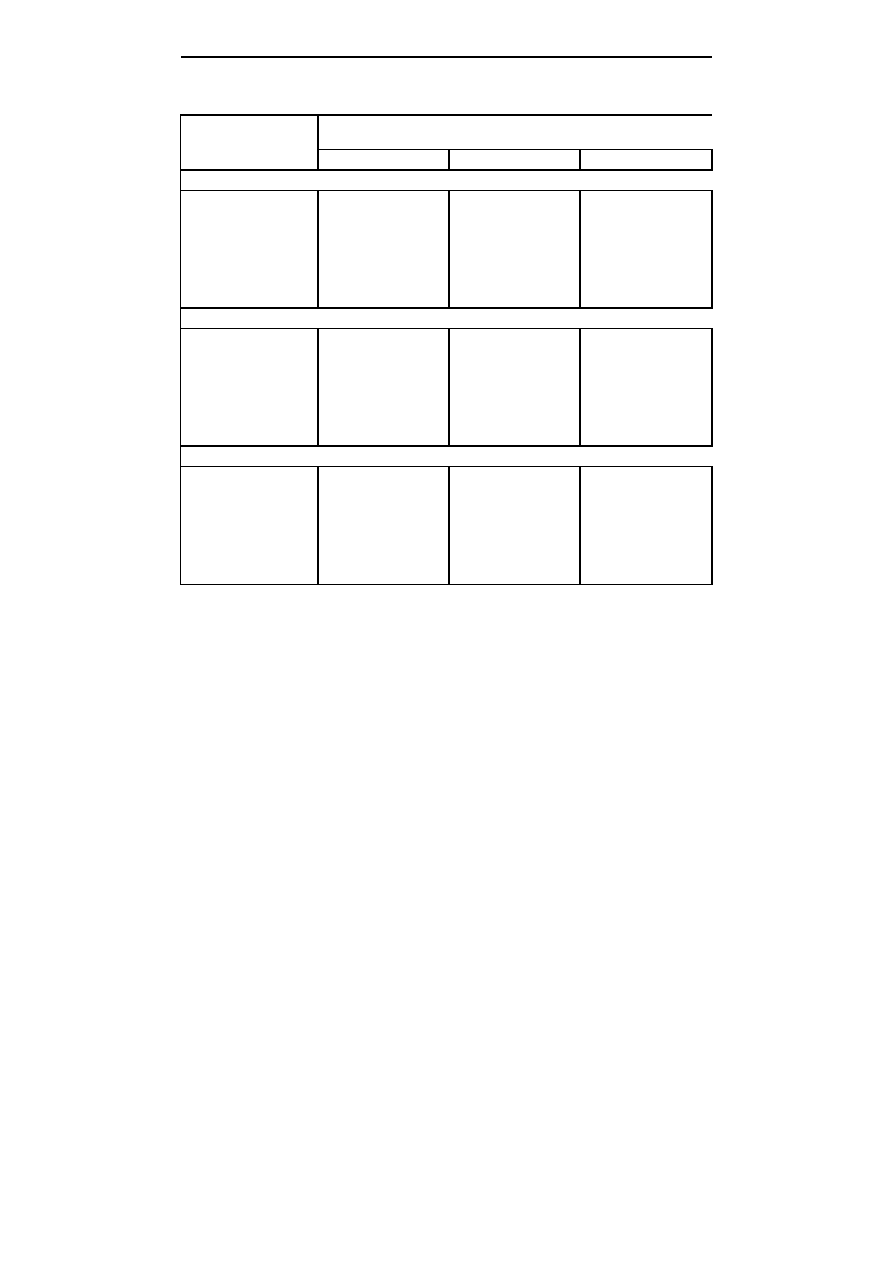
WPŁYW RÓśNYCH WĘGLOWODANÓW NA WZROST ...
89
Chlorophyll content (
µ
g
⋅
100 mg
-1
fresh weight) in Hemerocallis shoots depending
on the type and concentration of sugar in the MS medium
Cukier; Sugar
Stężenie cukru
Sugar concentration (g
⋅
dm
-3
)
10
30
60
Chlorofil a; Chlorophyll a
Sacharoza; Sucrose
16,5 f
9,7 c
8,0 b
Glukoza; Glucose
12,8 e
10,3 cd
12,3 e
Fruktoza; Fructose
11,4 de
15,4 f
-
Maltoza; Maltose
9,3 bc
18,8 g
-
Sorbitol; Sorbitol
18,4 g
21,2 h
-
Mannitol; Mannitol
5,4 a
5,6 a
-
Chlorofil b; Chlorophyll b
Sacharoza; Sucrose
5,7 f
4,3 de
2,7 a
Glukoza; Glucose
5,2 f
4,1 c-e
4,5 e
Fruktoza; Fructose
4,1 c-e
5,4 f
-
Maltoza; Maltose
3,5 bc
7,2 g
-
Sorbitol; Sorbitol
7,0 g
7,2 g
-
Mannitol; Mannitol
3,8 b-d
3,2 ab
-
Chlorofil a+b; Chlorophyll a+b
Sacharoza; Sucrose
21,6 f
13,4 bc
10,3 a
Glukoza; Glucose
17,4 e
13,9 bc
16,4 de
Fruktoza; Fructose
15,1 cd
20,0 f
-
Maltoza; Maltose
12,5 b
25,3 g
-
Sorbitol; Sorbitol
24,8 g
27,4 h
-
Mannitol; Mannitol
8,9 a
8,4 a
-
ś
rednie oznaczone tą samą literą nie różnią się istotnie według testu t-Duncana przy p=0,05, oddzielnie dla
chlorofilu a, b i a+b; means with the same letters are not different according to t-Duncan’s test at p=0.05,
separately for chlorophyll a, b and a+b
L. Kawa-Miszczak i inni
90
WPŁYW RÓśNYCH WĘGLOWODANÓW NA WZROST ...
91
Rys. 4. Zawartość węglowodanów (w 100 g suchej masy), glukozy (A), fruktozy (B) i skrobi (C),
w pędach liliowca w zależności od rodzaju i stężenia cukru w pożywce MS; średnie
oznaczone tą samą literą nie różnią się istotnie według testu t-Duncana przy p=0,05,
oddzielnie dla A, B i C
Fig. 4.
The level of carbohydrates (in 100 g of dry matter), glucose (A), fructose (B) and
starch (C), in Hemerocallis shoots after theit growth on the MS medium with dif-
ferent types and concentrations of sugar; means with the same letters are not different
according to t-Duncan’s test at p=0.05, separately for A, B and C
Analizując zawartość chlorofilu w pędach liliowca stwierdzono, że w przeli-
czeniu na jednostkę świeżej masy poziom chlorofilu był najwyższy w pędach rosnących
na pożywce zawierającej sorbitol, a najniższy na pożywce z mannitolem (tab. 1).
Wysoką zawartością chlorofilu charakteryzowały się również pędy rosnące na
pożywkach z maltozą i fruktozą, przy wyższych stężeniach tych cukrów (30 g
⋅
dm
-3
).
Stężenie glukozy w pożywce w niewielkim stopniu wpływało na zawartość chlorofilu w
pędach. Natomiast w przypadku pędów rosnących na pożywce z sacharozą, przy 10
g
⋅
dm
-3
zawartość chlorofilu była najwyższa i obniżała się wraz ze wzrostem stężenia
tego cukru w pożywce (tab. 1). Inne wyniki uzyskano w badaniach dotyczących
wpływu stężenia sacharozy i soli azotowych w pożywce oraz temperatury prowadzenia
kultur na zawartość chlorofilu w pędach Clematis pitcheri
[K
AWA
-M
ISZCZAK
i in. 2009].
Zawartość chlorofilu była najwyższa w pędach rosnących w 20
°
C, niższa w 25
°
C,
a najniższa w 15
°
C. Obniżenie poziomu związków azotowych w pożywce do 50%
normalnego składu pożywki MS stymulowało akumulację chlorofilu w pędach
Clematis, natomiast wpływ stężenia sacharozy w pożywce był niewielki
[K
AWA
-
M
ISZCZAK
i in. 2009].
Rodzaj i stężenie cukru oraz soli azotowych dodanych do pożywki
mogą wpływać nie tylko na wzrost i rozwój roślin w warunkach in vitro, w tym na
zawartość chlorofilu i intensywność fotosyntezy, ale również na aklimatyzację roślin w
warunkach ex vitro
[L
EES
i in. 1991; G
UIDI
i in. 1998; J
AIN
i in. 1999; S
OTIROPOULOS
i in.
2005].
Wnioski

L. Kawa-Miszczak i inni
92
1.
Wzrost i rozwój liliowca in vitro zależał od rodzaju i stężenia cukru w pożywce.
2.
Wszystkie badane cukry dodane do pożywki w stężeniu 30 g
⋅
dm
-3
wpływały
korzystniej na wzrost pędów niż w pozostałych zastosowanych stężeniach.
3.
Sacharoza w stężeniu 30 g
⋅
dm
-3
w największym stopniu zwiększała współczynnik
namnażania, liczbę liści i świeżą masę pędów.
4.
Rodzaj i stężenie cukru w pożywce wpływało na zawartość węglowodanów w
pędach.
5.
Dodanie do pożywki alkoholi cukrowych, bez dodatkowego źródła węgla, nie
wpływało korzystnie na wzrost liliowca, ale pędy rosnące na pożywce
z sorbitolem zawierały najwięcej chlorofilu.
Literatura
B
ORKOWSKA
B.,
S
ZCZERBA
J.
1991.
Influence of different carbon sources on invertase
activity and growth of sour cherry (Prunus cerasus L.) shoot cultures. J. Exp. Bot. 42:
911-915.
B
RUINSMA
J.
1963.
The quantitative analysis of chlorophyll a and b in plant extracts.
Phytochem. Phytobiol. (Chlor. Metabol. Symp.) 2: 241-249.
C
ABOCHE
M.
1987.
Nitrogen, carbohydrate and zinc requirements for the efficient in-
duction of shoot morphogenesis from protoplast-derived colonies of Nicotiana plum-
baginifoli. Plant Cell Tiss. Org. Cult. 8: 197-206.
C
AO
X.,
F
ORDHAM
I.,
D
OUGLASS
L.,
H
AMMERSCHLAG
F. 2003.
Sucrose level influences
micropropagation and gene delivery into leaves from in vitro propagated highbush
blueberry shoots. Plant Cell Tiss. Org. Cult. 75: 255-259.
C
OFFIN
R.,
T
APER
C.D.,
C
HONG
C.
1976.
Sorbitol and sucrose as carbon source for callus
culture of some species of Rosaceae. Can. J. Bot. 54: 547-551.
D
EBNATH
S.C.
2005.
Effects of carbon source and concentration on development of
lingonberry (Vaccinium vitis-idaea L.) shoots cultivated in vitro from nodal explants. In
Vitro Cell. Dev. Biol. – Plant 41: 145-150.
G
ABRYSZEWSKA
E.,
K
AWA
-M
ISZCZAK
L.
2006.
Zawartość węglowodanów w kulturach
piwonii zielnej w fazie namnażania. XI Ogólnopolska Konferencja Kultur in vitro
i Biotechnologii Roślin „Kultury in vitro podstawą biotechnologii roślin”, Między-
zdroje, 6-9 września 2006, PRINT GROUP Daniel Krzanowski, Szczecin, Streszczenia:
36.
G
ABRYSZEWSKA
E.,
K
AWA
-M
ISZCZAK
L.,
W
ĘGRZYNOWICZ
-L
ESIAK
E.,
S
ANIEWSKI
M. 2008.
Wpływ temperatury oraz zróżnicowanego poziomu węgla i azotu w pożywce na wzrost i
rozwój Clematis pitcheri in vitro. Zesz. Probl. Post. Nauk Rol. 524: 73-81.
G
UIDI
L.,
L
OREFICE
G.,
P
ARDOSSI
A.,
M
ALORGIO
F.,
T
OGNONI
F.,
S
OLDATINI
G.F.
1998.
Growth and photosynthesis of Lycopersicon esculentum (L.) plants as affected by
nitrogen deficiency. Biol. Plant. 40: 235-244.
H
O
S.L.,
C
HAO
Y.C.,
T
ONG
W.F.,
Y
U
S.M.
2001.
Sugar coordinately and differentially
regulates growth- and stress-related gene expression via a complex signal transduction
network and multiple control mechanisms. Plant Physiol. 125: 877-890.
J
AIN
V.,
P
AL
M.,
L
AKKINENI
K.C.,
A
BROL
Y.P.
1999.
Photosynthetic characteristics in two
wheat genotypes as affected by nitrogen nutrition. Biol. Plant. 42: 217-222.
J
EANNIN
G.,
B
RONNER
R.,
H
AHNE
G.
1995.
Somatic embryogenesis and ogranogenesis

WPŁYW RÓśNYCH WĘGLOWODANÓW NA WZROST ...
93
induced on the immature zygotic embryo of sunflower (Helianthus annuus L.) cultivated
in vitro: role of the sugar. Plant Cell Rep. 15: 200-204.
K
AWA
-M
ISZCZAK
L.,
G
ABRYSZEWSKA
E.,
W
ĘGRZYNOWICZ
-L
ESIAK
E.,
S
ANIEWSKI
M. 2008.
Carbohydrate content in Clematis pitcher shoots cultured in vitro depending on tem-
perature and on the level of sucrose and nitrogen in the medium. Zesz. Probl. Post.
Nauk Rol. 524: 349-355.
K
AWA
-M
ISZCZAK
L.,
W
ĘGRZYNOWICZ
-L
ESIAK
E.,
G
ABRYSZEWSKA
E.,
S
ANIEWSKI
M. 2009.
Effect of sucrose and nitrogen level in the medium on chlorophyll and anthocyanin
content in Clematis pitcheri shoots cultured in vitro at different temperature. J. Fruit
Ornam. Plant Res. (w druku).
K
OCH
K.E.
1996.
Carbohydrate modulated gene expression in plants. Annu. Rev. Plant
Physiol. Plant Mol. Biol. 47: 509-540.
L
EES
R.P.,
E
VANS
E.H.,
N
ICHOLAS
J.R.
1991.
Photosynthesis in Clematis, ‘The President’,
during growth in vitro and subsequent in vivo acclimatization. J. Exp. Bot. 42: 605-610.
L
EMAŃSKA
U.,
G
ABRYSZEWSKA
E. 2000.
Rozmnażanie liliowca in vitro. Zesz. Nauk. ISK
7: 291-296.
M
URASHIGE
T.,
S
KOOG
F.
1962.
A revised medium for rapid growth and bio-assays with
tobacco tissue cultures. Physiol. Plant. 15: 473-497.
N
ETO
V.B.P.,
O
TONI
W.C.
2003.
Carbon sources and their osmotic potential in plant
tissue culture: does it matter? Sci. Hort. 97: 193-202.
S
OTIROPOULOS
T.E.,
M
OUHTARIDOU
G.N.,
T
HOMIDIS
T.,
T
SIRAKOGLOU
V.,
D
IMASSI
K.N.,
T
HERIOS
I.N.
2005.
Effects of different N-sources on growth, nutritional status, chlo-
rophyll content, and photosynthetic parameters of shoots of the apple rootstock MM 106
cultured in vitro. Biol. Plant. 49: 297-299.
S
TAIKIDOU
I.,
W
ATSON
S.,
H
ARVEY
B.M.R.,
S
ELBY
C.
2005.
Narcissus bulblet formation in
vitro: effect of carbohydrate type and osmolarity of the culture medium. Plant Cell Tiss.
Org. Cult. 80: 313-320.
T
REMBLAY
L.,
T
REMBLAY
F.M.
1995.
Maturation of black spruce somatic embryos: su-
crose hydrolysis and resulting osmotic pressure of the medium. Plant Cell Tiss. Org.
Cult. 42: 39-46.
U
EDA
Y.,
I
SHAYAMA
H.,
F
UKUI
M.,
N
ISHI
A.
1974.
Invertase in cultured Daucus carota
cells. Phytochemistry 13: 383-387.
Słowa kluczowe:
Hemerocallis, mikrorozmnażanie, akumulacja węglowodanów,
zawartość chlorofilu
Streszczenie
Badano wpływu różnych węglowodanów na wzrost i rozwój liliowca in vitro. Do
pożywki MS dodawano cytokininy oraz sacharozę, glukozę, fruktozę, maltozę i
alkoholowe pochodne cukrów, sorbitol i mannitol. Sacharozę i glukozę stosowano w
stężeniach 10, 30 i 60 g
⋅
dm
-3
, a pozostałe cukry w stężeniach 10 i 30 g
⋅
dm
-3
. Po 6
tygodniach wzrostu kultur w 20
°
C mierzono liczbę i długość pędów, liczbę liści, świeżą
masę pędów i kalusa oraz zawartość węglowodanów i chlorofilu w pędach. Wszystkie
badane cukry dodane do pożywki w stężeniu 30 g
⋅
dm
-3
wpływały korzystniej na wzrost
pędów niż w pozostałych zastosowanych stężeniach. Najwięcej nowych pędów z
największą liczbą liści i o najwyższej świeżej masie formowało się na eksplantatach
umieszczonych na pożywce zawierającej 30 g
⋅
dm
-3
sacharozy, ale zawartość chlorofilu

L. Kawa-Miszczak i inni
94
była wyższa w pędach rosnących na pożywce z 10 g
⋅
dm
-3
sacharozy. Im wyższe było
stężenie sacharozy w pożywce, tym pędy akumulowały więcej węglowodanów.
Niezależnie od rodzaju cukru w pożywce, pędy liliowca nie zawierały sacharozy. Pędy
rosnące na pożywce z sorbitolem akumulowały najwięcej skrobi i zawierały najwięcej
chlorofilu, ale wpływ sorbitolu na wzrost pędów był niewielki. Natomiast na pożywce
zawierającej mannitol obserwowano brak wzrostu pędów.
EFFECT OF VARIOUS SUGARS ON THE GROWTH
AND DEVELOPMENT OF Hemerocallis in vitro
Ludwika Kawa-Miszczak, Elżbieta Węgrzynowicz-Lesiak, Eleonora Gabryszewska,
Justyna Góraj, Marian Saniewski
Research Institute of Pomology and Floriculture, Skierniewice
Key words:
Hemerocallis, micropropagation, carbohydrate accumulation, chlo-
rophyll content
Summary
The effect of carbohydrate type on the growth and development of Hemerocallis
in vitro was studied. MS medium supplemented with cytokinins and sucrose, glucose,
fructose, maltose, sorbitol and mannitol was used. Sucrose and glucose were provided at
10, 30 and 60 g
⋅
dm
-3
and other sugars at 10 and 30 g
⋅
dm
-3
. After 6 weeks of culture at
20
°
C the number and length of shoots, number of leaves, fresh weight of shoots and
callus were measured. The content of carbohydrate and chlorophyll in shoots was also
determined. All sugars added at 30 g
⋅
dm
-3
had better effect on the shoot growth than at
other concentrations used. As compared to other sugar types and concentrations, on the
medium with 30 g
⋅
dm
-3
of sucrose, the highest stimulation of plantlets growth and
development occurred. The higher concentration of sucrose in the medium the lower
level of chlorophyll and the higher content of carbohydrates in plantlets. Regardless of
the sugar used no sucrose was found in shoots. The highest accumulation of starch in
shoots took place after the addition of sorbitol to the medium. Explants cultured on the
medium with sorbitol also accumulated the highest level of chlorophyll but sorbitol had
a small effect on shoots growth. No shoots growth was observed on the medium with
mannitol.
Dr Ludwika Kawa-Miszczak
Instytut Sadownictwa i Kwiaciarstwa im. Szczepana Pieniążka
ul. Pomologiczna 18
96-100 SKIERNIEWICE
e-mail: Ludwika.Miszczak@insad.pl
Wyszukiwarka
Podobne podstrony:
in vitro, studia rolnictwo, rok IV
Kultury in vitro roslin rozmnazanie klonalne
In vitro antitumor actions of extracts
In vitro truskawka id 212540 Nieznany
1 1 Podstawowe definicje; główne kierunki przemian rozwojowych roślinnych tkanek in vitro(1)
Życie ludzkie świętość czy zabawka nt in vitro
In vitro, Sem 1, TMR3
6 Hodowle komórek skóry w warunkach in vitro
Kościół katolicki wobec zapłodnienia In vitro, Etyka, Bioetyka
IN VITRO GRZECH CZY SZANSA
In vitro tulipan
in vitro 2
In vitro a współczesna cywilizacja, RODZINA
In vitro groźne, godność życia-in vitro
wyklad V in vitro
in vitro cd07w2
Dr Półtawska o in vitro, bioetyka
więcej podobnych podstron