
Imię i Nazwisko:
Wydział: Grupa: Numer
ewidencyjny:
Temat ćwiczenia:
Data wykonania:
Data zaliczenia:
1. Cel
ćwiczenia:
Zapoznanie się z metodami ustalania rzędowości reakcji oraz wyznaczania
stałej szybkości reakcji zasadowej hydrolizy octanu etylu.
2. Sposób wykonania:
1.Włączyć termostat i nastawić temperaturę około 293 K.
2.Do trzech kolb wprowadzić odpowiednio: 110 cm3 roztworu NaOH
o stężeniu 0,02 mol/dm
3
, 50 cm3 wody destylowanej i 50 cm
3
octanu etylu
o stężeniu 0,02 mol/dm
3
. Zlewki wstawić do termostatu. Po około 10-15 min
temperatura wyrównuje się.
3. Za pomocą pipety dodać 50 cm
3
roztworu NaOH o stężeniu 0,02 mol/dm
3
(termostatowego) do kolby z wodą. Po dokładnym wymieszaniu roztworu
zanurzyć w nim czujnik konduktometryczny, który uprzednio należy opłukać
wodą destylowaną i delikatnie otrząsnąć. Zmierzyć przewodność tego
roztworu, oznaczając ją przez .
4.Do drugiej kolby zawierającej 50 cm
3
octanu etylu o stężeniu 0,02 mol/dm
3
wprowadzamy pipetą 50 cm
3
roztworu NaOH o stężeniu 0,02 mol/dm
3
(termostatowanego) i notujemy dokładnie czas (liczenie czasu zaczynamy od
momentu zmieszania roztworów).
5.W kolbie z mieszaniną reakcyjną umieszczamy czujnik konduktometryczny i
odczytujemy wartość przewodności, początkowo co 5 min, a po upływie około
20 min co 10 min. Otrzymujemy w ten sposób kolejne wartości .
Przewodność mierzymy tak długo, aż praktycznie osiągnie ona wartość stałą,
którą przyjmujemy jako
.
3. Sposób opracowania wyników:
1.Wyniki zestawić w tabeli.
2.Ustalić rząd reakcji:
a) metodą algebraiczną - wstawiając wyniki pomiarów do równania na
stałą szybkości reakcji I rzęd :
u
2,303
lg
i II rzędu:
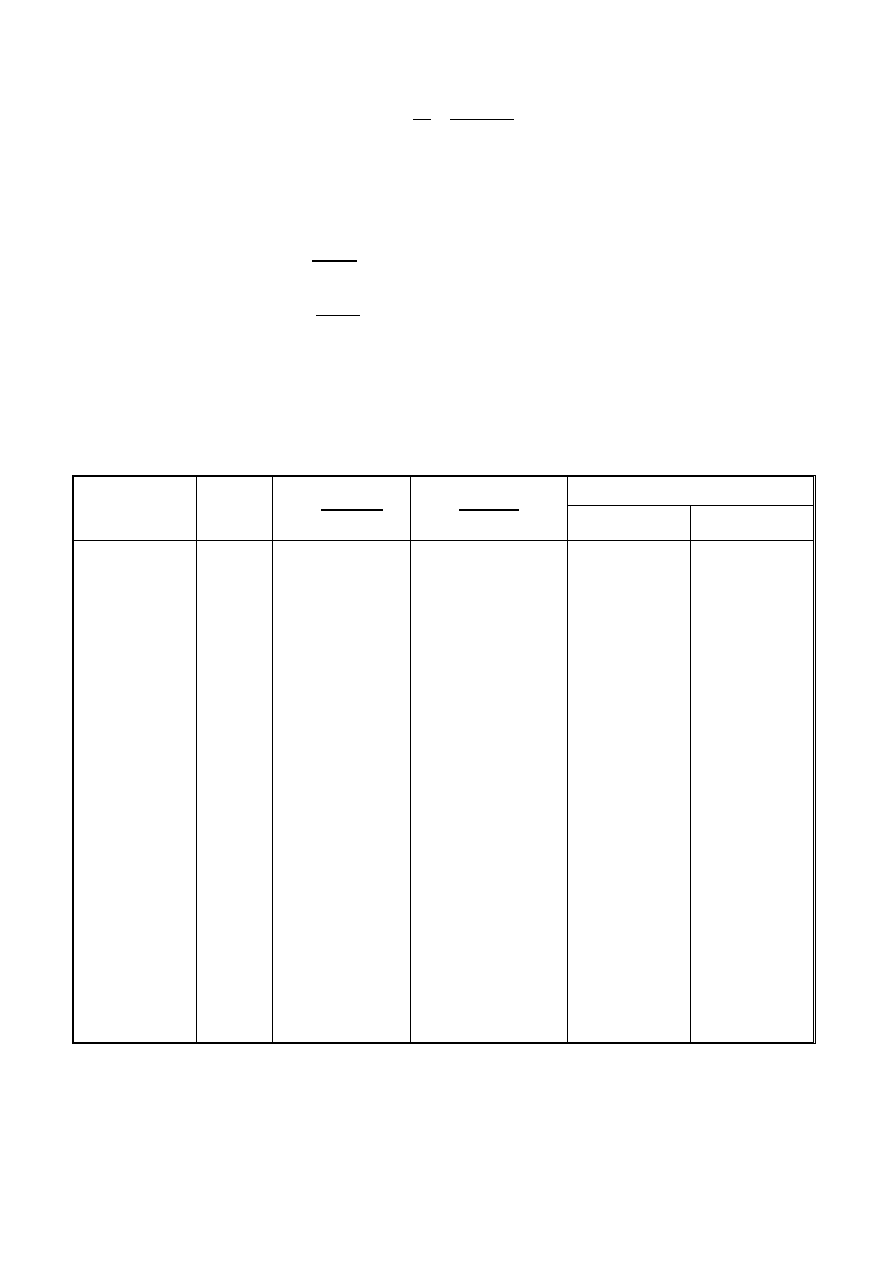
1
·
Sprawdzić, dla którego równania otrzymuje się stałą wartość k,
b) met ą graficzną, sporządzając wykres zależności:
od
od t (dla reakcji I rzędu)
i
od t (dla reakcji II rzędu)
Sprawdzić, która zależność daje wykres prostoliniowy.
Tabela - Kinetyka hydrolizy octanu etylu w roztworze zasadowym
Czas
hydrolizy
(s)
∞
∞
∞
Stałe szybkości dla reakcji
I rzędu II
rzędu

3.Wyznaczyć stałą szybkości reakcji:
a) metodą algebraiczną - korzystając z obliczeń w punkcie 2. (obliczyć
wartość średnią)
b) metodą graficzną - z tangensa kąta nachylenia właściwego wykresu
(ustalonego i sporządzonego w punkcie 2.).
4.Obliczyć czas połowicznej przemiany
reakcji zasadowej hydrolizy
octanu etylu z równania:
1
·
4. Obliczenia:

5. Wykresy

6. Wnioski:
Wyszukiwarka
Podobne podstrony:
SII 17 Technologie mobilne
17 Metodologia dyscyplin praktycznych na przykładzie teorii wychowania fizycznego
13 ZACHOWANIA ZDROWOTNE gr wtorek 17;00
prezentacja 17
Giddens środa 17 15
17 Tydzień zwykły, 17 wtorek
kinezyterapia 17 10, POSTAWA CIAŁA I KRYTERIA JEJ OCENY
Odwodnienie (dehydratatio) (17 12 2010 i 7 01 2011)
17 G11 H09 Składniki krwi wersja IHiT
CHF dr gębalska 17 01 03
CECHY STRUKTUR ORGANIZACYJNYCH PRACA GRUPOWA 17 KWIETNIA[1]
lec6a Geometric and Brightness Image Interpolation 17
Jama brzuszna c d 17 12 06 komentarz
Ekon Rozw W 17
TOiZ 17
więcej podobnych podstron