
ZWIĄZKI KOORDYNACYJNE
(ZWIĄZKI KOMPLEKSOWE)
Związki koordynacyjne są to związki zawierające wiązania koordynacyjne.
Składają się z atomu centralnego i otaczających go ligandów (będących
anionami lub
cząsteczkami obojętnymi).
Ligandy
połączone z atomem centralnym tworzą sferę koordynacyjną.
Liczba
ligandów związana z centralnym atomem metalu nosi nazwę liczby
koordynacyjnej.
Przykład: heksacyjanożelazian (II) potasu
K
4
[Fe(CN)
6
]
K
4
[Fe(CN)
6
]
↔ 4K
+
+ [Fe(CN)
6
]
4-
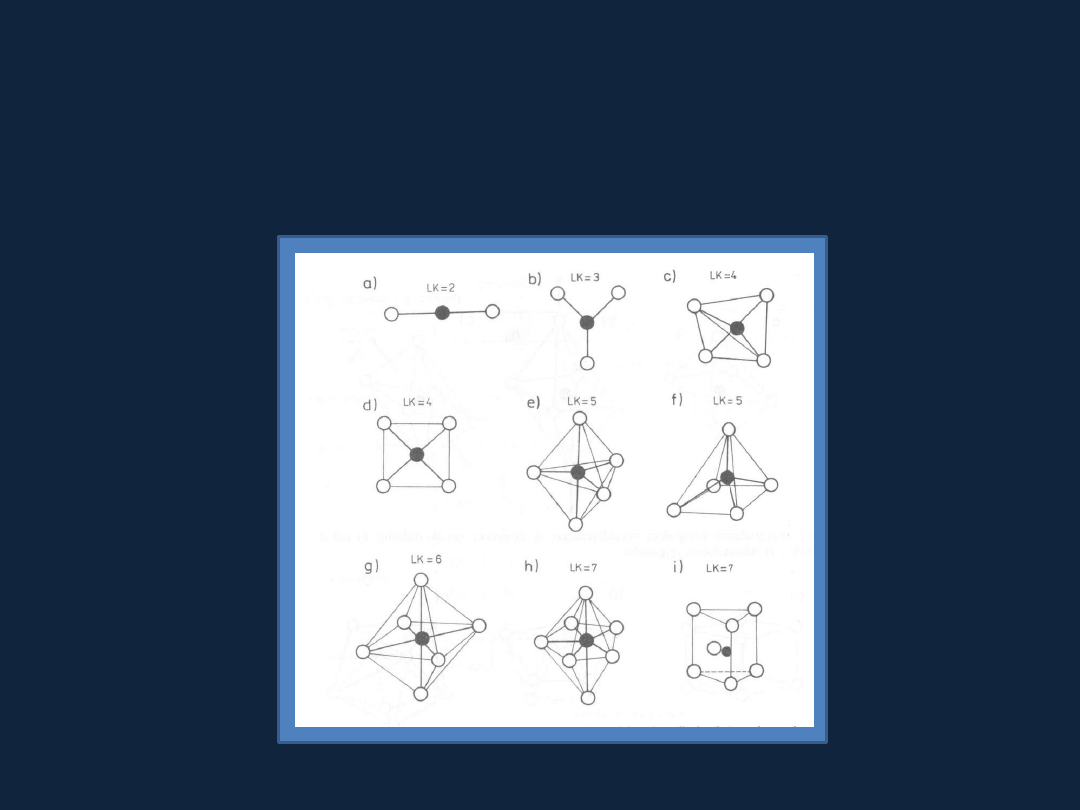
Liczba koordynacyjna a przestrzenne rozmieszczenie ligandów
w związkach kompleksowych
Rys. 15.1 str 465
Bielanski t. 2
Najczęściej liczba koordynacyjna przyjmuje wartości w granicach 2-8.

Nomenklatura związków koordynacyjnych
1.Pisząc pełną nazwę kompleksu wymieniamy najpierw nazwy ligandów,
a następnie nazwę atomu centralnego. We wzorach stosuje się porządek
odwrotny.
2. Stopień utlenienia centralnego atomu podaje się po nazwie kompleksu
umieszczając ją w nawiasie okrągłym, np. [Cu(NH
3
)
4
]
2+
- jon
tetraaminamiedzi (II).
3. W przypadku kompleksów noszących ładunek ujemny do nazwy atomu
centralnego dodaje się końcówkę –an.
4. Nazwy ligandów anionowych kończą się na –o. Dla wody przyjmuje się
nazwę akwa, amoniaku amina, tlenku węgla karbonyl.
5. Dla oznaczenia liczby ligandów używa się przedrostków di-, tri-, tetra-, itd.
Np.
K
3
[Fe(CN)
6
]
– heksacyjanożelazian (III) potasu
Fe(CO)
5
– pentakarbonylżelazo (0)

Przykłady nazw popularnych ligandów
Tablica 15.2
str 468
Bielanski t.2
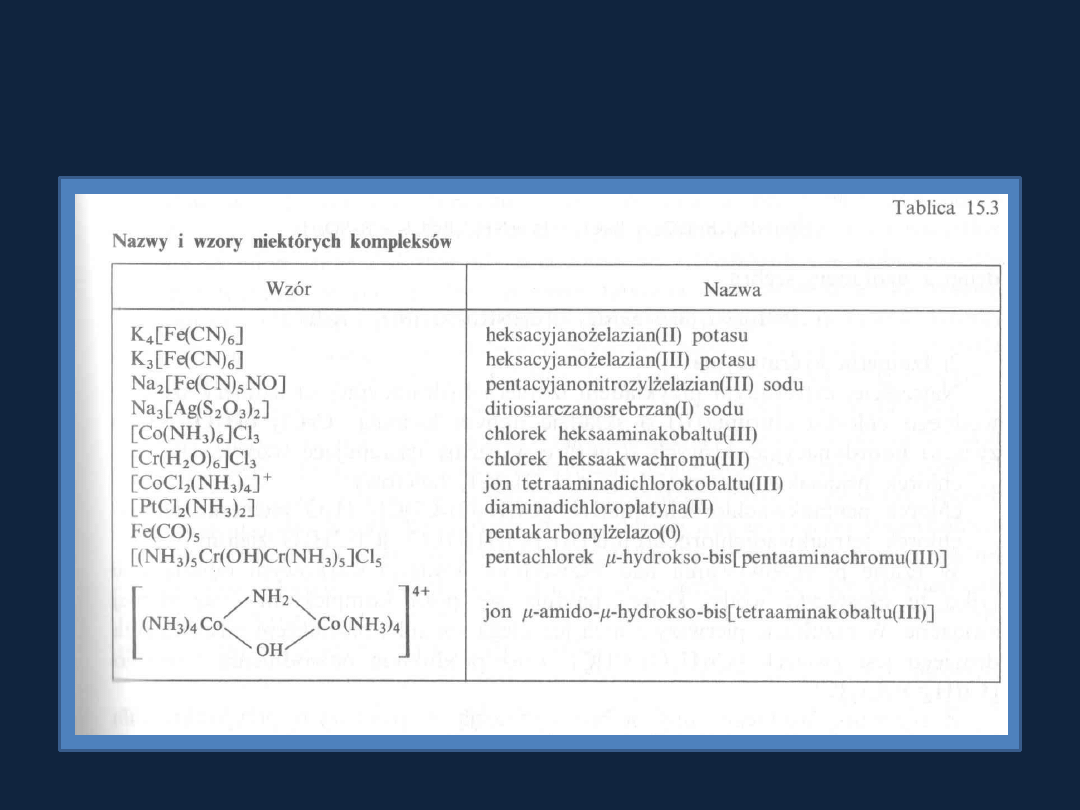
Nazwy i wzory wybranych związków koordynacyjnych
Tablica 15.3 str 469
Bielanski t.2
RODZAJE LIGANDÓW
Cząsteczki obojętne : NH
3
, H
2
O, CO
Jony ujemne: CN
-
, Cl
-
, OH
-
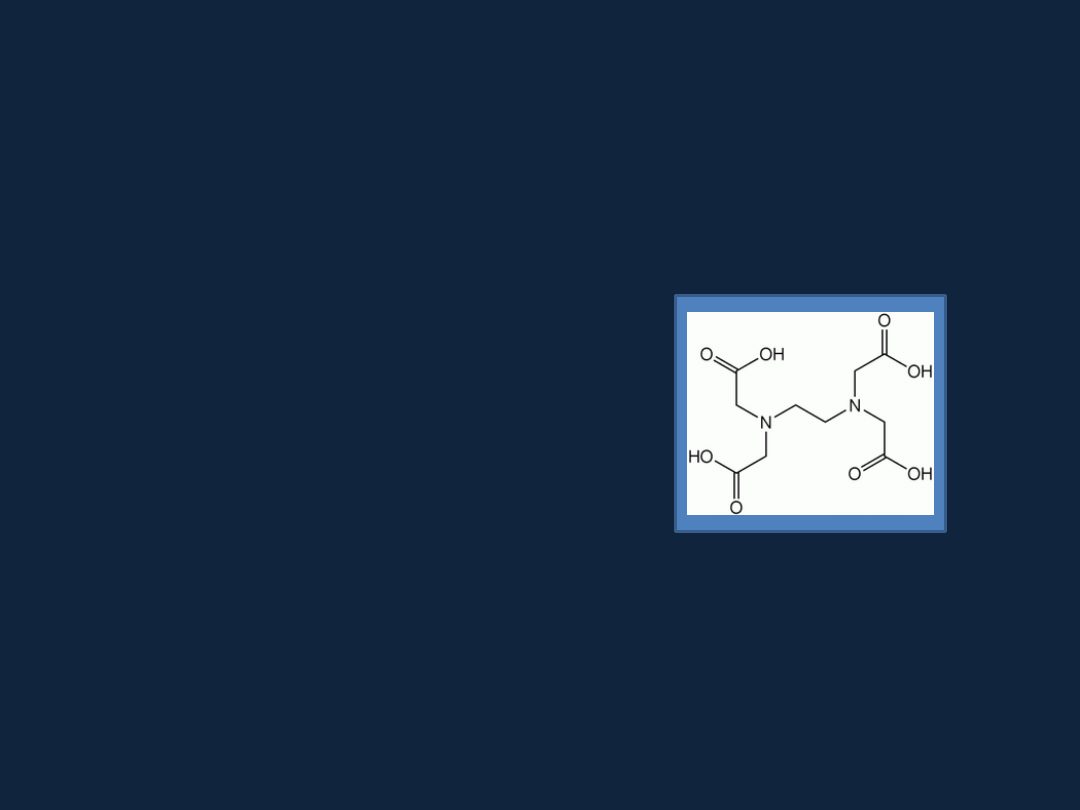
Ligandy chelatowe :
mogące zajmować więcej niż jedno miejsce wiążące w otoczeniu
atomu centralnego
np. kwas etylenodiaminotetraoctowy (kwas wersenowy) - EDTA
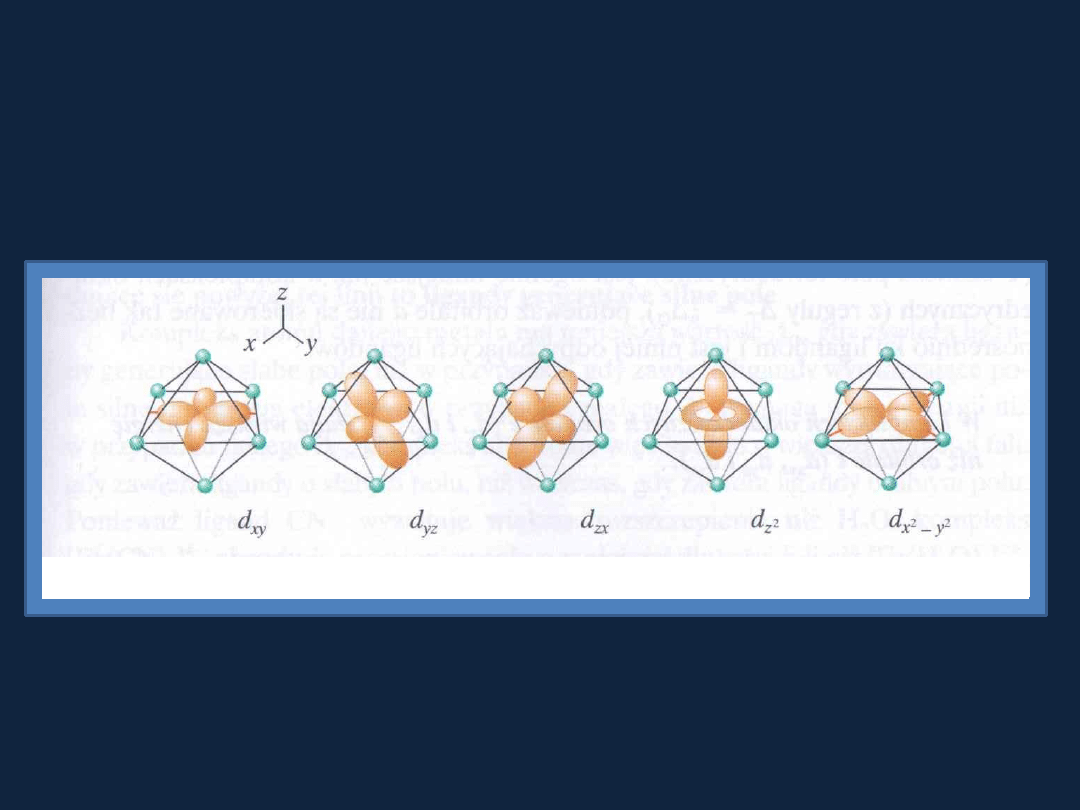
Podstawy teorii pola krystalicznego
Wpływ ligandów na elektrony d
Rys. 21.37 str. 997
Atkins t. 2
Kompleks oktaedryczny
– orbitale d
z2
i d
(x2-y2)
skierowane są ku ligandom
(większa energia elektronu).
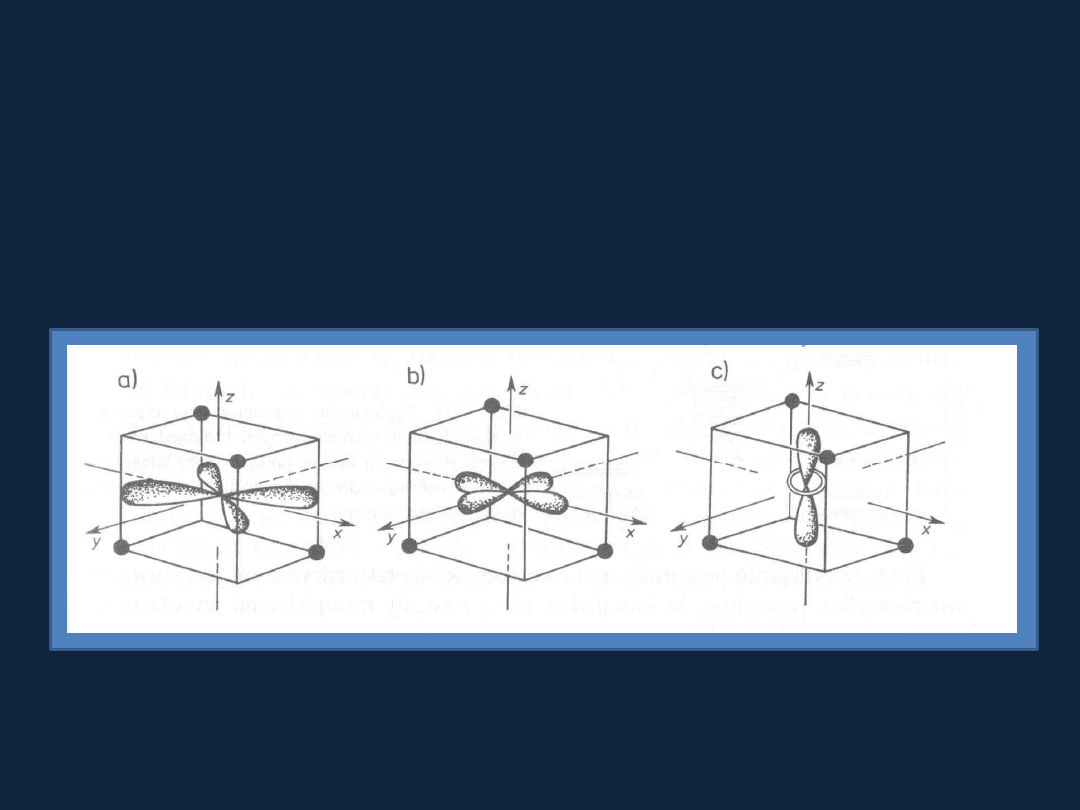
Kompleks tetraedryczny
Żaden z orbitali d nie jest skierowany bezpośrednio ku ligandom, jednak
orbitale d
xy
, d
xz
i d
yz
zbliżają się bardziej do do ligandów niż pozostałe
orbitale.
RYS. 15.15 str 497
Bielanski t.2
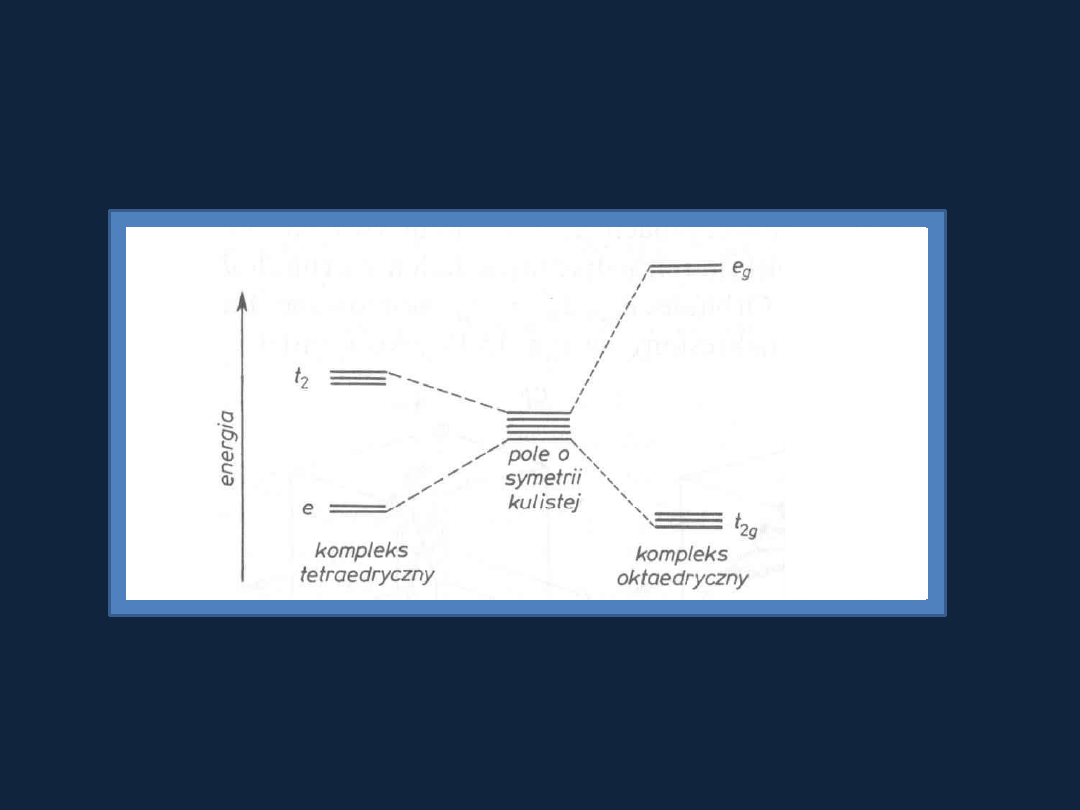
Porównanie poziomów energetycznych w kompleksach
tetraedrycznych i oktaedrycznych
Kompleksy wysoko- i niskospinowe
– przyczyny tworzenia.
RYS. 15.16 str 498
Bielanski t.2
Kompleks wysokospinowy
– maksymalna liczba niesparowanych elektronów,
ligandy generują słabe pole.
Kompleks niskospinowy
– minimalna liczba niesparowanych elektronów,
ligandy generują silne pole.
Wyszukiwarka
Podobne podstrony:
ChOiN II JG wyklad 6
ChOiN II JG wyklad 3
ChOiN II JG wyklad 2
ChOiN II JG wyklad 6
ChOiN I JG wyklad 6
ChOiN I JG wyklad 5
ChOiN I JG wyklad 2
ChOiN I JG wyklad 3
ChOiN I JG wyklad 1
ChOiN I JG wyklad 4
Syllabus -Negocjacje jako sposób, Prywatne, psychologia wsfiz, semestr II, Negocjacje wykłady
pytania testowe i chemia budowlana -zestaw3, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
Położnictwo wykład 4, Pielęgniarstwo, rok II, położnictwo, wykłady
BO II stacjonarne wykład nr 09
PRAWO FINANSOWE 29.04.2012, II rok, Wykłady, Prawo finansowe
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
DROGA I PRĘDKOŚĆ STATKU, Akademia Morska Szczecin, SEMESTR II, NAWIGACJA, wykłady II sem
więcej podobnych podstron