
CHEMIA OGÓLNA
I NIEORGANICZNA 1
dr hab. inż. Jacek GRAMS
Instytut Chemii Ogólnej i Ekologicznej
Wydział Chemiczny PŁ
Kierunki: Nanotechnologia, Ochrona Środowiska, Inżynieria Materiałowa

LITERATURA PODSTAWOWA
• L. Jones, P. Atkins, Chemia ogólna. Cząsteczki, materia,
reakcje, Wydawnictwo Naukowe PWN, Warszawa 2009,
tom I i II.
• A. Bielański, Chemia ogólna i nieorganiczna,
Wydawnictwo Naukowe PWN, Warszawa 1994, tom I, II
i III.
• J.D. Lee, Zwięzła chemia nieorganiczna, Wydawnictwo
Naukowe PWN, Warszawa 1994.

CHEMIA
Nauka zaliczana do grupy nauk
ścisłych
zajmująca
się
badaniem
substancji,
z
których
złożony
jest
wszechświat
i zmian,
którym one ulegają.
Chemia nieorganiczna,
chemia organiczna,
chemia analityczna,
chemia fizyczna,
chemia radiacyjna,
chemia kwantowa,
biochemia,
chemia polimerów,
krystalochemia,
toksykologia,
zielona chemia…
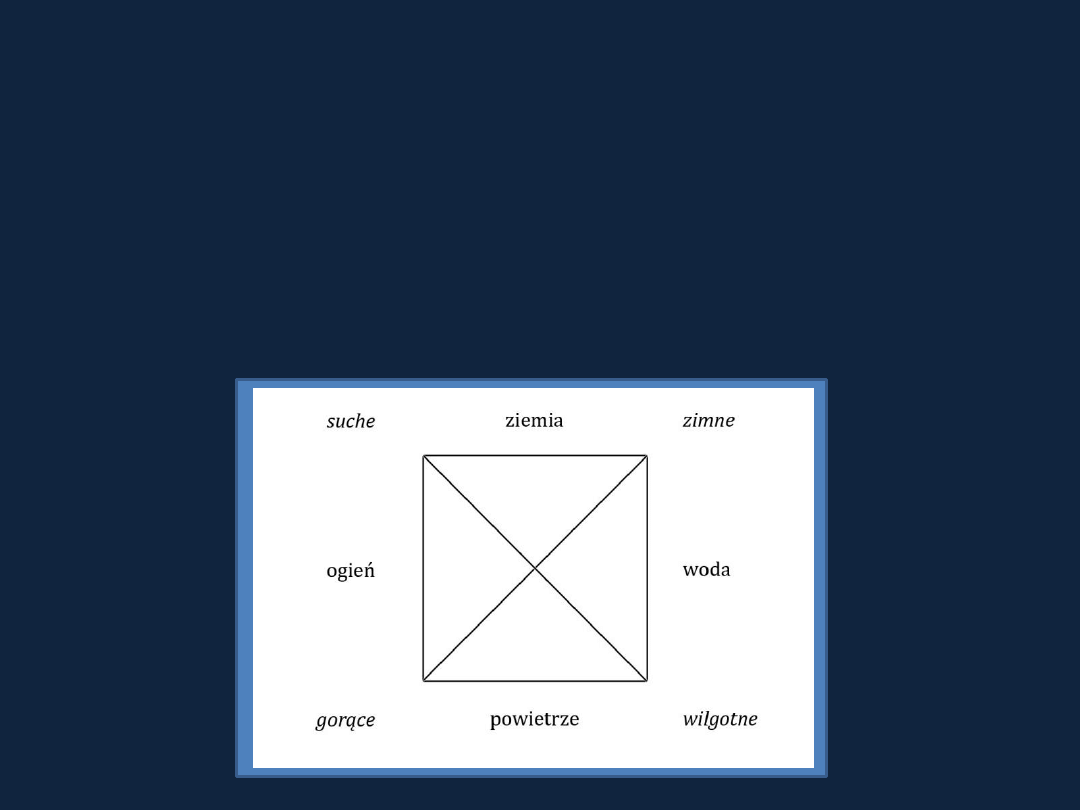
ROZWÓJ CHEMII
Starożytność
– początek rozwoju obróbki metali, ceramika, farby mineralne
Arystoteles ze Stagiry (384-322 p.n.e.)
– 4 elementy (ogień, woda, ziemia,
powietrze) + boska substancja
– eter

Alchemia
– poszukiwanie eliksiru życia, „kamienia
filozoficznego” umożliwiającego
transmutacje metali
i otrzymanie
złota
„Teoria flogistonowa”

Chemia
nowożytna
– nowe poglądy dotyczące
pierwiastków
i przemian chemicznych
Antoine Lavoisier (1743
– 1794) – wykazał, że procesy spalania
nie
polegają na wydzielaniu flogistonu, lecz są to reakcje
łączenia z tlenem, stworzył
tlenową teorię kwasów, wykazał
słuszność prawa zachowania masy, sprecyzował pojęcie
pierwiastka.
Został zgilotynowany w 1794 r. w okresie rewolucji francuskiej
ponieważ piastował za czasów króla Ludwika XVI stanowisko
generalnego
dzierżawcy podatków.

Odkrycia pierwiastków, układ okresowy
Koniec XVIII wieku
– znano około 40 pierwiastków
1827 rok
– 58 pierwiastków
Koniec XIX wieku
– Maria Skłodowska-Curie, Pierre Curie – odkrycie
Polonu i Radu
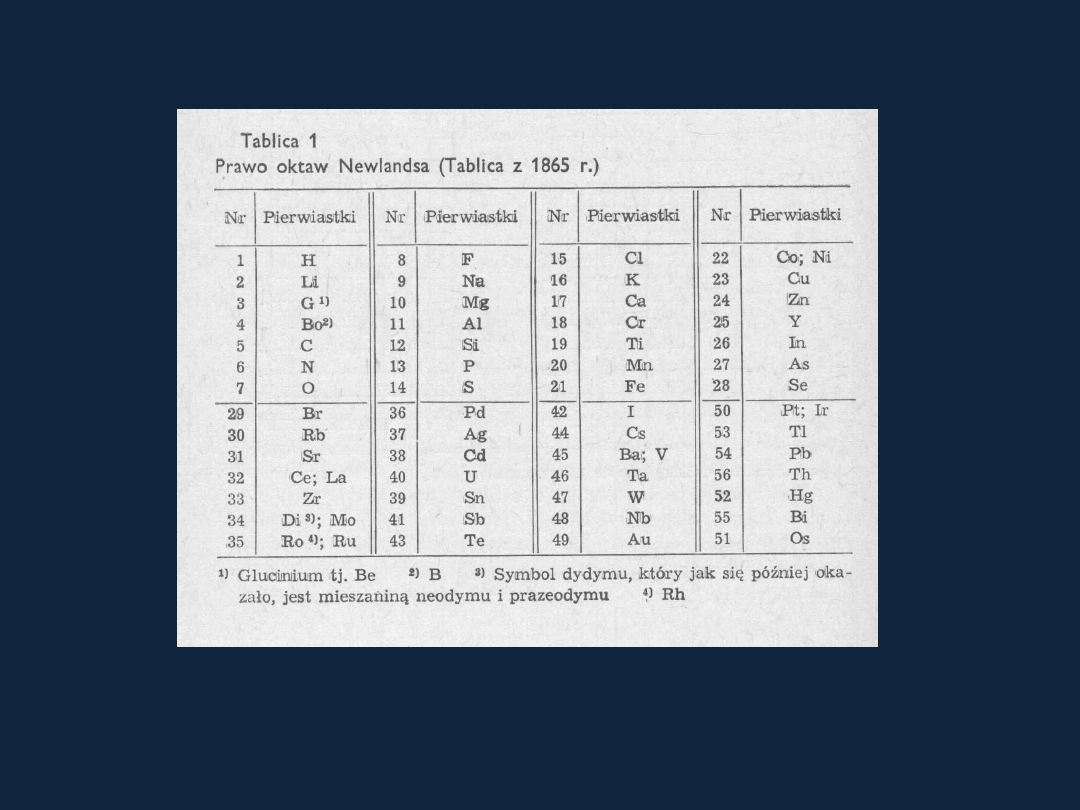
Prawo oktaw Newlandsa -1864 rok
SOŁONIEIWCZ Tablica
1 str 48
Pierwiastki
ułożone w kolejności ich wzrastających mas atomowych.
Zakładano, że podobne właściwości powtarzają się co 8 pierwiastek.
Zaobserwowano jednak
wyraźne odstępstwa od tego prawa.

Układ okresowy pierwiastków – Dimitrij Mendelejew – 1869 rok
SOŁONIEIWCZ Rys 7
str 55

-badaniem
właściwości substancji wynikających z ich budowy chemicznej
CZYM ZAJMUJĄ SIĘ CHEMICY?
-
syntezą substancji oraz badaniem ich przemian
zachodzących w wyniku reakcji chemicznych

Różnica między właściwościami chemicznymi i fizycznymi
Właściwości fizyczne
Właściwości chemiczne
Temperatura topnienia
Temperatura wrzenia
Ciśnienie pary
Barwa
Stan skupienia
Gęstośd
Rozpuszczalnośd
Twardośd
Reakcja z kwasami
Reakcja z zasadami
Reakcja z tlenem (spalanie)
Działanie utleniające
Działanie redukujące
Reakcja z innymi pierwiastkami
Rozkład na substancje prostsze
Korozja

PODSTAWOWE POJĘCIA I DEFINICJE
Materia
– wszystko co posiada masę i zajmuje objętość
Substancja chemiczna
– pojedyncza, czysta forma materii
Pierwiastek chemiczny
– substancja złożona z atomów jednego rodzaju
(każdy pierwiastek posiada swoją nazwę i symbol – np. wodór – H)
Związek chemiczny
–
substancja
składająca się z atomów dwu lub
więcej pierwiastków, jej skład pozostaje niezmienny (proporcje pomiędzy
ilością atomów różnych pierwiastków pozostają stałe)
Mieszanina
- kombinacja dwu lub
więcej substancji, przy czym zachowują
one
swoją
odrębność
chemiczną
(możliwe
jest
rozdzielenie
poszczególnych substancji tworzących mieszaninę za pomocą metod
fizycznych)

Różnice pomiędzy mieszaniną i związkiem chemicznym
Mieszanina
Związek chemiczny
Składniki można rozdzielid metodami
fizycznymi
Skład jest zmienny
Właściwości zależą od właściwości
składników
Składników nie można rozdzielid
metodami fizycznymi
Skład jest niezmienny
Właściwości nie zależą
od właściwości składników

TYPY MIESZANIN
Mieszanina
heterogeniczna
– skład niejednorodny (np. skała,
mieszanina soli i cukru, itp.)
Mieszanina homogeniczna
– skład jednorodny w całej objętości próbki
(np. cukier rozpuszczony w wodzie)
Mieszaniny homogeniczne
noszą nazwę
roztworów
.
Składnik roztworu
występujący
w
większej
ilości
to
rozpuszczalnik
,
w
którym
rozpuszczone
są pozostałe składniki.
Wyróżniamy
roztwory wodne, niewodne i
stałe
.
Proces odwrotny do rozpuszczania, to
krystalizacja
(substancja
rozpuszczona powoli wydziela
się z roztworu) lub
strącanie
(szybkie
wydzielanie, zazwyczaj powstaje drobny osad).
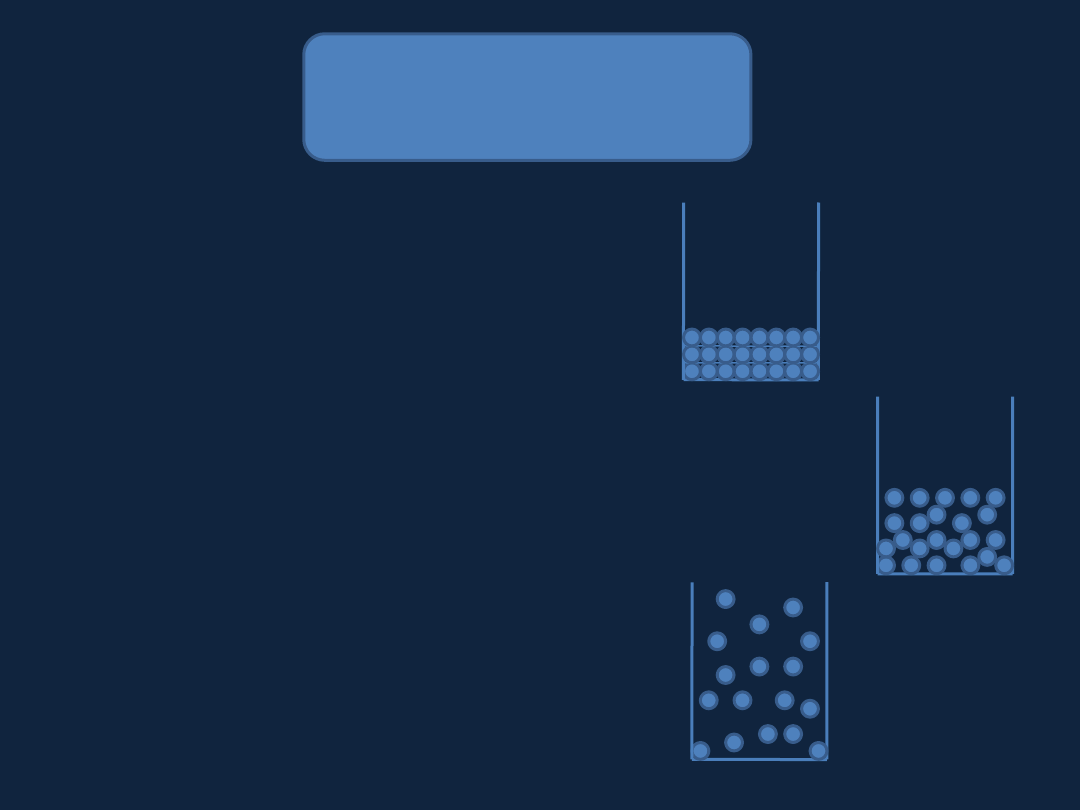
STANY SKUPIENIA
Ciało stałe
– sztywna forma materii
Ciecz
– płynna forma materii, znajduje dolną część
pojemnika, w którym się znajduje; ma wyraźnie określoną
powierzchnię
Gaz
– płynna forma materii, wypełnia
w całości pojemnik, w którym się znajduje

ATOM
– najmniejsza cząstka pierwiastka jaka może istnieć
zachowując przy tym właściwości danego pierwiastka
Wodór - H, Chlor - Cl
CZĄSTECZKA
– to określona, odrębna, obojętna elektrycznie grupa
powiązanych ze sobą atomów
Kwas solny - HCl
JON
– dodatnio (kation) lub ujemnie (anion) naładowany atom lub
grupa
powiązanych ze sobą atomów
H
+
, Cl
-
Cząsteczka
Cząstka
K-Cl
Jak jest różnica pomiędzy
cząstką, a cząsteczką?

MOL
– ilość materii zawierająca tyle cząstek (atomów, cząsteczek,
jonów, drobin) ile atomów znajduje się w 12g izotopu węgla
12
C)
Masa jednego atomu
węgla
12
C
– 1,99265 x 10
-23
g
Liczba cząstek w 1 molu materii = 12g/1,99265 x10
-23
g = 6,02x10
23
(liczba Avogadro)
Przykład:
He
1 mol - 6,02 x 10
23
atomów – objętość 22,4 dm
3
– masa molowa 4 g
(22,4 dm
3
-
objętość gazu w warunkach normalnych)
H
2
1 mol - 6,02 x 10
23
cząsteczek – objętość 22,4 dm
3
– masa molowa 2 g
Ar
1 mol - 6,02 x 10
23
atomów – objętość 22,4 dm
3
– masa molowa 40 g
NaCl
1 mol - 6,02 x 10
23
cząsteczek – ciało stałe – masa molowa 58,5 g
(warunki normalne
– ciśnienie 1 atm = 1013,25 hPa, temperatura – 273,15 K = 0°C)

Podstawowe jednostki układu SI
Nazwa
Jednostka
Wielkość
fizyczna
metr
m
długość
kilogram
kg
masa
sekunda
s
czas
amper
A
natężenie prądu
elektrycznego
kelwin
K
temperatura
kandela
cd
światłość
mol
mol
liczność materii
Temperatura - stopnie Celsjusza i Kelwina
273,15 K = 0°C,
373,15 K = 100°C
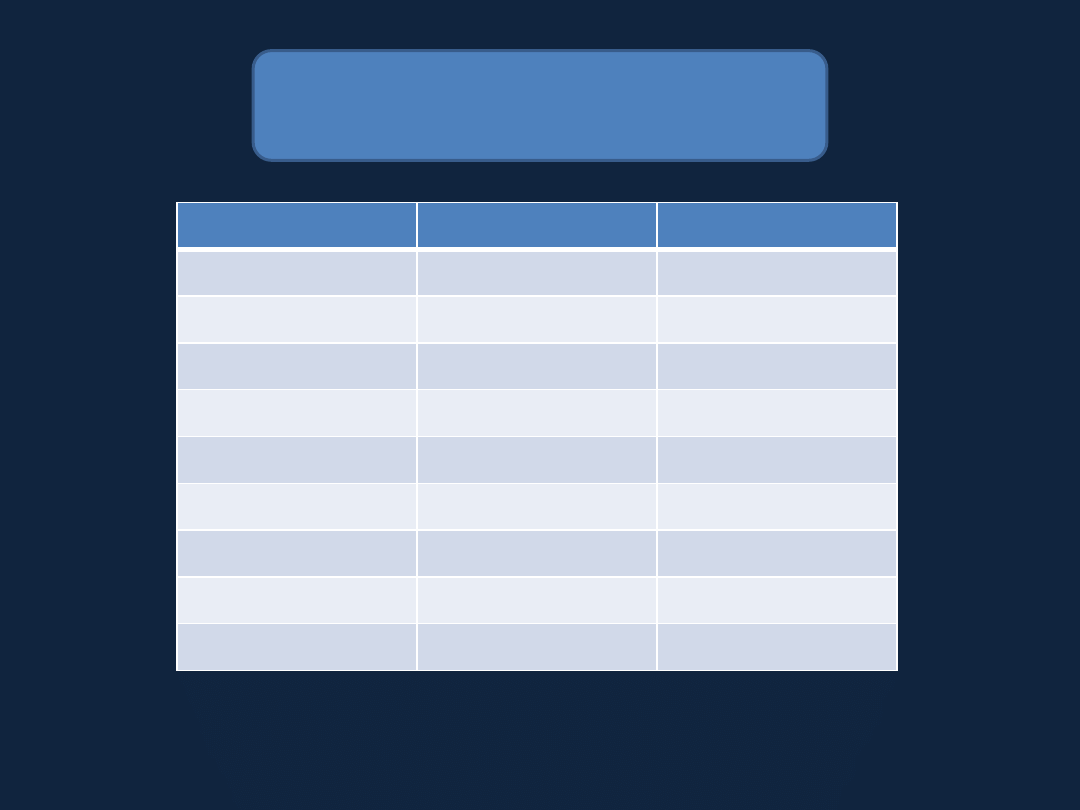
Przedrostki jednostek SI
Przedrostek
Nazwa
Znaczenie
G
giga
10
9
M
mega
10
6
k
kilo
10
3
d
decy
10
-1
c
centy
10
-2
m
mili
10
-3
μ
mikro
10
-6
n
nano
10
-9
p
piko
10
-12
Angstrem
– 10
-10
m

PODSTAWY
NOMENKLATURY
I SYMBOLIKI
ZWIĄZKÓW CHEMICZNYCH
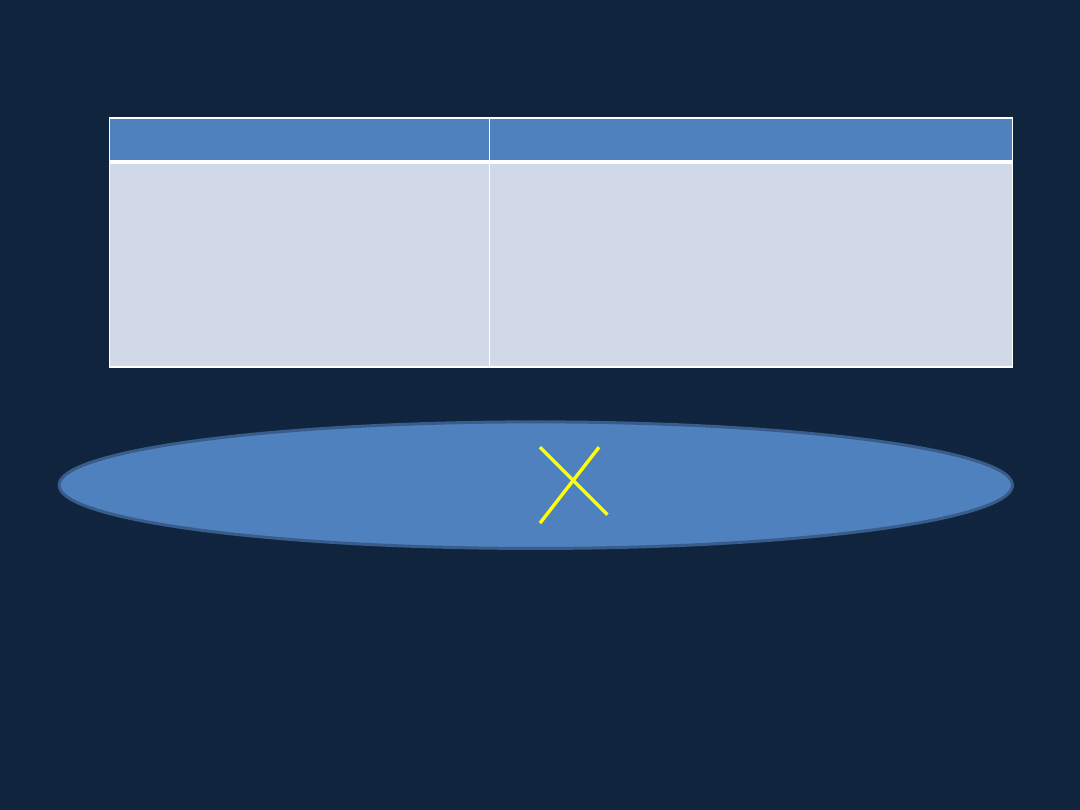
WZORY ZWIĄZKÓW CHEMICZNYCH
Pierwiastki
Związki chemiczne
H
– wodór
C
– węgiel
O
–tlen
Na
– sód
Fe -
żelazo
Au
– złoto
CaO
– tlenek wapnia
AgNO
3
– azotan (V) srebra
KBr
– bromek potasu
H
2
SO
4
– kwas siarkowy (VI)
Ni(OH)
2
- wodorotlenek niklu
Fe(NO
3
)
3
–azotan (V) żelaza (III)
Dlaczego H
2
O, a nie O
2
H? CaH
2
i HCl???
Zapis rozpoczynamy od symbolu atomu o mniejszej elektroujemności!!!
Przy
większej liczbie pierwiastków może decydować sposób powiązania atomów
w
cząsteczce, np.: HOCN (kwas cyjanowy), HNCO (kwas izocyjanowy).

NAZEWNICTWO TLENKÓW,
NADTLENKÓW I PONADTLENKÓW
Zalecane jest stosowanie nazewnictwa wg
systemu Stocka
.
W związku z tym, aby nadad nazwę tlenkowi używamy słowa „tlenek” oraz
podajemy nazwę pierwiastka tworzącego dany tlenek (jeśli to konieczne wraz
z wartościowością w nawiasie okrągłym).
Wzór tlenku
Nazwa
Fe
2
O
3
tlenek żelaza (III)
FeO
tlenek
żelaza (II)
CuO
tlenek miedzi (II)
Al
2
O
3
tlenek glinu
CaO
tlenek wapnia
SO
3
tlenek siarki (VI)
P
2
O
5
tlenek fosforu (V)
K
2
O
tlenek potasu
Cr
2
O
3
tlenek chromu (III)
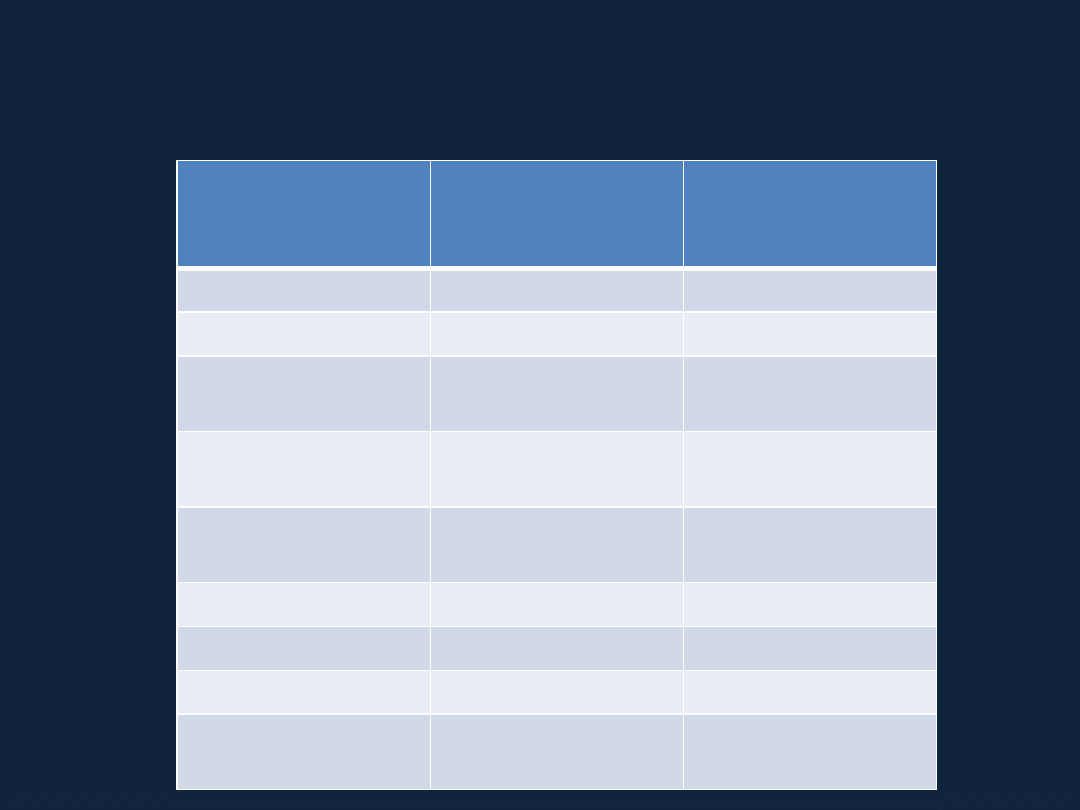
W
związku ze zmianami zasad nazewnictwa związków chemicznych, które
miały miejsce w przeszłości możemy również spotkać się w niektórych
opracowaniach z innymi systemami nomenklatury np.:
Wzór tlenku
Nazwa
obowiązująca
(system Stocka)
Przykład nazw
wg innych systemów
N
2
O
tlenek azotu (I)
podtlenek azotu
NO
tlenek azotu (II)
tlenek azotu
N
2
O
3
tlenek azotu (III)
trójtlenek azotu,
tritlenek diazotu
NO
2
tlenek azotu (IV)
dwutlenek azotu,
ditlenek azotu
N
2
O
5
tlenek azotu (V)
Pięciotlenek azotu,
pentatlenek diazotu
CrO
tlenek chromu (II)
tlenek chromawy
Cr
2
O
3
tlenek chromu (III)
tlenek chromowy
CO
tlenek węgla (II)
tlenek węgla
CO
2
tlenek węgla (IV)
dwutlenek węgla,
ditlenek węgla

NAZEWNICTWO NADTLENKÓW I PONADTLENKÓW
Wzór
Nazwa
nadtlenki
H
2
O
2
nadtlenek wodoru
K
2
O
2
nadtlenek potasu
BaO
2
nadtlenek baru
ZnO
2
nadtlenek cynku
ponadtlenki
KO
2
ponadtlenek potasu
NaO
2
ponadtlenek sodu

NAZEWNICTWO WODORKÓW
Wzór
Nazwa
KH
wodorek potasu
NaH
wodorek sodu
CaH
2
wodorek wapnia
NH
3
azan (amoniak, wodorek azotu)
PH
3
fosfan
H
2
S
sulfan (siarkowodór)
HF
fluorek wodoru
HCl
chlorek wodoru (chlorowodór,
kwas solny)
HBr
bromek wodoru
HI
jodek wodoru
CH
4
metan
Zasady nazewnictwa:
-
dla wodorków pierwiastków grup
1-
15 stosuje się system
dwuwyrazowy, np. wodorek
potasu,
- dodanie do rdzenia nazwy
pierwiastka przyrostka
–an, np.
fosfan,
-
grupa 17 układu okresowego
system dwuwyrazowy, ale na
początku nazwa pierwiastka,
drugi człon – wodór.

NAZEWNICTWO KWASÓW
Nazwy
kwasów składają się z wyrazu „kwas” oraz
przymiotnika
określającego
pierwiastek
wchodzący w skład cząsteczki kwasu (np. kwas
węglowy).
Jeżeli dany pierwiastek tworzy kilka kwasów, to
na
końcu nazwy w nawiasie okrągłym podaje się
stopień
utlenienia
atomu
tego
pierwiastka
(np. kwas azotowy (V).
Różne kwasy danego pierwiastka, w których jego
atomy
występują
na
tym
samym
stopniu
utlenienia
rozróżnia się za pomocą przedrostków
orto-, meta- (np. kwas ortokrzemowy).
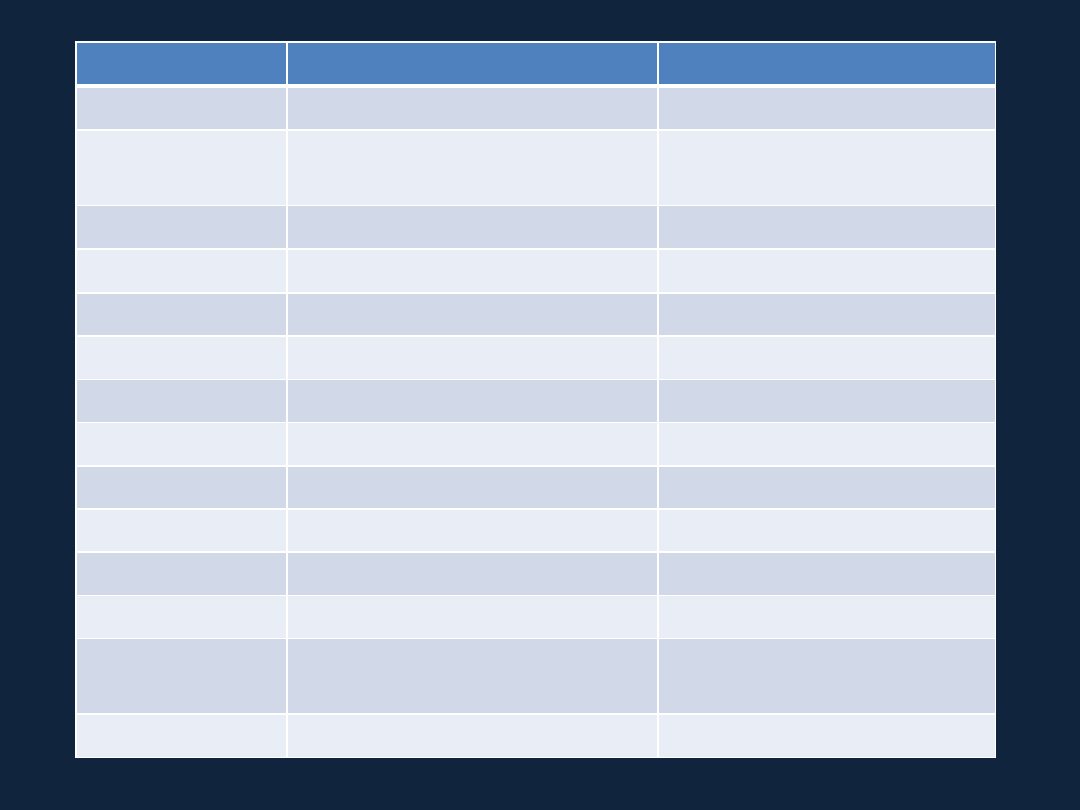
Wzór kwasu
Nazwa obowiązująca
Nazwa tradycyjna
HF
kwas fluorowodorowy
kwas fluorowodorowy
HCl
kwas solny
kwas solny, kwas
chlorowodorowy
H
2
S
kwas siarkowodorowy
kwas siarkowodorowy
HCN
kwas cyjanowodorowy
kwas cyjanowodorowy
HNO
2
kwas azotowy (III)
kwas azotawy
HNO
3
kwas azotowy (V)
kwas azotowy
HClO
kwas chlorowy (I)
kwas podchlorawy
HClO
2
kwas chlorowy (III)
kwas chlorawy
HClO
3
kwas chlorowy (V)
kwas chlorowy
HClO
4
kwas chlorowy (VII)
kwas nadchlorowy
H
2
SiO
3
kwas metakrzemowy
kwas krzemowy
H
4
SiO
4
kwas ortokrzemowy
H
3
PO
4
kwas ortofosforowy (V)
kwas fosforowy, kwas
ortofosforowy
HPO
3
kwas metafosforowy (V)
kwas metafosforowy
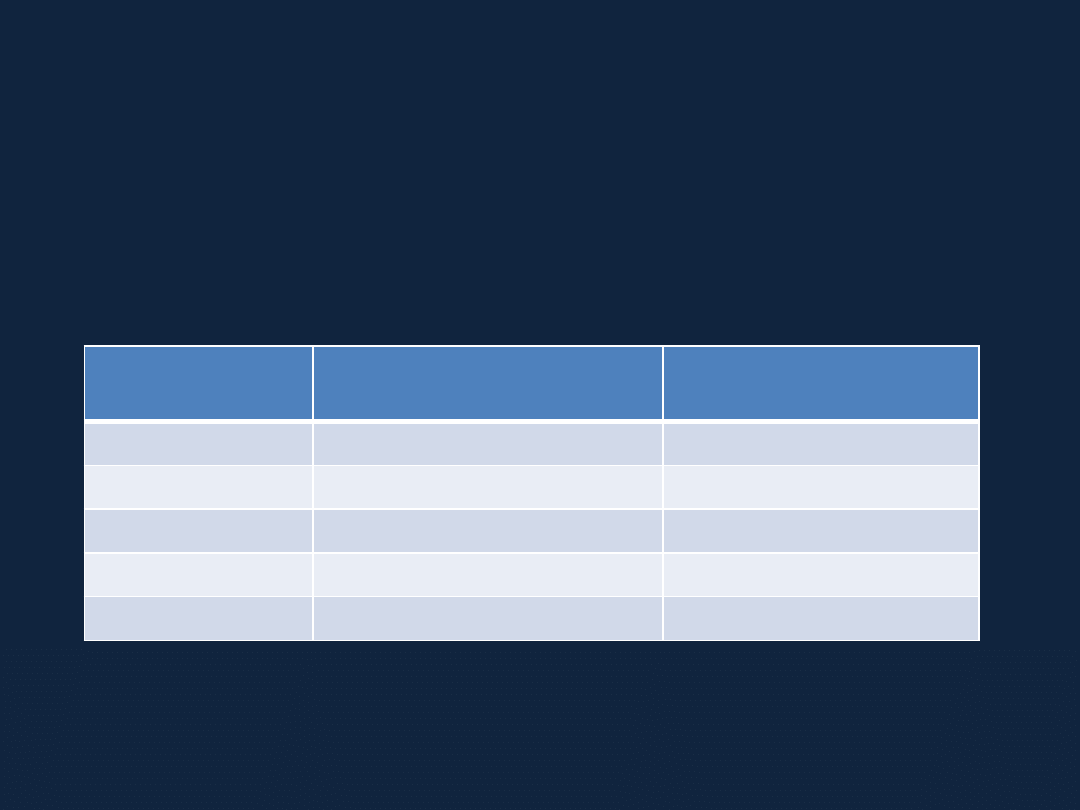
NAZEWNICTWO WODOROTLENKÓW
Nadając nazwę wodorotlenkowi używamy słowa „wodorotlenek” oraz
podajemy
nazwę pierwiastka tworzącego dany związek (jeśli to konieczne
wraz z
wartościowością w nawiasie okrągłym).
Wzór tlenku
Nazwa obowiązująca
(system Stocka)
Przykład nazw
tradycyjnych
KOH
wodorotlenek potasu
wodorotlenek potasu
NaOH
wodorotlenek sodu
wodorotlenek sodu
Ca(OH)
2
wodorotlenek wapnia
wodorotlenek wapnia
Fe(OH)
2
wodorotlenek żelaza (II)
wodorotlenek żelazawy
Fe(OH)
3
wodorotlenek żelaza (III)
wodorotlenek żelazowy
Szczególny rodzaj wodorotlenków to oksowodorotlenki (hydroksotlenki)
– EO
n
(OH)
m
, np. minerały limonit FeOOH, lanthinit UO
2
(OH)
2
.

NAZEWNICTWO SOLI
Nazwy soli prostych
składają się z dwóch wyrazów. Pierwszy z nich
określa resztę kwasową (końcówki: -an w przypadku soli tlenowych i –ek
beztlenowych). Drugi opisuje kation.
Wzór
Nazwa
Na
2
SO
4
siarczan (VI) sodu
Cu(NO
3
)
2
azotan (V) miedzi (II)
NH
4
Cl
chlorek amonu
Fe
2
S
3
siarczek żelaza (III)
K
2
MnO
4
manganian (VI) potasu
KJ
jodek potasu
Fe(ClO
3
)
3
chloran (V) żelaza (III)
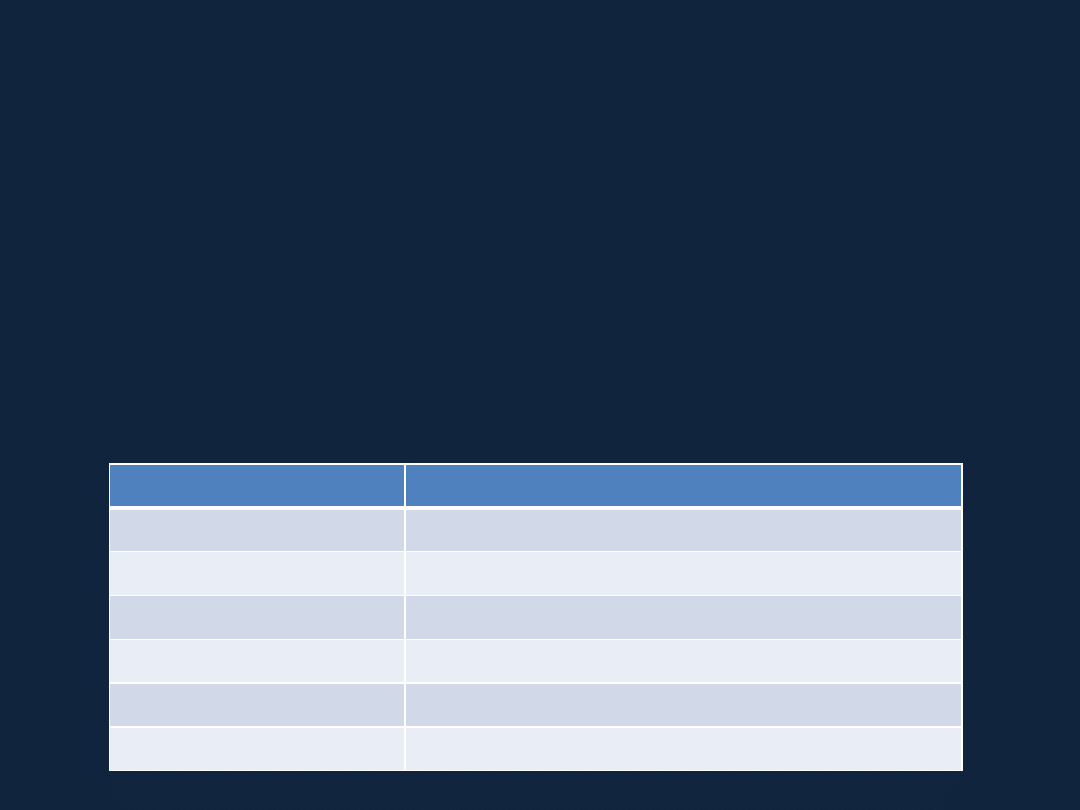
WODROROSOLE
W tym przypadku przed
nazwą reszty kwasowej (anionu) pojawiają się
przedrostki wodoro-, diwodoro- itd. (przedrostki di-, tri-
oznaczają liczbę
atomów wodoru, które pozostały w reszcie kwasowej.
HYDROKSOSOLE
Obok tradycyjnego
układu przed nazwą kationu pojawia się wyraz
wodorotlenek (z odpowiednim liczebnikiem
określającym liczbę
grup
wodorotlenowych) - np. dibromek wodorotlenek
żelaza.
Wzór
Nazwa
Na
2
HPO
4
wodorofosforan (V) sodu
NaH
2
PO
4
diwodorofosforan (V) sodu
NH
4
HCO
3
wodorowęglan (IV) amonu
Mg(OH)Cl
chlorek wodorotlenek magnezu
Al(OH)Br
2
bromek wodorotlenek glinu
Fe(OH)
2
NO
3
azotan (V) diwodorotlenek żelaza (III)

OKSOSOLE
Np. VOSO
4
– (traktowane często jako połączenie soli i tlenku) – nazwa
siarczan (VI) tlenek wanadu (IV)
SOLE
ZŁOŻONE I UWODNIONE
Nazwy soli
złożonych (zawierających kilka różnych kationów lub anionów)
tworzy
się podając nazwy jonów w kolejności alfabetycznej (nazwy
kationów rozdziela się łącznikiem „i”, a nazwy anionów podaje się bez
łącznika).
Np. MgNH
4
PO
4
– fosforan (V) amonu i magnezu.
Wzór
Nazwa
AlK(SO
4
)
2
siarczan (VI) glinu i potasu
Ca
5
F(PO
4
)
3
fluorek fosforan (V) wapnia
KNaCO
3
węglan potasu i sodu
CrNH
4
(SO
4
)
2
siarczan (VI) amonu i chromu (II)

Sole uwodnione
(zawierające wodę krystalizacyjną) nazywamy hydratami.
Na
początku nazwy podaje się nazwę „hydrat” wraz z przedrostkiem
określającym liczbę cząsteczek wody.
Wzór
Nazwa
CaSO
3
∙2H
2
O
2 hydrat siarczanu (IV) wapnia
MgNH
4
PO
4
∙6H
2
O
6 hydrat fosforanu (V) amonu i magnezu
Na
2
CO
3
∙10H
2
O
10 hydrat węglanu sodu

ZAPIS RÓWNAŃ REAKCJI CHEMICZNYCH
substraty → produkty
substrat 1 + substrat 2 → produkt 3
substrat 4 + substrat 5 → produkt 6 + produkt 7
wodór + tlen → woda
sód + woda → wodorotlenek sodu +wodór
H
2
+ O
2
→ H
2
O
Na + H
2
O → NaOH + H
2
Równanie szkieletowe
– określa tylko rodzaj produktów i substratów

Zbilansowane równanie chemiczne
-
po obu stronach równania
występuje jednakowa liczba atomów tego samego pierwiastka
2H
2
+ O
2
→ 2H
2
O
2Na + 2H
2
O → 2NaOH + H
2
Współczynniki przed wzorami chemicznymi reagentów noszą
nazwę współczynników stechiometrycznych.
Równanie chemiczne pokazuje przegrupowania atomów
w reakcji chemicznej.
Współczynniki stechiometryczne określają względne liczby moli
substratów i produktów reakcji.

Do równania chemicznego można również wprowadzić
dodatkową informację na temat stanu skupienia reagentów.
2Na(s) + 2H
2
O(c) → 2NaOH(aq) + H
2
(g)
gdzie: (s)
– stały, (c) – ciekły, (g) – gazowy, (aq) – roztwór ciekły

RÓWNANIA JONOWE
AgNO
3
(aq) + NaCl(aq
) → AgCl(s) + NaNO
3
(aq)
Pełne równanie jonowe
Ag
+
(aq) + NO
3
-
(aq) + Na
+
(aq) + Cl
-
(ag) → AgCl(s) + Na
+
(aq) + NO
3
-
(aq)
Skrócone równanie jonowe
Ag
+
(aq) + NO
3
-
(aq) + Na
+
(aq) + Cl
-
(ag) → AgCl(s) + Na
+
(aq) + NO
3
-
(aq)
Ag
+
(aq) + + Cl
-
(ag) → AgCl(s)
Pełne równanie jonowe uwzględnia wszystkie jony obecne w roztworze.
Skrócone równanie jonowe powstaje z pełnego równania po
wyeliminowaniu
jonów nie uczestniczących w reakcji.

REAKCJE CHEMICZNE
Procesy w których rozrywają się i powstają wiązania chemiczne.
TYPY REAKCJI
Reakcja syntezy
C + O
2
→ CO
2
Reakcja analizy
CaCO
3
→ CaO + CO
2
Reakcja wymiany
a) pojedynczej
8Al + 3Fe
3
O
4
→ 4Al
2
O
3
+ 9Fe
b) podwójnej
FeS
+ 2HCl → FeCl
2
+ H
2
S

Podział ze względu na rodzaj efektu reakcji:
- reakcje egzotermiczne
- reakcje endotermiczne
Reakcja utlenienia
– redukcji (redoks)
Następuje zmiana stopnia utlenienia pierwiastków podczas
reakcji.
2H
2
+ O
2
→ 2H
2
O
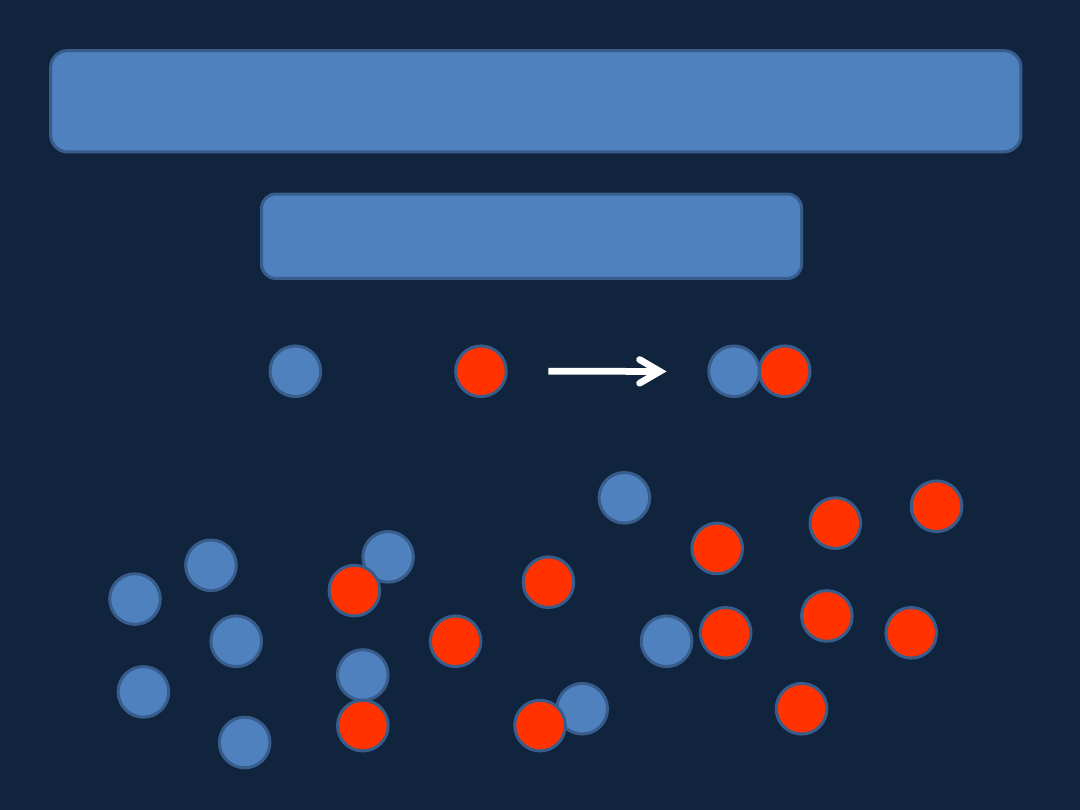
REAKCJA CHEMICZNA
– jak zachodzi???
Teoria zderzeń aktywnych
+
ENERGIA AKTYWACJI
Wielkość charakteryzująca barierę energetyczną, którą muszą
pokonać reagujące indywidua chemiczne, aby doszło do reakcji
chemicznej.
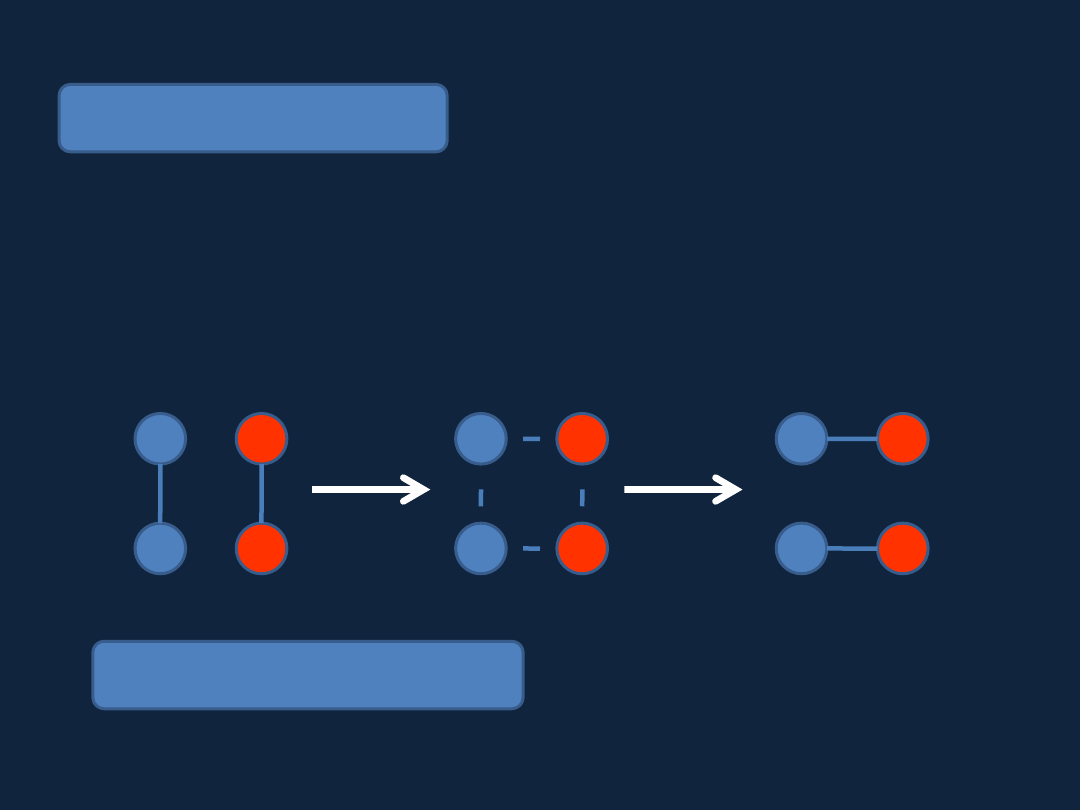
Teoria kompleksu aktywnego

gdzie:
N -
ilość cząsteczek posiadających energię większą niż energia
aktywacji
E
A
– energia aktywacji
N
0
-
całkowita ilość cząsteczek
k -
stała Boltzmanna
T -
temperatura (skala bezwzględna)
Które cząsteczki mogą zderzać się „efektywnie”?
Rozkład statystyczny Maxwella-Boltzmanna:
N = N
0
e(-E
A
/kT)
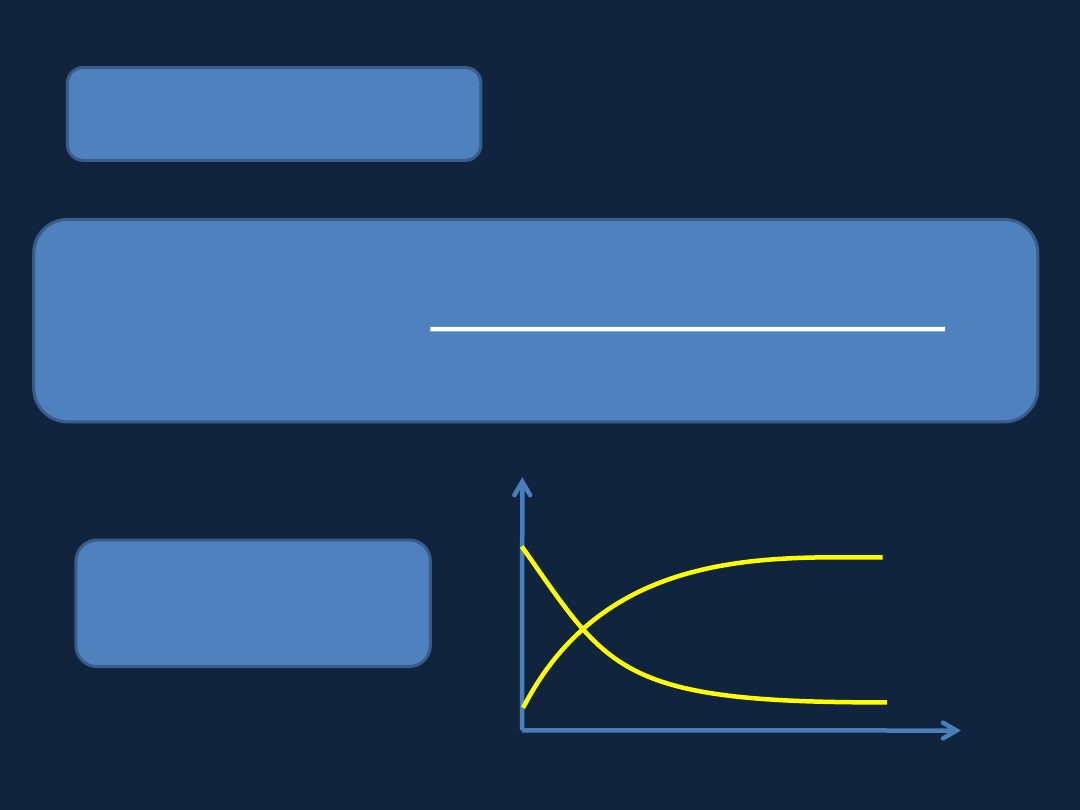
SZYBKOŚĆ REAKCJI
szybkość reakcji =
zmiana stężenia substratu/produktu
przedział czasu
ν = Δc / Δt
Stężenie
Czas
produkty
substraty

Równanie kinetyczne opisuje zależność szybkości reakcji od
stężenia substratów:
ν = k ∙ c
gdzie:
ν – szybkość reakcji, k – stała szybkości reakcji, c – stężenie
substratów

aA +bB
→ cC + dD
ν = k ∙ c
A
a
∙ c
B
b
gdzie:
k
– stała szybkości reakcji,
c
A
, c
B
– stężenia substratów,
a, b
– współczynniki stechiometryczne,
a + b = rząd reakcji
Reakcja I rzędu
A → B + C
ν = k ∙ c
A

Reakcja II rzędu
A + B → C
ν = k ∙ c
A
∙ c
B
2A → B + C
ν = k ∙ c
A
2
Czynniki wpływające na szybkość reakcji
-
stężenie substratu
- temperatura
-
ciśnienie (dla substratów gazowych)
-
obecność katalizatora
-
stopień rozdrobnienia (w przypadku substratów stałych)
Jak
zwiększyć szybkość reakcji?
Najprostsze sposoby, to
zwiększenie stężenia reagentów, czy
temperatury
reakcji,
jednakże może to być w praktyce
ograniczone
rozpuszczalnością reagentów, bądź wytrzymałością
aparatury.
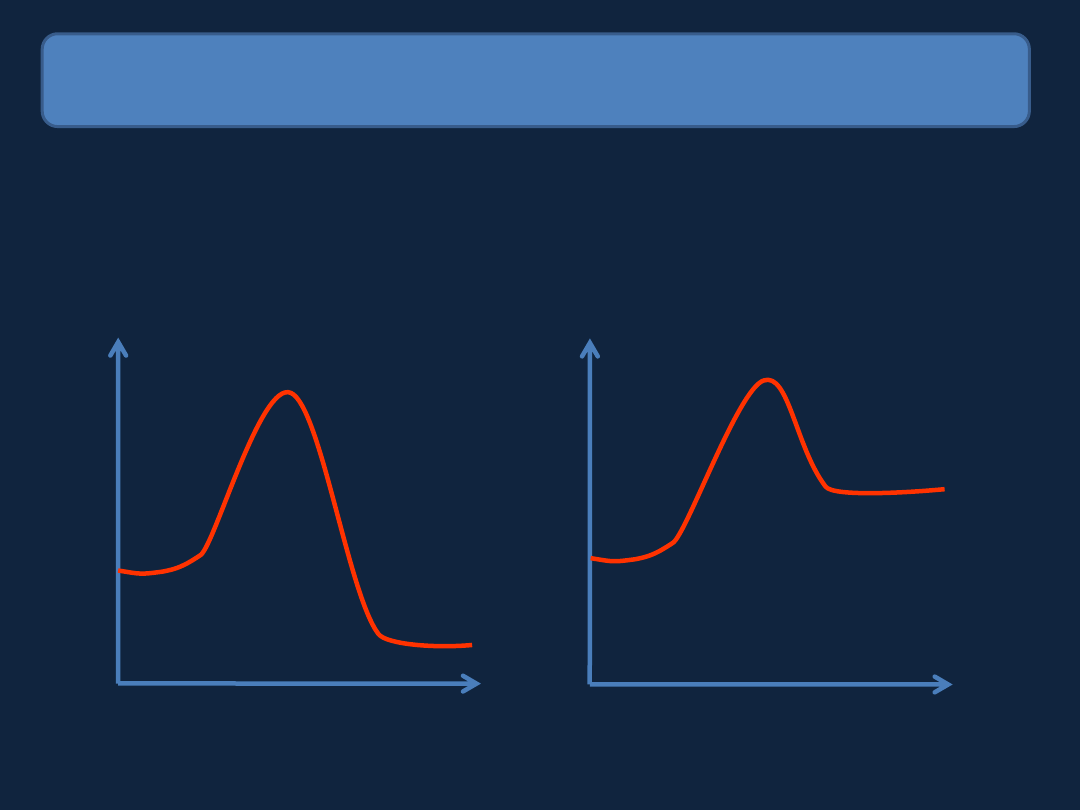
Energia
Czas
Energia
Czas
substraty
produkty
substraty
produkty
REACJE EGZOENERGETYCZNE I ENDOENERGETYCZNE
Wydzielenie nadmiaru energii do otoczenia,
energia
produktów reakcji jest niższa od
energii
substratów,
zmiana
energii
wewnętrznej układu - ujemna.
Pobranie energii z otoczenia, energia
produktów reakcji jest wyższa od energii
substratów, zmiana energii wewnętrznej
układu - udodatnia.
W reakcji egzoenergetycznej zwiększenie temperatury spowoduje zwiększenie szybkości
reakcji, ale obniży wydajność otrzymywania produktów.
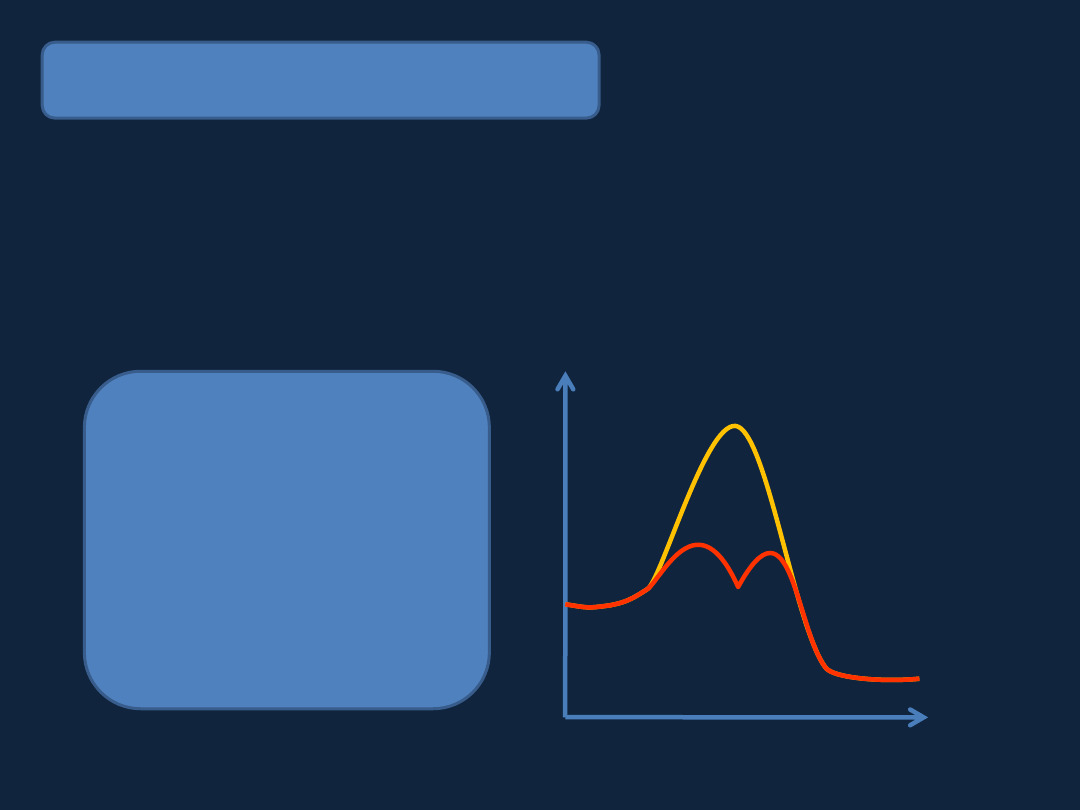
Energia
Czas
energia aktywacji
bez katalizatora
energia aktywacji
z katalizatorem
Zasada działania katalizatora
Katalizator to substancja,
która przyśpiesza reakcję chemiczną (dojście do
stanu
równowagi
chemicznej),
po
zakończeniu
reakcji
pozostając
w niezmienionym stanie.
Zwiększenie szybkości reakcji jest możliwe dzięki obniżeniu energii aktywacji .
Dlaczego tak się dzieje???
Reakcja bez katalizatora
1) A + B → C
Reakcja z katalizatorem
2) A + K → AK
3) AK + B → AB + K
1
2 3
MECHANIZM REAKCJI
Przemiana chemiczna
substratów w produkty może następować nie tylko
podczas jednego, ale
również w trakcie kilku następujących po sobie
(w
określonej kolejności) procesów nazywanych etapami reakcji.
Np.
2HI + H
2
O
2
→ I
2
+2H
2
O
Etap 1: HI + H
2
O
2
→ HIO + H
2
O - etap wolny
Etap 2: HIO + HI
→ H
2
O + I
2
- etap szybki
Mechanizm reakcji
wyjaśnia w jaki sposób zachodzi reakcja chemiczna
oraz jak
powstają i reagują produkty pośrednie, które nie występują
w
równaniu stechiometrycznym reakcji.
Produkty
pośrednie, to nietrwałe połączenia, które po krótkim czasie
ulegają rozpadowi lub przekształceniu w inne produkty.
Reakcje chemiczne
można podzielić na: następcze (zachodzące po sobie)
i
równoległe (zachodzące jednocześnie).
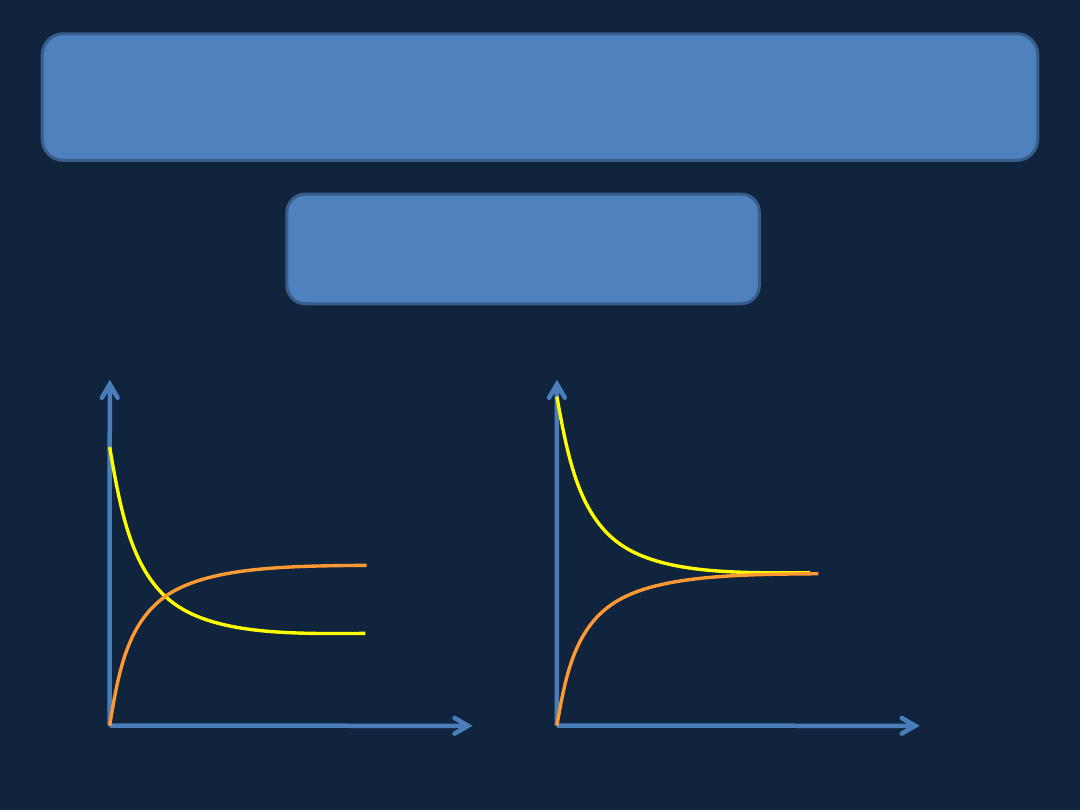
ODWRACALNOŚĆ REAKCJI CHEMICZNYCH – STAN
RÓWNOWAGI CHEMICZNEJ
Stężenie
Czas
stężenie
substratów
stężenie
produktów
stan
równowagi
Szybkość reakcji
Czas
V (C → A +B)
V (A+B
→ C)
stan
równowagi
A+B
C
←
→

Wszystkie reakcje chemiczne
są reakcjami odwracalnymi.
Reakcje
chemiczne
osiągają stan równowagi dynamicznej,
w
którym szybkości reakcji w obu kierunkach są jednakowe i nie
następuje zauważalna zmiana składu.
W stanie
równowagi chemicznej obie reakcje (z lewej na prawą
i z prawej na
lewą) zachodzą w dalszym ciągu.
Stan równowagi chemicznej wytwarza się w układach
zamkniętych!
A+B
C
←
→

STAN RÓWNOWAGI
Prawo
działania mas (Guldberg i Waage 1867r)
Stan
równowagi dynamicznej zostanie osiągnięty, gdy stosunek
iloczynu
stężeń substratów reakcji przyjmuje określoną wartość
charakterystyczną dla danej reakcji. Jest to stała równowagi
chemicznej.
aA + bB
cC + dD
←
→
Stała równowagi
(stężeniowa)
K
c
=
[C]
c
[D]
d
[A]
a
[B]
b
Szybkość reakcji a równowaga
A + B C + D
←
→
K
c
=
[C] [D]
[A] [B]
A + B → C + D szybkość v
1
= k
1
[A] [B]
C + D → A + B szybkość v
2
= k
2
[C] [D]
k
1
,k
2
– stałe szybkości reakcji
w stanie równowagi v
1
=v
2
,
więc
k
1
[A] [B] = k
2
[C] [D]
=
[C] [D]
[A] [B]
k
1
k
2
= K
c
Stała równowagi
reakcji jest równa
stosunkowi stałych
szybkości reakcji
w obu kierunkach

Równowagi w fazie gazowej
gdzie p -
ciśnienie ogólne, R – stała gazowa, T - temperatura,
n -
różnica sumarycznej liczby moli gazowych produktów i substratów
reakcji w równaniu stechiometrycznym
K
p
= K
c
(p/RT)
n
Stała równowagi
(ciśnieniowa)
CaCO
3(s)
CaO
(s)
+ CO
2(g)
←
→
K
p
= p
CO
2
Uwaga!

WYKORZYSTANIE STAŁYCH RÓWNOWAGI
Przewidywanie kierunku zachodzenia reakcji i stopnia przereagowania
substratów
A + B C + D
K =
[C] [D]
[A] [B]
Duże wartości K (większe niż 10
3
)
– w stanie równowagi dominują
produkty.
Pośrednie wartości K - w stanie równowagi nie dominują ani produkty,
ani substraty.
Małe wartości K (mniejsze niż 10
-3
)
– w stanie równowagi dominują
substraty.
←
→

WPŁYW ZMIANY WARUNKÓW
NA RÓWNOWAGI CHEMICZNE
Reguła przekory (Le Chatelier’a i Brauna)
Jeżeli na układ w stanie równowagi dynamicznej działa jakiś czynnik
zewnętrzny to powoduje on taką zmianę stanu równowagi, która
minimalizuje
działanie tego czynnika.
Zmiana
warunków – stężenie, ciśnienie, temperatura
1. Wprowadzanie i usuwanie
reagentów
Gdy do mieszaniny reakcyjnej w stanie
równowagi zostanie dodany
substrat lub
usunięty z niej produkt reakcja zachodzi w kierunku
tworzenia
się produktów, gdy usuwa się substraty lub dodaje
produktów powstaje więcej substratów.
A + B C + D
←
→

Przykład
BaCl
2
+ H
2
SO
4
BaSO
4
+ 2HCl
2.
Zmiana ciśnienia
Układ będzie dążył do zminimalizowania zmian ciśnienia, np.
3. Zmiana temperatury
W reakcjach egzotermicznych obniżenie temperatury sprzyja powstawaniu
produktów, a w reakcjach endotermicznych obniżenie temperatury
sprzyja powstawaniu substratów, np.
←
→
3H
2
+N
2
2NH
3
←
→
C + O
2
CO
2
reakcja egzotermiczna
←
→
2H
2
O
2H
2
+ O
2
reakcja endotermiczna
←
→

ENERGIA UKŁADÓW
Energia
całkowita obiektu jest sumą jego energii potencjalnej i kinetycznej
E = E
k
+ E
p
Energia
wewnętrzna próbki materii
jest
sumą energii kinetycznych
i potencjalnych wszystkich
atomów i cząsteczek w próbce.
Składać się na nią mogą - energia oddziaływań między cząstkami, energia
wiązań chemicznych, energia elektronów, siły spajające jądra atomowe,
energia anihilacji.
W przyrodzie
układy o najniższej energii są najbardziej uprzywilejowane.

Rodzaje
układów:
Układ otwarty – może wymieniać z otoczeniem energię i materię.
Układ zamknięty – może wymieniać z otoczeniem tylko energię.
Układ izolowany nie może wymieniać ani energii, ani materii.
ZASADA ZACHOWANIA ENERGII
Całkowita energia izolowanego układu jest stała.
Energia
może być przekazywana z układu do otoczenia, gdy układ
uwalnia
ciepło lub wykonuje pracę
Ciepło to przenoszenie energii zachodzące w wyniku występowania
różnicy temperatur (ciepło wzbudza ruch cząsteczek w otoczeniu).
Praca to przenoszenie energii,
które zachodzi gdy obiekt porusza się
pokonując jakąś siłę (np. ciśnienie).

PODSTAWOWE PRAWA CHEMICZNE
Prawo zachowania masy
– A. Lavoisier 1785r.
We wszystkich reakcjach chemicznych masa
produktów równa się masie
substratów (całkowita masa układu reagującego jest taka sama przed jak
i po reakcji).
Σm = const
A + B C + D
←
→
m
A
+ m
B
= m
C
+ m
D

Prawo zachowania masy i energii
Suma masy i energii w
układzie zamkniętym jest stała i nie zależy od
zmian
zachodzących w układzie.
Σm + ΣE = const
Prawo Einsteina E=mc
2
masa 1g materii jest równoważna ok. 9x10
13
J
Prawo
stosunków stałych – J. Proust 1779r.
Stosunek
części wagowych pierwiastków łączących się w dany związek
jest
stały (skład związku chemicznego jest stały, masy pierwiastków
tworzących dany związek są w nim w stałych ściśle określonych
stosunkach charakterystycznych dla tego
związku).
Prawo
stosunków wielokrotnych – J. Dalton 1808r.
Jeżeli dwa pierwiastki tworzą ze sobą dwa lub więcej związków, to masy
jednego z nich,
łączące się w tych związkach z tą samą masą drugiego
mają się do siebie jak proste liczby naturalne.

Prawo
objętościowe – J.L. Gay-Lussac 1805r.
Objętości substancji gazowych (mierzone w tej samej temperaturze i pod
tym samym
ciśnieniem) biorących udział w danej reakcji chemicznej mają
się do siebie jak proste liczby naturalne.
Prawo Avogadro
– 1811r.
Jednakowe
objętości dwóch różnych gazów (znajdujących się w tej samej
temperaturze i pod tym samym
ciśnieniem) zawierają jednakową liczbę
cząsteczek.
warunki normalne -
ciśnienie 1 atm = 1013,25 hPa, temperatura – 273,15 K = 0°C
objętość 22,4 dm
3
- 6,02 x 10
23
cząsteczek – 1 mol
Wyszukiwarka
Podobne podstrony:
ChOiN I JG wyklad 6
ChOiN I JG wyklad 5
ChOiN I JG wyklad 2
ChOiN I JG wyklad 3
ChOiN I JG wyklad 4
ChOiN II JG wyklad 6
ChOiN II JG wyklad 3
ChOiN II JG wyklad 2
ChOiN II JG wyklad 7
ChOiN II JG wyklad 6
9.03. wykład ZKL, Uniwersytet Ekonomiczny JG, ZKL
Napęd Elektryczny wykład
wykład5
Psychologia wykład 1 Stres i radzenie sobie z nim zjazd B
Wykład 04
geriatria p pokarmowy wyklad materialy
ostre stany w alergologii wyklad 2003
więcej podobnych podstron