
BUDOWA ATOMU
Rozwój teorii atomistycznej
John Dalton -
początek XIX wieku
Założenia:
1. Wszystkie
substancje
składają
się
z
niezmiernie
małych,
niepodzielnych
cząstek zwanych atomami, zachowujących swoją
indywidualność we wszystkich przemianach chemicznych.
2. Atomy danego pierwiastka
są identyczne pod każdym względem
(np.
mają jednakową masę). Atomy różnych pierwiastków różnią się
swoimi
właściwościami.
3.
Związki chemiczne powstają wskutek łączenia się atomów różnych
pierwiastków w określonych i stałych stosunkach liczbowych. Masy
atomów nie ulegają zmianie w czasie reakcji chemicznej.
Czy wszystkie
założenia są słuszne???
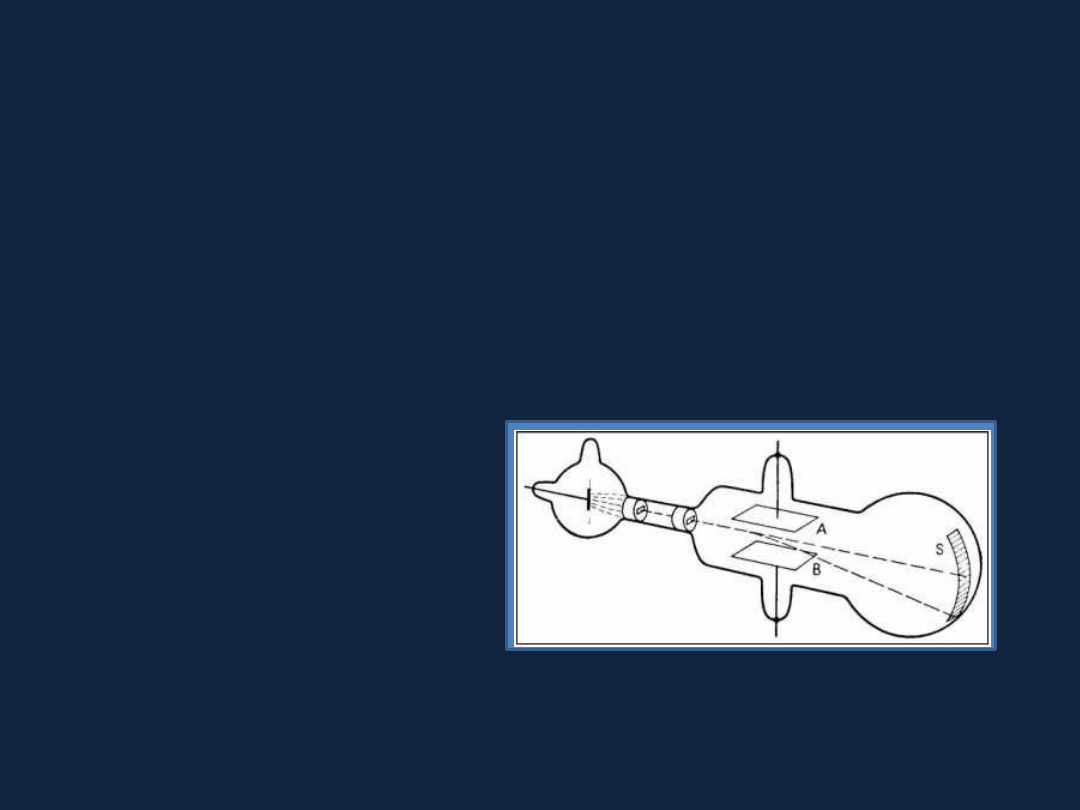
Doświadczenie J.J. Thomsona – 1897 rok
Pierwszy dowód istnienia wewnętrznej struktury atomu – odkrycie elektronu.
Badania nad promieniami katodowymi emitowanymi w warunkach próżniowych.
Stwierdzenie istnienia ujemnie
naładowanych cząstek, które
s
ą identyczne niezależnie od
materiału, z którego wykonano
katodę.
Wyznaczenie stosunku
ładunku elektronu do jego
masy e/m = 1,7588 x 10
8
C/g

Eksperymenty Roberta Millikana (1913 rok)
Wyznaczenie
ładunku elektronu
-
1.6220 x 10
-19
C
(najmniejszy
ładunek jaki udało się wykryć, wszystkie inne ładunki
stanowią wielokrotność tego ładunku – dlatego został nazwany ładunkiem
elementarnym)
Na podstawie tych i poprzednich
badań wyznaczono
masę elektronu
,
która
wynosi -
9.109 x 10
-28
g
Hipoteza dotycząca rozmieszczenia elektronów w jądrze atomowym
Atom
obojętny
elektrycznie
–
powinien
zawierać
ładunek dodatni równoważący
ujemne
ładunki elektronów .
Gdzie te
ładunki mogą być zlokalizowane ???
- model
„ciasta z rodzynkami”

Badania Ernesta Rutherforda (1908 rok)
Bombardowania cząstkami alfa (α) cienkiej folii platynowej
Rys. 1.9 str 7 Atkins1
Wyjaśnienie obserwowanych efektów – atom zawiera gęste, niemal
punktowe dodatnio
naładowane jądro, otoczone przez wielki niemal pusty
obszar, w
którym rozmieszczone są elektrony.

Jądrowy model atomu
1.
Atomy są zbudowane z cząstek subatomowych (elektrony, protony,
neutrony).
2.
Protony i neutrony tworzą zwarte, centralne ciało zwane jądrem
atomowym.
3.
Elektrony tworzą w przestrzeni chmurę otaczającą jądro.
Cząstka
Symbol
Ładunek
Masa [g]
Elektron
e
-
-1
9,109 x 10
-28
Proton
p
+1
1,673 x 10
-24
Neutron
n
0
1,675 x 10
-24
Elektron, proton i neutron
– podstawowe właściwości

Rozmiary atomu i jądra atomowego
Cząstka
Szacowany rozmiar
Atom
10
-10
m
Jądro atomowe
10
-14
– 10
-15
m
Elektron
10
-15
m
Czy to wszystko co wiemy o budowie atomu???
Jakie znamy cząstki elementarne???
Cząstkami elementarnymi nazywamy wszystkie cząstki, które są
niezbędne do wyjaśnienia własności wszystkich form materii.
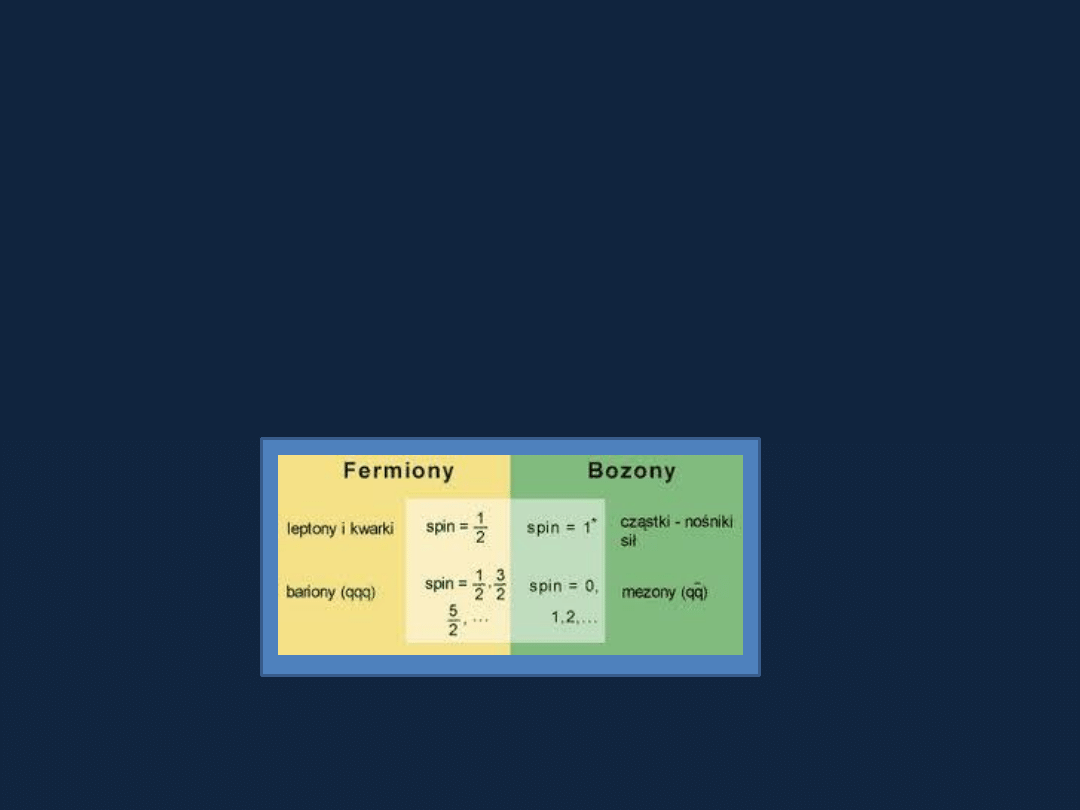
Model Standardowy zakłada istnienie:
-
12 cząstek, z których złożona jest materia – fermiony,
-
12 cząstek, które są odpowiedzialne za przenoszenie oddziaływań
między innymi cząstkami – bozony.
Od czego
zależą właściwości atomu???
Właściwości jądra
zależą od ilości
protonów i neutronów
.
Liczba
protonów
określa
ładunek elektryczny jądra
oraz decyduje o tym
jakiego rodzaju pierwiastka jest dany atom
.
Układ i ilość elektronów
wokół jądra decyduje
o przebiegu reakcji
chemicznych
z
udziałem danego atomu.
Ilość neutronów może wpływać na trwałość jądra atomowego i mieć
znaczenie np. w reakcjach
jądrowych.

LICZBA ATOMOWA I LICZBA MASOWA
Atom w normalnym stanie jest elektrycznie obojętny
l
iczba ładunków elementarnych w jądrze = liczbie elektronów
(liczba protonów = liczbie elektronów)
Liczba atomowa (Z)
– liczba dodatnich ładunków elementarnych
w atomie
Liczba masowa (A)
- liczba
nukleonów w jądrze atomowym (czyli suma
protonów i neutronów)
X
A
Z
Np.
He
4
2
O
16
8
Nukleony
– cząstki
jądra atomowego
(protony, neutrony)

IZOTOPY
Izotopy
– atomy o jednakowej liczbie atomowej (należące do tego
samego pierwiastka), lecz o
różnej liczbie masowej – ta sama liczba
protonów, różna liczba neutronów
Właściwości izotopów tego samego pierwiastka są niemal identyczne.
Większość pierwiastków posiada izotopy.
Mieszanina
izotopów danego pierwiastka występującego w przyrodzie
zachowuje zazwyczaj
stały skład.
Nuklidy
– atomy poszczególnych izotopów
H
1
1
O
16
8
Cl
35
17
D
2
1
T
3
1
O
17
8
O
18
8
Cl
37
17
Udział: 99,985% - 0,015% - 10
-16
%
Udział: 99,759% - 0,037% - 0,204%
Udział: 75,53% - 24,47%
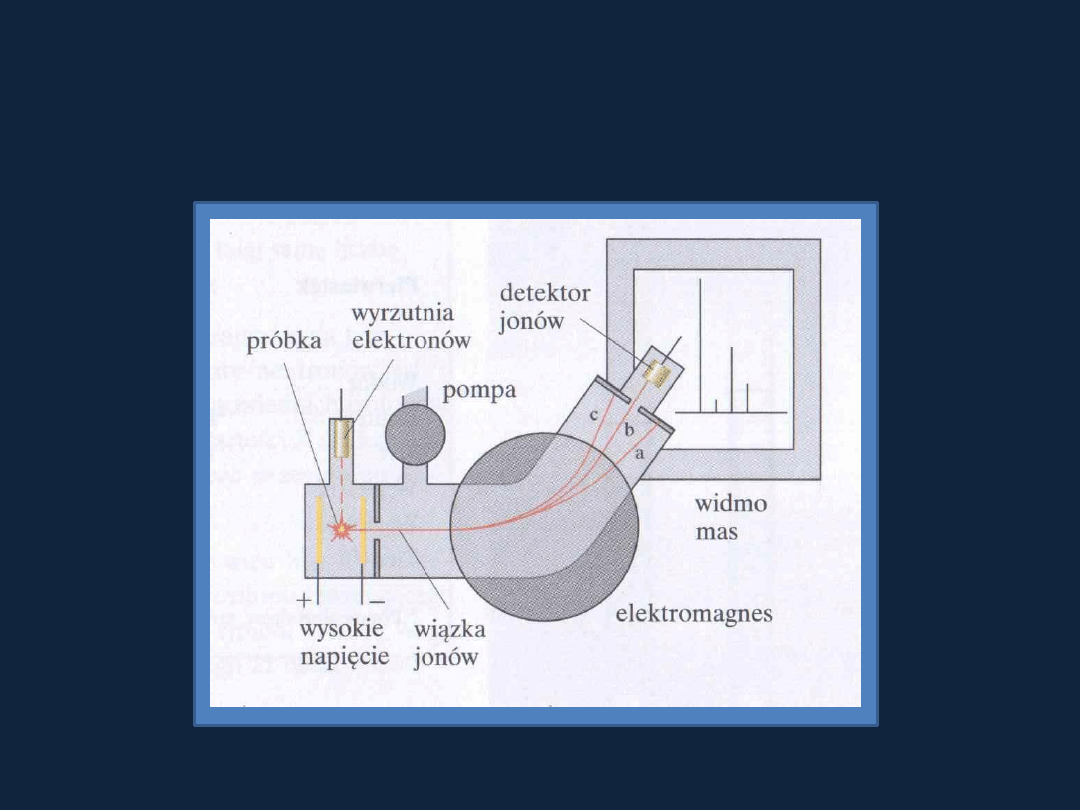
Istnienie izotopów wykazano doświadczalnie na początku XX wieku
za pomocą spektrometru mas
Rys str 11 Atkins1
MASA ATOMOWA
W celu ułatwienia porównywania mas nuklidów pochodzących od różnych
pierwiastków przyjęto jednostkę tzw. względnej masy atomowej (jednostka
masy atomowej
– j.m.a. - [u] – unit), która wynosi 1/12 część masy nuklidu
lżejszego izotopu węgla.
Względna masa atomowa
– to liczba określająca ile razy masa atomu
danego izotopu jest większa od 1/12 masy atomu węgla
12
C.
Średnia względna masa atomowa (masa atomowa)
– średnia ważona
względnych mas atomowych poszczególnych izotopów tego samego
pierwiastka.
Do obliczenia masy atomowej potrzebne są dane dotyczące:
a)
względnych mas atomowych poszczególnych izotopów,
b)
zawartości tych izotopów.

Przykład:
Węgiel
udziały poszczególnych izotopów –
12
C
– 0,989;
13
C
– 0,011
Względna masa atomowa -
12
C
– 12,000000;
13
C
– 13,003355
Średnia względna masa atomowa – A
r
Masa cząsteczkowa
– liczba określająca ile razy masa danej cząsteczki jest
większa od 1/12 masy atomu węgla
12
C.
Masa molowa
– masa jednego mola materii (jednostka np. - g/mol).
Masa atomowa i masa cząsteczkowa dotyczą pojedynczego indywiduum,
natomiast masa molowa określonej ich ilości.
A
r
= 0,989 ∙ 12,000000 + 0,011 ∙ 13,003355 = 12,011

Modele budowy
jądra atomowego
Model kroplowy
Ten model
zakłada, że nukleony w jądrze zachowują się w podobny sposób
jak
cząsteczki w kropli cieczy – dlatego właściwości jądra powinne być
podobne do
właściwości kropli cieczy.
Podobieństwa – jądro atomowe kształt kulisty, oddziaływanie jądrowe i siły
elektrostatyczne
mogą odpowiadać siłą występującym w kropli cieczy (np.
lepkość, czy napięcie powierzchniowe.
Model ten nie
wyjaśnia wszystkich zachodzących zjawisk.
Model
powłokowy
Ten model jest podobny do modelu
powłokowego układu elektronów
w atomie.
Zakłada, że nukleony poruszają się w polu jądra utworzonym przez inne
cząstki. Pole wytworzone przez nukleony zostało nazwane potencjałem
jądrowym (uśrednienie oddziaływań pomiędzy nukleonami).
J
ądra atomowe o „wypełnionych powłokach” są stabilniejsze niż jądra
sąsiednie.

Liczby
protonów, neutronów dla których wypełnione są powłoki nazwano
liczbami magicznymi.
Liczby magiczne dla protonów i neutronów to: 2, 8, 20, 28, 50, 82, 126.
Trwałość jąder atomowych
Znane jest około 270 trwałych nuklidów.
Liczba protonów
Liczba neutronów
Liczba trwałych
nuklidów
parzysta
parzysta
ponad 160
parzysta
nieparzysta
ponad 50
nieparzysta
parzysta
około 50
nieparzysta
nieparzysta
kilka

Jakie
siły działają na nukleony w jądrze?
Siły odpychania elektrostatycznego między protonami, które znajdują się
w
małych odległościach od siebie.
Jednak znamy jądra bardzo trwałe. Co równoważy ten efekt?
Siły przyciągania, które równoważą, a nawet przewyższają siły
odpychania -
są to tzw
.
siły jądrowe
– silne oddziaływania pomiędzy
nukleonami,
którym podlegają niezależnie od ich ładunku elektrycznego.
Cecha
charakterystyczną sił jądrowych – szybko zanikają w miarę
wzrostu
odległości (nie przekraczają rozmiarów jądra).

Energia wiązania nukleonów w jądrze – defekt masy
Przykład:
Beryl
– liczba atomowa – 4; liczba masowa – 9;
czyli jądro Be składa się z 4 protonów, 5 neutronów oraz 4 elektronów
Masa teoretyczna:
rodzaj i ilość
cząstek
masa [u]
masa 4 elektronów
4 ∙ 0,0005486 = 0,0021944
masa 5
neutronów
5 ∙ 1,0072764 = 4,0291056
masa 4 protonów
4 ∙ 1,0086650 = 5,0433250
masa
całkowita
= 9,0746250
Masa oznaczona eksperymentalnie (rzeczywista) wynosi
– 9,01218 [u]
Różnica: m
teoret.
– m
rzecz.
= 0,0624 [u] ???

Teoria
względności Einsteina
mówi, że w przyrodzie mogą zachodzić
procesy, w
których masa układu może ulec zmianie nie tylko na skutek
wymiany substancji z otoczeniem, ale wskutek wymiany energii.
E = mc
2
W analizowanym przypadku
różnica masy wynosi 0,0624 [u].
1 mol berylu (ok. 9 g)
– energia ok. 5,6 x 10
12
J
– co jest równoważne
energii
powstałej ze spalenia ponad 168 ton węgla.
Defekt (deficyt) masy
– różnica pomiędzy teoretyczną i rzeczywistą
masą atomu równoważna energii sił spajających jądro atomowe (energii
wiązania jądra).
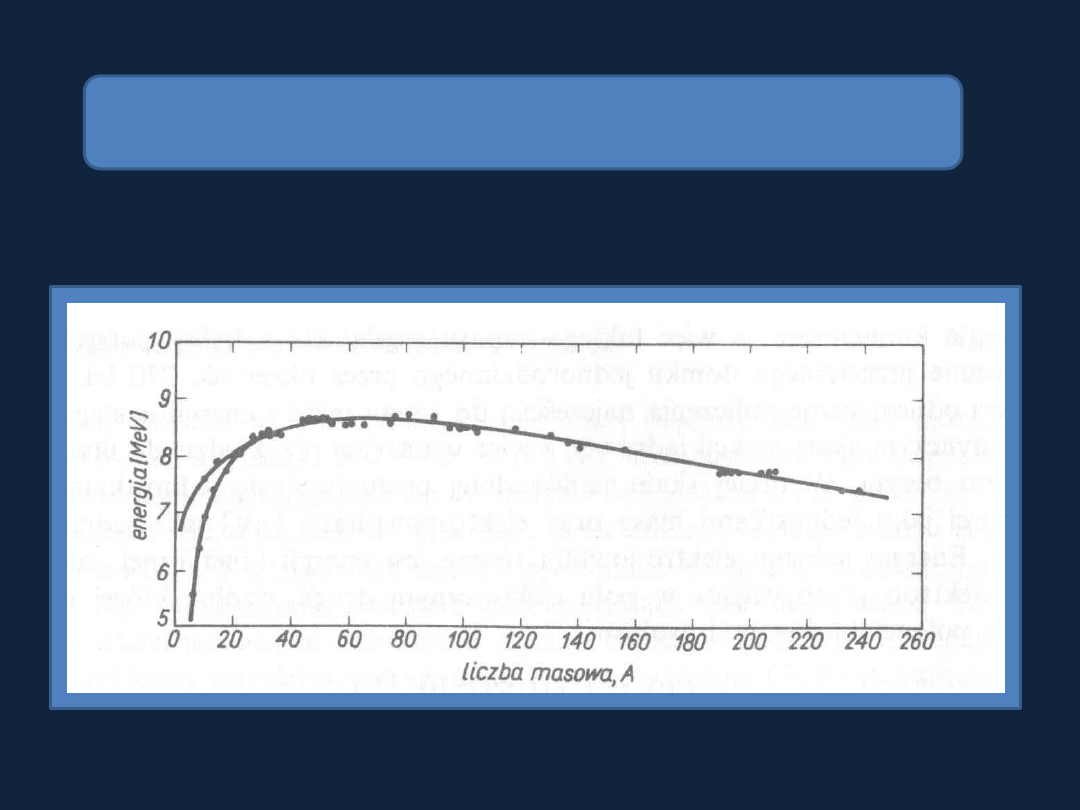
Zależność energii wiązania nukleonów w jądrze
od liczby masowej pierwiastka
Rys. 2.1 str 32
Bielanski1
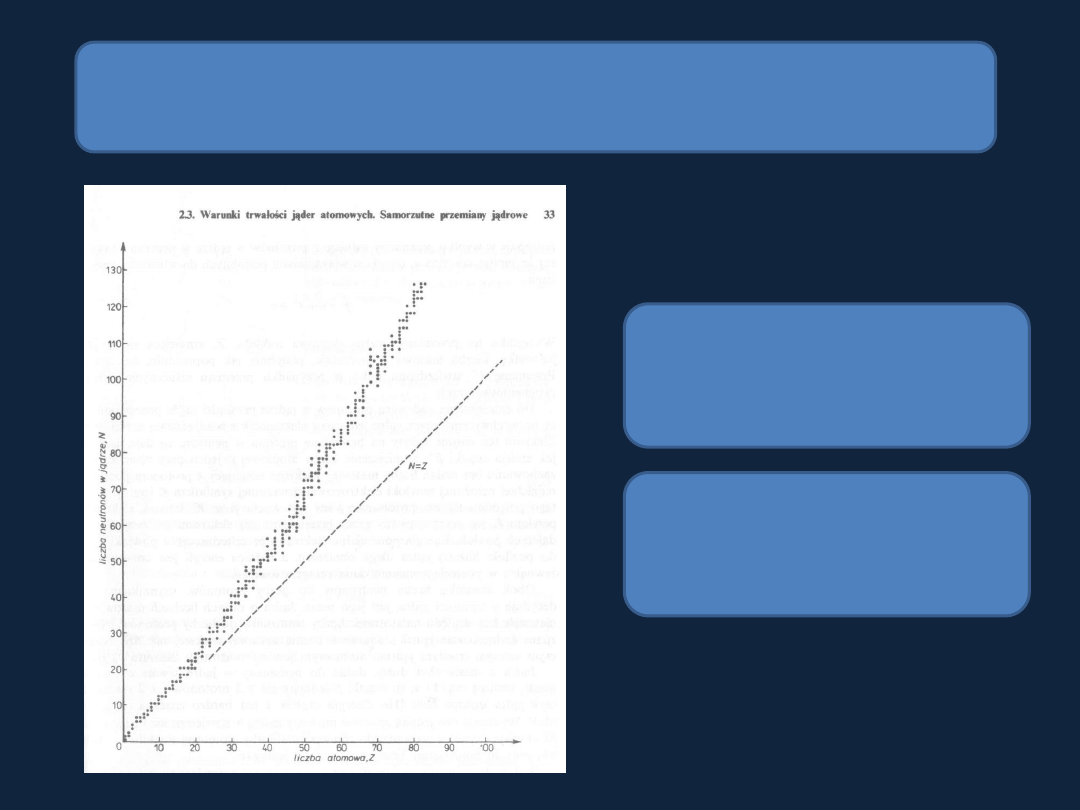
Zawartość neutronów w trwałych jądrach atomowych w zależności
od liczby atomowej pierwiastków
Małe liczby atomowej -
stosunek neutronów do
protonów (n/p) jest bliski 1
W przypadku wyższych
liczb atomowych stosunek
n/p nie przekracza 1,6
Rys. 2.2 str
33 Bielański

Przemiany jąder atomowych
Część jąder atomowych jest nietrwałych i może ulegać różnego rodzaju
przemianom
jądrowym.
Przemiany
jądrowe mogą być spowodowane oddziaływaniami wewnątrz
jąder atomowych lub oddziaływaniami z cząstkami elementarnymi (np.
neutronem).
Przemiany
jądrowe można podzielić na:
1) reakcje syntezy - w tym przypadku z
jąder lżejszych powstają jądra,
które posiadają większą liczbę atomową lub liczbę masową
2) reakcje rozpadu
– liczby atomowe lub liczby masowe produktów są
mniejsze
niż liczby atomowe lub liczby masowe produktów (dochodzi
do rozpadu
jąder na mniejsze)

Jakie
są cechy charakterystyczne reakcji jądrowej?
Jądra atomowe pierwiastków przekształcają się w jądra atomowe
innych
pierwiastków, innych izotopów tego samego pierwiastka lub
przechodzą na inny stan energetyczny.
W
reakcję
jądrową
są
zazwyczaj
zaangażowane
cząstki
elementarne (np. protony, neutrony), a przebieg reakcji jest
związany z emisją bądź uwolnieniem bardzo dużej ilości energii.
W
przeciwieństwie do reszty reakcji chemicznych nie obserwuje się
wpływu temperatury lub ciśnienia na szybkość reakcji jądrowej.

Promieniotwórczość i rodzaje promieniowania
Zjawisko
promieniotwórczości
jest
związane ze zdolnością jąder
atomowych do rozpadu
promieniotwórczego, w wyniku którego
obserwuje
się
emisję promieniowania
:
1)
cząstek alfa (α)
2)
cząstek beta (β) – elektronów lub pozytonów
3) promieniowania gamma
(γ) o wysokiej energii

Rozpad typu alfa (
α)
Reakcja
jądrowa, której wynikiem jest powstanie lżejszego jądra
atomowego oraz emisja
cząstki alfa – czyli jądra atomu helu
4
2
He
2+
X
A
Z
Y
A-4
Z-2
He
2+
4
2
+
U
238
92
Th
234
90
He
2+
4
2
+
Rozpad typu
(β)
Reakcja
jądrowa, której wynikiem jest otrzymanie jądra atomowego o
liczbie atomowej o jeden
większej lub mniejszej w stosunku do jądra
pierwotnego
Rozpad
β
-
W wyniku tej przemiany neutron zostaje
zastąpiony protonem, dodatkowo
obserwuje
się powstanie elektronu i antyneutrino elektronowego
Rozpad
β
+
Wynikiem tego rozpadu jest w
przeciwieństwie do poprzedniego
przypadku przemiana protonu w neutron, obserwuje
się również
powstanie pozytonu i neutrino
X
A
Z
Y
A
Z+1
+
elektron
+
antyneutrino
X
A
Z
Y
A
Z-1
+
pozyton
+
neutrino
Emisja promieniowania
(γ)
Proces, w
którym emitowane jest wyłącznie promieniowanie gamma
(promieniowanie elektromagnetyczne). Nie obserwuje
się emisji innych
cząstek. Liczba atomowa i liczba masowa pierwiastka pozostaje bez
zmian. Zmienia
się jedynie stan energetyczny jądra atomowego.
Może następować po rozpadzie alfa lub beta, po których jądro
znajduje
się w stanie wzbudzonym i jest związane z powrotem jądra
atomowego do stanu podstawowego o
niższej energii.
X
A
Z
Y*
A
Z+1
+
elektron
+
antyneutrino
Y*
A
Z+1
Y
A
Z+1
+
γ

Szybkość rozpadu promieniotwórczego
Szybkość rozpadu nietrwałych jąder atomowych danego pierwiastka jest
proporcjonalna do
ilości jeszcze nie rozłożonych atomów.
Szybkość rozpadu promieniotwórczego można przedstawić za pomocą
następującego równania:
λN = - (ΔN / Δt)
gdzie: N
– liczba nierozłożonych atomów pierwiastka, ΔN – liczba
przedstawiająca ubytek atomów (ze względu na ich rozpad) w przedziale
czasu
Δt, λ – stała rozpadu promieniotwórczego.
Przekształcając powyższe równanie, możemy obliczyć liczbę atomów
N
pozostającą po określonym czasie t:
N = N
0
∙ e
-
λt
gdzie: N
0
– początkowa liczba atomów pierwiastka radioaktywnego

Korzystając z przedstawionych wcześniej zależności można obliczyć
tzw
. okres
półtrwania izotopu promieniotwórczego – T
1/2
Jest to czas, w
którym ulega rozpadowi połowa ilości danego izotopu
Zakładając, że t = T
1/2
oraz N = N
0
/2, otrzymujemy:
T
1/2
= ln
2 / λ
Okres
półtrwania nie zależy od ilości początkowej izotopu.
Jest to
wielkość używana do charakteryzowania szybkości rozkładu
promieniotwórczego.
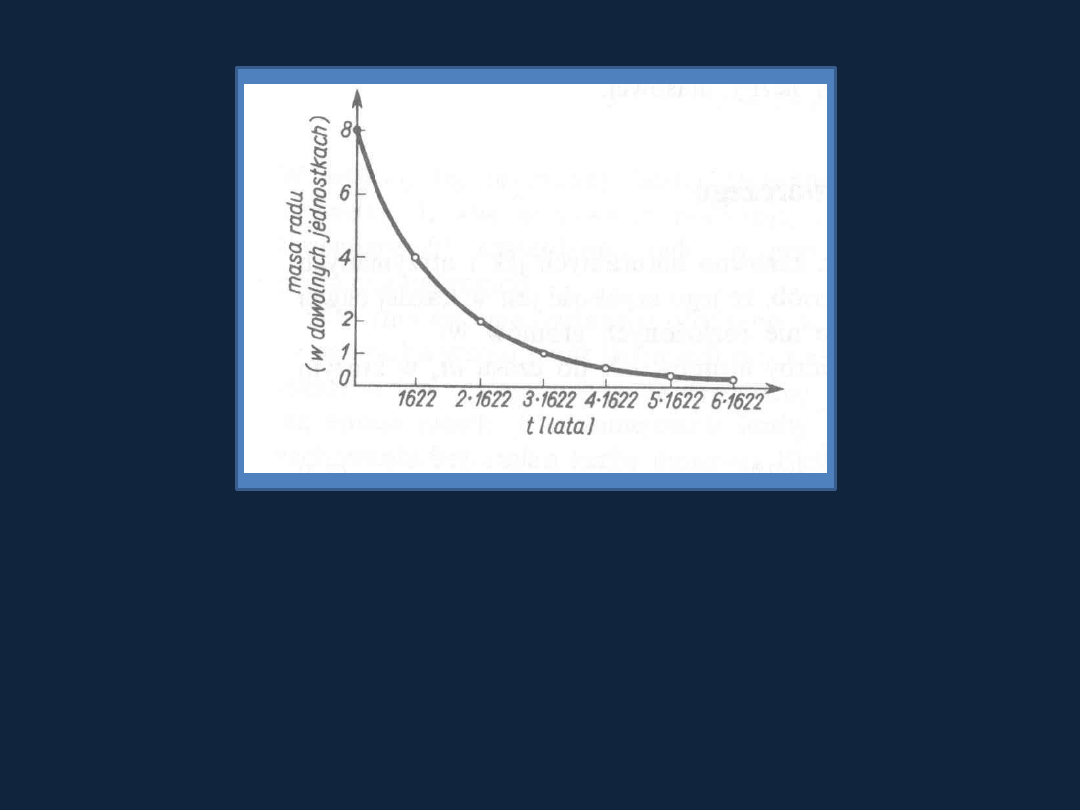
Rys. 2.3 str 36
Bielan1
Wartości jakie może przyjmować okres półtrwania różnych nuklidów
wahają się w szerokich granicach, np.:
U
238
92
Po
214
84
- 4,51 x 10
9
lat
- 1,62 x 10
-4
s

Reakcje
łańcuchowe
Następuje rozszczepienie jąder atomowych w wyniku których
następuje emisja cząstek elementarnych biorących udział w rozpadzie
kolejnych
jąder.
gdzie: n-neutron, X, Y
– jądra atomów powstałych podczas rozpadu
Liczby masowe
produktów rozpadu przyjmują wartości od 72 do 161
(w produktach rozszczepienia uranu wykryto
około 300 izotopów 37
różnych pierwiastków).
U + n
X + Y + (2-3)n
235
92
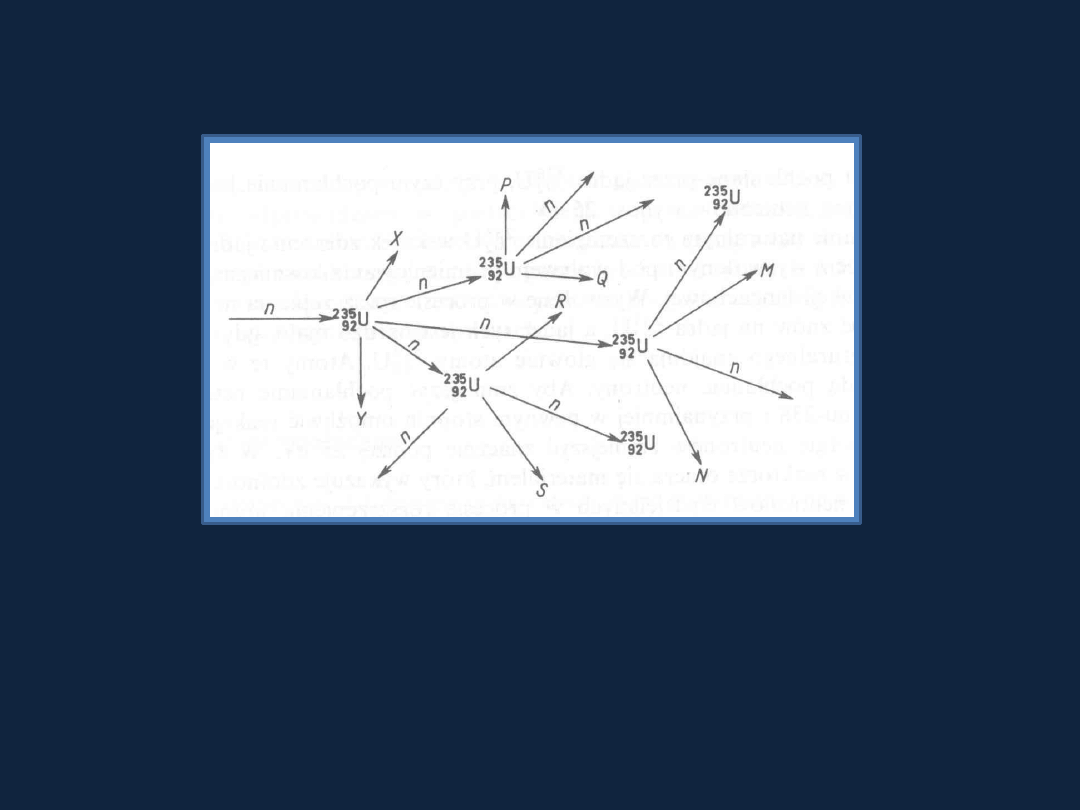
Rys 2.9 str 47 Bielan1
Łańcuchowa reakcja rozpadu jąder uranu
235
U.
Ruda uranowa zawiera 99,3% izotopu
238
U
– niezbędne wzbogacanie
Masa krytyczna
235
U
– ok. 20 kg
Rozszczepienie 1g izotopu
235
U
– energia powstała ze spalenia ok. 2500 kg
węgla
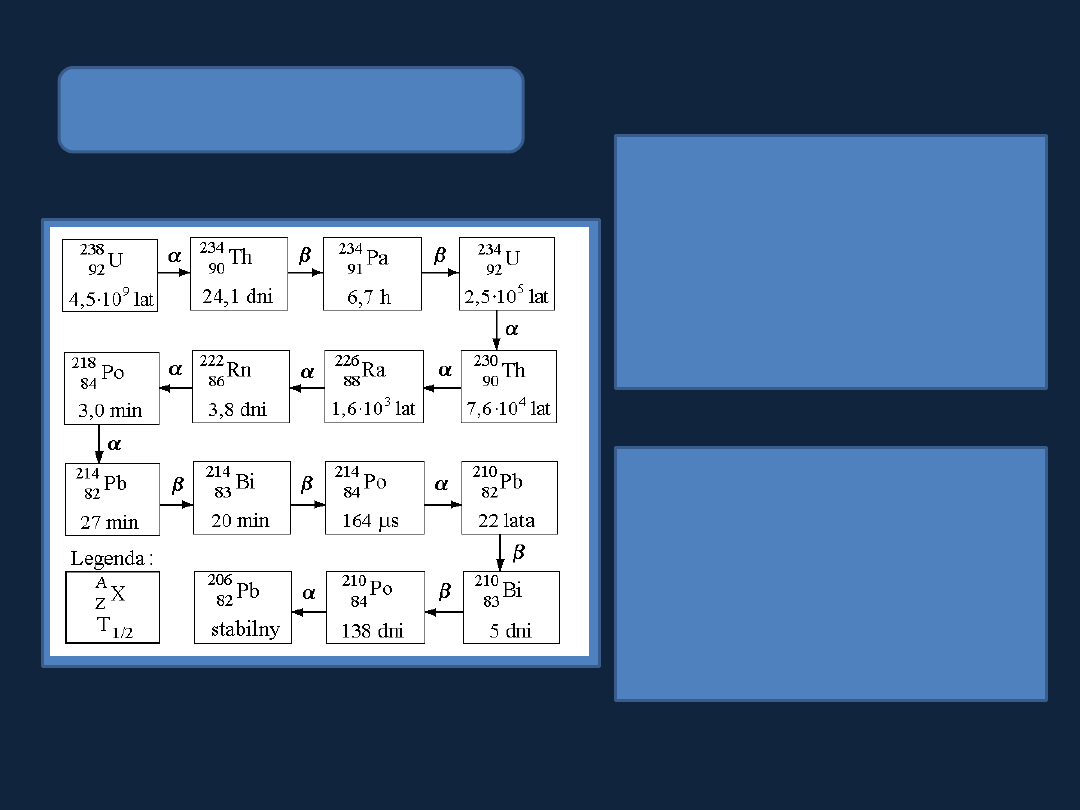
Szeregi
promieniotwórcze
Szereg uranowo-radowy
Wśród pierwiastków występujących
w przyrodzie
wyróżnia się 3 szeregi
promieniotwórcze: uranowo-radowy
(wywodzący się od izotopu
238
U),
uranowo-aktynowy
(wywodzący się
od
izotopu
235
U)
i
torowy
(wywodzący się od izotopu
232
Th).
Każdy
szereg
rozpoczyna
się
nuklidem
stosunkowo
trwałym,
zanikającym wolniej niż inne nuklidy
stanowiące ogniwa szeregu i kończy
się nuklidem niepromieniotwórczym,
który
nie
ulega
już
dalszym
przemianom.

ELEKTRONOWA
STRUKTURA ATOMU
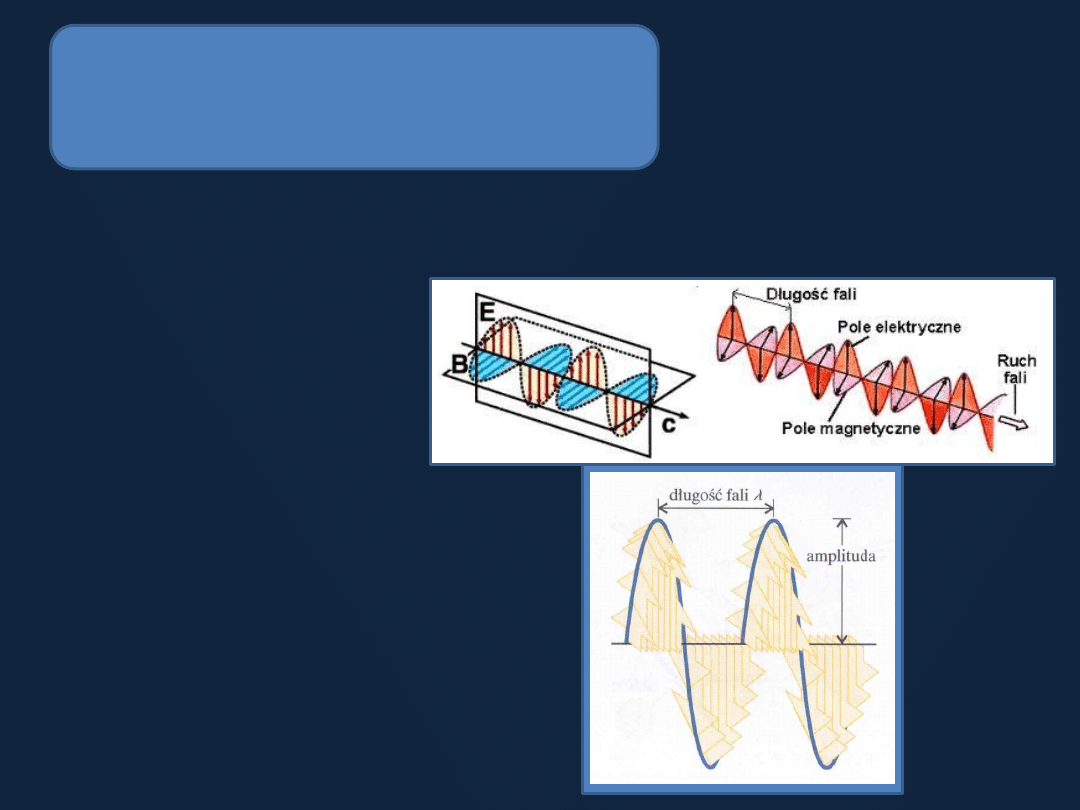
Dwoista natura światła i elektronów
(dualizm korpuskularno-falowy)
Światło - promieniowanie elektromagnetyczne jest falą charakteryzowaną
przez częstość i amplitudę.
Rys. 7.4 str
282 Atkins
lub
podobny
Częstość – liczba cykli
całkowitych zmian kierunku
fali
Jednostka
– herc (Hz)
1 Hz = 1/s
Częstość promieniowania
widzialnego
– rząd 10
14
Hz
Światło:
zielone 5,7x10
14
Hz,
żółte 5,2x10
14
Hz,
czerwone 4,3x10
14
Hz
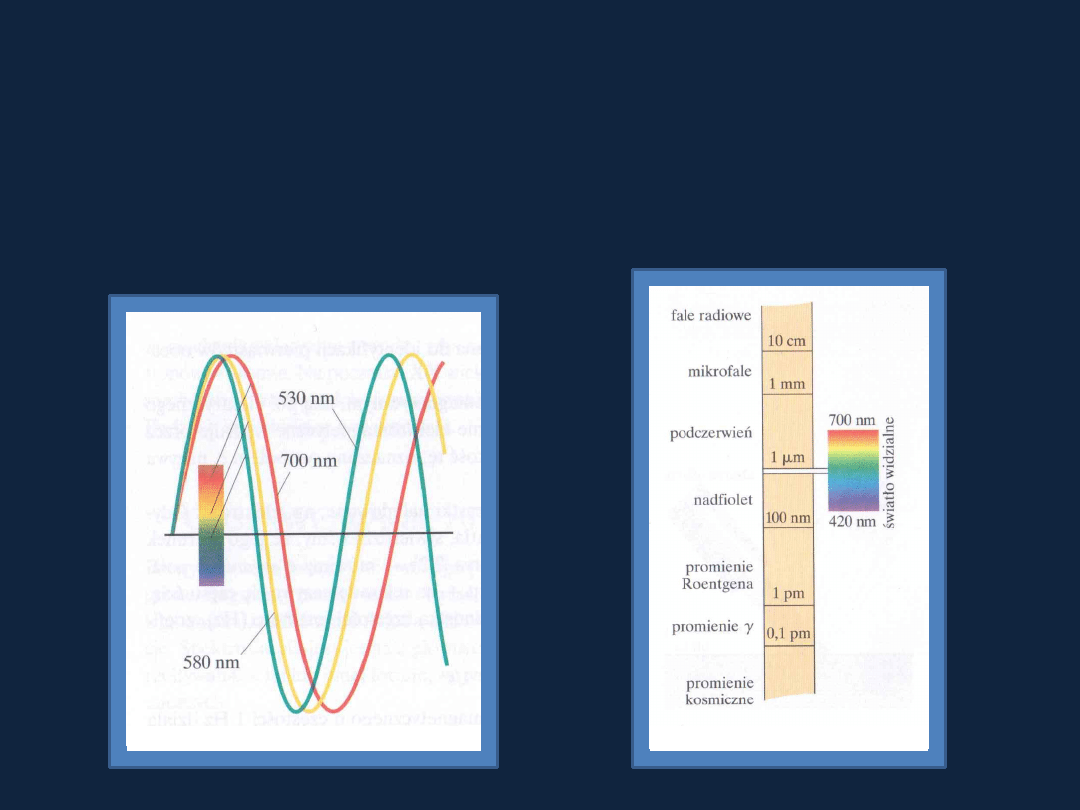
Rys. 7.3 a
str 282
Atkins
Rys. 7.6
str 283
Atkins
Zależność pomiędzy długością fali i częstością:
λ ∙ ν = c
gdzie:
λ – długość fali, ν – częstość, c - prędkość

Teoria kwantowa Plancka
Mechanika klasyczna
mówi o tym, że promieniowanie i materia mogą
mieć
dowolną
energię
–
nie
tłumaczy
to
jednak
wyników
eksperymentów dla małych obiektów takich jak elektrony.
Mechanika kwantowa
– może wyjaśniać zachowanie takich obiektów.
Promieniowanie elektromagnetyczne przenosi
energię w przestrzeni.
Światło jest emitowane nie w sposób ciągły, ale małymi porcjami, które
nazwano fotonami.
Energia fotonu jest proporcjonalna do częstości promieniowania:
E = h
∙ ν
gdzie: E
– energia fotonu, ν – częstość, h – stała Plancka
wartość h wynosi: 6,63 ∙ 10
-34
J
∙ s
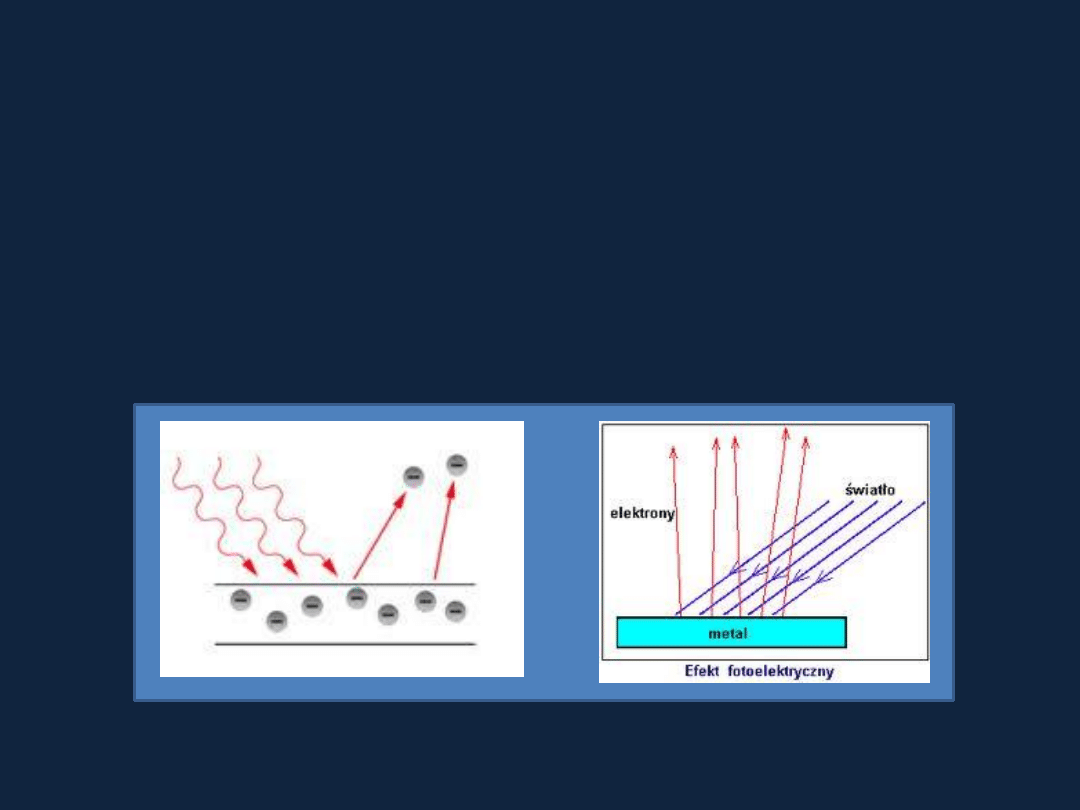
Rys. efekt
fotoelektryczny
z internetu
Z
równania wynika, że im większa jest częstość i tym samym mniejsza
długość fali tym większą energię niosą fotony promieniowania.
Dlatego np. promieniowanie w zakresie nadfioletu jest bardziej
szkodliwe dla
człowieka i może powodować poparzenia słoneczne.
Jeszcze
większą energię mają fotony promieniowania rentgenowskiego.
Efekt fotoelektryczny
Emisja elektronów z metalu, na którego powierzchnię działa promieniowanie
elektromagnetyczne.
Emisja
elektronów następuje przy określonej długości promieniowania
(dostatecznie
duża energia fotonu, żeby nastąpiła emisja elektronu).
Gdy energia
fotonów rośnie powyżej wartości progowej wzrasta
energia kinetyczna emitowanych
elektronów.
Efekt Comptona
Charakter korpuskularny
Zderzenie fotonu ze swobodnym elektronem
Rys. 3.3. str 59
Bielan
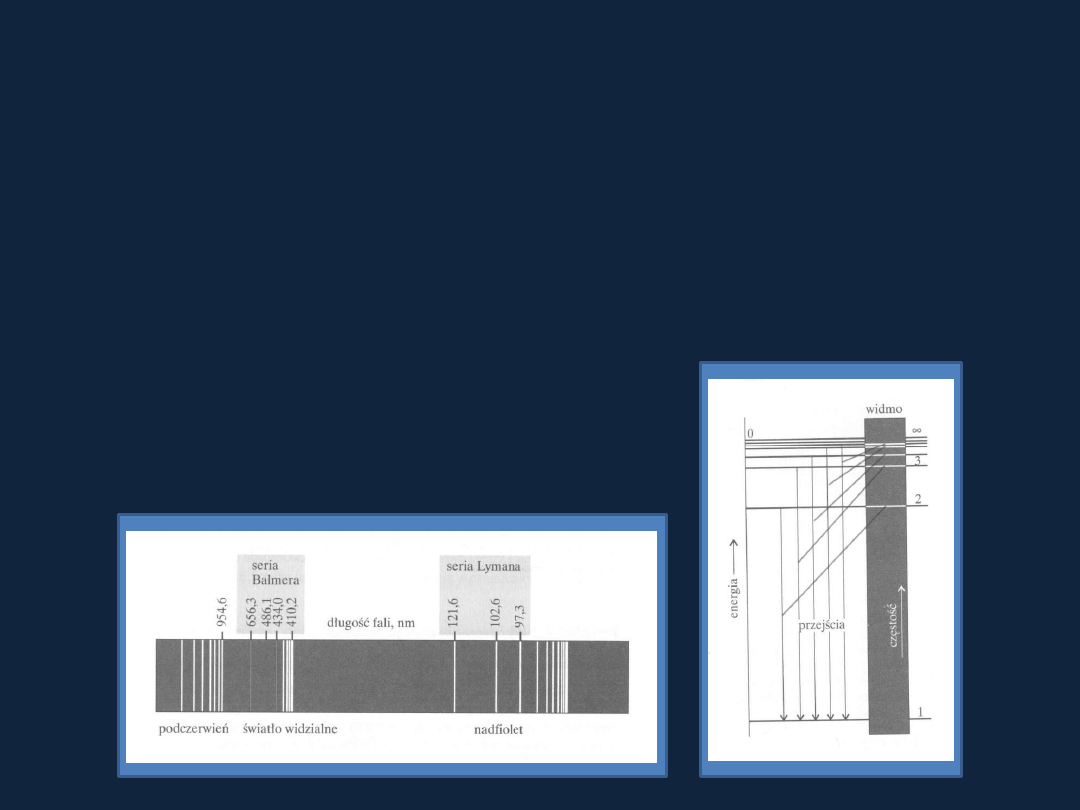
Widmo emisyjne wodoru
Atom emituje promieniowanie tylko przy
niektórych częstościach.
W atomie elektron
może występować tylko w określonych stanach
energetycznych
– poziomy energetyczne.
Przejściu elektronu z jednego poziomu na niższy towarzyszy emisja
energii
odpowiadającej różnicy tych poziomów w postaci fotonu
promieniowania.
Energia takiego fotonu -
E = h
ν
Rys. 7.9 str 286
Atkins
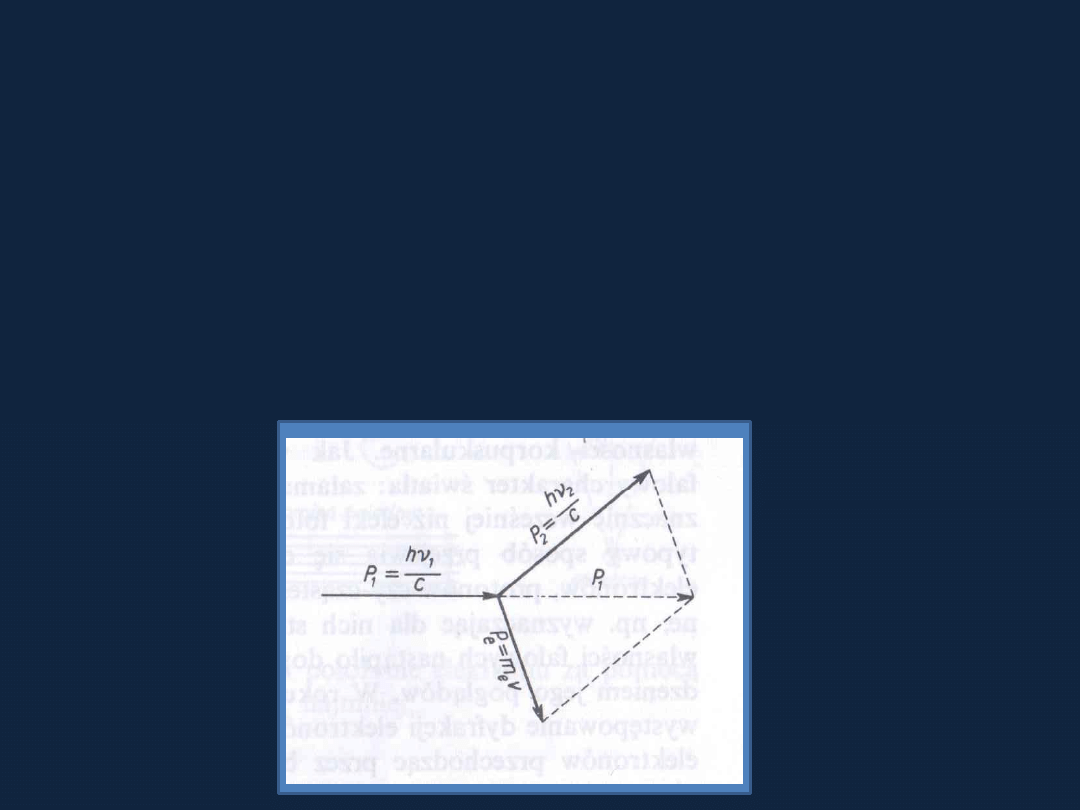
Hipoteza
Louis’a de Broglie’a
Wszelka materia wykazuje właściwości falowe
λ = h/mv = h/p
gdzie:
λ – długość fali, h – stała Plancka, m – masa, v – prędkość, p - pęd
Zgodnie ze wzorem
pęd fotonów (duża prędkość, mała masa) jest z reguły
mniejszy
niż pęd elektronów (mniejsza prędkość, ale większa masa) –
dlatego
fotonom
odpowiadają większe długości fali niż elektronom
– w przypadku fotonów dostrzega się bardziej ich właściwości falowe,
a
elektronów właściwości korpuskularne.

Davisson i Germer
– eksperyment potwierdzający hipotezę de Broglie’a
Elektrony
ugięte na krysztale dają obraz dyfrakcyjny na płycie
fotograficznej. Obraz ten odpowiada wynikowi
obliczeń wykonanych na
podstawie
równania de Broglie’a.
Rys. na str
289 góra
Atkins

Zasada
nieoznaczoności Heisenberga
Nie
można określić jednocześnie położenia (x) i pędu cząstki (p).
Δx ∙ Δp ≥ h
Im
dokładniejszy pomiar pędu, tym mniej dokładny pomiar położenia
cząstki i odwrotnie.
W rezultacie zamiast
określać dokładne położenie cząstki zakłada się
istnienie
określonego
prawdopodobieństwa
napotkania
cząstki
w danym miejscu przestrzeni.
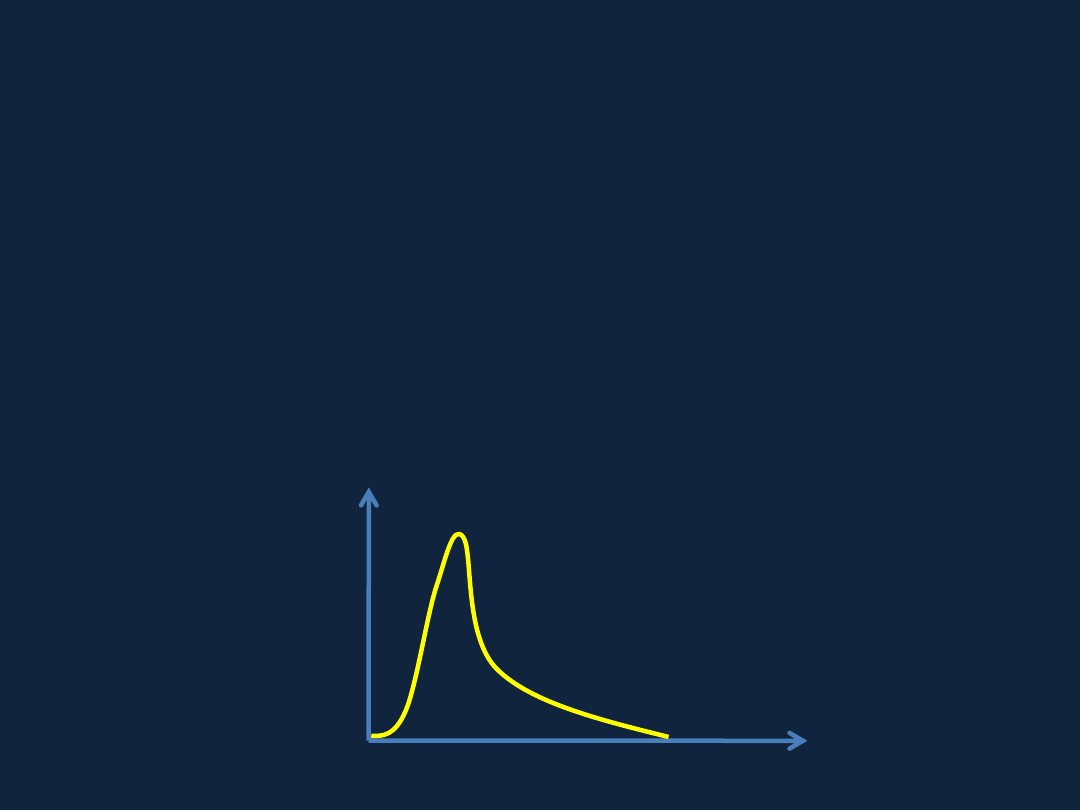
Gęstość prawdopodobieństwa napotkania elektronu (ϱ)
ϱ = W/dv
gdzie: W
– prawdopodobieństwo, v – objętość
W =
ϱ ∙ dv
ϱ = ϱ (x, y, z)
– gęstość jest zależna od miejsca
∫
ϱ ∙ dv = 1
całka prawdopodobieństwa napotkania cząstki
w całej przestrzeni wynosi 1
v
Odległość
Gęstość
prawdopodobieństwa
1s

Funkcje falowe i równanie Schrödingera
Równanie str. 64
Bielan
Ψ (psi) – amplituda fali
x, y, z
– współrzędne położenia elektronu w przestrzeni
E
– całkowita energia elektronu
V
– energia potencjalna elektronu
Rozwiązaniem równania Schrödingera są funkcje, które umożliwiają
obliczenie kształtu fali związanej z dowolną cząstką.
Fale mogą występować tylko dla pewnych wartości energii – poziomy
energetyczne elektronów.

Kwadrat
amplitudy
fali
elektronowej
jest
proporcjonalny
do
gęstości
prawdopodobieństwa znalezienia elektronu w danej objętości.
W =
ϱ (x, y, z) ∙ dv = [Ψ(x, y, z)]
2
Orbital
– funkcja falowa będąca rozwiązaniem równania Schrödingera dla
elektronu
znajdującego się na jednej z powłok elektronowych.
O orbitalu
mówimy, kiedy mamy na myśli obszar tzw. „chmury elektronowej”,
w
którym prawdopodobieństwo napotkania elektronu jest bardzo duże (0,9).
Energia i
kształt orbitalu zależą od energii oddziaływania elektromagnetycznego
z
jądrem atomowym i pozostałymi elektronami oraz energii danego elektronu.
Dostarczenie dodatkowej energii z
zewnątrz będzie skutkowało wzbudzeniem
elektronów (przeniesieniem ich na wyższy stan energetyczny) lub jonizacją
atomu (emisja elektronu).

Energia elektronu
– liczby kwantowe
Główna liczba kwantowa – n
Określa energię elektronu – średnią odległość od jądra atomowego – tym
samym informuje o rozmiarze orbitalu.
Im
wyższa wartość n, tym większa energia orbitalu i tym słabiej związany
elektron w atomie.
n = 1, 2, 3, 4
… (oznaczenie – K, L, N, M…)
Orbitalna (poboczna) liczba kwantowa
– l
Określa kształt orbitalu.
l - przyjmuje
wartości od 0 do 1-n (oznaczenie – s, p, d, f…)

Magnetyczna liczba kwantowa
– m
Informuje o orientacji przestrzennej orbitalu (określa kierunek).
Przyjmuje wartości od –l do l
Spinowa liczba kwantowa
Określa stan spinowy elektronowy (związana z ruchem wirowym)
Przyjmuje wartości -1/2 lub +1/2
Przykład:
Atom pierwiastka znajdującego się w 2 okresie układu okresowego
Głowna liczba kwantowa n = 1 i 2
Poboczna liczba kwantowa l = 0 (dla n = 1) i l = 0 i 1 (dla n = 2)
Magnetyczna liczba kwantowa m = 0 (dla n = 1) oraz m = 0 (dla n = 2 i l = 0)
oraz m = -1, 0, 1 (dla n = 2 i l =1)
Każdej wartości m odpowiada możliwość obsadzenia powłoki przez
2 elektrony o różnym spinie -1/2 lub +1/2.
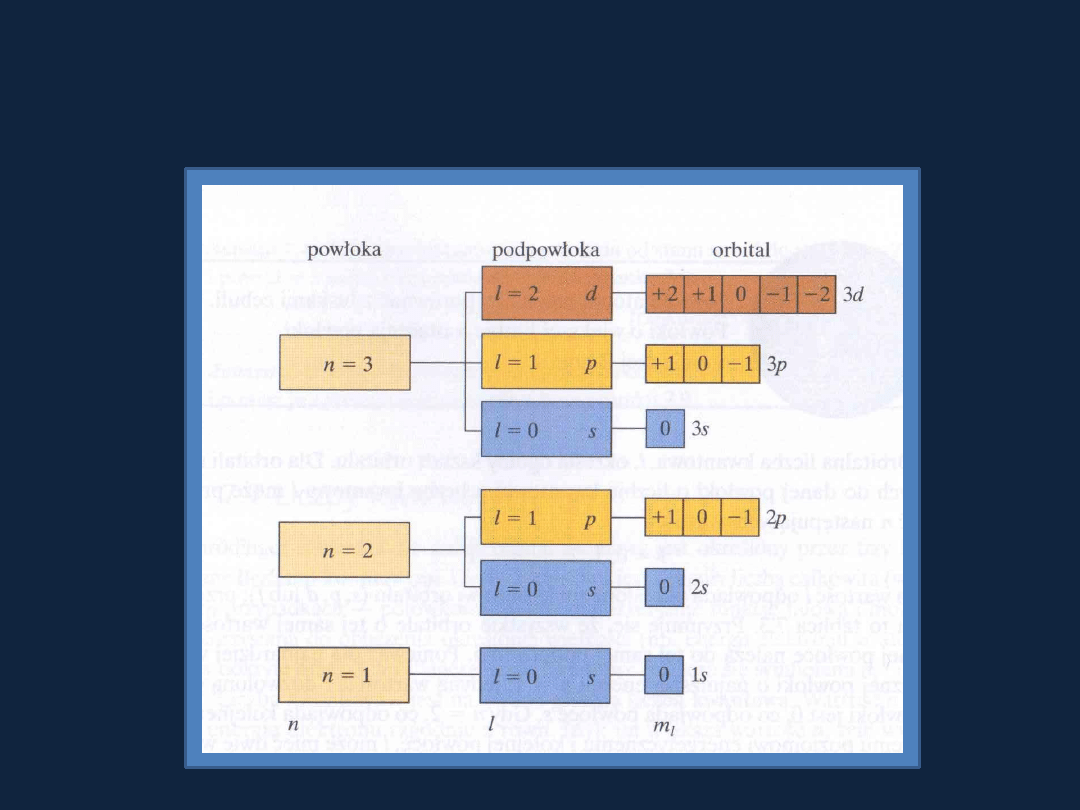
Układ powłok, podpowłok i orbitali w atomie oraz ich powiązanie
z wartościami liczb kwantowych
Rys. 7.23 str 296 Atkins
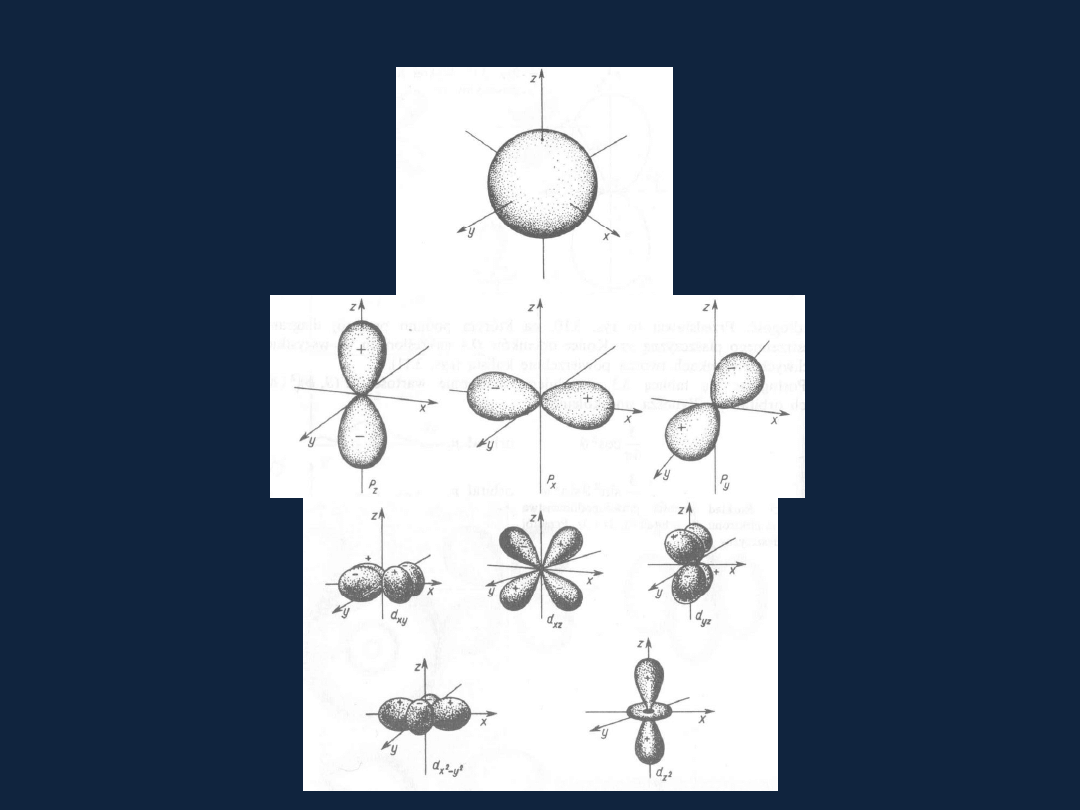
Kształt orbitali
Rys z Bielańskiego od str 75
Rys 3.11
3.13
3.14
Orbital s
Orbitale p
Orbitale d
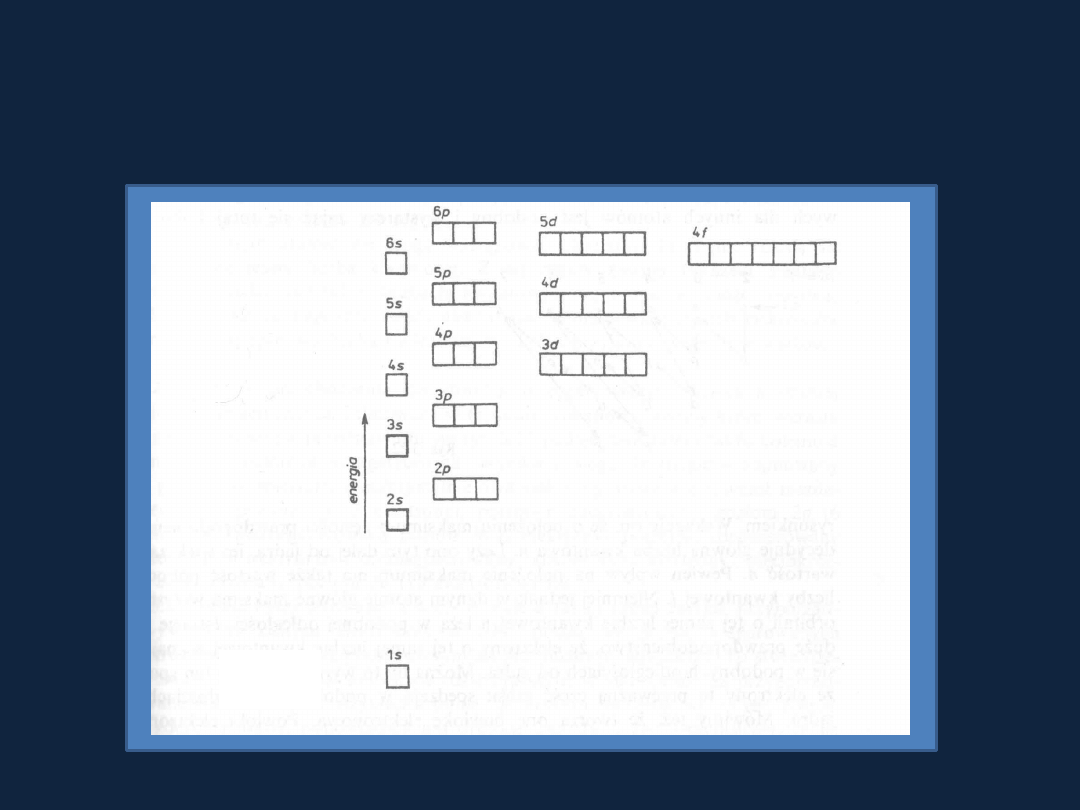
Schemat poziomów energetycznych w atomach wieloelektronowych
Rys. 3.21 str 87
Bielanski
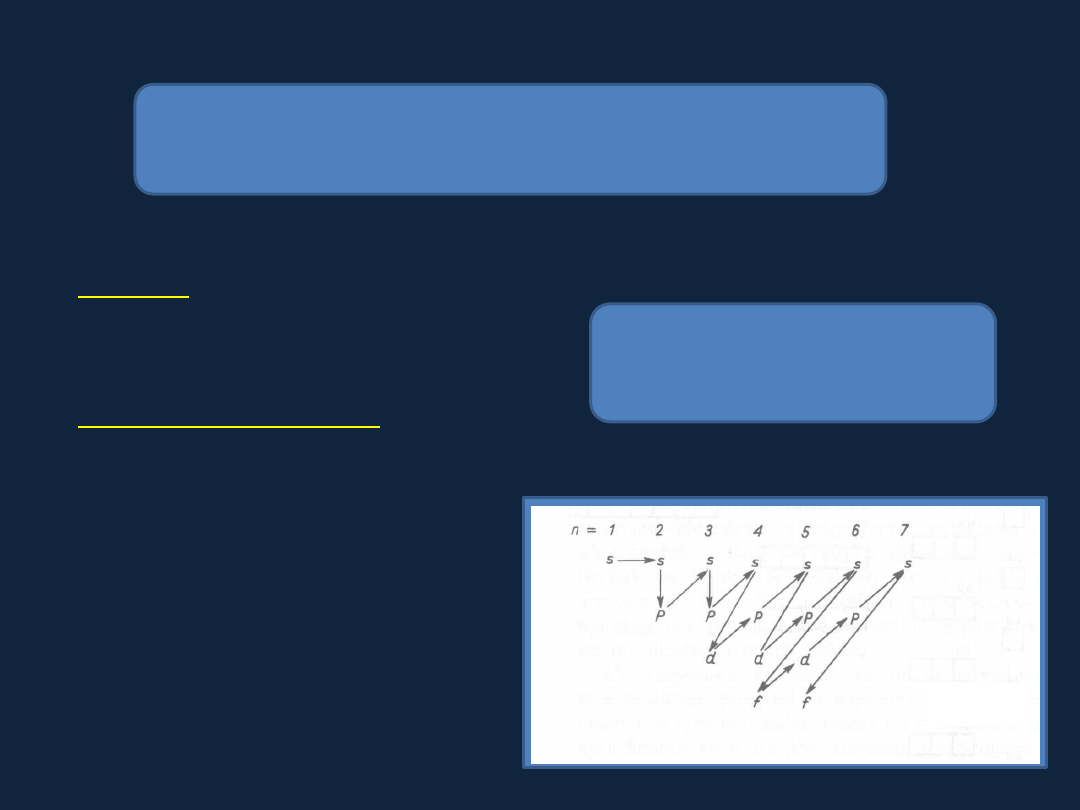
Zasady rozbudowy powłok elektronowych
Przykład:
Brom
–
35
Br
- liczba atomowa 35,
4 okres, 17 grupa układu okresowego
Konfiguracja elektronowa
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
5
(informacja dotyczy
– typu orbitalu,
poziomu energetycznego
podpowłoki
oraz liczby elektronów na podpowłoce)
Rys. 3.22 str.
88 Bielan
Schemat kolejności rozbudowy
powłok elektronowych
Na początku zapełniane są
orbitale o najniższej energii
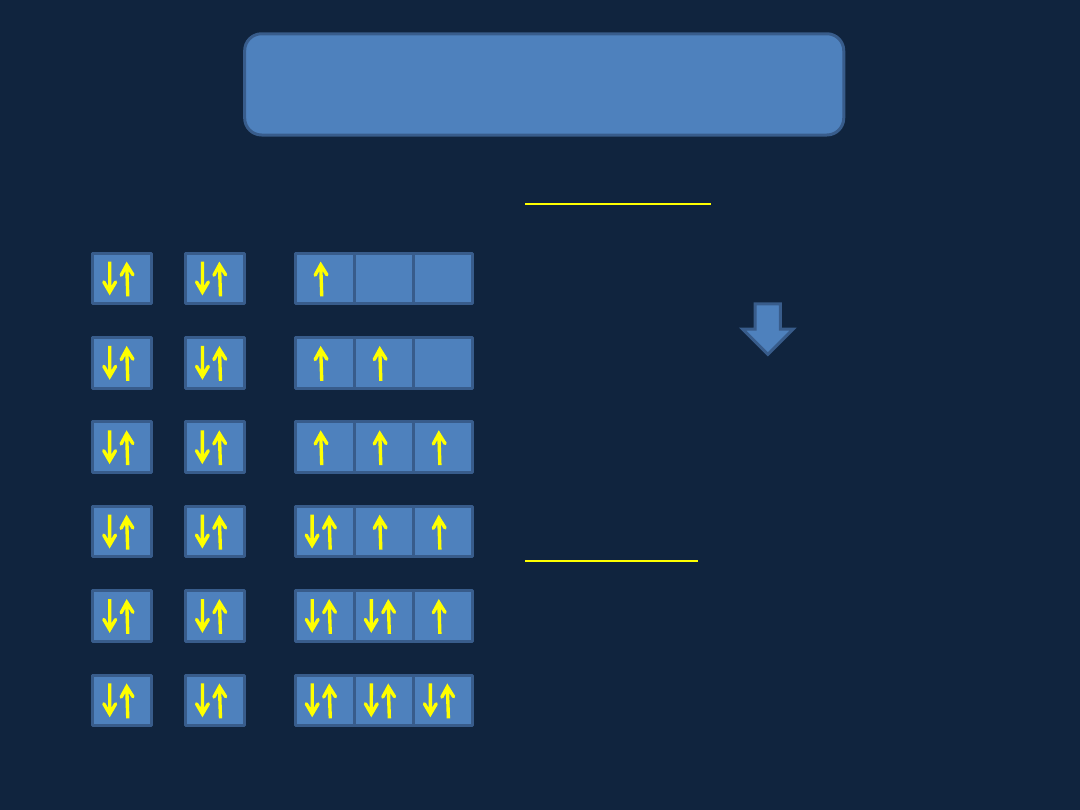
Zakaz Pauliego
i Reguła Hunda
B
C
N
O
F
Ne
1s 2s
2p
Zakaz Pauliego
W atomie nie mogą występować atomy,
które nie różnią się przynajmniej jedną
liczbą kwantową.
Dowolny orbital może być obsadzony
przez najwyżej 2 elektrony.
Gdy elektrony zajmują ten sam orbital,
ich spiny muszą być sparowane.
Reguła Hunda
Orbitale o tej samej energii
przyporządkowywane są kolejnym
elektronom, tak aby liczba
niesparowanych elektronów była jak
największa.

Obsadzanie
powłok elektronowych – metale bloku d
Stwierdzono,
że w przypadku metali przejściowych atom ma mniejszą
energię jeżeli podpowłoka 3d jest zapełniona w połowie (d
5
) lub
całkowicie
(d
10
).
Dążenie
do
takiej
konfiguracji
objawia
się
przeniesieniem jednego z
elektronów z podpowłoki 4s, np.:
24
Cr
– 1s
2
, 2s
2
, 2p
6
, 3s
2
, 3p
6
, 4s
1
, 3d
5
29
Cu
– 1s
2
, 2s
2
, 2p
6
, 3s
2
, 3p
6
, 4s
1
, 3d
10
Podobną sytuację obserwujemy również dla innych pierwiastków, np.:
46
Pd - 1s
2
, 2s
2
, 2p
6
, 3s
2
, 3p
6
, 4s
2
, 3d
10
, 4p
6
, 4d
10
47
Ag - 1s
2
, 2s
2
, 2p
6
, 3s
2
, 3p
6
, 4s
2
, 3d
10
, 4p
6
, 5s
1
, 4d
10
Wyszukiwarka
Podobne podstrony:
ChOiN I JG wyklad 6
ChOiN I JG wyklad 5
ChOiN I JG wyklad 3
ChOiN I JG wyklad 1
ChOiN I JG wyklad 4
ChOiN II JG wyklad 6
ChOiN II JG wyklad 3
ChOiN II JG wyklad 2
ChOiN II JG wyklad 7
ChOiN II JG wyklad 6
9.03. wykład ZKL, Uniwersytet Ekonomiczny JG, ZKL
Napęd Elektryczny wykład
wykład5
Psychologia wykład 1 Stres i radzenie sobie z nim zjazd B
Wykład 04
geriatria p pokarmowy wyklad materialy
ostre stany w alergologii wyklad 2003
więcej podobnych podstron